Cesio
Cesio
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liñas espectrais do Cesio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información xeral | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Cesio, Cs, 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Alcalinos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade | 1879 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza | 0,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparencia | Prateado dourado | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | 7440-46-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° EINECS | 231-155-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 132,90545196[1] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio medio | 260 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (calc) | 298 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 244±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio de van der Waals | 343 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe]6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electróns por nivel de enerxía | 2, 8, 18, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | +1, −1[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | base forte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | cúbica centrada no corpo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 301,59[3] K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebulición | 944 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 63,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2,092 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 2,5 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividade (Pauling) | 0,79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específica | 240 J/(K·kg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade eléctrica | 4,89 × 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 35,9 W/(K·m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª Enerxía de ionización | 375,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª Enerxía de ionización | 2234,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª Enerxía de ionización | 3400 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª Enerxía de ionización | {{{E_ionización4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª Enerxía de ionización | {{{E_ionización5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª Enerxía de ionización | {{{E_ionización6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª Enerxía de ionización | {{{E_ionización7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª enerxía de ionización | {{{E_ionización8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9.ª Enerxía de ionización | {{{E_ionización9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.ª Enerxía de ionización | {{{E_ionización10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos máis estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades segundo o SI e en condicións normais de presión e temperatura, salvo indicación contraria. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O cesio é un elemento químico de símbolo Cs e número atómico 55. É un metal alcalino brando de cor prateada-dourada, cun punto de fusión de 28,44 °C (301,59 K), un dos únicos cinco metais elementais que se poden atopar en estado líquido a temperatura ambiente.[a] As súas propiedades físicas e químicas aseméllanse ás do rubidio e ás do potasio. É extremadamente reactivo e pirofórico, reaccionando coa auga a temperaturas de ata −116 °C (157 K). É o elemento químico menos electronegativo e só ten un isótopo estable, o cesio-133. Obtense principalmente da extracción do mineral polucita, mentres que os seus radioisótopos, en especial o cesio-137 que é un produto de fisión, obtéñense dos residuos producidos polos reactores nucleares.
Foi descuberto no ano 1860 polos científicos alemáns Robert Bunsen e Gustav Kirchhoff mediante o método de análise espectral. O seu nome procede do latín caesius, que significa "azul ceo". As primeiras aplicacións a pequena escala deste elemento foron en tubos de baleiro e células fotoeléctricas. En 1967, baseándose na definición da velocidade da luz de Einstein como a dimensión máis constante do universo, o Sistema Internacional de Unidades illou dúas emisións de ondas específicas do espectro do cesio-133 para definir as medidas do segundo e do metro. Dende entón o cesio foi empregado habitualmente en reloxos atómicos de alta precisión.
Dende os anos 1990 a súa principal aplicación foi en forma de formiato de cesio para fluídos de perforación, pero tamén se emprega o elemento en aplicacións eléctricas, electrónicas e químicas. O isótopo radioactivo cesio-137 ten unha vida media duns 30 anos e úsase en aplicacións médicas, industriais e hidrolóxicas. O elemento presenta unha toxicidade media e considérase un metal perigoso, e os seus radioisótopos supoñen un risco para a saúde cando se liberan no ambiente.
Características[editar | editar a fonte]
Propiedades físicas[editar | editar a fonte]

O cesio é un elemento moi brando (0,2 Mohs) e dúctil, de cor pálida que se escurece na presenza de osíxeno.[4][5][6] O seu punto de fusión é de 28,4 °C (301,5 K), o que o converte nun dos poucos metais elementais que se poden atopar en estado líquido a temperatura ambiente. O mercurio é o único outro metal coñecido cun punto de fusión máis baixo que este elemento.[b][8] Tamén presenta un baixo punto de ebulición, 641 °C (914 K), o segundo máis baixo de tódolos metais.[9] Os seus compostos arden cunha cor azul [10][11] ou violeta.[11]
Forma aliaxes con outros metais alcalinos (agás co litio) e co ouro, así como amálgamas co mercurio. A temperaturas por baixo dos 650 °C (923 K) non forma aliaxes co cobalto, ferro, molibdeno, níquel, platino, tántalo ou volframio. Tamén forma compostos intermetálicos co antimonio, galio, indio e torio, que son fotosensitivos.[4] A aliaxe de menor concentración molar está formada por un 41% de cesio, 47% de potasio e 12% de sodio, e ten o punto de fusión máis baixo de tódalas aliaxes metálicas coñecidas, −78 °C (195 K).[8][12] Algunhas das súas amálgamas foron obxecto de estudo, como CsHg
2 que é de cor negra cun lustre metálico púrpura, mentres que CsHg é de cor dourada, tamén cun lustre metálico.[13]
Propiedades químicas[editar | editar a fonte]
O cesio é altamente reactivo e pirofórico. É capaz de entrar en ignición de forma espontánea no aire, e reacciona de forma explosiva coa auga incluso a baixas temperaturas, máis que o resto de membros dos metais alcalinos da táboa periódica.[4] Esta reacción coa auga pode darse a temperaturas de ata −116 °C (157 K),[8] o que fai que se clasifique como un material perigoso. Almacénase e transpórtase dentro de hidrocarbonos saturados secos, como o aceite mineral. Así mesmo debe manexarse baixo unha atmosfera de gas inerte, como por exemplo argon. Porén, as explosións de cesio-auga adoitan ser menos potentes que as de sodio-auga en iguais concentracións de cesio e sodio. Isto é así xa que o cesio estoura no mesmo instante de contacto coa auga, deixando moi pouco tempo como para que se acumule o hidróxeno.[14] Pode almacenarse en ampolas de vidro borosilicatado, aínda que para cantidades maiores de 100 gramos o transporte realízase dentro de contedores de aceiro inoxidable pechados hermeticamente.[4]
A química do cesio é semellante á dos outros metais alcalinos, en particular á do rubidio, que se atopa directamente enriba del na táboa periódica.[15] O seu estado de oxidación máis común é o +1, aínda que os haluros deste elemento conteñen o anión Cs− e polo tanto atópanse no estado de oxidación −1.[2] Un estudo de 2013 indicou que baixo condicións de presión extrema (máis de 30 GPa), os electróns internos 5p poderían formar ligazóns químicas, onde o cesio se comportaría como o sétimo elemento 5p, indicando que baixo este tipo de condicións poderían existir fluoruros de cesio con estados de oxidación deste elemento que variarían dende o +2 ata o +6.[16] Algunhas diferenzas co resto de alcalinos danse no feito de que ten maior masa atómica e electropositividade que os outros membros non radioactivos deste grupo.[17] O cesio é o elemento químico de maior electropositividade,[c][8] e o seu ión presenta un tamaño maior que o resto de elementos alcalinos máis lixeiros.[19]
Abundancia[editar | editar a fonte]

O cesio é un elemento relativamente escaso, con estimacións que indican unha presenza aproximada de 3 partes por millón deste elemento na codia terrestre.[20] Isto posiciónao como o 45º elemento químico máis abundante, e o 36º metal máis común. É máis abundante que elementos como o antimonio, cadmio, estaño e volframio, e dúas ordes de magnitude máis abundante que o mercurio e a prata. Non obstante, a súa abundancia é de tan só un 3,3% en comparación co rubidio, o elemento ao que máis se asemella quimicamente.[4]
Por mor do seu gran raio iónico, o cesio é un dos denominados "elementos incompatibles".[21] Durante o proceso de cristalización fraccionada o cesio concéntrase na fase líquida e cristaliza en último lugar.[22] Isto provoca que os maiores depósitos de cesio se atopen en corpos minerais de pegmatita formados por este proceso de enriquecemento.[23] Como o cesio non se substitúe polo potasio de forma tan doada como o rubidio, os minerais alcalinos silvina (KCl) e carnalina (KMgCl
3·6H
2O) adoitan conter tan só un 0,002% deste elemento. Poden atoparse tamén pequenas cantidades porcentuais de cesio no berilo (Be
3Al
2(SiO
3)
6) e na avogadrita ((K,Cs)BF
4). Dáse en concentracións de ata un 15 % de Cs2O na pezzottaíta (Cs(Be2Li)Al2Si6O18), ata un 8,4 % na londonita ((Cs,K)Al
4Be
4(B,Be)
12O
28), e en menor concentración no mineral máis común rodicita.[4] A única fonte mineral de cesio con importancia económica é a polucita Cs(AlSi
2O
6), que se atopa en diversas partes do mundo con presenza de minerais de pegmatita, e está asociado a outros minerais de litio de maior importancia económica como a lepidolita e a petalita.[23][24]
Unha das maiores fontes deste metal é a Mina Tanco en Bernic Lake, Manitoba, Canadá. Os depósitos alí atopados estímanse nunhas 350 000 toneladas de mineral de polucita, o que representa máis de dous terzos das reservas mundiais deste mineral.[24][25] Malia que o contido estoiquiométrico do cesio na polucita é dun 42,6%, as mostras de polucita puras deste depósito conteñen ao redor dun 34% de cesio,[25] mentres que a polucita que se comercializa contén ao redor dun 19% deste metal.[26] O depósito de pegmatita do Distrito de Bikita, en Cimbabue, trabállase para extraer petalita principalmente, pero tamén contén unha cantidade significativa de polucita, que tamén se pode atopar en cantidades notables na Rexión Erongo de Namibia.[25] Segundo estimacións feitas pola axencia U.S. Geological Survey no 2009, as reservas totais mundiais de cesio serían dunhas 70 000 toneladas.[25]
Isótopos[editar | editar a fonte]
O cesio ten un total de 39 isótopos coñecidos, que varían en número másico dende 112 ata 151. Varios destes isótopos sintetízanse dende elementos máis lixeiros mediante un lento proceso de captura de neutróns dentro das estrelas máis lonxevas,[27] así como no interior das supernovas.[28] Porén, o único isótopo estable do cesio é 133Cs, con 78 neutróns. Aínda que posúe un spin nuclear grande (7/2+), poden realizarse estudos de resonancia magnética nuclear con este isótopo a unha frecuencia resoante de 11,7 MHz.[29]
O isótopo radioactivo 135Cs ten unha vida media de aproximadamente 2,3 millóns de anos, a máis longa de tódolos isótopos radioactivos deste elemento. 137Cs e 134Cs teñen vidas medias de 30 e 2 anos respectivamente. 137Cs descomponse en 137mBa por emisións beta e posteriormente en bario non radioactivo, mentres que 134Cs transfórmase en 134Ba directamente. Os isótopos de número másico 129, 131, 132 e 136 teñen vidas medias de entre un día e dúas semanas, e o resto de isótopos teñen vidas medias non superiores a un segundo. Existe un total de polo menos 21 isómeros nucleares metaestables, todos eles moi inestables e con vidas medias duns poucos minutos.[30][31] 135Cs é tamén un dos produtos de gran lonxevidade resultantes da fisión do uranio que se forman nos reactores nucleares.[32] Porén, esta produción é reducida na maioría de reactores, xa que o seu predecesor 135Xe é un veleno nuclear moi potente e transmútase habitualmente a un 136Xe estable antes de que poida decaer ata 135Cs.[33][34]

O isótopo 137Cs é un potente emisor de radiación gamma debido ao seu decaemento por emisións beta.[36] A súa vida media convérteo no principal produto de lonxevidade media xunto ao 90Sr que resultan da fisión nuclear do uranio, sendo ámbolos dous responsables da radioactividade do combustible nuclear esgotado, que pode durar varios centos de anos tralo uso deste.[37] Como exemplo, no ano 2005 estimouse que o 137Cs xunto ao 90Sr estaban a ser a principal fonte de radioactividade na área afectada polo accidente de Chernóbil.[38] O tratamento do 137Cs por medio de captura de neutróns non é factible debido ao baixo ritmo de captura, o que provoca que se teña que permitir o decaemento natural deste isótopo.[39]
Case todo o cesio producido como resultado da fisión nuclear procede das emisións beta de produtos de fisión orixinariamente máis ricos en neutróns, pasando por varios isótopos de iodo e xenon.[40] Xa que estes dous elementos son volátiles e poden difundirse a través do combustible nuclear ou polo aire, o cesio radioactivo adoita formarse lonxe do sitio orixinal no que teña lugar a fisión.[41] As primeiras probas nucleares dos anos 1950 liberaron isótopos de 137Cs na atmosfera terrestre, que posteriormente retornaron á superficie da terra como parte da consecuente chuvia radioactiva.[4]
Compostos[editar | editar a fonte]
A gran maioría dos compostos de cesio conteñen este elemento en forma de catión Cs+
, que forma enlaces iónicos cunha ampla variedade de anións, sendo a excepción máis notable a esta maioría o anión cesiuro (Cs−
) e varios dos óxidos do elemento.[2]
Os sales de Cs+ son invariablemente incoloros agás nos casos nos que a unión en si mesma presente coloración. Moitos dos sales simples son higroscópicos, aínda que en menor medida que os sales correspondentes doutros metais alcalinos máis lixeiros. Os fosfatos[42] acetatos, carbonatos, haluros, óxidos, nitratos e sulfatos deste elemento son solubles en auga. As sales dobres presentan unha menor solubilidade, como no caso do sulfato de aluminio-cesio, empregado na purificación de Cs nos seus minerais. Outros sales dobres con baixa solubilidade son os de antimonio (p.ex.: CsSbCl
4), bismuto, cadmio, cobre, ferro e chumbo.[4]
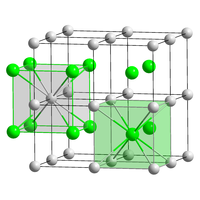
Ao igual que outros catións metálicos, Cs+ forma compostos con solucións en bases Lewis. Debido ao seu gran tamaño, Cs+ adopta habitualmente números de coordinación maiores que seis, comportamento habitual nos catións de metais alcalinos máis lixeiros. Este padrón é aparente na oitava coordinación no CsCl, que contrasta con outros cloruros de metais alcalinos. Este número de coordinación elevado e a súa tendencia para formar enlaces covalentes son as bases da separación de Cs+ doutros catións, práctica empregada no tratamento de residuos nucleares onde se separa o 137Cs+ de grandes cantidades de K+ non radioactivo.[43]
O hidróxido de cesio (CsOH) é higroscópico e unha base moi forte,[15] que actúa como augaforte moi rapidamente na superficie de semicondutores como por exemplo o silicio.[44] O CsOH estivo considerado durante un tempo polos químicos como a base máis forte, reflectindo a relativamente débil atracción experimentada entre os grandes ións Cs+ e o grupo OH−.[10] Este composto é de feito a base Arrhenius máis forte, aínda que hai unha serie de compostos que non poden existir en solucións acuosas, como o n-butil-litio e a amina de sodio, que son máis básicos.[15]
As mesturas estoiquiométricas de cesio e ouro reaccionan para formar un aururo de cesio (Cs+Au−) de cor amarela ao quentarse. Nestes casos o anión aururo compórtase como un pseudohalóxeno. O composto reacciona de forma violenta coa auga, producindo hidróxido de cesio, ouro metálico e gas de hidróxeno. Baixo amoníaco líquido este composto pode facerse reaccionar cunha resina específica de cesio de intercambio de ións para producir tetrametilamonio de aururo. O composto análogo de platino, o platinuro de cesio (Cs2Pt), contén o ión platinuro que se comporta como un pseudocalcóxeno.[45]
Haluros[editar | editar a fonte]

O fluoruro de cesio (CsF) é un sólido higroscópico de cor branca, empregado na química orgánica do flúor como fonte do anión fluoruro.[47] Este composto ten unha estrutura compacta, na que as compoñentes Cs+ e F− xúntanse nun arranxo cúbico compacto da mesma forma que fan o Na+ e o Cl− no cloruro de sodio.[15]
O cloruro de cesio (CsCl) cristaliza en forma de sistema cúbico simple. Tamén denominada "estrutura do cloruro de cesio",[17] este deseño estrutural componse dun entramado cúbico cunha base de dous átomos, cada un deles cunha coordinación de número 8. Os átomos de cloruro sitúanse nos puntos do entramado dos extremos do cubo, mentres que os átomos de cesio sitúanse nos ocos do centro dos cubos. Esta estrutura é igual á do bromuro de cesio (CsBr) e á do ioduro de cesio (CsI), así como á de moitos outros compostos que non conteñen cesio.[48]
Óxidos[editar | editar a fonte]
O cesio forma numerosos compostos binarios co osíxeno, máis que o resto de metais alcalinos. Cando arde no aire, o principal produto desta reacción é o superóxido CsO
2.[49] O monóxido de cesio (Cs
2O) forma cristais hexagonais de cor amarela-laranxa,[50] sendo o único óxido coñecido de tipo anti-CdCl
2.[51] Vaporízase a unha temperatura de 250 °C (523 K), e descomponse en metal de cesio e no peróxido Cs
2O
2 a temperaturas por riba dos 400 °C (673 K).[52] A maiores do superóxido e do ozonuro CsO
3,[53][54] existen varios subóxidos do cesio de cores brillantes que tamén foron obxecto de estudo.[55] Estes inclúen os compostos Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (verde escuro[56]), CsO, Cs
3O
2,[57] así como o Cs
7O
2.[58][59] Este último pode quentarse en condicións de baleiro para xerar Cs
2O.[51] Tamén existen outros compostos binarios con xofre, selenio e telurio.[4]
Historia[editar | editar a fonte]
No ano 1860 Robert Bunsen e Gustav Kirchhoff descubriron o cesio na auga mineral de Dürkheim, Alemaña. Debido ás liñas de cor azul brillante do seu espectro de emisións, escolleron un nome derivado do latín caesius, que significa "azul-ceo".[d][61][62] O cesio foi o primeiro elemento descuberto polo método da espectroscopia.[8][62]
Para obter unha mostra pura de cesio, evaporaron 44 000 litros de auga mineral para conseguir 240 kg de solución salina concentrada. Os metais alcalinotérreos precipitáronse en forma de sulfatos ou oxalatos, deixando o metal alcalino na solución. Tras unha conversión aos nitratos e unha extracción con etanol, obtiveron unha mestura libre de sodio. Deste produto, precipitaron o litio con carbonato de amoníaco. O potasio, rubidio e cesio forman sales non solubles en ácido cloroplatínico, pero estes sales presentan unha lixeira diferenza de solubilidade na auga quente, polo que os hexacloroplatínidos de cesio e rubidio ((Cs,Rb)2PtCl6), menos solubles, puideron obterse por medio de cristalización fraccionada. Tras unha redución do hexacloroplatínido con hidróxeno, conseguiron separar o cesio e o rubidio pola diferenza de solubilidade dos seus carbonatos en alcohol. Este proceso deu como resultado 9,2 g de cloruro de rubidio e 7,3 g de cloruro de cesio, partindo dos 44 000 litros de auga mineral iniciais.[61]

Os dous científicos empregaron o cloruro de cesio así obtido para facer unha estimación do peso atómico do novo elemento, ao que deron un valor de 123,35 (en comparación co finalmente aceptado de 132,9).[61] Tentaron producir cesio elemental por medio da electrólise de cloruro de cesio fundido, pero no canto dun metal obtiveron unha substancia homoxénea de cor azul que non amosaba trazas metálicas nin a simple vista nin baixo un microscopio, e como resultado definírono como un composto non estoiquiométrico (Cs
2Cl), cando en realidade este produto foi unha mestura coloidal do metal elemental e do cloruro de cesio.[63] A electrólise da solución acuosa de cloruro cun ánodo de mercurio produciu unha amálgama de cesio descomposta nesas condicións acuosas.[61] O metal puro sería eventualmente illado polo químico alemán Carl Setterberg mentres traballaba no seu doutoramento con Kekulé e Bunsen.[62] No ano 1882 conseguiu producir cesio metálico por medio da electrólise de cianuro de cesio, evitando os problemas experimentados anteriormente co cloruro.[64]
O uso máis importante do cesio foi historicamente nos campos de investigación, principalmente nos da química e da electricidade. Ata os anos 1920 existiron moi poucas aplicacións industriais para este elemento, momento no que se comezou a empregar en tubos de baleiro para radios. Nesta aplicación tiña dúas funcións: eliminar o exceso de osíxeno remanente trala manufactura, e como recubrimento do cátodo para incrementar a súa condutividade eléctrica.[65][66] O cesio non foi recoñecido como un metal industrial de alto rendemento ata os anos 1950,[67] cando comezou a aplicarse en células fotoeléctricas, tubos fotomultiplicadores, compoñentes ópticos de espectroscopios infravermellos, como catalizador para diversas reaccións orgánicas, en xeradores magnetohidrodinámicos[4] e como fonte de ións positivos na técnica de espectrometría de masas por ións secundarios (SIMS).[68]
Dende 1967 o Sistema Internacional de Unidades basea a súa unidade de tempo, o segundo, nas propiedades do cesio. O SI definiu o segundo como a duración de 9 192 631 770 ciclos a unha frecuencia de microondas da liña espectral correspondente á transición entre dous niveis de enerxía hiperfinos do estado fundamental do cesio-133.[69][70]
Produción[editar | editar a fonte]
A extracción de mineral de polucita é un proceso selectivo e faise a pequena escala en comparación con outras operacións mineiras. O mineral machúcase, seleccionase a man, habitualmente sen pasar un proceso de concentración, e finalmente lévase ata un estado fundamental. Neste punto extráese o cesio, principalmente por medio de tres métodos: dixestión ácida, descomposición alcalina e redución directa.[4][71]
No proceso de dixestión ácida, a rocha de polucita disólvese con ácidos fortes, como o ácido clorhídrico (HCl), o ácido sulfúrico (H
2SO
4), o ácido bromhídrico ou o ácido fluorhídrico (HF). Empregar o ácido clorhídrico dá como resultado unha mestura de cloruros solubles, e os sales dobres insolubles de cesio precipítanse como cloruro de antimonio-cesio (Cs
4SbCl
7), cloruro de iodo-cesio (Cs
2ICl) ou hexaclorocerato de cesio (Cs
2(CeCl
6)). Trala separación, o sal puro precipitado descomponse, obtendo CsCl puro ao evaporarse a auga.[71][72] O método que emprega ácido sulfúrico produce o sal dobre insoluble directamente en forma de alume de cesio (CsAl(SO
4)
2·12H
2O). O sulfato de aluminio contido neste sal convértese en óxido de aluminio insoluble tostando o alume con carbono, e o produto resultante sométese a un proceso de lixiviación con auga para producir unha solución de Cs
2SO
4.[4][71]
O proceso de tostado da polucita con carbonato de calcio e cloruro de calcio produce silicatos de calcio insolubles e un cloruro de cesio soluble. Unha lixiviación con auga ou amoníaco diluído (NH
4OH) da como resultado unha solución diluída de cloruro (CsCl).[4][73] Esta solución pode evaporarse para producir cloruro de cesio ou transformarse ben en alume de cesio ou ben en carbonato de cesio.[4][74] Aínda que non é comercialmente factible, a redución directa do mineral con potasio, sodio ou calcio no baleiro pode producir metal de cesio de forma directa.[4][75]

Outro método alternativo para obter metal de cesio é a partir dos compostos purificados derivados do mineral. O cloruro de cesio, así como os outros haluros, pode reducirse a unha temperatura de entre 700 °C (973 K) e 800 °C (1070 K) con calcio ou bario, para posteriormente aplicar un proceso de destilación do metal de cesio. De forma semellante, os compostos con aluminio, carbono e hidróxido poden reducirse con magnesio.[4] O metal pode illarse tamén por medio da electrólise de cesio fusionado con cianuro (CsCN). Un tipo de cesio excepcionalmente puro e libre de gases pode producirse por descomposición termal de azida de cesio CsN
3 a unha temperatura de 390 °C (663 K), composto que á súa vez se obtén a partir de sulfato acuoso de cesio e azida de bario.[71]
En aplicacións de baleiro pode facerse reaccionar dicromato de cesio con circonio para formar metal de cesio puro libre doutros produtos gasosos:[76]
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3
A gran maioría do cesio producido en extraccións mineiras en forma de sales convértese en formiato de cesio (HCOO−Cs+) para aplicacións na extracción de petróleo. A empresa Cabot Corporation construíu unha planta produtiva no ano 1997 na localización da mina Tanco, preto de Bernic Lake en Manitoba (Canadá), cunha capacidade produtiva de 1900 m3 de solución de formiato de cesio ao ano.[77] Os principais compostos comerciais a menor escala do cesio son o cloruro de cesio e o nitrato de cesio.[76] O prezo do cesio puro (en base metálica) cunha concentración de 99,8% era duns 10$ por gramo no ano 2009, mentres que os seus diversos compostos tiñan un prezo significativamente máis baixo.[25]
Aplicacións[editar | editar a fonte]
Exploracións petrolíferas[editar | editar a fonte]
O uso maioritario do cesio non radioactivo é en forma de formiato de cesio aplicado en fluídos de perforación para a industria petrolífera.[4] As solucións acuosas de formiato de cesio (HCOO−Cs+), obtidas ao facer reaccionar hidróxido de cesio con ácido fórmico, desenvolvéronse a mediados dos anos 1990 para o seu uso nos pozos petrolíferos. A función destes fluídos de perforación é a de lubricar as barrenas, desprazar os anacos de rochas cara á superficie e manter a presión na formación rochosa durante e despois da perforación do pozo.[4]
A alta densidade da solución salina de formiato de cesio (ata 2,3 g·cm−3)[78] e a natureza relativamente benigna da maioría dos compostos de cesio reducen o número de sólidos tóxicos de alta densidade nestes fluídos, supoñendo unha vantaxe tecnolóxica e medioambiental.[78] A solución de formiato de cesio pode mesturarse con formiatos de potasio e sodio para reducir a densidade do fluído ata igualar a da auga (1,0 g·cm−3). A maiores disto é biodegradable e reciclable, factor comercial importante para o seu uso debido ao custo deste produto (4000 $ por barril no ano 2001).[79] Os formiatos dos elementos alcalinos non presentan perigos no seu manexo e non resultan tan corrosivos como outras solucións salinas alternativas de alta densidade, como por exemplo solucións de bromuro de cinc (ZnBr
2), ademais de supoñer un menor custo de limpeza e eliminación que estas alternativas.[4]
Reloxos atómicos[editar | editar a fonte]

Os reloxos atómicos baseados no cesio observan as transicións electromagnéticas na estrutura hiperfina dos átomos de cesio-133 e empréganas como punto de referencia. O primeiro reloxo de cesio preciso construíuno Louis Essen no ano 1955 no National Physical Laboratory do Reino Unido.[80] Dende entón foron mellorados progresivamente, chegando a formar a base dos estándares de medidas do tempo e da frecuencia pola súa gran precisión.[69] O erro na medición de frecuencias destes reloxos é de 2 a 3 partes en 1014, o que corresponde a unha precisión na medida do tempo de 2 nanosegundos por día, ou un segundo en 1,4 millóns de anos. As versións máis recentes poden acadar unha precisión algo mellor que 1 parte en 1015, o que significa que o erro na medición é de 1 segundo en 20 millóns de anos.[4] Os reloxos de cesio tamén se empregan en redes de control para os tempos das transmisións de móbiles e do tráfico de información en Internet.[81]
Electricidade e electrónica[editar | editar a fonte]
Os xeradores termoiónicos de vapor de cesio son dispositivos que converten a enerxía térmica en enerxía eléctrica. Nos convertedores de tubos de baleiro de dous eléctrodos este vapor de cesio neutraliza a carga espacial que se acumula preto do cátodo, mellorando desta forma o fluxo da corrente.[82]
O cesio tamén resulta de importancia grazas ás súas propiedades fotoeléctricas de conversión de enerxía lumínica en fluxos de electróns. Emprégase en células fotoeléctricas debido a que os cátodos baseados en cesio, como o composto intermetálico K
2CsSb, teñen un límite de voltaxe baixo para a emisión de electróns.[83] Os distintos tipos de dispositivos que poden empregar cesio son dispositivos de recoñecemento óptico de caracteres, fotomultiplicadores, e tubos de videocámaras.[84][85] Outros elementos como o xermanio, o rubidio, o selenio, o silicio ou o telurio poden substituír o cesio nestes materiais fotosensitivos.[4]
Os cristais de ioduro de cesio (CsI), bromuro de cesio (CsBr) e fluoruro de cesio (CsF) empréganse en contadores de escintilación de uso estendido na exploración mineral e nas investigacións da física de partículas, grazas ás capacidades para a detección de raios gamma e radiación de raios X. O cesio, ao ser un elemento pesado, fornece un bo poder de parada e contribúe a mellorar a detección e o tempo de resposta destes aparellos.[72][86][87]
O vapor de cesio utilízase en moitos magnetómetros,[88] e o elemento emprégase como un estándar interno no campo da espectrofotometría.[89] Ao igual que outros metais alcalinos ten unha grande afinidade co osíxeno e emprégase como elemento que contribúe a manter o baleiro nos tubos de baleiro.[90] Outros usos do cesio nestes campos da ciencia inclúen aplicacións en láseres de grande enerxía, lámpadas fluorescentes e rectificadores de vapor.[4]
Fluídos de centrifugado[editar | editar a fonte]

Debido á súa alta densidade, é habitual o uso de diversas solucións de cloruro de cesio, sulfato de cesio e triofluoroacetato de cesio (Cs(O
2CCF
3)) na bioloxía molecular para o ultracentrifugado de gradientes de densidades.[72] Esta tecnoloxía aplícase principalmente no illamento de partículas virais, orgánulos subcelulares e ácidos nucleicos a partir de mostras biolóxicas.[91]
Usos na química e na medicina[editar | editar a fonte]
As aplicacións químicas do cesio son relativamente reducidas en comparación a outros elementos.[71] A dopaxe con compostos de cesio realízase para mellorar a efectividade de varios catalizadores de metal-ións empregados na produción de substancias químicas como o ácido acrílico, a antraquinona, o óxido de etileno, o metanol, o anhídrido ftálico, o estireno, monómeros de metacrilato de metilo e varios alquenos. Tamén se usa na conversión catalítica de dióxido de xofre en trióxido de xofre durante o proceso de produción de ácido sulfúrico.[4]
O fluoruro de cesio ten un uso especializado na química orgánica como base[15] e como fonte anhídrica de ión fluoruro,[92] mentres que os sales de cesio poden substituír as de potasio ou sodio na síntese orgánica en procesos de ciclicación, esterificación e polimerización.[93][94][95] O cesio tamén se emprega na dosimetría de radiación termoluminiscente (TLD). Ao expoñerse a radiación adquire defectos cristalinos que ao quentarse retornan unha emisión de luz proporcional á dose recibida. Medir este pulso de luz cun tubo fotomultiplicador permite cuantificar a dose de radiación acumulada.[96][97][98]
Os sales de cesio foron avaliadas como reaxentes antishock para o seu uso trala administración de medicamentos con base de arsénico, aínda que o seu uso é máis limitado que os sales de rubidio ou potasio debido ao seu efecto no ritmo cardíaco.[4][99] Estes sales tamén teñen sido probados para o tratamento da epilepsia e de convulsións.[100][101]
Aplicacións nucleares e dos isótopos de cesio[editar | editar a fonte]
O cesio-137 é un radioisótopo de uso común como emisor de raios gamma en aplicacións industriais. As vantaxes deste isótopo son a súa vida media de case 30 anos, a dispoñibilidade do mesmo a partir do ciclo do combustible nuclear e o feito de que teña o 137Ba como produto estable final. Por outra banda, a súa alta solubilidade en auga é unha desvantaxe que o fai incompatible con irradiadores para a produción de subministración de comida e medicinas.[102] Tense empregado na agricultura, en tratamentos médicos para o cancro e na esterilización de comida, lodos de sumidoiros e equipo cirúrxico.[4][103] Os isótopos radioactivos de cesio empregáronse en radioterapia para tratar certos tipos de cancro,[104] pero a aparición de alternativas mellores e o risco de contaminación por mor do uso de cloruro de cesio soluble en auga provocaron que estes usos do cesio se desbotasen progresivamente.[105][106] O cesio-137 aplícase en diversos calibres de medición industrial para a humidade, densidade, nivel e viscosidade.[107] Tamén se emprega en rexistros de perforación para medir a densidade de electróns das formacións rochosas.[108]
O isótopo 137 ten diversas aplicacións en estudos hidrolóxicos.[109] Sendo un produto das reaccións nucleares de fisión, por mor das probas nucleares comezadas en 1945 ata a década dos anos 1980 este isótopo foi liberado na atmosfera, onde se absorbeu rapidamente en forma de solución.[110] As variacións anuais coñecidas durante ese período permiten a súa correlación co solo e as capas de sedimentación.[111] Outros isótopos menos habituais como o cesio-134 e, en menor medida, o cesio-135, poden empregarse na hidroloxía para medir as emisións de cesio producidas pola industria da enerxía nuclear.[112][113][114]
Outros usos[editar | editar a fonte]

O cesio e o mercurio foron empregados como propelente nalgúns primeiros deseños de motores iónicos para propulsión aeroespacial en misións interplanetarias de longa duración. O método de ionización consistía en extraer o electrón exterior do propelente ao entrar en contacto cun eléctrodo de volframio ao que se lle aplicaba unha voltaxe. Porén, as preocupacións pola acción corrosiva do cesio en compoñentes de naves espaciais dirixiron o desenvolvemento na dirección de uso de gases inertes como propelentes no lugar deste elemento. Estes gases resultan máis doados de manexar nas probas en terra e teñen un menor potencial de interferencia coa nave espacial que o cesio.[4] Eventualmente o xenon sería o elemento empregado na nave experimental Deep Space 1, lanzada no ano 1998.[115][116] Malia todo iso, téñense construído motores de propulsión de emisión de campos eléctricos que empregan un sistema simple de aceleración de ións de metal líquido como o do cesio para crear o pulo.[117]
O nitrato de cesio pode usarse como oxidante e colorante pirotécnico para a combustión de silicio en bengalas infravermellas,[118] como por exemplo na denominada LUU-19,[119] xa que este elemento emite unha gran maioría da súa luminosidade no espectro infravermello.[120] O cesio tamén se usou para reducir a sinatura de radar dos gases de escape do avión militar Lockheed SR-71 Blackbird,[121] e xunto co rubidio tense engadido en forma de carbonato ao vidro para reducir a condutividade eléctrica e mellorar a estabilidade e durabilidade da fibra óptica e dos dispositivos de visión nocturna.[4]
Diversas investigacións sobre sistemas magnetohidrodinámicos de xeración de enerxía tiveron lugar, pero non conseguiron unha aceptación xeral da comunidade científica,[122] e o metal de cesio considerouse tamén como fluído de traballo en xeradores turboeléctricos de altas temperaturas do ciclo Rankine.[123]
Precaucións[editar | editar a fonte]

Os compostos de cesio non radioactivos considéranse medianamente tóxicos. A exposición a grandes cantidades destes compostos pode causar irritabilidade e espasmos debido ás semellanzas químicas do cesio co potasio. Porén, estas grandes cantidades non se atopan nas fontes naturais do elemento e o cesio non radioactivo non se considera un perigo significante para o medio ambiente.[125] A dose letal media (DL50) do cloruro de cesio en ratos é de 2,3 g por quilogramo, valor semellante ao das DL50 do cloruro de potasio e do cloruro de sodio.[126] O principal uso do cesio non radioactivo en forma de formiato de cesio como fluído para as perforacións petrolíferas presenta unha vantaxe na súa baixa toxicidade fronte a outras alternativas de menor custo económico.[78]
O metal de cesio é un dos elementos máis reactivos, altamente explosivo ao entrar en contacto coa auga. O gas de hidróxeno producido por esta reacción quéntase por medio da enerxía térmica liberada de forma simultánea, causando unha ignición e unha explosión violenta. Isto tamén pode suceder con outros metais alcalinos, pero o cesio en particular é tan potente que pode dar lugar a esta reacción explosiva incluso con auga fría.[4] A temperatura de autoignición do cesio é de −116 °C, o que fai que sexa moi pirofórico e poida comezar unha ignición no aire formando hidróxido de cesio e varios óxidos.[9][127] O hidróxido de cesio é unha base moi forte que provoca unha corrosión moi rápida no vidro.[128]
Os isótopos 134 e 137 atópanse na biosfera en pequenas cantidades produto de diversas actividades do ser humano, e representan unha carga radioactiva que varía segundo a localización. O cesio radioactivo non se acumula no corpo humano de forma tan efectiva como outros produtos de fisión como poden ser o iodo e o estroncio. Ao redor dun 10% do cesio radioactivo absorbido expúlsase relativamente rápido en forma de suor e nos ouriños, mentres que o 90% restante ten unha vida biolóxica media de entre 50 e 150 días.[129] O cesio radioactivo tende a acumularse rapidamente nos tecidos das plantas, así como nas froitas e verduras.[130][131][132] As distintas plantas absorben o cesio de diferentes maneiras. Algunhas absorben pequenas cantidades, mentres que outras absorben grandes cantidades e presentan unha gran resistencia aos seus efectos. Os fungos de bosques contaminados tamén acumulan o cesio radioactivo (137Cs) nos seus esporocarpos.[132][133] A acumulación de cesio-137 en lagos e outros corpos de auga semellantes pasou a ser unha preocupación medioambiental mundial dende o accidente de Chernóbil.[134][135] Os resultados dunha serie de experimentos con cans amosaron que unha única dose de 3,8 milicurios por quilogramo provoca a morte en tres semanas,[136] mentres que cantidades máis pequenas poden causar infertilidade e cancro.[137] A Axencia Internacional de Enerxía Atómica e outras fontes teñen alertado da posibilidade do uso de cesio-137 xunto a outros materiais radioactivos en dispositivos de dispersión radiolóxica.[138]
Accidentes significativos[editar | editar a fonte]
O accidente radiolóxico de Goiânia foi un evento de contaminación radioactiva que tivo lugar o 13 de setembro de 1987 en Goiânia, a capital do estado brasileiro de Goiás. Unha vella fonte de radioterapia foi roubada nun hospital abandonado na cidade, e posteriormente pasou polas mans dunha multitude de persoas, resultando na morte de catro delas. Aproximadamente 112 000 persoas sometéronse a un exame para detectar contaminación radioactiva, e 249 delas presentaron niveis significativos de material radioactivo no seu corpo.[139][140]
No ano 1998 a fábrica de Acerinox en Los Barrios (Cádiz) fundíu unha cápsula de cesio-137 que se atopaba nunha consigna de ferralla.[141][142] As substancias radioactiva liberáronse na atmosfera e estendéronse por toda Euorpa. As autoridades nucleares de Francia, Alemaña, Italia e Suíza detectaron ata 2400 μBq de radiación ionizante no aire, un valor 1000 veces maior do normal.[143] Outras dúas factorías en Huelva e Badaxoz tiveron tamén contaminación debido aos residuos que se transportaron alí dende a fábrica de Acerinox,[142] e durante o proceseo de limpeza botáronse unhas 7000 toneladas de residuos radioactivos nas marismas de Mendaña, en Huelva.[144] Os custos totais deste accidente estimáronse nuns 18 millóns de euros por mór da perda de produción na factoría, 3 millóns de euros para a limpeza e outros 3 millóns de euros para o almacenamento dos residuos.[141]
Notas[editar | editar a fonte]
- ↑ Xunto co rubidio (39 °C (312 K)), o francio (est. 27 °C (300 K)), o mercurio (−39 °C (234 K)) e o galio (30 °C (303 K)). O bromo tamén é líquido a temperatura ambiente, cun punto de fusión de -7,2 °C (265,9 K), pero é un halóxeno, non un metal.
- ↑ Crese que o francio tamén ten un punto de fusión menor, pero a súa radioactividade non permite unha medición directa.[7]
- ↑ A electropositividade do francio non esta medida de forma experimental debido á súa radioactividade. As medicións da primeira enerxía de ionización do francio suxiren que os seus efectos relativistas poden reducir a súa electronegatividade máis do esperado polas pautas que marca a súa posición na táboa periódica.[18]
- ↑ Bunsen cita a Aulus Gellius Noctes Atticae II, 26 por Nigidius Figulus: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.[60]
- Referencias
Todas as referencias en inglés agás cando se indique o contrario.
- ↑ "Standard atomic weights". CIAAW. Consultado o 17 de decembro de 2015.
- ↑ 2,0 2,1 2,2 Dye, J. L. (1979). "Compounds of Alkali Metal Anions". Angewandte Chemie International Edition 18 (8): 587–598. doi:10.1002/anie.197905871.
- ↑ "Caesium: the essentials". WebElements. Consultado o 17 de decembro de 2015.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 4,12 4,13 4,14 4,15 4,16 4,17 4,18 4,19 4,20 4,21 4,22 4,23 4,24 4,25 4,26 4,27 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). U.S. Geological Survey. Arquivado dende o orixinal (PDF) o 7 de febreiro de 2007. Consultado o 27 de decembro de 2009.
- ↑ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. pp. 201–203. ISBN 0-8306-3015-5.
- ↑ Addison, C. C. (1984). The Chemistry of the Liquid Alkali Metals. Wiley. ISBN 0-471-90508-9.
- ↑ "Francium". Periodic.lanl.gov. Consultado o 23 de febreiro de 2010.
- ↑ 8,0 8,1 8,2 8,3 8,4 Kaner, Richard (2003). "C&EN: It's Elemental: The Periodic Table – Cesium". American Chemical Society. Consultado o 25 de febreiro de 2010.
- ↑ 9,0 9,1 "Chemical Data – Caesium – Cs". Royal Society of Chemistry. Consultado o 27 de setembro de 2010.
- ↑ 10,0 10,1 Lynch, Charles T. (1974). CRC Handbook of Materials Science. CRC Press. p. 13. ISBN 978-0-8493-2321-8.
- ↑ 11,0 11,1 Clark, Jim (2005). "Flame Tests". Chemguide. Consultado o 29 de xaneiro de 2012.
- ↑ Taova, T. M.; et al. (22 de xuño de 2003). "Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems" (PDF). Fifteenth symposium on thermophysical properties, Boulder, Colorado. Arquivado dende o orixinal (PDF) o 09 de outubro de 2006. Consultado o 26 de setembro de 2010.
- ↑ Deiseroth, H. J. (1997). "Alkali metal amalgams, a group of unusual alloys". Progress in Solid State Chemistry 25 (1–2): 73–123. doi:10.1016/S0079-6786(97)81004-7.
- ↑ Gray, Theodore (2012). The Elements. Black Dog & Leventhal Publishers. p. 131. ISBN 1-57912-895-5.
- ↑ 15,0 15,1 15,2 15,3 15,4 Greenwood, N.N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford, Reino Unido: Pergamon Press. ISBN 0-08-022057-6.
- ↑ Moskowitz, Clara (21 de novembro de 2013). "A Basic Rule of Chemistry Can Be Broken, Calculations Show". Scientific American. Consultado o 22 de novembro de 2013.
- ↑ 17,0 17,1 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Vergleichende Übersicht über die Gruppe der Alkalimetalle". Lehrbuch der Anorganischen Chemie (en alemán) (91–100 ed.). Walter de Gruyter. pp. 953–955. ISBN 3-11-007511-3.
- ↑ Andreev, S. V.; Letokhov, V. S.; Mishin, V. I. (1987). "Laser resonance photoionization spectroscopy of Rydberg levels in Fr". Physical Review Letters 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. PMID 10035190. doi:10.1103/PhysRevLett.59.1274.
- ↑ Marinsky, Jacob A.; Marcus, Yitzhak, eds. (1997). Ion Exchange and Solvent Extraction: A Series of Advances. CRC Press. p. 302. ISBN 9780824798253.
- ↑ Turekian, K.K.; Wedepohl, K. H. (1961). "Distribution of the elements in some major units of the Earth's crust". Geological Society of America Bulletin 72 (2): 175–192. Bibcode:1961GSAB...72..175T. ISSN 0016-7606. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2.
- ↑ Rowland, Simon (4 de xullo de 1998). "Cesium as a Raw Material: Occurrence and Uses". Artemis Society International. Arquivado dende o orixinal o 08 de xullo de 2021. Consultado o 15 de febreiro de 2010.
- ↑ Geophysical Laboratory (1955). Annual Report of the Director of the Geophysical Laboratory (Informe). Carnegie Institution of Washington. ISSN 0576-792X. LCCN sn85006894.
- ↑ 23,0 23,1 Kogel, Jessica Elzea (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. SME. p. 601,607. ISBN 9780873352338.
- ↑ 24,0 24,1 Černý, Petr; Simpson, F. M. (1978). "The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite" (PDF). Canadian Mineralogist 16: 325–333.
- ↑ 25,0 25,1 25,2 25,3 25,4 Polyak, Désirée E. (2009). Cesium (PDF) (Informe). U.S. Geological Survey. Consultado o 17 de outubro de 2009.
- ↑ Norton, J. J. (1973). "Lithium, cesium, and rubidium—The rare alkali metals". En Brobst, D. A.; Pratt, W. P. United States mineral resources 820. U.S. Geological Survey Professional. pp. 365–378. Arquivado dende o orixinal o 21 de xullo de 2010. Consultado o 26 de setembro de 2010.
- ↑ Busso, M.; Gallino, R.; Wasserburg, G. J. (1999). "Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation" (PDF). Annula Review of Astronomy and Astrophysics 37: 239–309. Bibcode:1999ARA&A..37..239B. doi:10.1146/annurev.astro.37.1.239.
- ↑ Arnett, David (1996). Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present. Princeton University Press. p. 527. ISBN 0-691-01147-8.
- ↑ Goff, C; Matchette, Michael A.; Shabestary, Nahid; Khazaeli, Sadegh (1996). "Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide". Polyhedron 15 (21): 3897–3903. doi:10.1016/0277-5387(96)00018-6.
- ↑ Brown, F.; Hall, G.R.; Walter, A.J. (1955). "The half-life of Cs137". Journal of Inorganic and Nuclear Chemistry 1 (4–5): 241–247. doi:10.1016/0022-1902(55)80027-9.
- ↑ Sonzogni, Alejandro. "Interactive Chart of Nuclides". Brookhaven National Laboratory. Arquivado dende o orixinal o 10 de outubro de 2018. Consultado o 6 de xuño de 2008.
- ↑ Ohki, Shigeo; Takaki, Naoyuki (14–16 de outubro de 2002). Transmutation of Cesium-135 with Fast Reactors (PDF). Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. Jeju, Corea do Sur. Arquivado dende o orixinal (PDF) o 28 de setembro de 2011. Consultado o 26 de setembro de 2010.
- ↑ "20 Xenon: A Fission Product Poison". CANDU Fundamentals (PDF) (Informe). CANDU Owners Group Inc. Arquivado dende o orixinal (PDF) o 23 de xullo de 2011. Consultado o 15 de setembro de 2010.
- ↑ Taylor, V. F.; Evans, R. D.; Cornett, R. J. (2008). "Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination". Journal of Environmental Radioactivity 99 (1): 109–118. PMID 17869392. doi:10.1016/j.jenvrad.2007.07.006.
- ↑ Podgorsak, Ervin B. (2010). "Modes of Radioactive Decay". Radiation Physics for Medical Physicists. Biological and Medical Physics, Biomedical Engineering. Springer Berlin Heidelberg. pp. 475–521. ISBN 978-3-642-00874-0. ISSN 1618-7210. doi:10.1007/978-3-642-00875-7.
- ↑ "Cesium | Radiation Protection". U.S. Environmental Protection Agency. 28 de xuño de 2006. Arquivado dende o orixinal o 15 de marzo de 2011. Consultado o 15 de febreiro de 2010.
- ↑ Zerriffi, Hisham (24 de maio de 2000). IEER Report: Transmutation – Nuclear Alchemy Gamble (Informe). Institute for Energy and Environmental Research. Consultado o 15 de febreiro de 2010.
- ↑ Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine (PDF) (Informe). International Atomic Energy Agency. 2005. Consultado o 17 de decembro de 2015.
- ↑ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (1993). "Transmutation of Cesium-137 Using Proton Accelerator". Journal of Nuclear Science and Technology 30 (9): 911–918. doi:10.3327/jnst.30.911.
- ↑ Knief, Ronald Allen (1992). "Fission Fragments". Nuclear engineering: theory and technology of commercial nuclear power. Taylor & Francis. p. 42. ISBN 978-1-56032-088-3.
- ↑ Ishiwatari, N.; Nagai, H. "Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR". Nippon Genshiryoku Gakkaishi 23 (11): 843–850. OSTI 5714707.
- ↑ Hogan, C. M. (2011). "Phosphate". En Jorgensen, A.; Cleveland, C.J. Encyclopedia of Earth. Washington DC: National Council for Science and the Environment. Arquivado dende o orixinal o 25 de outubro de 2012.
- ↑ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (2005). "Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology". Macrocyclic Chemistry: 383–405. ISBN 1-4020-3364-8. doi:10.1007/1-4020-3687-6_24..
- ↑ Köhler, Michael J. (1999). Etching in microsystem technology. Wiley-VCH. p. 90. ISBN 3-527-29561-5.
- ↑ Jansen, Martin (30 de novembro de 2005). "Effects of relativistic motion of electrons on the chemistry of gold and platinum". Solid State Sciences 7 (12): 1464–1474. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ↑ Senga, Ryosuke; Suenaga, Kazu (2015). "Single-atom electron energy loss spectroscopy of light elements". Nature Communications 6: 7943. PMC 4532884. PMID 26228378. doi:10.1038/ncomms8943.
- ↑ Evans, F. W.; Litt, M. H.; Weidler-Kubanek, A. M.; Avonda, F. P. (1968). "Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction". Journal of Organic Chemistry 33 (5): 1837–1839. doi:10.1021/jo01269a028.
- ↑ Wells, A.F. (1984). Structural Inorganic Chemistry (5ª ed.). Oxford Science Publications. ISBN 0-19-855370-6.
- ↑ Cotton, F. Albert; Wilkinson, G. (1962). Advanced Inorganic Chemistry. John Wiley & Sons. p. 318. ISBN 0-471-84997-9.
- ↑ Lide, David R. (2006). CRC Handbook of Chemistry and Physics (87ª ed.). Taylor & Francis. pp. 451, 514. ISBN 9780849304873.
- ↑ 51,0 51,1 Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Cesium Monoxide". Journal of Physical Chemistry 60 (3): 338–344. doi:10.1021/j150537a022.
- ↑ "Information Bridge: DOE Scientific and Technical Information" (PDF). Office of Scientific and Technical Information — U.S. Department of Energy. 23 de novembro de 2009. Consultado o 15 de febreiro de 2010.
- ↑ Vol'nov, I. I.; Matveev, V. V. (1963). "Synthesis of cesium ozonide through cesium superoxide". Bulletin of the Academy of Sciences, USSR Division of Chemical Science 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ↑ Tokareva, S. A. (1971). "Alkali and Alkaline Earth Metal Ozonides". Russian Chemical Reviews 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ↑ Simon, A. (1997). "Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels". Coordination Chemistry Reviews 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ↑ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Tricesium Monoxide". Journal of Physical Chemistry 60 (3): 345–347. doi:10.1021/j150537a023.
- ↑ Okamoto, H. (2009). "Cs-O (Cesium-Oxygen)". Journal of Phase Equilibria and Diffusion 31: 86–87. doi:10.1007/s11669-009-9636-5.
- ↑ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ↑ Brauer, G. (1947). "Untersuchungen ber das System Csium-Sauerstoff". Zeitschrift fr anorganische Chemie 255: 101–124. doi:10.1002/zaac.19472550110.
- ↑ "Kirchoff's and Bunsen's Discoveries". Monthly Homoeopathic Review (The Ohio State University) 6: 271. 1862.
- ↑ 61,0 61,1 61,2 61,3 Kirchhoff, G.; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen". Annalen der Physik und Chemie 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ↑ 62,0 62,1 62,2 Weeks, Mary Elvira (1932). "The discovery of the elements. XIII. Some spectroscopic discoveries". Journal of Chemical Education 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ↑ Zsigmondy, Richard (2007). Colloids and the Ultra Microscope. Read books. p. 69. ISBN 978-1-4067-5938-9.
- ↑ Setterberg, Carl (1882). "Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst". Justus Liebig's Annalen der Chemie (en alemán) 211: 100–116. doi:10.1002/jlac.18822110105.
- ↑ Cardarelli, François (2008). Materials Handbook: A Concise Desktop Reference (2ª ed.). Springer Science & Business Media. p. 242. ISBN 9781846286698.
- ↑ "Electronics" 1. McGraw-Hill. 1930: 222. ISSN 0013-5070. LCCN 36015816.
- ↑ Strod, A.J. (1957). "Cesium—A new industrial metal". American Ceramic Bulletin 36 (6): 212–213.
- ↑ Rose, M. E. (1987). "Mass Spectrometry". Specialist Periodical Reports 9. Royal Society of Chemistry: 125. ISBN 9780851863382. ISSN 0305-9987.
- ↑ 69,0 69,1 "Cesium Atoms at Work". Time Service Department—U.S. Naval Observatory—Department of the Navy. Arquivado dende o orixinal o 23 de febreiro de 2015. Consultado o 20 de decembro de 2009.
- ↑ Blair, B.E. (1971). "Time and Frequency: a Bibliography of NBS Literature Published July 1955-December 1970". NBS special publication 13. U.S. National Bureau of Standards: 13. LCCN 73611327.
- ↑ 71,0 71,1 71,2 71,3 71,4 Burt, R. O. (1993). "Caesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology 5 (4ª ed.). Nova York: John Wiley & Sons. pp. 749–764. ISBN 978-0-471-48494-3.
- ↑ 72,0 72,1 72,2 Bick, Manfred; Prinz, Horst (2003). "Cesium and Cesium Compounds". Ullmann's Encyclopedia of Industrial Chemistry 40 (6ª ed.). John Wiley & Sons. pp. 301–306. ISBN 9783527303854.
- ↑ Dean, K.C.; Johnson, P.H.; Nichols, I.L. (1964). "Dissolution and roasting techniques for extracting cesium from pollucite ores". Report of investigations. Bureau of Mines.
- ↑ "Metallurgia: The International Journal of Metals and Materials". 35-36. Kennedy Press. 1946. ISSN 0026-0835. LCCN 45043392.
- ↑ "Chemical elements". The New Encyclopaedia Britannica: Macropaedia : Knowledge in depth. Encyclopaedia Britannica. 2003. p. 966. ISBN 9780852299616.
- ↑ 76,0 76,1 Eagleson, Mary, ed. (1994). Concise encyclopedia chemistry. Berlín: de Gruyter. p. 198. ISBN 978-3-11-011451-5.
- ↑ Benton, William; Turner, Jim (2000). "Cesium formate fluid succeeds in North Sea HPHT field trials" (PDF). Drilling Contractor: 38–41.
- ↑ 78,0 78,1 78,2 Downs, J. D.; Blaszczynski, M.; Turner, J.; Harris, M. (febreiro de 2006). Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review. IADC/SPE Drilling Conference. Miami, Florida: USASociety of Petroleum Engineers. doi:10.2118/99068-MS. Arquivado dende o orixinal o 12 de outubro de 2007. Consultado o 18 de decembro de 2015.
- ↑ Flatern, Rick (2001). "Keeping cool in the HPHT environment". Offshore Engineer: 33–37.
- ↑ Essen, L.; Parry, J.V.L. (1955). "An Atomic Standard of Frequency and Time Interval: A Caesium Resonator". Nature 176 (4476): 280–282. Bibcode:1955Natur.176..280E. doi:10.1038/176280a0.
- ↑ Reel, Monte (22 de xullo de 2003). "Where timing truly is everything". The Washington Post. p. B1. Arquivado dende o orixinal o 29 de abril de 2013. Consultado o 26 de xaneiro de 2010.
- ↑ Rasor, Ned S.; Warner, Charles (1964). "Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces". Journal of Applied Physics 35 (9): 2589–2600. Bibcode:1964JAP....35.2589R. doi:10.1063/1.1713806.
- ↑ "Cesium Supplier & Technical Information". American Elements. Arquivado dende o orixinal o 16 de xaneiro de 2010. Consultado o 25 de xaneiro de 2010.
- ↑ Smedley, John; Rao, Triveni; Wang, Erdong (2009). "K2CsSb Cathode Development". American Institute of Physics Conference Proceedings 1149: 1062–1066. doi:10.1063/1.3215593.
- ↑ Görlich, P. (1936). "Über zusammengesetzte, durchsichtige Photokathoden". Zeitschrift für Physik (en alemán) 101 (5–6): 335–342. Bibcode:1936ZPhy..101..335G. doi:10.1007/BF01342330.
- ↑ Fiederle, Michael; Burger, Arnold; Franks, Larry; Lynn, Kelvin; Perry, Dale L.; Yasuda, Kazuhito, eds. (2012). Nuclear Radiation Detection Materials - 2011. MRS Proceedings 1341. Materials Research Society. ISBN 9781605113180.
- ↑ Birks, J. B. (2013). Fry, D.W.; Costrell, L.; Kandiah, K., eds. The Theory and Practice of Scintillation Counting. International Series of Monographs in Electronics and Instrumentation 27. Elsevier. pp. 436, 509–511. ISBN 9781483156064.
- ↑ Groeger, S.; Pazgalev, A. S.; Weis, A. (2005). "Comparison of discharge lamp and laser pumped cesium magnetometers". Applied Physics B 80 (6): 645–654. Bibcode:2005ApPhB..80..645G. arXiv:physics/0412011. doi:10.1007/s00340-005-1773-x.
- ↑ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (1994). "Internal Standards". Laboratory instrumentation. Nova York: John Wiley and Sons. p. 108. ISBN 978-0-471-28572-4.
- ↑ McGee, James D. (1969). Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968 1. Academic Press. p. 391. ISBN 978-0-12-014528-7.
- ↑ Desai, Mohamed A., ed. (2000). "Gradient Materials". Downstream processing methods. Totowa, N.J.: Humana Press. pp. 61–62. ISBN 978-0-89603-564-5.
- ↑ Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter; Sansotera, Maurizio (2001). "Cesium Fluoride". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. ISBN 9780470842898. doi:10.1002/047084289X.rc050.pub2.
- ↑ Crich, David; Hao, Xiaolin (1997). "Generation and Cyclization of Acyl Radicals from Thiol Esters Under Nonreducing, Tin-Free Conditions". The Journal of Organic Chemistry 62 (17): 5982–5988. doi:10.1021/jo970500j.
- ↑ Lidstrom, P.; Westman, J.; Lewis, A. (2002). "Enhancement of Combinatorial Chemistry by Microwave-Assisted Organic Synthesis". Combinatorial Chemistry & High Throughput Screening 5 (6): 441–458. doi:10.2174/1386207023330147.
- ↑ Wang, Su-Sun; Gisin, B. F.; Winter, D. P.; Makofske, R.; Kulesha, I. D.; Tzougraki, C.; Meienhofer, J. (1977). "Facile synthesis of amino acid and peptide esters under mild conditions via cesium salts". The Journal of Organic Chemistry 42 (8): 1286–1290. doi:10.1021/jo00428a004.
- ↑ Gooden, David S.; Brickner, Jr., T. J. (1972). "The Routine Use of Thermoluminescence Dosimetry for Radiation Therapy". Radiology 102 (3): 685–690. PMID 5060182. doi:10.1148/102.3.685.
- ↑ Chen, Z; Bongiorni, P; Nath, R. (2005). "Dose rate constant of a cesium-131 interstitial brachytherapy seed measured by thermoluminescent dosimetry and gamma-ray spectrometry". Med Phys. 32 (11): 3279–85. PMID 16372409.
- ↑ Oberhofer, M.; Scharmann, A. (1993). Techniques and Management of Personnel Thermoluminescence Dosimetry Services. Current Issues in Production Ecology 2. Springer Science & Business Media. p. 298-299. ISBN 9780792324362. ISSN 0926-9770.
- ↑ Hart, W.A. (1993). "The chemistry of Lithium, Sodium, Potasium, Rubidium, Cesium and Francium". En Parker, Sybil P. McGraw-Hill Encyclopedia of Chemistry (2ª ed.). McGraw-Hill. ISBN 978-0070454552.
- ↑ Cepeda, Carlos; André, Véronique M.; Vinters, Harry V.; Levine, Michael S.; Mathern, Gary W. (2005). "Are Cytomegalic Neurons and Balloon Cells Generators of Epileptic Activity in Pediatric Cortical Dysplasia?". Epilepsia (Blackwell Science Inc) 46: 1528–1167. doi:10.1111/j.1528-1167.2005.01013.x.
- ↑ Winston, Sheryl M.; Hayward, Michael D.; Nestler, Eric J.; Duman, Ronald S. (1990). "Chronic Electroconvulsive Seizures Down–Regulate Expression of the Immediate-Early Genes c-fos and c-jun in Rat Cerebral Cortex". Journal of Neurochemistry (Blackwell Publishing Ltd) 54 (6): 1471–4159. doi:10.1111/j.1471-4159.1990.tb04892.x.
- ↑ Okumura, Takeshi (21 de setembro de 2003-10-21). The material flow of radioactive cesium-137 in the U.S. 2000 (PDF) (Informe). United States Environmental Protection Agency. Arquivado dende o orixinal (PDF) o 20 de xullo de 2011. Consultado o 20 de decembro de 2009.
- ↑ Jensen, N. L. (1985). "Cesium". Mineral facts and problems 675. U.S. Bureau of Mines. pp. 133–138.
- ↑ "IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center". Medical News Today. 17 de decembro de 2007. Consultado o 15 de febreiro de 2010.
- ↑ Bentel, Gunilla Carleson (1996). "Caesium-137 Machines". Radiation therapy planning. McGraw-Hill Professional. pp. 22–23. ISBN 978-0-07-005115-7.
- ↑ National Research Council (U.S.). Committee on Radiation Source Use and Replacement (2008). Radiation source use and replacement: abbreviated version. National Academies Press. ISBN 978-0-309-11014-3.
- ↑ Loxton, R.; Pope, P., eds. (1995). "Level and density measurement using non-contact nuclear gauges". Instrumentation : A Reader. Londres: Chapman & Hall. pp. 82–85. ISBN 978-0-412-53400-3.
- ↑ Timur, A.; Toksoz, M. N. (1985). "Downhole Geophysical Logging". Annual Review of Earth and Planetary Sciences 13: 315–344. Bibcode:1985AREPS..13..315T. doi:10.1146/annurev.ea.13.050185.001531.
- ↑ Walling, D.E.; Quine, T.A. (1992). The use of caesium-137 measurements in soil erosion surveys (PDF). Proceedings of the Oslo Symposium. Erosion and Sediment Transport Monitoring Programmes in River Basins. IAHS 210. Arquivado dende o orixinal (PDF) o 22 de decembro de 2015. Consultado o 21 de decembro de 2015.
- ↑ Henriksen, Thormod; Maillie, David H. (2003). Radiation and Health. CRC Press. ISBN 9780203166352.
- ↑ Zhang, Xinbao; Higgitt, D. L.; Walling, D. E. (1990). "A preliminary assessment of the potential for using caesium-137 to estimate rates of soil erosion in the Loess Plateau of China". Hydrological Sciences Journal 35 (3): 243–252. doi:10.1080/02626669009492427.
- ↑ Kendall, Carol. "Isotope Tracers Project – Resources on Isotopes – Cesium". National Research Program – U.S. Geological Survey. Consultado o 2010-01-25.
- ↑ Taylor, V.F.; Evans, R.D.; Cornett, R.J. (2008). "Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination". Journal of Environmental Radioactivity 99 (1): 109–118. doi:10.1016/j.jenvrad.2007.07.006.
- ↑ Yoshida, Naohiro; Takahashi, Yoshio. "Land-Surface Contamination by Radionuclides from the Fukushima Daiichi Nuclear Power Plant Accident". Elements 8 (3): 201–206. doi:10.2113/gselements.8.3.201.
- ↑ Marcucci, M. G.; Polk, J. E. (2000). "NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)". Review of Scientific Instruments 71 (3): 1389–1400. Bibcode:2000RScI...71.1389M. doi:10.1063/1.1150468.
- ↑ Sovey, James S.; Rawlin, Vincent K.; Patterson, Michael J. "A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I" (PDF). NASA. Arquivado dende o orixinal (PDF) o 29 de xuño de 2009. Consultado o 12 de decembro de 2009.
- ↑ Marrese, C.; Polk, J.; Mueller, J.; Owens, A.; Tajmar, M.; Fink, R.; Spindt, C. (outubro de 2001). In-FEEP Thruster Ion Beam Neutralization with Thermionic and Field Emission Cathodes. 27th International Electric Propulsion Conference. Pasadena. pp. 1–15. Arquivado dende o orixinal o 27 de maio de 2010. Consultado o 25 de xaneiro de 2010.
- ↑ "Infrared illumination compositions and articles containing the same". Freepatentsonline.com. United States Patent 6230628. Consultado o 25 de xaneiro de 2010.
- ↑ "LUU-19 Flare". Federation of American Scientists. 23 de abril de 2000. Arquivado dende o orixinal o 06 de agosto de 2010. Consultado o 12 de decembro de 2009.
- ↑ Charrier, E.; Charsley, E.L.; Laye, P.G.; Markham, H.M.; Berger, B.; Griffiths, T.T. (2006). "Determination of the temperature and enthalpy of the solid–solid phase transition of caesium nitrate by differential scanning calorimetry". Thermochimica Acta 445: 36–39. doi:10.1016/j.tca.2006.04.002.
- ↑ Crickmore, Paul F. (2000). Lockheed SR-71: the secret missions exposed. Osprey. p. 47. ISBN 978-1-84176-098-8.
- ↑ National Research Council (U.S.) (2001). Energy research at DOE—Was it worth it?. National Academy Press. pp. 190–194. ISBN 978-0-309-07448-3. Consultado o 26 de setembro de 2010.
- ↑ Roskill Information Services (1984). Economics of Caesium and Rubidium (Reports on Metals & Minerals). Londres: Roskill Information Services. p. 51. ISBN 978-0-86214-250-6.
- ↑ Datos tomados a partir de:
- Nuclear Energy Agency (2002). Chernobyl: Assessment of Radiological and Health Impacts (PDF) (Informe). pp. 33–37.
- Wilson, B. J. The Radiochemical Manual (2ª ed.). Radiochemical Centre. ASIN B000X8JACI.
- ↑ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A 16 (5): 549– 567. doi:10.1080/10934528109375003.
- ↑ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Acute toxicity of cesium and rubidium compounds". Toxicology and Applied Pharmacology 32 (2): 239–245. PMID 1154391. doi:10.1016/0041-008X(75)90216-1.
- ↑ Lynch, Charles T. (1989). Practical handbook of matérials science. CRC Press. p. 14. ISBN 9780849337024.
- ↑ Emsley, John (2001). "Caesium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. p. 83. ISBN 9780198503408.
- ↑ Rundo, J. (1964). "A Survey of the Metabolism of Caesium in Man". British Journal of Radiology 37 (434): 108–114. PMID 14120787. doi:10.1259/0007-1285-37-434-108.
- ↑ Nishita, H.; Dixon, D.; Larson, K. H. (1962). "Accumulation of Cs and K and growth of bean plants in nutrient solution and soils". Plant and Soil 17 (2): 221–242. doi:10.1007/BF01376226.
- ↑ Avery, S. (1996). "Fate of caesium in the environment: Distribution between the abiotic and biotic components of aquatic and terrestrial ecosystems". Journal of Environmental Radioactivity 30 (2): 139–171. doi:10.1016/0265-931X(96)89276-9.
- ↑ 132,0 132,1 Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (1992). "Availability of caesium isotopes in vegetation estimated from incubation and extraction experiments". Analyst 117 (3): 487–491. Bibcode:1992Ana...117..487S. PMID 1580386. doi:10.1039/AN9921700487.
- ↑ "Accumulation of potassium, rubidium and caesium (133Cs and 137Cs) in various fractions of soil and fungi in a Swedish forest". Science of The Total Environment 408 (12): 2543–2548. 2010. doi:10.1016/j.scitotenv.2010.02.024.
- ↑ Smith, Jim T.; Beresford, Nicholas A. (2005). Chernobyl: Catastrophe and Consequences. Berlín: Springer. ISBN 3-540-23866-2.
- ↑ Eremeev, V. N.; Chudinovskikh, T. V.; Batrakov, G. F.; Ivanova, T. M. (1991). "Radioactive isotopes of caesium in the waters and near-water atmospheric layer of the Black Sea". Physical Oceanography 2 (1): 57–64. doi:10.1007/BF02197418.
- ↑ Redman, H. C.; McClellan, R. O.; Jones, R. K.; Boecker, B. B.; Chiffelle, T. L.; Pickrell, J. A.; Rypka, E. W. (1972). "Toxicity of 137-CsCl in the Beagle. Early Biological Effects". Radiation Research 50 (3): 629–648. JSTOR 3573559. PMID 5030090. doi:10.2307/3573559.
- ↑ "Chinese 'find' radioactive ball". BBC News. 27 de marzo de 2009. Consultado o 25 de xaneiro de 2010.
- ↑ Charbonneau, Louis (12 de marzo de 2003). "IAEA director warns of 'dirty bomb' risk". The Washington Post. Reuters. p. A15. Arquivado dende o orixinal o 05 de decembro de 2008. Consultado o 28 de abril de 2010.
- ↑ The Radiological accident in Goiânia (PDF). Viena: International Atomic Energy Agency. 1988. ISBN 92-0-129088-8.
- ↑ Foderaro, Lisa (8 de xullo de 2010). "Columbia Scientists Prepare for a Threat: A Dirty Bomb"". The New York Times. Consultado o 26 de xaneiro de 2016.
- ↑ 141,0 141,1 Azuara, JA (1999). Main Issues in the Acerinox Event. Procs. Conf. Safety of Radiation Sources and Security of Radioactive Materials, Dijon. International Atomic Energy Agency.
- ↑ 142,0 142,1 "El CSN detectó la fuga antes del 9 de junio, pero no informó por considerarla menor". La Vanguardia (en castelán). 17 de xuño de 1998.
- ↑ de Elvira, MR (23 de setembro de 1998). "El caro incidente de la chatarra en Cádiz". El País (en castelán) (Madrid).
- ↑ "Los Verdes exige que el cesio de Mendaña sea trasladado a El Cabril". Huelva Información (en castelán). 7 de febreiro de 2008.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Cesio |
Bibliografía[editar | editar a fonte]
- "Táboa periódica dos elementos" (PDF). Consello da Cultura Galega, Xunta de Galicia, Real Academia Galega de Ciencias, Real Academia Galega e Ciencia Nosa. 2019.
- Bermejo, M. R.; González, A.; Vázquez, M. (2006). O nome e o símbolo dos elementos químicos (PDF). Xunta, Secretaría Xeral de Política Lingüística e CRPIH. ISBN 978-84-453-4325-8.
- Bermejo, M. R.; González, A.; Maneiro, M. (2018). Guía dos elementos químicos. Historia, propiedades e aplicacións. Xunta de Galicia e CRPIH. ISBN 978-84-453-5297-7.
Ligazóns externas[editar | editar a fonte]
- Steck, Daniel A. (2 de maio de 2008). "Cesium D Line Data" (PDF) (en inglés). Revisión 2.0.1.
- "Toxic Substances Portal - Cesium". Agency for Toxic Substances and Disease Registry (en inglés).
