Ácido
  | |
  | |
|
Un ácido (do latín acidus, que significa agre) é considerado tradicionalmente como calquera composto químico que, cando se disolve en auga, produce unha solución cunha actividade de catión hidronio maior que a auga pura, isto é, un pH menor que 7. Isto aproxímase á definición moderna de Johannes Nicolaus Brønsted e Thomas Martin Lowry, quen definiron independentemente un ácido como un composto que doa un catión hidróxeno H+
a outro composto (denominado base). Algúns exemplos comúns son o ácido acético (no vinagre), o ácido clorhídrico (no salfumant e os mollos gástricos), o ácido acetilsalicílico (na aspirina), ou o ácido sulfúrico (usado en baterías de automóbil). Os sistemas ácido/base diferéncianse das reaccións redox en que, nestas últimas hai un cambio no estado de oxidación. Os ácidos poden existir en forma de sólidos, líquidos ou gases, dependendo da temperatura e tamén poden existir como substancias puras ou en solución.
O concepto de ácido é o contraposto ao de base. Para medir a acidez dun medio utilízase o concepto de pH. Ás substancias químicas que teñen a propiedade dun ácido denomínanse ácidas.
Distintas definicións de "ácido":[editar | editar a fonte]
Os ácidos son substancias capaces de doar un protón (H ), mentres que as bases son capaces de aceptalos. A definición anterior corresponde a formulada por Brönsted e Lowry en 1923, e xeneraliza a teoría anterior a definición do químico sueco Arrhenius (1859 - 1927), de 1887. Segundo a definición de Arrhenius un ácido é unha substancia que ao ionizarse produce ións H+ (en solución acuosa). A teoría de Brönsted e Lowry de ácidos tamén serve para disolucións non acuosas; as dúas teorías son moi parecidas na definición de ácido, pero a de Bronsted-Lowry é moito máis xeral.
Lewis en 1923 ampliou aínda máis a definición de ácidos, teoría que non obtivo repercusión ata algúns anos máis tarde. Segundo a teoría de Lewis un ácido é aquela especie química que, en calquera medio, pode aceptar un par de electróns. Desta forma inclúense substancias que se comportan como ácidos, pero non cumpren a definición de Brönsted e Lowry, sendo denominadas ácidos de Lewis. Visto que o protón, segundo esta definición, é un ácido de Lewis (ten baleiro o orbital 1s, onde pode aloxarse o par de electróns), pódese afirmar que todos os ácidos de Brönsted-Lowry son ácidos de Lewis, e todos os ácidos de Arrhenius son de Bronsted-Lowry.
- Exemplos de ácidos de Brönsted e Lowry: HCl, HNO3, H3PO4.
- Se estiveren en solución acuosa tamén son ácidos de Arrhenius.
- Exemplos de ácidos de Lewis: Ag+, AlCl3, CO2, SO3.
Propiedades dos ácidos[editar | editar a fonte]
- Teñen sabor agre como no caso do ácido cítrico da laranxa e do limón.
- Cambian a cor do papel tornasol azul a rosa, o laranxa de metilo de laranxado a vermello e deixa incolora á fenolftaleína.
- Son corrosivos.
- Producen queimaduras da pel.
- Son bos condutores de electricidade en disolucións acuosas.
- Reaccionan con metais activos formando un sal e hidróxeno.
- Reaccionan con bases para formar un sal máis auga.
- Reaccionan con óxidos metálicos para formar un sal máis auga.
Ácidos de Arrhenius[editar | editar a fonte]

O químico sueco Svante Arrhenius foi o primeiro en atribuír as propiedades de acidez ao hidróxeno en 1884. Un ácido de Arrhenius é unha substancia que aumenta a concentración de catión hidronio, 3O+, cando se disolve en auga. Esta definición parte do equilibrio da disociación da auga en hidronio e hidróxido:
- H2O(l) + H2O (l) ⇌ H3O+(ac) + OH-(ac)
En auga pura, a maioría das moléculas existen como H2O, pero un número pequeno de moléculas están constantemente disociándose e reasociándose. A auga pura é neutra con respecto á acidez ou basicidade, debido a que a concentración de ions hidróxido é sempre igual á concentración de ions hidronio. Unha base de Arrhenius é unha molécula que aumenta a concentración do ion hidróxido cando está disolta en auga. En química escríbese con frecuencia H+(ac) significando ion hidróxeno ou protón ao describir reaccións ácido-base, pero non hai evidencia suficiente de que exista en disolución acuosa o núcleo de hidróxeno libre; si que está probada a existencia do ion hidronio, H3O+ e ata de especies de maior nuclearidade. Os compostos que non teñen hidróxeno na súa estrutura non son considerados ácidos de Arrhenius. Tampouco son bases de Arrhenius os compostos que non teñen OH na súa estrutura.
Ácidos de Brønsted-Lowry[editar | editar a fonte]
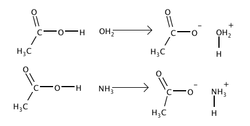
Aínda que o concepto de Arrhenius é moi útil para describir moitas reaccións, tamén está un pouco limitado no seu alcance. En 1923, os químicos Johannes Nicolaus Brønsted e Thomas Martin Lowry recoñeceron independentemente que as reaccións ácido-base involucran a transferencia dun protón. Un ácido de Brønsted-Lowry (ou simplemente ácido de Brønsted) é unha especie que doa un protón a unha base de Brønsted-Lowry. A teoría ácido-base de Brønsted-Lowry ten varias vantaxes sobre a teoría de Arrhenius. Considere as seguintes reaccións do ácido acético (CH3COOH), o ácido orgánico que lle dá ao vinagre o seu sabor característico:
Ambas teorías describen facilmente a primeira reacción: o CH3COOH actúa como un ácido de Arrhenius porque actúa como fonte de H3O+ cando está disolto en auga, e actúa como un ácido de Brønsted ao doar un protón á auga. No segundo exemplo, o CH3COOH sofre a mesma transformación, doando un protón ao amoníaco (NH3), pero non pode ser descrito usando a definición de Arrhenius dun ácido, porque a reacción non produce catións hidronio. A teoría de Brønsted-Lowry tamén pode ser usada para describir compostos moleculares, mentres que os ácidos de Arrhenius deben ser compostos iónicos. O cloruro de hidróxeno (HCl) e o amoníaco combínanse baixo varias condicións diferentes para formar cloruro de amonio, NH4Cl. En solución acuosa, o HCl compórtase como ácido clorhídrico e existe como catións hidronio e anións cloruro. As seguintes reaccións ilustran as limitacións da definición de Arrhenius:
- 1.) H3O+(ac) + Cl-(ac) + NH3 → Cl-(ac) + NH
(aq) - 2.) HCl(benceno) + NH3(benceno) → NH4Cl(s)
- 3.) HCl(g) + NH3(g) → NH4Cl(s)
Como coas reaccións do ácido acético, ambas definicións traballan para o primeiro exemplo, onde a auga é o líquido e fórmase ion hidronio. As seguintes dúas reaccións non involucran a formación de ións, pero poden ser vistas como reaccións de transferencia de protóns. Na segunda reacción, o cloruro de hidróxeno e o amoníaco reaccionan para formar cloruro de amonio sólido nun liquide benceno, e na terceira, HCl gaseoso e NH3 combínanse para formar o sólido.
Ácidos de Lewis[editar | editar a fonte]
Un terceiro concepto foi proposto polo físicoquímico Gilbert N. Lewis en 1923, o cal inclúe reaccións con características ácido-base que non involucran unha transferencia de protóns. Un ácido de Lewis é unha especie que acepta un par de electróns doutra especie; noutras palabras, é un aceptor de par de electróns. As reaccións ácido-base de Brønsted son reaccións de transferencia de protones, mentres que as reaccións ácido-base de Lewis son transferencias de pares de electróns. Todos os ácidos de Brønsted son tamén ácidos de Lewis, pero non todos os ácidos de Lewis son ácidos de Brønsted. As seguintes reaccións poderían ser descritas en termos de química ácido-base
Na primeira reacción, un anión fluoruro, F-, cede un par electrónico ao trifluoruro de boro para formar o produto tetrafluoroborato. O fluoruro "perde" un par de electróns de valencia debido a que os electróns compartidos no enlace B-F están situados na rexión de espazo entre os dous núcleos atómicos e, en consecuencia, están máis distantes do núcleo do fluoruro que no anión fluoruro solitario. BF3 é un ácido de Lewis porque acepta o par de electróns do fluoruro. Esta reacción non pode ser descrita en termos da teoría de Brønsted, debido a que non hai transferencia de protóns. A segunda reacción pode ser descrita por calquera das dúas últimas teorías. Un protón é transferido desde un ácido de Brønsted non especificado cara ao amoníaco, unha base de Brønsted; alternativamente, o amoníaco actúa como unha base de Lewis e transfire un par libre de electróns para formar un enlace cun ión hidróxeno. A especie que gaña o par de electróns é o ácido de Lewis; por exemplo, o átomo de osíxeno en H3O+ gaña un par de electróns cando un dos enlaces H-O se rompe, e os electróns compartidos no enlace localízanse no osíxeno. Dependendo do contexto, os ácidos de Lewis tamén poden ser descritos como axentes redutores ou como electrófilo.
A definición de Brønsted-Lowry é a definición máis amplamente usada; salvo que se especifique doutro xeito, asúmese que as reaccións ácido-base involucran a transferencia dun catión hidrón (H+) dun ácido a unha base.
Disociación e equilibrio[editar | editar a fonte]
As reaccións de ácidos son xeneralizadas frecuentemente na forma HA ⇌ H+ + A-, onde HA representa o ácido, e A- é a base conxugada. Os pares ácido-base conxugados difieren nun protón, e poden ser interconvertidos pola adición ou eliminación dun protón (protonación e deprotonación, respectivamente). Obsérvese que o ácido pode ser a especie cargada, e a base conxugada pode ser neutra, nese caso o esquema de reacción xeneralizada podería ser descrito como HA+ ⇌ H+ + A. En solución existe un equilibrio entre o ácido e a súa base conxugada. A constante de equilibrio K é unha expresión das concentracións do equilibrio das moléculas ou ións en solución. Os corchetes indican concentración, así [H2O] significa a concentración de [H2O]. A constante de disociación ácida Ka é usada xeralmente no contexto das reaccións ácido-base. O valor numérico de Ka é igual á concentración dos produtos, dividida pola concentración dos reactantes, onde o reactante é o ácido (HA) e os produtos son a base conxugada e H+.
O máis forte dos dous ácidos terá Ka maior que o ácido máis débil; a relación dos ións hidróxeno ao ácido será maior para o ácido máis forte, posto que o ácido máis forte ten unha tendencia maior a perder o seu protón. Debido ao rango de valores posibles para Ka esténdese por varias ordes de magnitude, máis frecuentemente utilízase unha constante máis manipulable, pKa, onde pKa = -log10 Ka. Os ácidos máis fortes teñén pKa menor que os ácidos débiles. Os valores de pKa. determinados experimentalmente a 25 °C en solución acuosa adoitan presentarse en libros de texto e material de referencia.
Forza dos ácidos[editar | editar a fonte]
A forza dun ácido refírese á súa habilidade ou tendencia a perder un protón. Un ácido forte é un que se disocia completamente en auga; noutras palabras, un mol dun ácido forte HA disólvese en auga producindo un mol de H+ e un mol do seu base conxugada, A-, e nada do ácido protonado HA. En contraste, un ácido débil se disocia só parcialmente e, no equilibrio, existen na solución tanto o ácido como a súa base conxugada. Algúns exemplos de ácidos fortes son o ácido clorhídrico (HCl), ácido iodhídrico (HI), ácido bromhídrico (HBr), ácido perclórico (HClO4), ácido nítrico (HNO3) e ácido sulfúrico (H2SO4). En auga, cada un destes ionizase practicamente ao 100%. Mentres máis forte sexa un ácido, máis facilmente perde un protón, H+. Dous factores clave que contribúen á facilidade de deprotonación son a polaridade do enlace H-A. A forza dos ácidos adoita ser discutida tamén en termos da estabilidade da base conxugada.
Os ácidos máis fortes teñen Ka máis alto, e pKa máis baixo que os ácidos máis débiles.
Os ácidos alquilsulfónicos e arilsulfónicos, que son oxiácidos orgánicos, son un tipo de ácidos fortes. Un exemplo común é o ácido toluenosulfónico (ácido tósico ou tosílico). A diferenza do ácido sulfúrico mesmo, os ácidos sulfónicos poden ser sólidos. En efecto, o poliestireno funcionalizado en sulfonato de poliestireno, é un plástico sólido fortemente ácido, que é filtrable.
Os superácidos son ácidos máis fortes que o ácido sulfúrico ao 100%. Algúns exemplos de superácidos son o ácido fluoroantimónico, ácido máxico e ácido perclórico. Os superácidos poden protonar permanentemente a auga, para producir "sales" de oxonio iónicas, cristalinas. Tamén poden estabilizar cuantitativamente aos carbocatións.
Polaridade e o efecto indutivo[editar | editar a fonte]
A polaridade refírese á distribución de electróns nun enlace químico, a rexión de espazo entre dous núcleos atómicos onde se comparte un par de electróns (ver TREPEV). Cando os dous átomos teñen aproximadamente a mesma electronegatividade (potencia para atraer electróns do enlace), os electróns son compartidos aproximadamente por igual e pasan o mesmo tempo en calquera extremo do enlace. Cando hai unha diferenza significativa nas electronegatividades dos dous átomos enlazados, os electróns pasan máis tempo preto ao núcleo do elemento máis electronegativo, e fórmase un dipolo eléctrico, ou separación de cargas, tal que hai unha carga parcial negativa localizada no elemento electronegativo, e unha carga parcial positiva no elemento electropositivo. O hidróxeno é un elemento electropositivo e acumula unha carga lixeiramente positiva cando está unido a un elemento electronegativo, como o osíxeno ou o bromo. Ao decrecer a densidade electrónica no átomo de hidróxeno, faise máis fácil que sexa abstraído en forma de protón, noutras palabras, é máis ácido. Ao moverse de esquerda a dereita ao longo dunha fila na táboa periódica, os elementos tenden a facerse máis electronegativos, e a forza do ácido binario formado polo elemento aumenta coherentemente en:
| Fórmula | Nome | pKa[1] |
|---|---|---|
| HF | ácido fluorhídrico | 3.17 |
| H2O | auga | 15.7 |
| NH3 | amoníaco | 38 |
| CH4 | metano | 48 |
O elemento electronegativo non necesita estar unido directamente ao hidróxeno ácido para incrementar a súa acidez. Un átomo electronegativo pode "tomar" densidade electrónica desde o enlace ácido, a través do efecto indutivo. A habilidade para atraer electróns diminúe rapidamente coa distancia do elemento electronegativo ao enlace ácido. O efecto é ilustrado pola seguinte serie de ácidos butanoicos haloxenados. O cloro é máis electronegativo que o bromo e, en consecuencia, ten o efecto máis forte. O átomo de hidróxeno unido ao osíxeno é o hidróxeno ácido. O ácido butanoico é un ácido carboxílico.
| Estrutura | Nome | pKa[2] |
|---|---|---|

|
ácido butanoico | ≈4.8 |

|
ácido 4-clorobutanoico | 4.5 |

|
ácido 3-clorobutanoico | ≈4.0 |
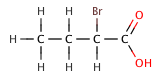
|
ácido 2-bromobutanoico | 2.93 |

|
ácido 2-clorobutanoico | 2.86 |
Á vez que o átomo de cloro afástase do enlace ácido O-H, o efecto diminúe. Cando o átomo de cloro está a un átomo de carbono de distancia do grupo ácido carboxílico, a acidez do composto increméntase significativamente, comparado co ácido butanoico (tamén chamado ácido butírico). Con todo, cando o átomo de cloro está separado por varios enlaces, o efecto é moito menor. O bromo é máis electronegativo que o carbono ou o hidróxeno, pero non tan electronegativo como o cloro, co que o pKa do ácido 2-bromobutanoico é lixeiramente maior co pKa do ácido 2-clorobutanoico.

O número de átomos electronegativos adxacentes a un enlace ácido tamén afecta á forza do ácido. Os oxiácidos teñen a fórmula xeral HOX, onde X pode ser calquera átomo e pode ou non compartir enlaces con outros átomos. Ao aumentar o número de átomos ou grupos electronegativos no átomo X, diminúese a densidade electrónica no enlace ácido, facendo que a perda do protón sexa máis fácil. O ácido perclórico é un ácido moi forte (pKa ≈ -8), e disociase completamente en auga. A súa fórmula química é HClO4, e comprende un átomo de cloro central, con catro átomos de osíxeno ao redor, un dos cales está unido a un átomo de hidróxeno extremadamente ácido, que é eliminable facilmente. En contraste, o ácido clórico (HClO3) é un ácido algo menos forte (pKa = -1.0), mentres que o ácido cloroso (HClO2, pKa = +2.0) e o ácido hipocloroso (HClO, pKa = +7.53) son ácidos débiles.[3]
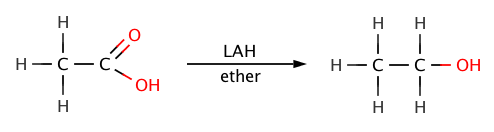
Os ácidos carboxílicos son ácidos orgánicos que conteñen un grupo hidroxilo ácido e un grupo carbonilo. Os ácidos carboxílicos poden ser reducidos ao alcohol correspondente; a substitución dun átomo de osíxeno electronegativo con dous átomos de hidróxeno electropositivos conduce a un produto que é esencialmente non ácido. A redución do ácido acético a etanol usando LiAlH4 (hidruro de litio e aluminio o LAH) e éter é un exemplo de dita reacción.
O valor de pKa para o etanol é 16, comparado con 4,76 para o ácido acético.[2][4]
Raio atómico e forza do enlace[editar | editar a fonte]
Outro factor que contribúe á habilidade dun ácido para perder un protón é a forza de enlace entre o hidróxeno ácido e o anión da molécula que o ten (ver base conxugada). Isto, á súa vez, é dependente do tamaño dos átomos que comparten o enlace. Para un ácido HA, á vez que aumenta o tamaño do átomo A, a forza do enlace diminúe, significando isto que é máis fácil de ser roto, e a forza do ácido aumenta. A forza do enlace é unha medida de canta enerxía é necesaria para romper un enlace. Noutras palabras, require menos enerxía romper o enlace cando o átomo A se fai máis grande, e o protón é máis facilmente removible por unha base. Isto explica parcialmente por que o ácido fluorhídrico é considerado un ácido débil, mentres que os demais ácidos de halóxeno (HCl, HBr, HI) son ácidos fortes. Aínda que o flúor é máis electronegativo que os outros halóxenos, o seu raio atómico é tamén moito menor, polo que comparte un enlace forte co hidróxeno. Ao moverse cara a abaixo nunha columna na táboa periódica, os átomos fanse menos electronegativos, pero tamén significativamente máis grandes, e o tamaño do átomo tende a dominar a acidez no enlace co hidróxeno. O sulfuro de hidróxeno, H2S, é un ácido máis forte que a auga, aínda que o osíxeno é máis electronegativo que o xofre. Isto é debido a que o xofre é máis grande que o osíxeno, e o enlace hidróxeno-xofre é máis facilmente rompible que o enlace hidróxeno-osíxeno.
Características químicas[editar | editar a fonte]
Ácidos monopróticos[editar | editar a fonte]
Os ácidos monopróticos son aqueles ácidos que son capaces de doar un protón por molécula durante o proceso de disociación química (chamado algunhas veces ionización), como se mostra a continuación (simbolizado por HA):
- HA(aq) + H2O(l) ⇌ H3O+(ac) + A−(ac) Ka
Algúns exemplos comúns de ácidos monopróticos en ácidos minerais inclúen ao ácido clorhídrico (HCl) e o ácido nítrico (HNO3). Por outra banda, para os ácidos orgánicos, o termo xeralmente indica a presenza dun grupo carboxilo, e algunhas veces estes ácidos son coñecidos como ácidos monocarboxílicos. Algúns exemplos de ácidos orgánicos inclúen o ácido fórmico (HCOOH), o ácido acético (CH3COOH) e o ácido benzoico (C6H5COOH).
Ácidos polipróticos[editar | editar a fonte]
Os ácidos polipróticos son capaces de doar máis dun protón por molécula de ácido, en contraste aos ácidos monopróticos que só doan un protón por molécula. Os tipos específicos de ácidos polipróticos teñen nomes máis específicos, como ácido diprótico (dous protóns potenciais para doar) e ácido triprótico (tres protóns potenciais para doar).
Un ácido diprótico (simbolizado aquí como H2A) pode sufrir unha ou dúas disociacións, dependendo do pH. Cada disociación ten a súa propia constante de disociación, Ka1 e Ka2.
- H2A(ac) + H2O(l) ⇌ H3O+(ac) + HA−(ac) Ka1
- HA−(ac) + H2O(l) ⇌ H3O+(ac) + A2−(ac) Ka2
A primeira constante de disociación é maior que a segunda; isto é: Ka1 > Ka2. Por exemplo, o ácido sulfúrico (H2SO4) pode doar un protón para formar o anión bisulfato (HSO
), para o que Ka1 é moi grande; logo pode doar un segundo protón para formar o anión sulfato (SO
), onde Ka2 é comparativamente pequeno, indicando unha forza intermedia. O valor grande de Ka1 para a primeira disociación significa que o ácido sulfúrico é un ácido forte. De modo similar, o inestable e débil ácido carbónico (H2CO3) pode perder un protón para formar o anión bicarbonato (HCO
) e perder un segundo protón para formar o anión carbonato (CO
). Ambos valores de Ka son pequenos, pero Ka1 > Ka2.
Un ácido triprótico (H3A) pode sufrir unha, dúas, ou tres disociacións, e ten tres constantes de disociación, onde Ka1 > Ka2 > Ka3.
- H3A(ac) + H2O(l) ⇌ H3O+(ac) + H2A−(ac) Ka1
- H2A−(ac) + H2O(l) ⇌ H3O+(ac) + HA2−(ac) Ka2
- HA2−(ac) + H2O(l) ⇌ H3O+(ac) + A3−(ac) Ka3
Un exemplo inorgánico dun ácido triprótico é o ácido ortofosfórico (H3PO4), xeralmente chamado simplemente ácido fosfórico. Os tres protóns poden ser perdidos consecutivamente, producindo H2PO
, logo HPO
, e finalmente PO
, o anión ortofosfato, simplemente chamado fosfato. Un exemplo orgánico de ácido triprótico é o ácido cítrico, que pode perder consecutivamente tres protóns para formar finalmente o anión citrato. Aínda que as posicións dos protóns na molécula orixinal poden ser equivalentes, os valores de Ka defiren posto que é enerxeticamente menos favorable perder un protón se a base conxugada está cargada negativamente.
Neutralización[editar | editar a fonte]

A neutralización é a reacción entre un ácido e unha base, producindo un sal e base neutralizado; por exemplo, o ácido clorhídrico e o hidróxido de sodio forman cloruro de sodio e auga:
- HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq)
A neutralización é a base da titulación, onde un indicador de pH mostra o punto de equivalencia cando o número equivalente de moles dunha base foron engadidos a un ácido. Xeralmente asúmese incorrectamente que a neutralización resulta nunha solución con pH 7,0, o que é soamente o caso cando o ácido e a base teñen forza similar durante a reacción e atópanse en concentracións semellantes. A neutralización cunha base máis débil que o ácido resulta nun sal debilmente ácido. Un exemplo é o cloruro de amonio, que é debilmente ácido, producido a partir do ácido forte cloruro de hidróxeno e a base débil amoníaco. Recíprocamente, a neutralización dun ácido débil cunha base forte produce un sal debilmente básico, por exemplo, o fluoruro de sodio, formado a partir do fluoruro de hidróxeno e o hidróxido de sodio.
Equilibrio ácido débil/base débil[editar | editar a fonte]
- Artigo principal: Ecuación de Henderson-Hasselbalch.
Para que se poida perder un protón, é necesario que o pH do sistema suba sobre o valor de pKa do ácido protonado. A diminución na concentración de H na solución básica despraza o equilibrio cara á base conxugada (a forma deprotonada do ácido). En solucións a menor pH (máis ácidas), hai suficiente concentración de H na solución para que o ácido permaneza na súa forma protonada, ou para que se protone a base conxugada.
As solucións de ácidos débiles e sales das súas bases conxugadas forman as solucións tampón.
Dureza de ácidos[editar | editar a fonte]
- Artigo principal: Teoría ácido-base duro-brando.
En 1963, Pearson introduciu o concepto de ácidos e bases duros e brandos. Son ácidos duros aqueles catións de pequeno tamaño e alta carga, de baixa polarizabilidade: alcalinos, alcalinotérreos lixeiros, catións de transición de alta carga, como o Ti4+, Cr3+, Fe3+, Co2+etc.
Son ácidos brandos as especies químicas de gran tamaño, pequena ou nula carga, e alta polarizabilidade: metais máis pesados de carga máis baixa, como Ag+, Cu+, Pt2+, Hg2+etc.
As especies duras tenden a combinarse entre si. A interacción duro-duro ou brando-brando conduce a especies máis estables. Isto débese a un maior solapamento de orbitais, que orixina un enlace máis forte que nas interaccións duro-brando ou brando-duro. O anterior é útil, de forma aproximada, para predicir o sentido de numerosas reaccións.
Aplicacións dos ácidos[editar | editar a fonte]
Hai numerosos usos dos ácidos. Os ácidos son usados frecuentemente para eliminar ferruxe e outra corrosión dos metais nun proceso coñecido como pickling. Poden ser usados tamén como electrólitos nunha batería, como o ácido sulfúrico nunha batería de automóbil.
Os ácidos fortes, o ácido sulfúrico en particular, son amplamente usados en procesamento de minerais. Por exemplo, os minerais de fosfato reaccionan con ácido sulfúrico producindo ácido fosfórico para a produción de fertilizantes, e o cinc é producido disolvendo óxido de cinc en ácido sulfúrico, purificando a solución e aplicando electrólise.
Na industria química, os ácidos reaccionan nas reaccións de neutralización para producir sales. Por exemplo, o ácido nítrico reacciona co amoníaco para producir nitrato de amonio, un fertilizante. Adicionalmente, os ácidos carboxílicos poden ser esterificados con alcoholes en presenza de ácido sulfúrico, para producir ésteres.
Os ácidos son usados como catalizadores; por exemplo, o ácido sulfúrico é usado en grandes cantidades no proceso de alquilación para producir gasolina. Os ácidos fortes, como o ácido sulfúrico, fosfórico e clorhídrico, tamén teñen efecto en reaccións de deshidratación e condensación. Os ácidos son usados tamén como aditivos en bebidas e alimentos, posto que alteran o seu sabor e serven como preservantes. Por exemplo, o ácido fosfórico é un compoñente das bebidas con cola.
Abundancia biolóxica[editar | editar a fonte]

Moitas moléculas bioloxicamente importantes son ácidos. Os ácidos nucleicos, incluíndo ao ADN e o ARN conteñen o código xenético que determina moitas das características dun organismo, e é transferido de pais a fillos. O ADN contén o molde químico para a síntese das proteínas, que están feitas de subunidades de aminoácidos.
Un α-aminoácido ten un carbono central (o carbono α ou alfa) que está unido a un grupo carboxilo (por iso é polo que son ácidos carboxílicos), un grupo amino, un átomo de hidróxeno, e un grupo variable. O grupo variable, tamén chamado grupo R ou cadea lateral, determina a identidade e moitas das propiedades dun aminoácido específico. Na glicina, o aminoácido máis simple, o grupo R é un átomo de hidróxeno, pero en todos os demais aminoácidos contén un ou máis átomos de carbono unidos a hidróxeno, e pode conter outros elementos, tales como xofre, selenio, osíxeno ou nitróxeno. Con excepción da glicina, os aminoácidos presentes na natureza son quirales e case invariablemente están presentes na configuración L. Algúns peptidoglicanos, atopados nalgunhas paredes celulares bacterianas conteñen pequenas cantidades de D-aminoácidos. A pH fisiolóxico, típicamente ao redor de 7, existen aminoácidos libres en forma iónica, onde o grupo carboxilo ácido (-COOH) perde un protón (-COO-) e o grupo amino básico (-NH2) gaña un protón (-NH+3). A molécula enteira teñen unha carga neta neutra, e é un zwitterión.
Os ácidos graxos e derivados de ácidos graxos son outro grupo de ácidos carboxílicos que xogan un rol significativo en bioloxía. Estes conteñen longas cadeas de hidrocarburo e un grupo ácido carboxílico nun extremo. A membrana celular de case todos os organismos está feita principalmente dunha bicapa fosfolipídica, unha micela de cadeas hidrofóbicas de ácidos graxos con grupos fosfato hidrofílicos.
En humanos e moitos outros animais, o ácido clorhídrico é parte do ácido gástrico segregado no estómago para axudar a hidrolizar ás proteínas, así como para converter a proenzima inactiva pepsinóxeno na enzima activa pepsina. Algúns organismos producen ácidos para a súa defensa; por exemplo, as formigas producen o ácido fórmico.
O equilibrio ácido-base xoga un rol crítico na regulación da respiración dos mamíferos. O gas osíxeno (O2) leva a cabo a respiración celular, proceso polo cal os animais liberan a enerxía potencial química almacenada nos alimentos, producindo dióxido de carbono (CO2) como produto. O osíxeno e o dióxido de carbono son intercambiados nos pulmóns, e o corpo responde as demandas enerxéticas variables axustando a velocidade de ventilación pulmonar. Por exemplo, durante períodos de exercitación, o corpo rompe rapidamente os carbohidratos almacenados, liberando CO2 ao torrente sanguíneo. En solucións acuosas como o sangue, o CO2 existe en equilibrio con ácido carbónico e o anión bicarbonato.
- CO2 + H2O ⇌ H2CO3 ⇌ H+ + HCO3-
É a diminución no pH o sinal que leva ao cerebro para respirar máis rapidamente e profundo, liberando o exceso de CO2 e resuministrando ás células con O2.

As membranas celulares son xeralmente impermeables ás moléculas polares, cargadas ou grandes, debido ás cadeas graxas acílicas lipófilas contidas no seu interior. Moitas moléculas biolóxicamente importantes, incluíndo un gran número de axentes farmacéuticos, son ácidos orgánicos débiles que poden crusar a membrana na súa forma protonada, na forma sen carga, pero non poden facelo na súa forma cargada (como base conxugada). Por esta razón, a actividade de moitas drogas pode ser aumentada ou diminuída polo uso de antiácidos ou alimentos ácidos. Con todo, a forma cargada adoita ser máis soluble no sangue e o citosol, ambos os medios acuosos. Cando o medio extracelular é máis ácido que o pH neutro dentro da célula, certos ácidos existirán na súa forma neutra e serán solubles na membrana, permitíndolles cruzar a bicapa lipídica. Os ácidos que perden un protón a pH intracelular existirán na súa forma cargada, soluble, polo que son capaces de difundirse a través do citosol ao seu obxectivo. O ibuprofeno, a aspirina e a penicilina son exemplos de drogas que son ácidos débiles.
Algúns ácidos[editar | editar a fonte]
- Ácido acético.
- Ácido acetilsalicílico.
- Ácido acrílico.
- Ácido bórico.
- Ácido clorhídrico.
- Ácidos graxos.
- Ácido nítrico.
- Ácido nitroso.
- Ácido ribonucleico.
- Ácido sulfúrico.
- Ácido tartárico.
- Ácido úrico.
- Aminoácido.
- EDTA.
Notas[editar | editar a fonte]
- ↑ "pKa's of Inorganic and Oxo-Acids" (PDF) (en inglés). Arquivado dende o orixinal (PDF) o 19 de xuño de 2018. Consultado o 25 de decembro do 2015. Arquivado 19 de xuño de 2018 en Wayback Machine.
- ↑ 2,0 2,1 "63847_8".
- ↑ pKa values for HClOn desde C.E.Housecroft and A.G.Sharpe "Inorganic Chemistry" (Pearson, 2d edn 2005), p.171
- ↑ "Copia arquivada" (PDF). Arquivado dende o orixinal (PDF) o 02 de xuño de 2010. Consultado o 11 de outubro de 2015. Arquivado 24 de agosto de 2003 en Wayback Machine.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Ácido |
Bibliografía[editar | editar a fonte]
- Listing of strengths of common acids and bases. Arquivado 18 de decembro de 2001 en Wayback Machine.
- Zumdahl, Chemistry, 4th Edition.
- Ebbing, D. D., & Gammon, S. D. (2005). General chemistry (8th ed.). Boston, MA: Houghton Mifflin. ISBN 0-618-51177-6.
- Pavia, D. L., Lampman, G. M., & Kriz, G. S. (2004). Organic chemistry volume 1: Organic chemistry 351. Mason, OH: Cenage Learning. ISBN 978-0-7593-4272-4.


![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{A}}^{-}]}{[{\mbox{HA}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36fd173f3aa9cd2548061b2f8320116932f338bc)