Osíxeno
Osíxeno
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liñas espectrais do Osíxeno | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información xeral | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Osíxeno, O, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Non metais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 16, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade | 1,429 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparencia | Incoloro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 15,99903 – 15,99977 [1] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (calc) | 60 (48) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio de van der Waals | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 2, 1, −1, −2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | cúbica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas (paramagnético) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 54,36 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebulición | 90,188 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | (O2) 6,82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | (O2) 0,444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molar | 17,36×10-3 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividade (Pauling) | 3,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específica | 920 J/(K·kg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 26,58×10−3 W/(K·m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª Enerxía de ionización | 1313,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª Enerxía de ionización | 3388,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª Enerxía de ionización | 5300,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª Enerxía de ionización | 7469,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª Enerxía de ionización | {{{E_ionización5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª Enerxía de ionización | {{{E_ionización6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª Enerxía de ionización | {{{E_ionización7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª enerxía de ionización | {{{E_ionización8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9.ª Enerxía de ionización | {{{E_ionización9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.ª Enerxía de ionización | {{{E_ionización10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos máis estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades segundo o SI e en condicións normais de presión e temperatura, salvo indicación contraria. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O osíxeno[2] ou oxíxeno (pronunciado /oks/[3]), é un elemento químico de número atómico 8 e símbolo O. Forma parte do grupo dos calcóxenos e é un non metal reactivo e forte axente oxidante que forma compostos facilmente coa maioría doutros elementos, principalmente en forma de óxidos. Ten a segunda electronegatividade máis alta de todos os elementos químicos, só superado polo flúor.[4] Medido pola súa masa, o osíxeno é o terceiro elemento máis abundante do universo, tras o hidróxeno e o helio,[5] e o máis abundante na codia terrestre como parte de compostos óxidos, formando practicamente a metade da súa masa.[6] En condicións normais de presión e temperatura, dous átomos do elemento enlázanse para formar o diosíxeno, un gas diatómico incoloro, inodoro (sen olor) e insípido con fórmula O
2. Esta substancia constitúe o 20,8% da atmosfera e resulta vital e necesaria para soster a vida terrestre.[7] Non obstante, varios estudos dos niveis de osíxeno atmosférico indican unha progresión global descendente da proporción deste elemento, principalmente a causa das emisións procedentes da queima de combustibles fósiles.[8]
É un gas incoloro, inodoro e insípido. Unha gran parte das clases maiores de moléculas orgánicas dos organismos vivos conteñen osíxeno, como as proteínas, ácidos nucleicos, carbohidratos e graxas, así como nos constituíntes maioritarios inorgánicos de cascas animais, dentes e ósos. A maior parte da masa dos organismos vivos ten o osíxeno, un dos compoñentes da auga, como o principal constituínte das formas de vida. Participa de forma moi importante no ciclo enerxético dos seres vivos, esencial na respiración celular dos organismos aerobios.
Debido á súa reactividade química, o osíxeno non pode permanecer na atmosfera terrestre como elemento libre sen ser reabastecido constantemente pola acción fotosintética dos organismos que utilizan a enerxía solar para producir osíxeno. O osíxeno elemental O2 soamente empezou a acumularse na atmosfera logo da aparición destes organismos, aproximadamente fai 2500 millóns de anos.[9] O alótropo ozono (O
3) é un forte absorbente de radiación ultravioleta, e a capa de ozono a grande altitude da Terra axuda a protexer a biosfera desta radiación. Porén, o ozono é un axente contaminante preto da superficie terrestre, dándose como produto derivado do smog. A altitudes de órbita baixa terrestre, o osíxeno atómico presente causa a corrosión das naves espaciais.[10]
O osíxeno foi descuberto de forma independente polo químico sueco Carl Wilhelm Scheele en Uppsala cara ao ano 1773, e polo científico británico Joseph Priestley en Wiltshire no ano 1774,[11] pero Priestley adoita nomearse de forma prioritaria xa que a súa obra publicouse primeiro. En 1777 Antoine Lavoisier deulle o seu nome, e grazas aos seus experimentos axudou a desacreditar a ata entón popular teoría do floxisto da combustión e corrosión. O nome provén das raíces gregas ὀξύς (oksýs) («ácido», literalmente «punzante», en referencia ao sabor dos ácidos) e γόνος (-gónos) («produtor», literalmente «enxendrador»), porque na época en que se lle deu esta denominación críase, incorrectamente, que todos os ácidos requirían osíxeno para a súa composición. As aplicacións máis habituais do osíxeno son entre outras o seu uso en calefaccións residenciais e motores de combustión interna, na produción de aceiro, plásticos e téxtiles, aplicacións de corte industrial e soldadura de aceiros e outros metais, como propulsor para foguetes, para terapias de osíxeno e sistemas de soporte vital en aeronaves, submarinos, naves espaciais tripuladas e no mergullo.
Características[editar | editar a fonte]
Estrutura molecular e propiedades[editar | editar a fonte]
En condicións normais de presión e temperatura o osíxeno é un gas incoloro e inodoro con fórmula molecular O2, no que dous átomos de osíxeno se enlazan cunha configuración electrónica en estado triplete. Este enlace ten unha orde de enlace de dous e adóitase simplificar nas descricións como un enlace dobre[12] ou como unha combinación dun enlace de dous electróns e dous enlaces de tres electróns.[13]

O osíxeno triplete[a] é o estado fundamental da molécula O2,[14] que conta con dous electróns desemparellados que ocupan dous orbitais moleculares dexenerados.[b] Estes orbitais clasifícanse como antienlaces -debilitan a orde de enlace de tres a dous-, de maneira que o enlace do diosíxeno é máis débil que o triplo enlace do nitróxeno diatómico, no que todos os orbitais dos enlaces moleculares se reenchen, pero algúns orbitais de antienlace non o están.[14][16]
Na súa forma normal de triplete, as moléculas de O2 son paramagnéticas; é dicir, que en presenza dun campo magnético forman un imán, debido ao momento magnético do spin dos electróns desemparellados na molécula e a interacción de cambio negativa entre moléculas de O2 contiguas.[17] Un imán atrae o osíxeno líquido ata tal punto que, en demostracións de laboratorio, un fío de osíxeno líquido pode sosterse contra o seu propio peso entre os polos dun imán potente.[18][c]
O osíxeno molecular singlete é un nome dado a varias especies de O2 de maior enerxía, nas que todos os spins dos electróns se emparellan. É moito máis reactivo con moléculas orgánicas habituais que o osíxeno molecular en si mesmo. Na natureza, o osíxeno singlete adóitase formar coa auga na fotosíntese, usando a enerxía solar.[20] Tamén se produce na troposfera por mor da fotólise do ozono pola luz de onda curta,[21] así como polo sistema inmunitario como unha fonte de osíxeno activo.[22] Nos organismos fotosintéticos -e posiblemente tamén nos animais- os carotenoides xogan un papel fundamental na absorción de enerxía do osíxeno singlete e a conversión deste ao seu estado non excitado antes de que poida causar dano aos tecidos.[23]
Alótropos[editar | editar a fonte]
- Artigo principal: Alótropos do osíxeno.

O alótropo máis normal do osíxeno elemental é o chamado diosíxeno (O2), que ten unha lonxitude de enlace de 121 pm e unha enerxía de enlace de 498 kJ•mol−1,[24] menor que a enerxía dos outros enlaces dobres ou pares de enlaces simples presentes na biosfera, e responsable da reacción exotérmica do O2 con calquera molécula orgánica.[25][26] Esta é a forma que usan as formas de vida complexas, como os animais, na súa respiración celular e é a forma que ten unha grande importancia na composición da atmosfera terrestre.
O triosíxeno (O3) coñécese habitualmente como ozono e é un alótropo moi reactivo, daniño para o tecido pulmonar.[27] O ozono prodúcese na atmosfera superior cando o O2 se combina co osíxeno atómico a causa da división do O2 pola radiación ultravioleta.[28] Xa que o ozono é un poderoso absorbente na rexión ultravioleta do espectro electromagnético, a capa de ozono da atmosfera superior funciona como un escudo protector da radiación que recibe o planeta.[28] Preto da superficie terrestre, non obstante, é un contaminante formado como subproduto das emisións de automóbiles (do smog).[27] En 2001 descubriuse a molécula metaestable do tetraosíxeno (O4),[29][30] e deuse por descontado que existía nunha das seis fases do osíxeno sólido. En 2006 demostrouse que esta fase, creada mediante a presurización do O2 a 20 GPa, é, de feito, un clúster[d] O8 do sistema trigonal.[32] Este clúster ten potencial para ser un oxidante moito máis potente que o O2 e o O3 e podería, polo tanto, ser usado como propulsor de foguetes.[29][30] En 1990 descubriuse unha fase metálica cando o osíxeno sólido se somete a unha presión superior a 96 GPa[33] e demostrouse en 1998 que a temperaturas moi baixas se converte en supercondutor.[34]
Propiedades físicas[editar | editar a fonte]
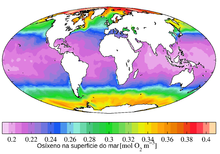
O osíxeno é máis soluble en auga que o nitróxeno; esta contén en disolución aproximadamente unha molécula de O2 por cada dúas moléculas de N2, comparado coa proporción na atmosfera, que vén ser de 1:4. A solubilidade do osíxeno na auga depende da temperatura, disolvéndose arredor do dobre (14,6 mg•L−1) a 0 °C que a 20 °C (7,6 mg•L−1).[36][37] A 25 °C e 1 atmosfera de presión, a auga doce conten arredor de 6,04 mililitros (ml) de osíxeno por litro, mentres que a auga mariña contén arredor de 4,95 ml por litro.[38] A 5 °C a solubilidade incrementase ata 9,0 ml (un 50 % máis que a 25 °C) por litro na auga e 7,2 ml (45 % máis) na auga do mar.[37]
O osíxeno condénsase a 90,20 K (-182,95 °C, -297,31 °F) e conxélase a 54,36 K (-218,79 °C, -361,82 °F).[39] Tanto o O2 líquido como o sólido son substancias cunha suave cor azul ceo causado pola absorción no vermello, en contraste coa cor azul do ceo, que se debe á dispersión de Rayleigh da luz azul. O O2 líquido de gran pureza adóitase obter a través da destilación fraccionada de ar licuado.[40] O osíxeno líquido tamén pode producirse por condensación do ar, usando nitróxeno líquido como refrixerante. É unha substancia altamente reactiva e debe separarse de materiais inflamables.[41]
A espectroscopia do osíxeno molecular asóciase cos procesos atmosféricos das auroras e outras emisións de luz na atmosfera.[42] A absorción no continuo Herzberg e nas bandas de Schumann–Runge no ultravioleta produce osíxeno atómico de notable importancia na química da atmosfera media.[43] O osíxeno molecular singlete en estado excitado é responsable da luminescencia química vermella nas solucións.[44]
Abundancia[editar | editar a fonte]
- Véxase tamén: Silicato.
O osíxeno é o elemento químico máis abundante, por masa, na biosfera, o aire, o mar e o chan terrestre. É, así mesmo, o terceiro máis abundante no universo, tralo hidróxeno e o helio.[5] Ao redor do 0,9 % da masa do Sol é osíxeno, que constitúe tamén o 49,2 % da masa da codia terrestre (arredor dun 46,7%), e é o principal compoñente dos océanos (arredor do 87% como compoñente da auga)[7] O osíxeno gaseoso é o segundo compoñente máis abundante na atmosfera xa que supon un 20,8 % do seu volume e o 23,1 % da súa masa (unhas 1015 toneladas).[6][7][45][e] A Terra é unha excepción entre os planetas do Sistema Solar pola alta concentración de osíxeno gaseoso na súa atmosfera; por exemplo, Marte (cun 0,1 % de O2 do total do seu volume) e Venus teñen concentracións moito menores. Con todo, o O2 que rodea a estes planetas provén exclusivamente das reaccións que sofren moléculas que conteñen osíxeno, como o dióxido de carbono, por efecto da radiación ultravioleta.[46]
Os óxidos de metais, silicatos (SiO44-) e carbonatos (CO32-) atópanse a miúdo en rochas e chan. Na atmosfera atópase como osíxeno molecular, O2, dióxido de carbono e en menor proporción como monóxido de carbono (CO), ozono (O3), dióxido de nitróxeno (NO2), monóxido de nitróxeno (NO) ou dióxido de xofre (SO2). Nos planetas exteriores (os que están máis lonxe do Sol) e en cometas atópase auga xeada e outros compostos de osíxeno, por exemplo, en Marte hai dióxido de carbono xeado.[47] O espectro deste elemento tamén se aprecia con frecuencia nas estrelas.[48]
| Z | Elemento | Fracción de masa en partes por millón |
|---|---|---|
| 1 | Hidróxeno | 739 000 |
| 2 | Helio | 240 000 |
| 8 | Osíxeno | 10 400 |
| 6 | Carbono | 4 600 |
| 10 | Neon | 1 340 |
A infrecuentemente alta concentración de osíxeno gaseoso na Terra é o resultado do ciclo de circulación. Este ciclo bioxeoquímico describe o movemento do osíxeno no interior das súas tres principais reservas no planeta: a atmosfera, a biosfera e a litosfera. O factor de condución máis importante neste ciclo é a fotosíntese, responsable da atmosfera moderna da Terra, que libera osíxeno na atmosfera, mentres que os procesos de respiración e descomposición elimínano.[50]
O osíxeno non combinado tamén se dá en solucións nas masas de auga do planeta. A maior solubilidade do O2 a baixa temperatura ten implicacións importantes para a vida mariña, xa que os océanos polares sosteñen unha densidade de vida moito maior debido ao seu superior contido de osíxeno.[f] A cantidade de O2 na auga pode verse reducida pola contaminación hídrica, debido á acción da descomposición das algas e outros biomateriais por un proceso chamado eutrofización. Os científicos avalían este aspecto da calidade da auga a través da medición da súa demanda biolóxica de osíxeno, ou cantidade de O2 necesaria para degradar a materia orgánica acumulada.[51]
Isótopos e orixe estelar[editar | editar a fonte]
- Artigo principal: Isótopos do osíxeno.
O osíxeno que atopamos na natureza componse de tres isótopos estables: 16O, 17O e 18O, sendo o 16O o máis abundante (99,762 % de abundancia natural).[52] A maior parte do 16O sintetízase ao final do proceso de combustión do helio nunha estrela masiva, pero outra parte prodúcese no proceso de combustión do neon.[53] O 17O xorde fundamentalmente pola combustión do hidróxeno en helio durante o ciclo CNO, converténdoo nun isótopo común nas zonas de combustión de hidróxeno nas estrelas.[53] Pola súa banda, a maioría do 18O prodúcese cando o 14N —que abunda debido á combustión CNO— captura un núcleo de 4He, causando unha abundancia de 18O nas zonas ricas en helio das estrelas masivas.[53]
Caracterizáronse catorce radioisótopos, dos que os máis estables son o 15O cun período de semidesintegración de 70,606 segundos.[52] Todos os restantes isótopos radioactivos teñen períodos de semidesintegración inferiores a 27 segundos e a maior parte destes, inferiores a 83 milisegundos.[52] A forma de descomposición dos isótopos máis lixeiros que o 16O é a descomposición β+[54][55][56] para producir nitróxeno e, para os máis pesados que o 18O, a desintegración beta para formar flúor.[52]
Compostos[editar | editar a fonte]

- Véxase tamén: Categoría:Compostos de osíxeno.
O estado de oxidación do osíxeno é -2 en case todos os compostos coñecidos do osíxeno. Pola súa banda, o estado de oxidación -1 atópase nuns cantos compostos, como os peróxidos.[57] Os compostos noutro estado de oxidación son moi pouco comúns: -1/2 (superóxidos), -1/3 (ozónidos), 0 (elemental, hipofluoroso), +1/2 (diosixenil), +1 (difluoruro de diosíxeno) e +2 (difluoruro de osíxeno).[58]
A súa alta electronegatividade fai que reaccione con case calquera elemento químico, agás os gases nobres. O composto máis salientable que forma é a auga (H2O); outros compostos ben coñecidos son o dióxido de carbono, os alcois (R-OH), aldehidos, (R-CHO), e ácidos carboxílicos (R-COOH).[59] Os radicais clorato (ClO3-), perclorato (ClO4-), cromato (CrO42-), dicromato (Cr2O72-), permanganato (MnO4-) e nitrato (NO3-) son fortes axentes oxidantes.[60][61] O ozono (O3) fórmase por descargas eléctricas en presenza de osíxeno molecular, como por exemplo durante as tormentas eléctricas.[62] Tamén se ten atopado no osíxeno líquido, en pequenas cantidades, unha dobre molécula de osíxeno (O2)2.[63]
Óxidos e outros compostos inorgánicos[editar | editar a fonte]
A auga (H2O) é o óxido de hidróxeno e é o composto de osíxeno máis común. Os átomos de hidróxeno están enlazados covalentemente ao osíxeno na molécula da auga, pero nunha masa de auga tamén están atraídos (cunha atracción duns 23,3 kJ•mol−1 por átomo de hidróxeno) polo átomo de osíxeno doutra molécula de auga próxima.[64] Estes enlaces de hidróxeno entre as moléculas de auga mantéñenas aproximadamente un 15 % máis preto do que sería esperable nun líquido simple só coas forzas de Van der Waals.[65][g]

Debido a súa electronegatividade, o osíxeno forma enlaces químicos con case todos os demais elementos a temperaturas elevadas para dar os óxidos correspondentes. Con todo, algúns elementos forman óxidos directamente en condicións normais de presión e temperatura, como o óxido formado do ferro. A superficie de metais como o aluminio e o titanio oxidase en presenza do aire e cóbrese cunha fina capa de óxido que pasiva o metal e ralentiza a corrosión. Algúns dos óxidos metálicos de transición atópanse na natureza como compostos non estequiométricos, con lixeiramente menos metal do que a fórmula química suxire. Por exemplo, o FeO (wustita), que se forma de xeito natural, escríbese en realidade como Fex-1O, onde a «x» está normalmente en torno a 0,05.[66]
O osíxeno como composto está presente na atmosfera en pequenas cantidades en forma de dióxido de carbono (CO2). As rochas da codia terrestre compóñense en gran parte de óxidos de silicio (dióxido de silicio SiO2, que se atopa no granito e a area), de aluminio (alúmina Al2O3, na bauxita e o corindón), de ferro (óxido férrico Fe2O3, na hematita e no óxido) e de calcio (carbonato de calcio CaCO3, na calcaria). O resto da codia terrestre componse tamén de compostos de osíxeno, en particular varios silicatos complexos. No manto terrestre, que ten unha masa moito maior que a codia terrestre, abundan os silicatos de ferro e magnesio.
Os silicatos solubles en auga coas formas Na4SiO4, Na2SiO3 e Na2Si2O5 utilizanse como deterxentes e adherentes.[67] O osíxeno tamén actúa como ligazón para metais de transición, formando enlaces de O2 metálico co átomo de iridio no complexo de Vaska,[68] co platino no PtF6 e co centro de ferro no grupo hemo da hemoglobina.[69]
Compostos orgánicos e biomoléculas[editar | editar a fonte]

Entre as clases máis importantes de compostos orgánicos que conteñen osíxeno están os seguintes (onde «R» é un grupo orgánico): alcohois (R-OH), éteres (R-O-R), cetonas (R-CO-R), aldehidos (R-CO-H), ácidos carboxílicos (R-COOH), ésteres (R-COO-R), anhídridos de ácido (R-CO-O-CO-R) e amidas (R-C(O)-NR2).[70] Hai moitos disolventes orgánicos importantes que conteñen osíxeno, entre eles: acetona, metanol, etanol, alcohol isopropílico, furano, tetrahidrofurano, éter etílico, dioxano, etanoato de etilo, dimetilformamida, dimetilsulfóxido, ácido acético e ácido fórmico. A acetona (CH3(CO)CH3) e o fenol (C6H5OH) úsanse como materiais na síntese de moitas substancias diferentes.[71] Outros compostos orgánicos importantes que conteñen osíxeno son: glicerol, formaldehido, glutaraldehido, ácido acético e acetamida.[72] Os epóxidos son éteres nos cales o átomo de osíxeno forma parte dun anel de tres átomos.[73]
O osíxeno reacciona espontáneamente con moitos compostos orgánicos a temperatura ambiente ou inferior, nun proceso chamado autoxidación.[74] A maior parte dos compostos orgánicos que conteñen osíxeno non se producen pola acción directa do O2. Os compostos orgánicos importantes na industria e o comercio producidos por oxidación directa dun precursor inclúen ao óxido de etileno e o ácido peracético.[67]
O elemento atópase en case todas as biomoléculas importantes para (ou xeradas por) a vida.[75] Só unhas cantas biomoléculas complexas comúns, como o escualeno e o caroteno, non conteñen osíxeno. Dos compostos orgánicos con relevancia biolóxica, os carbohidratos conteñen a maior proporción de osíxeno na súa masa. Todas as graxas, ácidos graxos, aminoácidos e proteínas conteñen osíxeno (debido á presenza de grupos carbonilos neses ácidos e os seus residuos de éster). O osíxeno tamén está presente en grupos de fosfato (PO3−
4) nas moléculas bioloxicamente importantes que transportan enerxía, ATP e ADP, na estrutura pentosa-fosfato e nas purinas (excepto a adenina e as pirimidinas do ARN e ADN) e nos ósos como fosfato de calcio e hidroxiapatita.
Papel biolóxico[editar | editar a fonte]
Fotosíntese e respiración[editar | editar a fonte]
O osíxeno respirado polos organismos aerobios, liberado polas plantas mediante a fotosíntese, participa en posteriores procesos na conversión de nutrientes en enerxía (ATP). O osíxeno molecular é o aceptor último de electróns da cadea de transporte de electróns na respiración aeróbica celular. A súa diminución provoca hipoxemia, e a falla total del, anoxia que pode provocar a morte do organismo.[76] Segundo algunhas estimacións, as algas verdes e as cianobacterias de ambientes mariños proporcionan ao redor do 70 % do producido na Terra, e as plantas terrestres, o resto.[77] Outros investigadores estiman que a contribución oceánica ao osíxeno atmosférico é aínda maior, mentres que outros a sitúan por baixo, en torno a un 45 % do osíxeno atmosférico total do planeta cada ano.[78]

Unha fórmula global simplificada da fotosíntese é:[79]
A formación fotolítica do osíxeno a partir de moléculas de auga ten lugar nas membranas dos tilacoides dos organismos fotosintéticos e require a enerxía de catro fotóns.[h] Están implicados moitos procesos, pero o resultado é a formación dun gradiente de protóns a través da membrana tilacoidal, que se usa para sintetizar adenosín trifosfato (ATP) por medio da fotofosforilación, e a redución do NADP+. O O2 resultante da oxidación e rotura da molécula de auga libérase á atmosfera.[80][i]
O diosíxeno molecular é esencial para a respiración celular en todos os organismos aerobios, xa que as mitocondrias o usan na súa cadea de transporte electrónico, o que indirectamente axuda a que máis tarde se xere adenosín trifosfato durante a fosforilación oxidativa. A ecuación da reacción global da respiración aerobica é basicamente a contraria á da fotosíntese (aínda que o proceso non é o inverso, senón moi diferente) e simplifícase da seguinte forma:
Nos vertebrados, o O2 difunde a través de membranas pulmonares ou polas branquias cara aos glóbulos vermellos. A hemoglobina únese ao O2 cambiando a súa cor dun vermello azulado a un vermello brillante[27] (o CO2 libérase desde outra parte da hemoglobina mediante o efecto Bohr). Outros animais usan a hemocianina (moluscos e algúns artrópodos) ou a hemeritrina (arañas e lagostas).[45] Un litro de sangue pode disolver 200 cm³ de O2.[45]
As especies reactivas do osíxeno, como o ión superóxido (O2-) e o peróxido de hidróxeno, son perigosos subprodutos orixinados no uso do osíxeno que fan os organismos.[45] Algunhas partes do sistema inmunitario de organismos máis avanzados, con todo, crean peróxido, superóxido e osíxeno singlete para destruír microbios invasores. As especies reactivas do osíxeno tamén teñen un rol importante na resposta hipersensible das plantas contra ataques de patóxenos.[80]
Un adulto humano en repouso respira unha media de 13,5 veces por minuto, tomando de 1,8 a 2,4 gramos de osíxeno por minuto.[j] A suma da cantidade inhalada por todas as persoas do planeta é duns 6000 millóns de toneladas de osíxeno por ano.[k]
Contido no corpo[editar | editar a fonte]
| Unidade | Presión alveolar dos gases pulmonares |
Osíxeno do sangue arterial |
Gas sanguíneo venoso |
|---|---|---|---|
| kPa [l] | 14.2 | >11 | 4.0-5.3 |
| mmHg[82] | 107 | >79 | 30-40 |
O contido de osíxeno libre expresado como presión parcial no corpo dun organismo vertebrado vivo é normalmente maior no sistema respiratorio e diminúe ao longo de calquera sistema arterial, os tecidos periféricos e o sistema venoso, respectivamente. A presión parcial é a presión que tería o osíxeno se ocupase por si só o volume.[83]
Acumulación na atmosfera[editar | editar a fonte]
- Véxase tamén: Historia xeolóxica do oxíxeno.

O osíxeno gaseoso non combinado era case inexistente na atmosfera terrestre antes da evolución das bacterias e arqueas fotosintéticas. Apareceu por primeira vez en cantidades significativas durante o eón Paleoproterozoico (fai ao redor de 3000 e 2300 millóns de anos).[84] Nun principio, o osíxeno combinouse con ferro disolto nos océanos para crear formacións de ferro bandeado. Os océanos comezaron a exhalar osíxeno non combinado fai ao redor de 3000 e 2700 millóns de anos, alcanzando o 10 % do seu nivel actual hai uns 1700 millóns de anos.[84][85]
A presenza de grandes cantidades de osíxeno non combinado disolto nos océanos e na atmosfera puido conducir á extinción da maioría dos organismos anaerobios que vivían entón, durante a Grande Oxidación (catástrofe do osíxeno) hai uns 2400 millóns de anos. Con todo, o uso de O2 na respiración celular permite producir aos organismos aerobios moito máis ATP que os anaerobios, axudando aos primeiros a dominar a biosfera da Terra.[86] A fotosíntese e a respiración celular do O2 permitiron a evolución das células eucariotas e, finalmente, a aparición de organismos multicelulares complexos como plantas e animais.
Desde o comezo do período Cámbrico fai 540 millóns de anos, os niveis de O2 flutuaron entre o 15 % e o 30 % por volume.[87] Cara a finais do Carbonífero (hai uns 300 millóns de anos) o nivel de O2 na atmosfera alcanzou un volume máximo do 35 %,[87] que puido contribuír ao gran tamaño dos insectos e anfibios daquela época.[88] As variacións nos niveis de osíxeno ó longo da historia foron modificando os distintos climas. A redución de niveis de osíxeno causou unha baixada na densidade atmosferica, que á súa vez incrementou a evaporación de auga na superficie, dando lugar a un incremento de precipitacións e unhas temperaturas máis temperás.[89] A actividade humana, incluíndo a combustión de 7000 millóns de toneladas de combustible fósil cada ano, tivo un impacto moi pequeno na cantidade de osíxeno combinado na atmosfera.[17] Cos niveis actuais da fotosíntese, levaría uns 2000 anos rexenerar a cantidade total de O2 na atmosfera actual.[90]
Historia[editar | editar a fonte]
Primeiros experimentos[editar | editar a fonte]
Un dos primeiros experimentos coñecidos sobre a relación entre a combustión e o aire desenvolveuno o escritor sobre mecánica da Antiga Grecia Filón de Bizancio, no século II a. C. Na súa obra Pneumatica, Filón observou que invertendo un recipiente sobre unha candea prendida e rodeando o pescozo deste con auga, unha parte do líquido subía polo pescozo.[91] Supuxo, de forma incorrecta, que algunhas porcións do aire no recipiente convertíanse no elemento clásico lume e, entón, era capaz de escapar a través de poros no cristal. Moitos séculos despois, Leonardo da Vinci observou que unha porción do aire consómese durante a combustión e a respiración.[92]
A finais do século XVII, Robert Boyle probou que o aire é necesario para a combustión. O químico inglés John Mayow perfeccionou o seu traballo mostrando que só requiría dun compoñente do aire, que chamou spiritus nitroaereus ou simplemente nitroaereus.[93] Nun experimento, descubriu que, colocando un rato ou unha candea acesa nun contedor pechado sobre auga, facía que esta subise e substituíse un catorceavo do volume do aire antes de que se apagase a candea e morrese o rato. Debido a isto, supuxo que o nitroaereus consómese tanto pola respiración coma pola combustión.[94]
Mayow observou que o antimonio incrementaba o seu peso ao quentarse e inferiu que o nitroaereus combinárase con el.[93] Pensou tamén que os pulmóns separaban o nitroaereus do aire e pasábano ao sangue, e que a calor animal e o movemento muscular eran produto da reacción do nitroaereus con certas substancias no corpo.[93] Publicou informes sobre estes experimentos e outras ideas en 1668, na súa obra Tractatus duo, no tratado «De respiratione».[94]
Teoría do floxisto[editar | editar a fonte]
- Artigo principal: Teoría do floxisto.

Robert Hooke, Ole Borch, Mikhail Lomonosov e Pierre Bayen produciron osíxeno durante experimentos entre os séculos XVII e XVIII, pero ningún deles o recoñeceu como un elemento.[36] Isto puido deberse en parte á prevalencia da filosofía da combustión e a corrosión, denominada teoría do floxisto, que por aquel entón era a explicación preferida para eses procesos.[95]
Esta teoría, establecida en 1667 polo químico alemán Johann Joachim Becher e modificada polo tamén químico Georg Stahl en 1731,[96] postulaba que todos os materiais combustibles constaban de dúas partes; unha, chamada floxisto, que era emitida ao queimar a substancia en cuestión, e outra, denominada desfloxisticada, que se tiña pola súa verdadeira forma o calx (cinza; creta en latín).[92]
Os materiais altamente combustibles que deixan pouco residuo, como a madeira ou o carbón, críanse feitos na súa maior parte por floxisto, mentres as substancias non combustibles que se corroen, como o ferro, conteñen moi pouco. O aire non tiña ningún papel na teoría do floxisto nin se realizaron experimentos cuantivativos para poñer a proba a idea; pola contra, baseábase en observacións do que sucedía cando algo se queimaba: os obxectos máis comúns parecían volverse máis lixeiros e perder algo no proceso.[92] O feito de que unha substancia como a madeira realmente gañase peso no seu conxunto durante o queimado ocultábase pola flotabilidade dos produtos gaseosos da combustión. Unha das primeiras pistas sobre a falsidade da teoría do floxisto foi que os metais tamén gañaban peso na oxidación (cando supostamente perdían floxisto).[95]
Descubrimento[editar | editar a fonte]


Foi descuberto polo boticario sueco Karl Wilhelm Scheele que produciu osíxeno gaseoso quentando óxido de mercurio e varios nitratos ao redor do ano 1772,[7][92] Scheele chamou ao gas «aire do lume», porque era o único apoio coñecido para a combustión, e escribiu un informe do seu descubrimento nun manuscrito que titulou «Chemische Abhandlung von der Luft und dem Feuer» («Tratado químico do aire e do lume») e enviouno ao seu editor en 1775, aínda que non se publicou ata 1777.[97]
O seu traballo non tivo recoñecemento inmediato, sendo en ocasións atribuído a Joseph Priestley, que fixo un descubrimento independente o 1 de agosto de 1774. Este levou a cabo un experimento no que enfocou a luz solar sobre óxido de mercurio(II) (HgO) no interior dun tubo de cristal, que liberou un gas que el chamou «aire desfloxisticado».[7][11] Notou que as candeas prendían máis vívamente no gas e que o rató estaba máis activo e vivía máis tempo mentres o respiraba. Tras inhalar el mesmo o gas, escribiu: «A sensación do gas nos meus pulmóns non era perceptiblemente diferente ao do aire normal, pero sentín o meu peito particularmente lixeiro e desafogado durante un intre despois».[11][36] Priestley publicou os seus achados en 1775 nun artigo titulado «An Account of Further Discoveries in Air» («Informe de máis descubrimentos no aire»), que incluíu no segundo volume do seu libro titulado Experiments and Observations on Different Kinds of Air.[92][98] Debido a que publicou os seus achados primeiro, Priestley adoita ser considerado o autor do descubrimento.
O famoso químico francés Antoine Lavoisier reclamou posteriormente ter descuberto a substancia de forma independente. No entanto, Priestley visitou a Lavoisier en outubro de 1774 e faloulle sobre o seu experimento e de como liberara o novo gas. Scheele tamén escribiu unha carta a Lavoisier o 30 de setembro dese mesmo ano, na que describía o seu propio descubrimento da substancia antes descoñecida, pero o francés nunca recoñeceu tela recibido. Logo da morte de Scheele atopouse unha copia da carta entre as súas pertenzas.[97]
Contribución de Lavoisier[editar | editar a fonte]

Aínda que foi cuestionado na súa época, Lavoisier conduciu os primeiros experimentos cuantitativos adecuados sobre a oxidación e deu a primeira explicación correcta sobre o funcionamento da combustión.[7] Usou estes e outros experimentos similares que comezaron en 1774 para desacreditar a teoría do floxisto e para demostrar que a substancia descuberta por Priestley e Scheele era un elemento químico.[96]
Nun experimento, Lavoisier observou que non se producía un incremento global no peso cando se quentaban o estaño e o aire nun contedor pechado.[7] Notou que, cando abriu o contedor, o aire entrou subitamente nel, o que indicaba que parte do aire atrapado consumirase. Tamén notou que o estaño aumentara o seu peso e que o aumento era igual ao do peso do aire que volveu ao contedor cando o abriu. Este e outros experimentos sobre a combustión documentaronse no seu libro Sur la combustion en général, publicado en 1777.[7] Nesa obra, probou que o aire é unha mestura de dous gases: o «aire esencial», fundamental para a combustión e a respiración, e o azote (do grego ἄζωτον, ádsõton, sen vida), que non servía para ningunha das dúas, denominaríase posteriormente nitróxeno.[7]
Lavoisier renomeou ao «aire esencial» como osíxeno en 1777, das raíces gregas ὀξύς (oksýs) (ácido, literalmente «punzante», polo sabor dos ácidos) e -γενής (-genēs) (produtor, literalmente «enxendrador»), porque pensaba, erroneamente, que o oxíxeno era un constituínte de todos os ácidos.[28] Os químicos -en particular sir Humphry Davy en 1812- ao cabo dun tempo determinaron que Lavoisier se equivocara na súa apreciación, pois, de feito, o que forma a base dos ácidos é o hidróxeno, mais o nome xa se popularizara o suficiente como para permanecer.[99]
Historia posterior[editar | editar a fonte]

A hipótese atómica orixinal de John Dalton asumía que todos os elementos eran monoatómicos e que os átomos dos compostos terían normalmente as relacións atómicas máis simples. Por exemplo, Dalton pensaba que a fórmula da auga era HO, presentando a masa atómica do osíxeno como 8 veces a do hidróxeno, no canto de 16, o valor que se lle dá hoxe en día.[100] En 1805, Louis Joseph Gay-Lussac e Alexander von Humboldt mostraron que a auga está formada por dous volumes de hidróxeno e un de osíxeno e, en 1811, Amedeo Avogadro deu coa correcta interpretación da composición do líquido, baseada na que hoxe se denomina Lei de Avogadro e na suposición de moléculas diatómicas elementais.[101] [m]
A finais do século XIX, os investigadores déronse conta de que o aire podía licuarse e os seus compoñentes illarse mediante compresión e arrefriamento. Utilizando un método de fervenza, o químico e físico suízo Raoul Pictet evaporou dióxido de xofre para licuar dióxido de carbono, que pola súa banda era evaporado para arrefriar o osíxeno gaseoso o suficiente para pasalo a líquido. Enviou un telegrama á Academia de Ciencias de Francia o 22 de decembro de 1877 anunciando o seu descubrimento do osíxeno líquido.[103] Só dous días despois, o físico francés Louis Paul Cailletet anunciou o seu propio método para licuar osíxeno molecular.[103] En ambos os casos só se produciron unhas poucas pingas do líquido, polo que non se puido levar a cabo unha análise concluínte. O osíxeno foi licuado de forma estable por primeira vez o 29 de marzo de 1883 polos científicos polacos da Universidade Iaguelónica Zygmunt Wróblewski e Karol Olszewski.[104]
En 1891, o químico escocés James Dewar puido producir a suficiente cantidade de osíxeno líquido para estudalo.[17] O primeiro proceso viable comercialmente para producir osíxeno líquido foi desenvolvido en 1895 de forma independente polos enxeñeiros Carl von Linde, alemán, e William Hampson, británico. Reduciron a temperatura do aire ata que se licuou e, entón, destilaron os compoñentes gaseosos facéndoos chegar á ebulición un a un e capturándoos.[105] Máis tarde, en 1901, a soldadura de oxiacetileno demostrouse por primeira vez ao queimar unha mestura de acetileno e O2 comprimido. Este método de soldaxe e cortado do metal converteríase despois no habitual.[105] O físico William Thomson, en 1898, calculou que o osíxeno que permanece no planeta ten só uns 400 ou 500 anos, baseándose no ritmo de uso dos combustibles fósiles na combustión.[106][107]
En 1923, o científico estadounidense Robert Goddard converteuse na primeira persoa en desenvolver un motor foguete, que usaba gasolina como combustible e osíxeno líquido como oxidante. O 16 de marzo, fixo voar con éxito un pequeno foguete propulsado por combustible líquido durante 56 m a 97 km/h, en Auburn, Massachusetts.[105][108]
Produción industrial[editar | editar a fonte]

- Véxase tamén: Destilación fraccionada.
Empréganse principalmente dous métodos para producir 100 millóns de toneladas de O2 extraídas do aire para usos industriais cada ano[97] O máis común consiste en destilar fraccionadamente aire licuado nos seus diversos compoñentes, co N2 destilado como vapor e o O2 deixado como líquido.[97]
O outro método principal de obtención de O2 gaseoso consiste en pasar un chorro de aire limpo e seco a través dun leito de barutos moleculares de ceolita, que adsorben o nitróxeno e deixan pasar un chorro de gas que é dun 90 a un 93 % O2.[97] Simultaneamente, o outro leito de ceolita saturada de nitróxeno libera este gas ao reducir a presión de funcionamento da cámara e introducir nela ao contraxeito parte do osíxeno separado no leito produtor. Logo de cada ciclo completo, os leitos intercámbianse, permitindo un fornezo constante de osíxeno. Isto coñécese por adsorción por oscilación de presión e utilízase para producir osíxeno a pequena escala.[109]
O osíxeno tamén pode producirse mediante a electrólise da auga, descompoñéndoa en osíxeno e hidróxeno, para o que debe usarse unha corrente continua; se se usase unha corrente alterna os gases de cada extremo consistirían en hidróxeno e osíxeno na explosiva relación 2:1. Contrariamente á crenza popular, a relación 2:1 observada na electrólise de corrente continua da auga acidificada non demostra que a fórmula empírica da auga sexa H2O, a menos que se asuman certas premisas sobre a fórmula molecular do hidróxeno e o osíxeno. Un método similar é a evolución electrocatalítica do O2 de óxidos a oxoácidos. Tamén se poden usar catalizadores químicos, como no xerador químico de osíxeno ou nas candeas de osíxeno que se usan no equipamento de apoio en submarinos e que aínda son parte do equipamento estándar en aerolíneas comerciais para casos de despresurización. Outra tecnoloxía de separación do aire consiste en forzar a disolución do aire a través de membranas de cerámica baseadas en dióxido de circonio, xa sexa por alta presión ou por corrente eléctrica, para producir O2 gaseoso practicamente puro.[51]
Almacenamento[editar | editar a fonte]
Por razóns de economía, o osíxeno adóitase transportar en grandes cantidades en estado líquido, almacenado en tanques especialmente illados, xa que un litro de osíxeno licuado equivale a 840 litros de osíxeno gaseoso a presión atmosférica e 20 °C (68 °F).[97] Estas cisternas úsanse para reencher os grandes contedores de osíxeno líquido que se atopan no exterior dos hospitais e demais institucións que necesitan inxentes cantidades de osíxeno gaseoso puro. O osíxeno líquido pásase por uns intercambiadores de calor que converten o líquido crioxénico en gas antes de que entre no edificio. O osíxeno tamén se almacena e envía en cilindros que conteñen o gas comprimido, o que resulta útil para certas aplicacións médicas portátiles e oxicorte.[97]
Aplicacións[editar | editar a fonte]
- Véxase tamén: Oxidorredución e Combustión.
O 55% da produción mundial de osíxeno consómese na produción de aceiro, outro 25% dedicase a industria química, do 20% restante a maior parte usase para aplicacións medicinais, oxicorte, como oxidante en combustible de foguetes e no tratamento de augas.[51]
Medicina[editar | editar a fonte]
- Artigo principal: Osixenoterapia.

O propósito esencial da respiración é tomar O2 do aire e, en medicina, úsanse suplementos de osíxeno. O tratamento non só incrementa os niveis de osíxeno no sangue do paciente, senón que ten o efecto secundario de diminuír a resistencia ao fluxo do sangue en moitos tipos de pulmóns doentes, facilitando o traballo de bombeo do corazón. A osixenoterapia úsase para tratar o enfisema, a pneumonía, algunhas insuficiencias cardíacas, algunhas desordes que causan unha elevada presión arterial pulmonar e calquera enfermidade que afecte á capacidade do corpo para tomar e usar o osíxeno.[110]
Os tratamentos son o suficientemente flexibles como para ser usados en hospitais, na vivenda do paciente ou, cada vez máis, con instrumentos móbiles. Así, as tendas de osíxeno adoitábanse usar como suplementos de osíxeno, pero fóronse substituíndo polas máscaras de osíxeno e as cánulas nasais.[111]
A medicina hiperbárica (de alta presión) usa cámaras especiais de osíxeno para aumentar a presión parcial do O2 no paciente e, cando son necesarias, no persoal médico.[112] A intoxicación por monóxido de carbono, a mionecrose (gangrena gaseosa) e a síndrome de descompresión ás veces trátanse con estes aparellos.[113] O aumento da concentración de O2 nos pulmones axuda a desprazar o monóxido de carbono do hemogrupo da hemoglobina.[114][115] O osíxeno é tóxico para a bacteria anaerobia que causa a gangrena gaseosa, de maneira que aumentar a súa presión parcial axuda a acabar con elas.[116][117] A síndrome de descompresión sucédelles aos mergulladores que saen demasiado rápido do mar, o que resulta na formación de burbullas de gas inerte, sobre todo nitróxeno, no seu sangue.[110][118][119]
Tamén se usa osíxeno para pacientes que necesitan ventilación mecánica, normalmente a concentracións superiores o 21 % atopado no aire ambiental. Por outra banda, o isótopo 15O usouse de forma experimental na tomografía por emisión de positróns.[120]
Apoio vital e uso recreativo[editar | editar a fonte]

Unha aplicación notable do O2 como gas respirable de baixa presión atópase nos traxes espaciais modernos, que envolven o corpo dos seus ocupantes con aire presurizado. Estes dispositivos usan osíxeno case puro a unha presión de ao redor dun terzo da común, resultando nunha presión parcial normal no O2 do sangue. Este intercambio de osíxeno de alta concentración para unha baixa presión é necesario para manter a flexibilidade dos traxes espaciais.[121][122]
Os mergulladores e os tripulantes de submarinos tamén usan O2 artificialmente proporcionado, pero a maioría usan unha presión normal ou unha mestura de osíxeno e aire. O uso de O2 puro ou case puro en mergullo a presións por encima do nivel do mar limítase xeralmente aos descansos, descompresións e tratamentos de urxencia a relativamente pouca profundidade (~6 metros ou menos). O mergullo a maior profundidade require unha dilución significativa de O2 con outros gases, como nitróxeno ou helio, para axudar a previr a toxicidade do osíxeno.[123][124]
Os escaladores de montaña e os que viaxan en avións non presurizados ás veces teñen un suplemento de O2.[n] Os pasaxeiros de avións comerciais (presurizados) teñen un fornecemento de O2 para urxencias, que se lles pon automaticamente á súa disposición en caso de despresurización da cabina. Unha perda repentina de presión na cabina activa xeradores químicos de osíxeno sobre cada asento e fanse caer máscaras de osíxeno. Ao tirar da máscara para comezar o fluxo de osíxeno, tal e como indican as instrucións de seguridade, fórzanse as limaduras de ferro no clorato de sodio dentro do recipiente. Prodúcese, entón, un chorro constante de osíxeno debido á reacción exotérmica.[51]
O osíxeno, como substancia cun suposto efecto eufórico suave, ten unha historia de uso recreativo en deportes e bares de osíxeno. Estes son establecementos que apareceron no Xapón, California e Las Vegas a finais dos anos 1990 que ofertan exposicións a niveis de O2 superiores ao normal a cambio dunha determinada tarifa.[125] Os atletas profesionais, especialmente en fútbol americano, tamén saen do campo en ocasións, durante os descansos, para poñerse máscaras de osíxeno e obter unha estimulación no seu xogo. O efecto farmacolóxico é dubidoso e o efecto placebo é a explicación máis factible.[125] Existen estudos que apoian esa estimulación con mesturas de O2 enriquecido, pero só se se inhalan durante o exercicio aerobio.[126]
Industria[editar | editar a fonte]

A fundición de mena de ferro na produción de aceiro consome o 55 % do osíxeno producido comercialmente. Neste proceso, o O2 é inxectado mediante unha lanza de alta presión no ferro fundido, que expulsa as impurezas de xofre e o exceso de carbono, en forma dos seus respectivos óxidos, SO2 e CO2. As reaccións son exotérmicas e a temperatura ascende ata os 1700 Cº.[51]
Outro 25 % deste osíxeno dedicase a industria química. O etileno reacciona co O2 para crear óxido de etileno, que, á súa vez, convértese en etilenoglicol, o material usado como base para fabricar unha gran variedade de produtos, incluíndo anticonxelantes e polímeros de poliéster (os precursores de moitos plásticos e téxtiles).[51]
O osíxeno úsase no oxicorte queimando acetileno con O2 para producir unha chama moi quente. Neste proceso, o metal, que pode ter ata 60 cm de grosor, quéntase primeiro cunha pequena chama de oxiacetileno para despois ser rapidamente cortado por un gran chorro de O2.[127]
Investigación[editar | editar a fonte]

Os paleoclimatólogos miden a relación entre o osíxeno-18 e o osíxeno-16 nos esqueletos e exoesqueletos dos organismos mariños para determinar como era o clima hai millóns de anos. As moléculas de auga do mar que conteñen o isótopo máis lixeiro, o osíxeno-16, evapóranse a un ritmo lixeiramente maior que as moléculas que conteñen osíxeno-18 (un 12 % máis pesado); esta disparidade increméntase a baixas temperaturas.[128] En períodos cunha temperatura global máis baixa, a neve e a choiva procedentes desa auga evaporada tenden a ser máis ricas en osíxeno-16, mentres que a auga mariña que queda tende a selo en osíxeno-18. Os organismos mariños, xa que logo, incorporan máis osíxeno-18 nos seus esqueletos e exoesqueletos do que o farían nun medio máis cálido. Os paleoclimatólogos tamén miden directamente esta relación nas moléculas de auga de mostras de núcleos de xeo que se coservaron durante varios centos de miles de anos.[128]
Os xeólogos planetarios mediron as diferenzas na abundancia de isótopos de osíxeno en mostras da Terra, a Lúa, Marte e meteoritos, pero non puideron obter valores de referencia para as relacións entre isótopos do Sol, que se cren iguais a aquelas da nebulosa protosolar. Con todo, a análise dunha oblea de silicio exposta ao vento solar no espazo e devolta á Terra pola sonda Genesis desvelou que o Sol ten unha proporción de osíxeno-16 maior que o noso planeta. A medición implica que un proceso descoñecido esgotou o osíxeno-16 do disco protoplanetario do Sol antes da fusión dos grans de po que formaron a Terra.[129]
O osíxeno presenta dúas bandas de absorción espectrofotométrica con máximos en lonxitudes de onda de 687 e 760 nanómetros. Algúns científicos de detección remota propuxeron usar a medición do resplandor procedente dos doseis de vexetación naquelas bandas para caracterizar a saúde das plantas desde unha plataforma satelital. Esta aproximación explota o feito de que nesas bandas é posible distinguir a reflectividade da vexetación da súa fluorescencia, que é moito máis débil. A medición ten unha alta dificultade técnica, debido á baixa relación sinal/ruído e a estrutura física da vexetación, pero propúxose como un posible método de monitoreo do ciclo do carbono desde satélites a escala global.[130]
Seguridade e precaucións[editar | editar a fonte]
Toxicidade[editar | editar a fonte]
- Artigo principal: Efecto de Paul Bert.


O osíxeno gaseoso pode ser tóxico a presións parciais elevadas, producindo convulsións e outros problemas de saúde.[123][o][132] A toxicidade xeralmente comeza a aparecer con presións parciais de máis de 50 kPa ou 2,5 veces a presión parcial do O2 a nivel do mar (21 kPa; igual a ao redor do 50 % da composición do osíxeno a presión normal). Isto non resulta un problema excepto para pacientes con ventilación mecánica, debido a que o gas administrado a través das máscaras de osíxeno componse típicamente de só un 30 %-50 % de O2 por volume (sobre 30 kPa a presión normal), aínda que estas cifras varían sensiblemente dependendo do tipo de máscara.[36]
Durante un tempo, os bebés prematuros colocábanse en incubadoras que contiñan aire rico en O2, pero esta práctica cesou despois de que algúns destes nenos perdesen a visión.[36][133]
A respiración de O2 puro en aplicacións espaciais, como nalgúns traxes aeroespaciais modernos ou en naves pioneiras como a Apollo, non causa danos debido ás baixas presións totais utilizadas. No caso dos traxes, a presión parcial do O2 no gas respiratorio atópase, en xeral, sobre 30 kPa (1,4 veces o normal) e a presión parcial resultante no sangue arterial do astronauta só está marxinalmente por encima do normal ao nivel do mar.[121][134]
A toxicidade do osíxeno para os pulmóns e o sistema nervioso central tamén pode darse no mergullo profundo e no mergullo profesional.[36][123] A respiración prolongada dunha mestura de aire cunha presión parcial de O2 maior a 60 kPa pode chegar a producir unha fibrose pulmonar permanente.[135]
A exposición a presións parciais superiores a 160 kPa (~1,6 atmosferas) podería causar convulsións, normalmente fatais para os mergulladores. A toxicidade aguda pode producirse ao respirar unha mestura de aire con máis dun 21 % de O2 a 66 ou máis metros de profundidade; o mesmo pode ocorrer ao respirar un 100 % de O2 a só 6 metros.[135][136][137][138]
Combustión e outros riscos[editar | editar a fonte]

As atmosferas ricas en osíxeno en presenza de materiais combustibles son susceptibles de provocar incendios que se propagan con gran rapidez, igual que explosións. Os riscos de lume e explosión danse cando os oxidantes concentrados e os combustibles se sitúan demasiado preto entre si; con todo, a ignición, xa sexa pola calor ou por unha faísca, é necesaria para iniciar a combustión.[25][139] Outro tanto pasa se as fontes de osíxeno son cloratos, percloratos, dicromatos etc.; estes compostos con alto poder oxidante poden provocar tamén queimaduras químicas. O osíxeno por si mesmo non é un combustible, senón un oxidante. Os riscos da combustión tamén se aplican a compostos de osíxeno de alto potencial oxidante, como os peróxidos, cloratos, nitratos, percloratos e dicromatos, porque poden dar osíxeno ao lume.[25][26]
O O2 concentrado permite unha combustión rápida e enérxica.[139] Os tubos e os recipientes de aceiro usados para almacenar e transmitir tanto o osíxeno líquido coma o gaseoso actúan como combustible; xa que logo, o deseño e a fabricación dos sistemas de O2 requiren unha atención especial para asegurar que as fontes de ignición se minimicen.[139] O incendio que acabou coa vida da tripulación do Apollo 1 en 1967 nunha proba na plataforma de lanzamento estendeuse tan rapidamente debido a que a cápsula estaba presurizada con O2 puro, pero a unha presión lixeiramente maior que a atmosférica, en lugar dunha presión de 1/3 da normal que debía usarse na misión.[p][141]
En caso dun derramo de osíxeno líquido, se este chega a empaparse en materia orgánica como madeira, produtos petroquímicos e asfalto pode provocar que estes materiais detonen de forma impredicible ao sufrir un impacto mecánico posterior. Do mesmo xeito que outros líquidos crioxénicos, en contacto co corpo humano poden causar conxelamento en pel e ollos.[139]
Notas[editar | editar a fonte]
- ↑ Non confundir co ozono, O3.
- ↑ Un orbital é un concepto de mecánica cuántica que modela un electrón como unha dualidade onda-partícula que ten unha distribución espacial ao redor dun átomo ou molécula.[15]
- ↑ O paramagnetismo do osíxeno pode usarse analíticamente en analizadores de osíxeno gaseoso paramagnético que determinan a puridade do gas.[19]
- ↑ En química inorgánica, o termo clúster utilízase para indicar un composto caracterizado pola presenza dun ou máis enlaces metálicos.[31]
- ↑ As cifras ofrecidas son para valores de ata 80 km sobre a superficie.
- ↑ De The Chemistry and Fertility of Sea Waters, de H.W. Harvey, 1955, citando a C.J.J. Fox, On the coefficients of absorption of atmospheric gases in sea water, Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Con todo, Harvey sostén que, de acordo a artigos posteriores en Nature, os valores parecen estar sobreestimados nun 3 %.
- ↑ Tamén, debido á maior electronegatividade do osíxeno respecto ao hidróxeno, a diferenza na carga convértea nunha molécula polar. As interaccións entre os diferentes dipolos de cada molécula causan unha forza de atracción global.
- ↑ As membranas tilacoidais son parte dos cloroplastos de algas e plantas, mentres que son unha simple estrutura membranosa máis das moitas que teñen as cianobacterias. De feito, crese que os cloroplastos evolucionaron desde as cianobacterias que unha vez foron compañeiros simbióticos dos predecesores das plantas e algas.
- ↑ A oxidación da auga catalízase por un complexo de enzimas que contén manganeso, coñecido como complexo enzimático que escinde a auga, que se atopa asociado co lumen dos discos tilacoides. O manganeso é un cofactor importante e o calcio e o cloro son tamén necesarios para que a reacción poida suceder.[80]
- ↑ En humanos, o volume normal é de 6 a 8 litros de aire por minuto.[81]
- ↑ (1,8 gramos/min/persoa)×(60 min/h)×(24 h/día)×(365 días/ano)×(6600 millóns de persoas)/1 000 000 g/t=6240 millóns de toneladas.
- ↑ Derivado dos valores de mmHg usando 0,133322 kPa/mmHg.
- ↑ Estes resultados ignoráronse na súa maior parte ata 1860. Parte deste rexeitamento debíase á crenza de que os átomos dun elemento non terían afinidade química cara aos átomos do mesmo elemento, e outra parte debíase ás aparentes excepcións á Lei de Avogadro que non foran explicadas en termos de disociación de moléculas.[102]
- ↑ A razón é que, incrementando a proporción de osíxeno no gas respiratorio a baixa presión, aumenta a presión parcial do O2 inspirado ata preto da do nivel do mar.
- ↑ Xa que a presión parcial do O2 é a proporción de O2 multiplicado pola presión total, a elevada presión parcial pode ocorrer ben por unha alta concentración de O2 no gas respiratorio, ben pola alta presión do gas ou por unha combinación de ambas.
- ↑ Non se identificou de xeito concluínte ningunha fonte de ignición no incendio, aínda que algunhas probas o achacan desde un arco eléctrico ata unha faísca.[140]
- Referencias
- Todas as referencias en inglés agás cando se indique o contrario
- ↑ "Standard Atomic Weights". Commission on Isotopic Abundances and Atomic Weights. Consultado o 20 de abril de 2016.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para osíxeno.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para oxíxeno.
- ↑ "WebElements: the periodic table on the web – Oxygen: electronegativities". WebElements. Consultado o 7 de novembro de 2011.
- ↑ 5,0 5,1 Emsley 2001, p. 297
- ↑ 6,0 6,1 "Oxygen". Los Alamos National Laboratory. Arquivado dende o orixinal o 26 de outubro de 2007. Consultado o 22 de xullo de 2012.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 Cook & Lauer 1968, p. 500
- ↑ "Atmospheric Oxygen Research". Scripps Institute. Consultado o 20 de abril de 2016.
- ↑ NASA, ed. (27 de setembro de 2007). "NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago" (en inglés). Arquivado dende o orixinal o 13 de marzo de 2008. Consultado o 22 de xullo de 2012.
- ↑ "Atomic oxygen erosion". Arquivado dende o orixinal o 13 de xuño de 2007. Consultado o 8 de agosto de 2009.
- ↑ 11,0 11,1 11,2 Cartwright, John (2000). "Contexto histórico antes de la química en el siglo XVIII". Del flogisto al oxígeno (en castelán). Fundación Canaria Orotava. ISBN 9788460711117.
- ↑ "Molecular Orbital Theory" (en inglés). Purdue University. Arquivado dende o orixinal o 10 de maio de 2008. Consultado o 24 de agosto de 2014.
- ↑ Pauling, L. (1960). The nature of the chemical bond and the structure of molecules and crystals : An introduction to modern structural chemistry (3ª ed.). Cornell University Press. ISBN 0-8014-0333-2.
- ↑ 14,0 14,1 Jakubowski, Henry. "Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen". Biochemistry Online. Saint John's University. Consultado o 28 de xaneiro de 2008.
- ↑ McMurry, John; Fay, Robert C. (2001). Chemistry (3ª ed.). Prentice Hall. p. 193. ISBN 9780130872050.
- ↑ Barrett, Jack (2002). Atomic Structure and Periodicity. Basic concepts in chemistry 9. Cambridge, Reino Unido: Royal Society of Chemistry. p. 153. ISBN 0854046577.
- ↑ 17,0 17,1 17,2 Emsley 2001, p. 303
- ↑ "Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet". University of Wisconsin-Madison Chemistry Department Demonstration lab. Arquivado dende o orixinal o 17 de decembro de 2007. Consultado o 22 de xullo de 2012.
- ↑ "Company literature of Oxygen analyzers (triplet)". Servomex. Arquivado dende o orixinal o 08 de marzo de 2008. Consultado o 21 de setembro de 2014.
- ↑ Krieger-Liszkay, Anja (13 de outubro de 2004). "Singlet oxygen production in photosynthesis". Journal of Experimental Botanics (Oxford Journals) 56 (411): 337–346. PMID 15310815. doi:10.1093/jxb/erh237.
- ↑ Harrison, Roy M. (1990). Pollution: Causes, Effects & Control (2ª ed.). Cambridge: Royal Society of Chemistry. ISBN 0-85186-283-7.
- ↑ Wentworth Jr., Paul; McDunn, JE; Wentworth, AD; Takeuchi, C; Nieva, J; Jones, T; Bautista, C; Ruedi, JM; Gutierrez, A (13 de decembro de 2002). "Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation". Science 298 (5601): 2195–2219. Bibcode:2002Sci...298.2195W. PMID 12434011. doi:10.1126/science.1077642.
- ↑ Hirayama, Osamu; Nakamura, Kyoko; Hamada, Syoko; Kobayasi, Yoko (1994). "Singlet oxygen quenching ability of naturally occurring carotenoids". Lipids (Springer) 29 (2): 149–150. PMID 8152349. doi:10.1007/BF02537155.
- ↑ Chieh, Chung. "Bond Lengths and Energies". University of Waterloo. Arquivado dende o orixinal o 14 de decembro de 2007. Consultado o 11 de outubro de 2014.
- ↑ 25,0 25,1 25,2 Weiss, Hilton M. (2008). "Appreciating Oxygen". J. Chem. Educ. 85 (9): 1218. doi:10.1021/ed085p1218.
- ↑ 26,0 26,1 Schmidt-Rohr, K. (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2". J. Chem. Educ. 92: 2094–2099. doi:10.1021/acs.jchemed.5b00333.
- ↑ 27,0 27,1 27,2 Stwertka, Albert (1998). Guide to the Elements. Oxford University Press. pp. 48–49. ISBN 0-19-508083-1.
- ↑ 28,0 28,1 28,2 Parks, G. D.; Mellor, J. W. (1939). Mellor's Modern Inorganic Chemistry (en inglés) (6ª ed.). Londres: Longmans, Green and Co.
- ↑ 29,0 29,1 Cacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). "Experimental Detection of Tetraoxygen". Angewandte Chemie International Edition 40 (21): 4062–65. PMID 12404493. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X.
- ↑ 30,0 30,1 Phillip, Ball (16 de setembro de 2001). "New form of oxygen found". Nature News. Arquivado dende o orixinal o 21 de outubro de 2013. Consultado o 22 de xullo de 2012.
- ↑ Mingos, D. M. P.; Wales, David J. (1990). Introduction to Cluster Chemistry. Prentice Hall. ISBN 9780134790497.
- ↑ Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; Loubeyre, Paul (2006). "Observation of an O8 molecular lattice in the phase of solid oxygen". Nature 443 (7108): 201–04. Bibcode:2006Natur.443..201L. PMID 16971946. doi:10.1038/nature05174.
- ↑ Desgreniers, S; Vohra, Y. K.; Ruoff, A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". J. Phys. Chem. 94 (3): 1117–22. doi:10.1021/j100366a020.
- ↑ Shimizu, K.; Suhara, K.; Ikumo, M.; Eremets, M. I.; Amaya, K. (1998). "Superconductivity in oxygen". Nature 393 (6687): 767–69. Bibcode:1998Natur.393..767S. doi:10.1038/31656.
- ↑ "World Ocean Atlas 2009". National Centers for Environmental Information. Consultado o 26 de abril de 2016.
- ↑ 36,0 36,1 36,2 36,3 36,4 36,5 Emsley 2001, p. 299
- ↑ 37,0 37,1 "Air solubility in water". The Engineering Toolbox. Consultado o 26 de outubro de 2014.
- ↑ Evans, David Hudson; Claiborne, James B. (2006). The Physiology of Fishes. CRC Press. p. 88. ISBN 0-8493-2022-4.
- ↑ Lide, David R. (2003). "Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements". CRC Handbook of Chemistry and Physics (84ª ed.). Boca Raton, Florida: CRC Press. ISBN 0-8493-0595-0.
- ↑ "Overview of Cryogenic Air Separation and Liquefier Systems". Universal Industrial Gases, Inc. Consultado o 15 de xaneiro de 2015.
- ↑ "Liquid Oxygen Material Safety Data Sheet" (PDF). Matheson Tri Gas. Arquivado dende o orixinal (PDF) o 11 de abril de 2014. Consultado o 15 de xaneiro de 2015.
- ↑ Krupenie, Paul H. (1972). "The Spectrum of Molecular Oxygen". Journal of Physical and Chemical Reference Data 1 (2): 423. doi:10.1063/1.3253101.
- ↑ Brasseur, Guy P.; Solomon, Susan (2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. p. 220. ISBN 978-1-4020-3824-2.
- ↑ Kearns, David R. (1971). "Physical and chemical properties of singlet molecular oxygen". Chemical Reviews 71 (4): 395–427. doi:10.1021/cr60272a004.
- ↑ 45,0 45,1 45,2 45,3 Emsley 2001, p. 298
- ↑ Belton, M. J. S.; Hunten, D. M. (1968). "A Search for O2 on Mars and Venus: a Possible Detection of Oxygen in the Atmosphere of Mars". Astrophysical Journal 153: 963. Bibcode:1968ApJ...153..963B.
- ↑ Elikns-Tanton, Linda T. (2006). Mars. Infobase Publishing. p. 82. ISBN 9781438107264.
- ↑ Boozer, Allen Hayne (1970). Late stages of stellar evolution: carbon-oxygen stars and neutron stars. Dissertation Abstracts International (Tese) (Cornell University). p. 7067. Bibcode:1970PhDT........11B.
- ↑ Croswell, Ken (1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5.
- ↑ Taube, M. (2012). Evolution of Matter and Energy on a Cosmic and Planetary Scale. Springer Science & Business Media. p. 158. ISBN 9783642954535.
- ↑ 51,0 51,1 51,2 51,3 51,4 51,5 Emsley 2001, p. 301
- ↑ 52,0 52,1 52,2 52,3 "Oxygen Nuclides / Isotopes". EnvironmentalChemistry.com. Consultado o 15 de xaneiro de 2015.
- ↑ 53,0 53,1 53,2 Meyer, B.S. (19-21 de setembro de 2005). "Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen" (PDF). Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Workshop on Oxygen in the Earliest Solar System. Gatlinburg, Tennessee. 9022.
- ↑ "NUDAT 13O". Arquivado dende o orixinal o 04 de outubro de 2018. Consultado o 22 de xullo de 2012.
- ↑ "NUDAT 14O". Arquivado dende o orixinal o 07 de xuño de 2022. Consultado o 21 de febreiro de 2015.
- ↑ "NUDAT 15O". Arquivado dende o orixinal o 07 de xuño de 2022. Consultado o 21 de febreiro de 2015.
- ↑ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (en inglés) (2ª ed.). Butterworth–Heinemann. p. 28. ISBN 0080379419.
- ↑ TMH. "13 - Oxygen". Study Package for NDA. Tata McGraw-Hill Education. p. 359. ISBN 9780071074643.
- ↑ Clugston, Michael; Flemming, Rosalind (2000). Advanced Chemistry. OUP Oxford. ISBN 9780199146338.
- ↑ Weiner, Eugene R. (2012). Applications of Environmental Aquatic Chemistry: A Practical Guide (3ª ed.). CRC Press. p. 87. ISBN 9781439853337.
- ↑ TMH (2010). Course In Chemistry Iit Jee 2011. Tata McGraw-Hill Education. 4.8. ISBN 9780070703360.
- ↑ Peyrous, R; Pignolet, P; Held, B (1989). "Kinetic simulation of gaseous species created by an electrical discharge in dry or humid oxygen". Journal of Physics D: Applied Physics 22 (11): 1658.
- ↑ Oda, Tatsuki; Pasquarello, Alfredo (21 de outubro de 2002). "Ab Initio Molecular Dynamics Investigation of the Structure and the Noncollinear Magnetism in Liquid Oxygen: Occurrence of O4 Molecular Units". Phys. Rev. Lett. 89 (197204). doi:10.1103/PhysRevLett.89.197204.
- ↑ Maksyutenko, P.; Rizzo, T. R.; Boyarkin, O. V. (2006). "A direct measurement of the dissociation energy of water". J. Chem. Phys. 125 (18): 181101. Bibcode:2006JChPh.125r1101M. PMID 17115729. doi:10.1063/1.2387163.
- ↑ Chaplin, Martin (4 de xaneiro de 2008). "Water Hydrogen Bonding". Arquivado dende o orixinal o 14 de maio de 2015. Consultado o 27 de xuño de 2015.
- ↑ Smart, Lesley E.; Moore, Elaine A. (2005). Solid State Chemistry: An Introduction (3ª ed.). CRC Press. p. 214. ISBN 978-0-7487-7516-3.
- ↑ 67,0 67,1 Cook & Lauer 1968, p. 507
- ↑ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (3ª ed.). John Wiley & Sons. p. 152. ISBN 978-0-471-18423-2.
- ↑ Cook & Lauer 1968, p. 505
- ↑ Manahan 2013, p. 568
- ↑ Manahan 2013, p. 246
- ↑ Ebbing, Darrell; Gammon, Steven D. (2016). General Chemistry. Cengage Learning. p. 834. ISBN 9781305580343.
- ↑ Guenter Sienel; Robert Rieth; Kenneth T. Rowbottom (2005). "Epoxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a09_531.
- ↑ Cook & Lauer 1968, p. 506
- ↑ Decker, Heinz; van Holde, Kensal E (2010). Oxygen and the Evolution of Life. Springer Science & Business Media. p. 99. ISBN 9783642131790.
- ↑ Martin, Lawrence (1999). All you really need to know to interpret arterial blood gases (2ª ed.). Philadelphia: Lippincott Williams & Wilkins. p. xxvi. ISBN 978-0683306040.
- ↑ Fenical, William (1983). Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). Marine Plants: A Unique and Unexplored Resource (DIANE Publishing). p. 147. ISBN 1-4289-2397-7.
- ↑ Walker, J. C. G. (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag.
- ↑ Brown, Theodore L.; LeMay, Burslen (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. p. 958. ISBN 0-13-048450-4.
- ↑ 80,0 80,1 80,2 Raven, Evert & Eichhorn 2005, pp. 115–127
- ↑ Bipal, Kr. Jana; Mrinmoy, Majumder, eds. (2010). Impact of Climate Change on Natural Resource Management. Springer Science & Business Media. p. 14. ISBN 9789048135813.
- ↑ "ABG (Arterial Blood Gas)". brooksidepress.org. Consultado o 21 de abril de 2016.
- ↑ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 0-7645-7419-1.
- ↑ 84,0 84,1 Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. (2013). "Atmospheric oxygenation three billion years ago". Nature 501 (7468): 535–538. PMID 24067713. doi:10.1038/nature12426.
- ↑ Campbell, Neil A.; Reece, Jane B. (2005). Biology, 7ª Edición. San Francisco: Pearson – Benjamin Cummings. pp. 522–523. ISBN 0-8053-7171-0.
- ↑ Freeman, Scott (2005). Biological Science, 2nd. Pearson – Prentice Hall. pp. 214, 586. ISBN 0-13-140941-7.
- ↑ 87,0 87,1 Berner, Robert A. (1999). "Atmospheric oxygen over Phanerozoic time". Proceedings of the National Academy of Sciences of the USA 96 (20): 10955–57. Bibcode:1999PNAS...9610955B. PMC 34224. PMID 10500106. doi:10.1073/pnas.96.20.10955.
- ↑ Butterfield, N. J. (2009). "Oxygen, animals and oceanic ventilation: an alternative view". Geobiology 7 (1). PMID 19200141. doi:10.1111/j.1472-4669.2009.00188.x.
- ↑ Poulsen, Christopher J.; Tabor, Clay; White, Joseph D. "Long-term climate forcing by atmospheric oxygen concentrations". Science. doi:10.1126/science.1260670.
- ↑ Dole, Malcolm (1965). "The Natural History of Oxygen" (PDF). The Journal of General Physiology 49 (1): 5–27. PMC 2195461. PMID 5859927. doi:10.1085/jgp.49.1.5.
- ↑ Jastrow, Joseph (1936). Story of Human Error. Ayer Publishing. p. 171. ISBN 0-8369-0568-7.
- ↑ 92,0 92,1 92,2 92,3 92,4 Cook & Lauer 1968, p. 499
- ↑ 93,0 93,1 93,2 Contribuidores da Britannica (1911). "John Mayow". Encyclopaedia Britannica (11ª ed.). Arquivado dende o orixinal o 25 de agosto de 2013. Consultado o 20 de xuño de 2015.
- ↑ 94,0 94,1 Contribuídores de World of Chemistry (2005). "John Mayow". World of Chemistry. Thomson Gale. ISBN 0-669-32727-1.
- ↑ 95,0 95,1 Conant, James Bryan, ed. (1950). The Overthrow of Phlogiston Theory: The Chemical Revolution of 1775–1789 14. Cambridge: Harvard University Press. OCLC 301515203.
- ↑ 96,0 96,1 Morris, Richard (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN 0-309-08905-0.
- ↑ 97,0 97,1 97,2 97,3 97,4 97,5 97,6 Emsley 2001, p. 300
- ↑ Priestley, Joseph (1775). "An Account of Further Discoveries in Air". Philosophical Transactions 65: 384–94. doi:10.1098/rstl.1775.0039.
- ↑ Cobb, Cathy; Goldwhite, Harold (1995). "ca. 1800–1848: The Professional Chemist". Creations of Fire: Chemistry’s Lively History from Alchemy to the Atomic Age. Springer. pp. 185–211. ISBN 978-1-4899-2770-5. doi:10.1007/978-1-4899-2770-5_10.
- ↑ DeTurck, Dennis; Gladney, Larry; Pietrovito, Anthony (1997). "Do We Take Atoms for Granted?". The Interactive Textbook of PFP96. University of Pennsylvania. Arquivado dende o orixinal o 17 de xaneiro de 2008. Consultado o 28 de xaneiro de 2008.
- ↑ Roscoe, Henry Enfield; Schorlemmer, Carl (1883). A Treatise on Chemistry. D. Appleton and Co. p. 38.
- ↑ Rocke, Alan J. (1984). Chemical Atomism in the Nineteenth Century. Ohio State University Press.
- ↑ 103,0 103,1 Daintith, John (1994). Biographical Encyclopedia of Scientists. CRC Press. p. 707. ISBN 0-7503-0287-9.
- ↑ "Poland – Culture, Science and Media. Condensation of oxygen and nitrogen". 4 de outubro de 2008. Arquivado dende o orixinal o 04 de outubro de 2010. Consultado o 20 de xuño de 2015.
- ↑ 105,0 105,1 105,2 "How Products are Made - Oxygen". Answers.com. 2002. Consultado o 22 de xullo de 2012.
- ↑ "Papers Past — Evening Post — 30 July 1898 — A Startling Scientific Prediction". Paperspast.natlib.govt.nz. Consultado o 2 de xuño do 2015.
- ↑ "The Oxygen Famine". The Evening News. 16 de xullo de 1901. Consultado o 20 de xuño do 2015.
- ↑ "Goddard-1926". NASA. Arquivado dende o orixinal o 08 de novembro de 2007. Consultado o 20 de xuño do 2015.
- ↑ "Non-Cryogenic Air Separation Processes". UIG Inc. 2003. Consultado o 22 de xullo de 2012.
- ↑ 110,0 110,1 Cook & Lauer 1968, p. 510
- ↑ Sim, MA; Dean, P; Kinsella, J; Black, R; Carter, R; Hughes, M (2008). "Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated". Anaesthesia 63 (9): 938–40. PMID 18540928. doi:10.1111/j.1365-2044.2008.05536.x.
- ↑ Stephenson, RN; Mackenzie, I; Watt, SJ; Ross, JA (1996). "Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy". Undersea Hyperb Med 23 (3): 185–8. PMID 8931286. Arquivado dende o orixinal o 11 de agosto de 2011. Consultado o 21 de xuño de 2015.
- ↑ "Indications for hyperbaric oxygen therapy". Undersea and Hyperbaric Medical Society. Arquivado dende o orixinal o 25 de maio de 2011. Consultado o 20 de xuño do 2015.
- ↑ "Carbon Monoxide". Undersea and Hyperbaric Medical Society. Arquivado dende o orixinal o 25 de xullo de 2008. Consultado o 22 de xullo de 2012.
- ↑ Piantadosi, CA (2004). "Carbon monoxide poisoning". Undersea Hyperb Med 31 (1): 167–77. PMID 15233173.
- ↑ Hart, GB; Strauss, MB (1990). "Gas Gangrene – Clostridial Myonecrosis: A Review". J. Hyperbaric Med 5 (2): 125–144. Arquivado dende o orixinal o 03 de febreiro de 2011. Consultado o 21 de xuño de 2015.
- ↑ Zamboni, WA; Riseman, JA; Kucan, JO (1990). "Management of Fournier's Gangrene and the role of Hyperbaric Oxygen". J. Hyperbaric Med 5 (3): 177–186. Arquivado dende o orixinal o 03 de febreiro de 2011. Consultado o 21 de xuño de 2015.
- ↑ "Decompression Sickness or Illness and Arterial Gas Embolism". Undersea and Hyperbaric Medical Society. Arquivado dende o orixinal o 05 de xullo de 2008. Consultado o 22 de xullo de 2012.
- ↑ Acott, C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal 29 (2). ISSN 0813-1988. OCLC 16986801.
- ↑ Agostini, D.; Iida, H.; Takahashi, A. (1995). "Positron emission tomography with oxygen-15 of stunned myocardium caused by coronary artery vasospasm after recovery". British Heart Journal 73 (1): 69–72. PMC 483759. PMID 7888266. doi:10.1136/hrt.73.1.69.
- ↑ 121,0 121,1 Morgenthaler, GW; Fester, DA; Cooley, CG (1994). "As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations". Acta Astronaut 32 (1): 39–49. PMID 11541018. doi:10.1016/0094-5765(94)90146-5.
- ↑ Webb, JT; Olson, RM; Krutz, RW; Dixon, G; Barnicott, PT (1989). "Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures". Aviat Space Environ Med 60 (5): 415–21. PMID 2730484.
- ↑ 123,0 123,1 123,2 Acott, C. (1999). "Oxygen toxicity: A brief history of oxygen in diving". South Pacific Underwater Medicine Society Journal 29 (3). ISSN 0813-1988. OCLC 16986801. Arquivado dende o orixinal o 25 de decembro de 2010. Consultado o 21 de xuño de 2015.
- ↑ Longphre, J. M.; Denoble, PJ; Moon, RE; Vann, RD; Freiberger, JJ (2007). "First aid normobaric oxygen for the treatment of recreational diving injuries". Undersea Hyperb Med. 34 (1): 43–49. ISSN 1066-2936. OCLC 26915585. PMID 17393938. Arquivado dende o orixinal o 13 de xuño de 2008. Consultado o 21 de xuño de 2015.
- ↑ 125,0 125,1 Bren, Linda (2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer magazine. U.S. Food and Drug Administration. Arquivado dende o orixinal o 18 de outubro de 2007. Consultado o 22 de xullo de 2012.
- ↑ "Ergogenic Aids". Peak Performance Online. Arquivado dende o orixinal o 28 de setembro de 2007. Consultado o 22 de xullo de 2012.
- ↑ Cook & Lauer 1968, p. 508
- ↑ 128,0 128,1 Emsley 2001, p. 304
- ↑ Hand, Eric (13 de marzo de 2008). "The Solar System's first breath". Nature 452 (7185): 259. Bibcode:2008Natur.452..259H. PMID 18354437. doi:10.1038/452259a.
- ↑ Miller, J.R.; Berger, M.; Alonso, L.; Cerovic, Z.; Goulas, Y.; Jacquemoud, S.; Louis, J.; Mohammed, G.; Moya, I.; Pedros, R.; Moreno, J.F.; Verhoef, W.; Zarco-Tejada, P.J. "Progress on the development of an integrated canopy fluorescence model". Geoscience and Remote Sensing Symposium, 2003. IGARSS '03. Proceedings. 2003 IEEE International. doi:10.1109/IGARSS.2003.1293855.
- ↑ Dharmeshkumar, N; Ashish, Goel; Agarwal, SB; Garg, Praveenkumar; Lakhani, Krishna K (2003). "Oxygen Toxicity" (PDF). Indian Academy of Clinical Medicine 4 (3): 234. Arquivado dende o orixinal (PDF) o 22 de setembro de 2015. Consultado o 28 de xuño de 2015.
- ↑ Cook & Lauer 1968, p. 511
- ↑ Drack, AV (1998). "Preventing blindness in premature infants". N. Engl. J. Med. 338 (22): 1620–1. PMID 9603802. doi:10.1056/NEJM199805283382210.
- ↑ Wade, Mark (2007). "Space Suits". Encyclopedia Astronautica. Arquivado dende o orixinal o 13 de decembro de 2007. Consultado o 28 de xuño do 2015.
- ↑ 135,0 135,1 Wilmshurst, P (1998). "Diving and oxygen". BMJ 317 (7164): 996–9. PMC 1114047. PMID 9765173. doi:10.1136/bmj.317.7164.996.
- ↑ Donald, Kenneth (1992). Oxygen and the Diver. SPA. ISBN 1-85421-176-5.
- ↑ Donald, K. W. (1947). "Oxygen Poisoning in Man: Part I". Br Med J 1 (4506): 667–72. PMC 2053251. PMID 20248086. doi:10.1136/bmj.1.4506.667.
- ↑ Donald, K. W. (1947). "Oxygen Poisoning in Man: Part II". Br Med J 1 (4507): 712–7. PMC 2053400. PMID 20248096. doi:10.1136/bmj.1.4507.712.
- ↑ 139,0 139,1 139,2 139,3 Werley, Barry L., ed. (1991). "Fire Hazards in Oxygen Systems". ASTM Technical Professional training. ASTM International Subcommittee G-4.05.
- ↑ NASA History Office. Apollo 204 Review Board (Informe). Washington, DC: NASA Historical Reference Collection.
- ↑ Chiles, James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. Nova York: HarperCollins Publishers Inc. ISBN 0-06-662082-1.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Osíxeno |
Bibliografía[editar | editar a fonte]
- "Táboa periódica dos elementos" (PDF). Consello da Cultura Galega, Xunta de Galicia, Real Academia Galega de Ciencias, Real Academia Galega e Ciencia Nosa. 2019.
- Bermejo, M. R.; González, A.; Vázquez, M. (2006). O nome e o símbolo dos elementos químicos (PDF). Xunta, Secretaría Xeral de Política Lingüística e CRPIH. ISBN 978-84-453-4325-8.
- Bermejo, M. R.; González, A.; Maneiro, M. (2018). Guía dos elementos químicos. Historia, propiedades e aplicacións. Xunta de Galicia e CRPIH. ISBN 978-84-453-5297-7.
- Cook, Gerhard A.; Lauer, Carol M. (1968). "Oxygen". En Hampel, Clifford A. The Encyclopedia of the Chemical Elements (en inglés). Nova York: Reinhold Book Corporation. LCCN 68-29938.
- Emsley, John (2001). Oxygen. Nature's Building Blocks: An A-Z Guide to the Elements (en inglés) (Oxford University Press). ISBN 0-19-850340-7.
- Manahan, Stanley E. (2013). Fundamentals of Environmental and Toxicological Chemistry: Sustainable Science, Fourth Edition (en inglés). CRC Press. ISBN 9781466553163.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants, 7th Edition (en inglés). Nova York: W.H. Freeman and Company Publishers. ISBN 0-7167-1007-2.
Ligazóns externas[editar | editar a fonte]
- "Oxygen: the essentials". WebElements.com (en inglés).
- "Element Oxygen - O". EnvironmentalChemistry.com (en inglés).
- "It's Elemental - The Element Oxygen". Jefferson Lab (en inglés).
