Elementos do grupo 12
Os elementos do grupo 12, segundo a numeración recomendada pola IUPAC,[1] é un grupo de elementos químicos da táboa periódica que inclúe o cinc (Zn), o cadmio (Cd) e mailo mercurio (Hg).[2] Varios experimentos sobre átomos individuais de copernicio (Cn)[3] apoian a inclusión deste elemento tamén no grupo 12. Segundo o sistema de numeración antigo, tanto da IUPAC coma do CAS, este grupo coñecíase como IIB.
Tanto o cinc coma o cadmio e o mercurio están presentes na natureza e teñen aplicacións moi variadas nos eidos da electricidade e a electrónica, así como para a formación de aliaxes. Os dous primeiros, metais sólidos en condicións normais, teñen propiedades moi semellantes. O mercurio, pola súa banda, é o único metal líquido a temperatura ambiente. O cinc ten unha grande importancia na bioquímica dos seres vivos, pero o cadmio e o mercurio son altamente tóxicos. Canto ao copernicio, dado que non existe de xeito natural, debe sintetizarse no laboratorio.
Propiedades físicas[editar | editar a fonte]
Coma noutros grupos da táboa periódica, os elementos do grupo 12 amosan certos padróns na súa configuración electrónica, especialmente nas capas máis externas, o cal orixina tendencias no seu comportamento químico:
| Z | Elemento | Núm. de electróns por capa |
|---|---|---|
| 30 | cinc | 2, 8, 18, 2 |
| 48 | cadmio | 2, 8, 18, 18, 2 |
| 80 | mercurio | 2, 8, 18, 32, 18, 2 |
| 112 | copernicio | 2, 8, 18, 32, 32, 18, 2 (predición) |
Os elementos do grupo 12 son metais brandos, diamagnéticos e bivalentes, cos puntos de fusión máis baixos de todos os metais de transición. O cinc é branco azulado e brillante,[4] aínda que a meirande parte de calidades comerciais posúen un acabado mate.[5] O cadmio é brando, maleable, dúctil e de cor branca azulada. O mercurio, pola súa banda, é un metal líquido denso e prateado. É o único metal líquido a temperatura ambiente e, en comparación con outros metais, é un mal condutor da calor pero un condutor eléctrico moderadamente bo.[6]
Na táboa inferior amósase un resumo das principais propiedades físicas dos elementos do grupo 12. Sábese moi pouco sobre o copernicio e ningunha das súas propiedades físicas se confirmou aínda, agás o seu punto de ebulición (provisionalmente).[7]
| Nome | Cinc | Cadmio | Mercurio | Copernicio |
|---|---|---|---|---|
| Punto de fusión | 693 K (420 °C) | 594 K (321 °C) | 234 K (−39 °C) | ? |
| Punto de ebulición | 1180 K (907 °C) | 1040 K (767 °C) | 630 K (357 °C) | 357+112 −108 K (84+112 −108 °C) |
| Densidade | 7,14 g cm−3 | 8,65 g cm−3 | 13,534 g cm−3 | 23,7 g cm−3 (?) |
| Aparencia | branco azulado metálico | branco azulado | prateado | ? |
| Raio atómico | 135 pm | 155 pm | 150 pm | 147 pm (?) |
O cinc é algo menos denso ca o ferro e ten unha estrutura cristalina hexagonal.[8] Trátase dun metal duro e fráxil en condicións normais, pero vólvese maleable entre 100 e 150 °C.[4][5] Por riba dos 210 °C recupera a súa fraxilidade e pode pulverizarse por golpeo.[9] O cinc é un condutor eléctrico aceptable e, para se tratar dun metal, ten uns puntos de fusión e ebulición relativamente baixos. O cadmio é semellante a el en moitos aspectos, pero este forma complexos.[10] Contrariamente a outros metais, o cadmio é resistente á corrosión; é por iso que se emprega como cobertura protectora revestindo outros metais. En bloque, o cadmio é insoluble en auga e non é inflamable, pero en forma de po pode arder e liberar fumes tóxicos.[11] Canto ao mercurio, ten unha temperatura de fusión excepcionalmente baixa para ser un metal do bloque d.
O cinc, o cadmio e o mercurio poden formar un amplo abano de aliaxes. O latón, por exemplo, é unha aliaxe de cinc e cobre. Tamén poden formar aliaxes co cinc o aluminio, o antimonio, o bismuto, o chumbo, o cobalto, o estaño, o ferro, o magnesio, o mercurio, o níquel, a prata, o ouro, o sodio e o telurio.[12] Aínda que nin o cinc nin o circonio son ferromagnéticos, a súa aliaxe ZrZn2 si amosa ferromagnetismo por debaixo dos 35 K.[4] O cadmio, pola súa banda, emprégase en numerosas aliaxes para soldadura e chumaceiras, grazas ao seu baixo coeficiente de fricción e á súa resistencia á fatiga.[13] Tamén se atopa nalgunhas das aliaxes de punto de fusión máis baixo, coma o metal de Wood.[14] O mercurio, como é un líquido, disolve outros metais e as aliaxes que forma chámanse amálgamas. Por exemplo, coñécense amálgamas co ouro, o cinc, o sodio e moitos outros metais. O ferro é unha excepción, polo que se empregaron tradicionalmente recipientes deste metal para o almacenamento do mercurio. Outros metais que non se amalgaman co mercurio son o tántalo, o volframio e o platino. A amálgama de sodio é un axente redutor moi común en síntese orgánica e tamén se emprega nas lámpadas de vapor de sodio de alta presión. O mercurio tamén se combina facilmente co aluminio para formar unha amálgama de aluminio cando ambos os metais puros entran en contacto. Como a amálgama reacciona co aire para dar óxido de aluminio, pequenas cantidades de mercurio poden corroer o aluminio; é por iso que, normalmente, non se permite introducir mercurio en avións ou barcos.[15]
Propiedades químicas[editar | editar a fonte]
A meirande parte da química só se estudou para os tres primeiros membros do grupo 12. A química do copernicio aínda non está ben establecida; polo tanto, esta sección trata unicamente os casos do cinc, o cadmio e o mercurio.
Tendencias periódicas[editar | editar a fonte]
Todos os elementos deste grupo son metais. A semellanza dos raios metálicos do cadmio e o mercurio débese á contracción dos lantánidos; como consecuencia, a tendencia neste grupo é diferente á do grupo 2, os metais alcalinotérreos, onde o raio metálico increméntase progresivamente ao baixar no grupo. Os tres metais teñen puntos de fusión e ebulición relativamente baixos, o que é sinal dun enlace metálico feble cun solapamento relativamente pequeno entre as bandas de valencia e condución.[16] Por isto o cinc está preto da liña de demarcación entre os metais e os metaloides, que normalmente se establece entre o galio e o xermanio, se ben o galio participa en semicondutores como o arseniuro de galio.
O cinc e o cadmio son electropositivos, pero o mercurio non;[16] en consecuencia, ambos os metais son bos axentes redutores. Os elementos do grupo 12 teñen un estado de oxidación +2 no cal os ións teñen unha configuración electrónica d10 relativamente estable, cunha subcapa chea. Porén, o mercurio pode reducirse facilmente ao estado de oxidación +1, no cal dous ións mercurio(I) xúntanse por medio dun enlace metal-metal para formar a especie diamagnética Hg22+.[17] O cadmio tamén pode formar ións como o [Cd2Cl6]4−, onde o estado de oxidación do metal é +1. Como sucede co mercurio, a formación dun enlace metal-metal resulta nun composto diamagnético sen electróns desemparellados, o que o fai moi reactivo. O cinc(I) só se coñece en fase gasosa, en compostos como o Zn2Cl2, lineal e análogo ao calomelanos.
Clasificación[editar | editar a fonte]
Normalmente, considérase que os elementos do grupo 12 forman parte do bloque d, pero non se consideran metais de transición porque a súa capa d está completa. Algúns autores considéranos dentro dos elementos representativos porque os seus electróns de valencia se atopan en orbitais ns2; porén, comparten moitas características cos veciños elementos do grupo 11 da táboa periódica, que se consideran elementos de transición de xeito case universal. Por exemplo, o cinc ten características en común co metal de transición adxacente, o cobre: os complexos de cinc están incluídos na serie de Irving–Williams ao posuíren a mesma estequiometría ca os complexos de cobre(II), se ben con constantes de estabilidade menores.[18] Hai poucas semellanzas entre o cadmio e a prata, pois os compostos de prata(II) son escasos e os que existen son axentes oxidantes moi fortes. Do mesmo xeito, o estado de oxidación máis común para o ouro é +3, así que tampouco hai unha gran similitude entre a química do mercurio e a do ouro; emporiso, si existen parecidos entre o mercurio(I) e o ouro(I), tales como a formación de complexos lineais diciano, [M(CN)2]−.
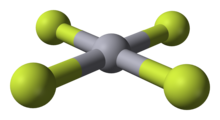
De acordo coa definición da IUPAC de metal de transición como «elemento cuxo átomo ten unha subcapa d incompleta ou pode dar lugar a catións cunha subcapa d incompleta»,[19] o cinc e o cadmio non son metais de transición, pero o mercurio si: só o mercurio forma un composto coñecido cun estado de oxidación maior ca +2, o fluoruro de mercurio(IV).[20] De todos os xeitos, esta clasificación basearíase nun composto extraordinariamente raro que non se observou en condicións de equilibrio e que contradí a química máis típica do mercurio, polo que se suxeriu que sería mellor clasificalo fóra dos metais de transición.[21]
Relación cos metais alcalinotérreos[editar | editar a fonte]
Aínda que o grupo 12 está incluído no bloque d da moderna táboa periódica de 18 columnas, os electróns d do cinc, o cadmio e, case sempre, o mercurio, compórtanse como electróns internos e non teñen parte no enlace. Este comportamento é semellante ao dos elementos representativos, pero contrasta sensiblemente co dos veciños elementos do grupo 11 (cobre, prata e ouro), que tamén posúen as súas subcapas d completas no estado fundamental pero que se comportan quimicamente coma metais de transición. Por exemplo, os enlaces no sulfuro de cromo(II) (CrS) envolven principalmente os electróns 3d, os do sulfuro de ferro(II) (FeS) envolven tanto os electróns 3d coma os 4s, pero os do sulfuro de cinc (ZnS) envolven só os electróns 4s e os electróns 3d compórtanse coma electróns internos.
Pódese, entón, facer unha comparación útil entre as propiedades dos elementos do grupo 12 e as dos dous primeiros elementos do grupo 2, o berilio e o magnesio. Por exemplo, o cinc e o cadmio son semellantes a eles nos seus raios atómicos, raios iónicos, electronegatividades e tamén na estrutura dos seus compostos binarios e na súa capacidade para formar ións complexos con diversos ligandos nitroxenados e osixenados, tales como hidratos e aminas. Con todo, o berilio e o magnesio son átomos pequenos, contrariamente aos alcalinotérreos máis pesados e igual ca os elementos do grupo 12 (que teñen unha maior carga nuclear pero o mesmo número de electróns de valencia), e as tendencias periódicas ao descender polo grupo 2 desde o berilio ata o radio non están tan definidas ao baixar desde o berilio ata o mercurio, por mor das contraccións dos lantánidos e do bloque d. Débense tamén ás devanditas contraccións moitas das propiedades características do mercurio.[21]
| Nome | Berilio | Magnesio | Calcio | Estroncio | Bario | Radio |
|---|---|---|---|---|---|---|
| Config. electróns de valencia | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 |
| Config. electróns internos | [He] | [Ne] | [Ar] | [Kr] | [Xe] | [Rn] |
| Estados de oxidación[nota 1] | +2, +1 | +2, +1 | +2, +1 | +2, +1 | +2 | +2 |
| Punto de fusión | 1560 K (1287 °C) | 923 K (650 °C) | 1115 K (842 °C) | 1050 K (777 °C) | 1000 K (727 °C) | 973 K (700 °C) |
| Punto de ebulición | 2742 K (2469 °C) | 1363 K (1090 °C) | 1757 K (1484 °C) | 1655 K (1382 °C) | 2170 K (1897 °C) | 2010 K (1737 °C) |
| Aparencia | metálico agrisado | gris metálico | prateado mate | branco prateado | gris prateado | branco prateado |
| Densidade | 1,85 g cm−3 | 1,738 g cm−3 | 1,55 g cm−3 | 2,64 g cm−3 | 3,51 g cm−3 | 5,5 g cm−3 |
| Electronegatividade de Pauling | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
| Raio atómico | 105 pm | 150 pm | 180 pm | 200 pm | 215 pm | 215 pm |
| Raio iónico | 59 pm | 86 pm | 114 pm | 132 pm | 149 pm | 162 pm |
| Cor da chama | branca[21] | branca brillante[22] | vermello ladrillo[22] | carmesí[22] | verde mazá[22] | carmesí[nota 2] |
| Química organometálica | ampla | ampla | pobre | moi pobre | moi pobre | extremadamente pobre |
| Hidróxido | anfótero | básico | básico | fortemente básico | fortemente básico | fortemente básico |
| Óxido | anfótero | fortemente básico | fortemente básico | fortemente básico | fortemente básico | fortemente básico |
| Nome | Berilio | Magnesio | Cinc | Cadmio | Mercurio | Copernicio |
| Config. electróns de valencia | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 (?) |
| Config. electróns internos | [He] | [Ne] | [Ar]3d10 | [Kr]4d10 | [Xe]4f145d10 | [Rn]5f146d10 (?) |
| Estados de oxidación[nota 1] | +2, +1 | +2, +1 | +2, +1 | +2, +1 | +4, +2, +1 | +4, +2, +1, 0 (?)[24][25][26] |
| Punto de fusión | 1560 K (1287 °C) | 923 K (650 °C) | 693 K (420 °C) | 594 K (321 °C) | 234 K (−39 °C) | ? |
| Punto de ebulición | 2742 K (2469 °C) | 1363 K (1090 °C) | 1180 K (907 °C) | 1040 K (767 °C) | 630 K (357 °C) | 357+112 −108 K (84+112 −108 °C) |
| Aparencia | metálico agrisado | gris metálico | gris azulado metálico | gris prateado | prateado | ? |
| Densidade | 1,85 g cm−3 | 1,738 g cm−3 | 7,14 g cm−3 | 8,65 g cm−3 | 13,534 g cm−3 | 23,7 g cm−3 (?)[25] |
| Electronegatividade de Pauling | 1,57 | 1,31 | 1,65 | 1,69 | 2,00 | ? |
| Raio atómico | 105 pm | 150 pm | 135 pm | 155 pm | 150 pm | 147 pm (?)[25] |
| Raio iónico | 59 pm | 86 pm | 88 pm | 109 pm | 116 pm | 75 pm (?)[25] |
| Cor da chama | branca | branca brillante | verde azulada[nota 3] | ? | ? | ? |
| Química organometálica | ampla | ampla | ampla | ampla | ampla | ? |
| Hidróxido | anfótero | básico | anfótero | debilmente básico | ? | ? |
| Óxido | anfótero | fortemente básico | anfótero | moderadamente básico | moderadamente básico | ? |
Compostos[editar | editar a fonte]
Os tres ións metálicos forman especies tetraédricas, coma o MCl2−
4. O cinc e o cadmio tamén poden formar complexos octaédricos coma os ións acuo [M(H2O)6]2+, presentes nas disolucións acuosas das sales dos devanditos metais.[27] O carácter covalente acádase ao usar os orbitais s e, posiblemente, os p. O mercurio, porén, raramente supera un número de coordinación de catro. Tamén se coñecen números de coordinación de 2, 3, 5, 7 e 8.
Extensións[editar | editar a fonte]
Aínda que o copernicio é o elemento do grupo 12 máis pesado coñecido, existen investigacións teóricas sobre elementos máis pesados ca el. Unha simple extrapolación da táboa periódica poñería o elemento 162, o unhexbio (Uhb), debaixo do copernicio, pero os cálculos relativistas de Dirac–Fock predín que tal elemento debería ser o 164, o unhexcuadio (Uhq), cuxa configuración electrónica predita é [Uuo] 5g18 6f14 7d10 8s2 8p½2.[25][28] Predise que os orbitais 8s e 8p½ serían tan estables por mor de efectos relativistas que devirían en electróns internos e non participarían nas reaccións químicas, contrariamente aos restantes elementos do grupo 12, cuxos orbitais s se comportan coma electróns de valencia. Porén, si se espera que os niveis 9s e 9p½ teñan parte nos enlaces e nas hibridacións, así que o unhexcuadio aínda debería comportarse quimicamente coma un metal de transición normal. Os cálculos predín que os seus electróns 7d terían parte facilmente en reaccións químicas, así que o unhexcuadio debería amosar, ademais do usual +2, estados de oxidación estables +4 e +6 en disolución acuosa con ligandos fortes. Polo tanto, este elemento debería poder formar compostos coma o Uhq(CO)4, o Uhq(PF3)4 (os dous tetraédricos) e o Uhq(CN)2−
2 (lineal), un comportamento moi distinto ao do chumbo, do cal sería homólogo se se desprezasen os efectos relativistas. Emporiso, a especie principal en disolución acuosa sería o unhexcuadio(II), cunha química máis semellante á do chumbo ca o unhexcuadio(IV) e o unhexcuadio(VI).[25][26]
O unhexcuadio debería ser un metal brando, coma o mercurio, e predise que, ao formar enlaces covalentes metal-metal, tería un alto punto de fusión. Tamén se espera que sexa un ácido de Lewis brando, cun parámetro de Ahrlands preto dos 4 eV, e debería ter semellanzas cos outros elementos do grupo 12 e co ununoctio.[25] O unhexcuadio tería unha reactividade, como moito, moderada, ao ter unha primeira enerxía de ionización de arredor de 685 kJ mol−1, da orde do molibdeno.[26][29] Por mor das contraccións dos lantánidos, actínidos e superactínidos, o unhexcuadio tería un raio metálico de tan só 158 pm, moi preto do magnesio, pero cunha masa atómica unhas 19,5 veces maior: arredor de 474 Da.[29] Cun raio tan pequeno e unha masa tan elevada, espérase que teña unha altísima densidade duns 46 g cm−3, máis ca duplicando a do osmio, o elemento máis denso coñecido actualmente, con 22,61 g cm−3; isto converteríao no segundo elemento máis denso nos 9 primeiros períodos da táboa, só por detrás do unhextrio (Uht, o elemento 163) con 47 g cm−3.[29] Canto ao unhexcuadio metálico, debería ser relativamente estable, pois os electróns 8s e 8p½ se atopan en capas moi interiores e só os electróns 7d están dispoñibles para formar enlaces. Esta substancia tería unha grande enerxía de cohesión a causa dos enlaces covalentes, o que resultaría nun alto punto de fusión.[26]
O interese teórico na química do unhexcuadio está motivado principalmente polas predicións de que este elemento, máis en concreto o seu isótopo 482Uhq (con 164 protóns e 318 neutróns), sería o centro dunha hipotética segunda illa de estabilidade. A primeira estaría centrada no 306Ubb, con 122 protóns e 184 neutróns.[30][31][32]
Historia[editar | editar a fonte]
Os elementos do grupo 12 descubríronse ao longo de toda a Historia, ben usados desde tempos antigos, ben descubertos en laboratorios. O grupo non ten un nome trivial, pero foi denominado grupo IIB no pasado.
Cinc[editar | editar a fonte]
Detectáronse usos do cinc en formas impuras desde a Antigüidade, e tamén se atoparon aliaxes coma o latón de ata 2000 anos de idade.[33][34] O cinc foi identificado como un metal de seu, baixo o nome jasada (जसद), xa nun manual médico atribuído ao rei hindú Madanapāla e escrito arredor do ano 1374.[35] Tamén era empregado polos alquimistas.[36] O nome do metal documéntase por primeira vez no século xvi[37] e, probablemente, deriva da palabra alemá Zinke, «puga», debido ao aspecto acicular dos cristais metálicos.[38]

O illamento, no mundo occidental, do cinc metálico pode ser atribuído de xeito independente a varias persoas no século xvii.[39] Normalmente recoñéceselle ao alquimista alemán Andreas Marggraf o descubrimento do cinc metálico puro, grazas a un experimento de 1746 no que quentaba unha mestura de calamina e carbón nun recipiente pechado sen cobre para obter un metal.[40] O italiano Luigi Galvani, grazas aos seus experimentos en 1780 con latón en ras, abriu o camiño para o descubrimento da batería eléctrica, a galvanización e a protección catódica.[41][42] Nese mesmo ano, o seu colega Alessandro Volta inventa a pila voltaica.[41] Porén, a importancia biolóxica do cinc non foi descuberta ata o ano 1940, cando se demostrou que a anhidrase carbónica, un encima que elimina o dióxido de carbono do sangue, posuía un átomo de cinc no seu sitio activo.[43]
Cadmio[editar | editar a fonte]

O cadmio foi descuberto en Alemaña en 1817 por Friedrich Stromeyer e Karl Samuel Hermann, en forma de impurezas en minerais de carbonato de cinc (calamina).[44] O seu nome provén do nome latino da calamina, cadmia, que procede á súa vez de Κάδμος, o nome grego de Cadmo, fundador mitolóxico de Tebas.[45]
No ano 1927, a Oficina Internacional de Pesos e Medidas redefiniu o metro en función da liña espectral vermella do cadmio, asignándoo a 1 553 164,13 lonxitudes de onda.[46] Esta definición cambiou co tempo; a actual fai referencia á velocidade da luz no baleiro.[47]
Mercurio[editar | editar a fonte]
Atopouse mercurio en tumbas exipcias de máis de 3500 anos de antigüidade, onde fora empregado coma cosmético.[48] Tamén o utilizaron os antigos chineses, que crían que melloraba a saúde e alongaba a vida.[49] Arredor do 500 a. C. o mercurio xa se empregaba para fabricar amálgamas con outros metais.[50] Os alquimistas considerábano a prima materia, a substancia primordial a partir da cal formábanse todos os demais metais variando a proporción de xofre contido no mercurio. O metal máis puro era o ouro, así que se recorría ao mercurio para intentar producir a transmutación doutros metais «impuros» en ouro, obxectivo último da alquimia.[51]
O símbolo químico moderno do mercurio é Hg. Este símbolo provén do nome latino do metal, hydrargyrum, latinización do grego ὑδράργυρος, «hydrárgyros». A palabra grega quere dicir «prata de auga», debido á aparencia do metal, e dela procede o termo literario galego para designar este elemento, hidrarxirio. O nome mercurio provén do deus romano Mercurio, a quen se lle atribuían as virtudes da velocidade e a mobilidade. Tamén está asociado ao planeta Mercurio: o símbolo astrolóxico deste corpo celeste, «☿», é tamén un dos símbolos alquímicos do metal.[52] O mercurio é, de feito, o único metal cuxo nome planetario superou o ámbito da alquimia para se converter no nome común do elemento.[51]
Copernicio[editar | editar a fonte]
O elemento máis pesado do grupo 12, o copernicio, foi creado por primeira vez o 9 de febreiro de 1996 na Gesellschaft für Schwerionenforschung (GSI) de Darmstadt (Alemaña) por Sigurd Hofmann, Victor Ninov et al.[53] O 19 de febreiro de 2010, aniversario do nacemento de Nicolao Copérnico, a IUPAC outorgoulle o nome oficial «copernicio», substituíndo o nome provisional que posuía ata entón, «unumbio».[54]
Abundancia[editar | editar a fonte]
Como sucede na meirande parte dos grupos do bloque d, a abundancia dos elementos do grupo 12 na codia terrestre diminúe ao aumentar o número atómico. O cinc é, cunha concentración de 65 ppm, o elemento máis abundante do grupo, mentres que o cadmio, con 0,1 ppm, e o mercurio, con 0,04 ppm, son varias ordes de magnitude máis escasos.[55] Canto ao copernicio, como se trata dun elemento sintético cun período de semidesintegración duns poucos minutos, só se atopa nos laboratorios onde é producido.

Os metais do grupo 12 son calcófilos: teñen unha baixa afinidade polo osíxeno e prefiren formar sulfuros. Os minerais destes metais formáronse tras a solidificación da codia da Terra primixenia baixo as condicións redutoras da atmosfera existente daquela.[56] Os ditos minerais son, polo tanto, eminentemente sulfuros.[16] O mineral de cinc máis amplamente aproveitado é a blenda, unha forma de sulfuro de cinc (ZnS) cun contido neste metal de entre o 60 % e o 62 %.[8] Contrariamente, non se coñecen depósitos significativos de minerais de cadmio. O único que posúe unha certa importancia é a greenockita (CdS), pero está asociada case sempre á blenda debido á semellanza química entre o cinc e o cadmio, semellanza que, ademais, fai difícil a súa separación xeolóxica. Consecuentemente, o cadmio adóitase obter como produto secundario do procesamento dos minerais de cinc e, en menor medida, chumbo e cobre.[57][58] O mercurio, pola súa banda, é un elemento especialmente raro na codia terrestre, ao non se combinar xeoquimicamente cos elementos máis comúns. Aínda que pode atoparse nativo, adoita estar presente en minerais coma o cinabrio, a corderoíta ou a livingstonita.[59]
As reservas mundiais de cinc estímanse en 1900 millóns de toneladas,[60] localizándose os principais depósitos en Australia, Canadá e os Estados Unidos.[56] Ata 2002, extraéranse arredor de 346 millóns de toneladas de cinc ao longo da historia, e estímase que seguen actualmente en uso máis de 100 millóns de toneladas deste material.[61] Varios estudos suxiren que, ao actual ritmo de consumo, o esgotamento das reservas se produciría entre os anos 2027 e 2055.[62][63] Canto ao mercurio, a súa primeira produtora mundial é a China, que controla case dúas terzas partes do comercio mundial, seguida de México.[64]
Produción[editar | editar a fonte]
Cunha produción anual duns 13 millóns de toneladas, o cinc é o cuarto metal máis empregado, só por detrás do ferro, o aluminio e o cobre.[65] O 95 % deste metal extráese de depósitos de sulfuros, nos cales a blenda está case sempre mesturada cos sulfuros de cobre, chumbo e ferro. O cinc metálico prodúcese mediante técnicas de metalurxia extractiva.[66] Un proceso de torrado converte o sulfuro de cinc concentrado en óxido de cinc, a partir do cal o metal pode obterse ou ben mediante procesos pirometalúrxicos, ou ben a través de extracción electrolítica.[67] O procesado pirometalúrxico opera reducindo o óxido de cinc con monóxido de carbono a 950 °C, obténdose o metal como vapor que é posteriormente condensado.[68] A extracción electrolítica leva a cabo unha lixiviación do mineral con ácido sulfúrico para, a continuación, obter o cinc metálico mediante electrólise.[69]
O cadmio é unha impureza común nos minerais de cinc, e adoita obterse durante o procesado deste metal. Certos concentrados de minerais de cinc conteñen ata un 1,4 % de cadmio. O metal pode illarse dos fumes de proceso mediante estila ao baleiro, ou ben precipitando o sulfato da solución electrolítica.[70]
Os minerais máis ricos en mercurio conteñen ata un 2,5 % en masa deste metal, pero mesmo os depósitos menos concentrados conteñen, como mínimo, un 0,1 %, sendo o cinabrio (sulfuro de mercurio, HgS) o mineral máis común.[59] O mercurio extráese del quentando o mineral nunha corrente de aire e condensando o vapor.[71]
Por último, os elementos superpesados coma o copernicio prodúcense bombardeando átomos de elementos máis lixeiros en aceleradores de partículas, o que dá como resultado reaccións de fusión nuclear. Porén, aínda que a meirande parte dos isótopos de copernicio pódense obter directamente deste xeito, os máis pesados só se observaron como produtos do decaemento radioactivo doutros elementos de maior número atómico.[72] A primeira reacción de fusión que produciu copernicio levouse a cabo na GSI en 1996, segundo o seguinte esquema:[53]
En total, lévanse producidos uns 75 átomos de copernicio a través de diversas reaccións nucleares.
Aplicacións[editar | editar a fonte]
Por mor das súas semellanzas físicas, os elementos do grupo 12 poden atoparse nunha multitude de situacións comúns. O cinc e o cadmio empréganse de xeito habitual como axentes de galvanización contra a corrosión,[2] pois tenden a atraer toda a oxidación no seu ambiente ata se corroer por completo.[73] Esta cobertura protectora pode aplicarse sobre outros metais mediante galvanización térmica, bañando o obxecto no metal fundido,[74] ou mediante galvanoplastia por medios electrolíticos, á cal pódeselle engadir unha pasivación con cromatos.[75] Os elementos deste grupo tamén se empregan na electroquímica como alternativa ao eléctrodo estándar de hidróxeno, ademais de servir de eléctrodo de referencia secundario.[76]
Nos Estados Unidos o cinc emprégase na súa maioría para o galvanizado (55%) e para aliaxes de latón, bronce e outras (37%).[77] A reactividade relativa do cinc e a súa capacidade para oxidarse fai que sexa un ánodo de sacrificio eficiente nas proteccións catódicas. Por exemplo, a protección catódica dunha tubaxe soterrada pode conseguirse conectando ánodos feitos de cinc á propia tubaxe.[78] O cinc fai de ánodo corroéndose lentamente mentres transfire a corrente eléctrica á tubaxe de aceiro.[78][nota 4] O cinc emprégase tamén para protexer catodicamente outros metais expostos á auga do mar.[79][80] O cinc tamén se usa coma un material para ánodos de baterías coma nas baterías de cinc-carbono[81][82] ou nas de cinc-aire.[83][84][85] O latón é unha aliaxe de uso estendido que contén cinc e cobre, cunha proporción de cinc que pode variar entre o 3% e o 45% dependendo do tipo de latón.[78] O latón adoita ser máis dúctil e forte que o cobre e ten unha resistencia á corrosión superior.[78] Estas propiedades fan que sexa útil en equipos de comunicación, ferramentas, instrumentos musicais e válvulas.[78]
O cadmio ten moitos usos industriais, sendo un compoñente chave na produción de baterías, pigmentos de cadmio,[86] recubrimentos protectores,[87] e placas eléctricas.[88] No 2009 o 86% do cadmio foi usado en baterías, predominantemente recargables. A Unión Europea prohibiu o uso de cadmio na electrónica no ano 2004, con algunhas excepcións que só permiten un 0,002% deste elemento.[89] As placas eléctricas constitúen un 6% da produción mundial e atópanse na industria aeronáutica grazas a resistencia a corrosión facilitada por este elemento cando se aplica a compoñentes de aceiro.[88]
O mercurio emprégase principalmente na fabricación de químicos industriais ou en aplicacións eléctricas e electrónicas. Úsase tamén nalgúns termómetros, especialmente aqueles empregados para medir temperaturas altas. O mercurio e os seus compostos téñense empregado na medicina, uso apenas conservado debido ao maior coñecemento dos efectos tóxicos deste elemento e dos seus compostos.[90] A finais do século XX o uso principal do mercurio foi no proceso de células de mercurio, chamado tamén proceso Castner-Kellner, aplicado na produción de cloros e sosa cáustica.[91][92][93]
Función biolóxica e toxicidade[editar | editar a fonte]
Os elementos do grupo 12 teñen múltiples efectos nos organismos biolóxicos. O cadmio e o mercurio son tóxicos, mentres que o cinc é necesario para moitas plantas e animais en cantidades pequenas.
O cinc é un elemento esencial a baixas concentracións, necesario para as plantas,[94] animais,[95] e microorganismos.[96] Adoita ser o segundo metal de transición máis abundante nos organismos biolóxicos despois do ferro, sendo o único metal que aparece en tódalas clases de encimas.[94] Hai entre 2 e 4 gramos de cinc distribuídos polo corpo humano,[97][98] tendo un papel biolóxico importante.[99] Un estudo de 2006 estimou que ao redor do 10% das proteínas humanas ligan potencialmente o cinc, a maiores dos centos destas que transportan o elemento.[94]
O mercurio e o cadmio son tóxicos e poden causar danos no medio ambiente ao entrar en contacto con ríos ou coa auga da chuvia. Isto pode causar a contaminación de cultivos[100] así coma unha acumulación biolóxica nas cadeas alimenticias que pode dar lugar a aumentos de enfermidades por envelenamento de mercurio e cadmio.[101]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Os estados de oxidación máis comúns aparecen en grosa.
- ↑ A cor da chama do radio puro nunca se observou. A cor carmesí é unha extrapolación da cor das chamas dos seus compostos.[23]
- ↑ Ás veces descrita como branca.[21]
- ↑ A corrente eléctrica flúe de forma natural entre o cinc e o aceiro, pero nalgunhas circunstancias poden usarse os ánodos cunha fonte externa de corrente continua.
- ↑ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. (en inglés) 60 (3): 431–436. doi:10.1351/pac198860030431. Consultado o 28 de agosto de 2015.
- ↑ 2,0 2,1 Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (en inglés) (2.ª ed.). Oxford: Elsevier Butterworth–Heinemann. ISBN 0-7506-3365-4. Consultado o 28 de agosto de 2015.
- ↑ Eichler, R.; Aksenov, N. V.; Belozerov, A. V.; et al. (3 de maio de 2007). "Chemical Characterization of Element 112". Nature (en inglés) 447 (7140): 72–75. Bibcode:2007Natur.447...72E. PMID 17476264. doi:10.1038/nature05761.
- ↑ 4,0 4,1 4,2 Colaboradores de CRC (2004). David R. Lide, ed. Handbook of Chemistry and Physics (en inglés) (85.ª ed.). Boca Raton (Florida): CRC Press. p. 4-35. ISBN 0-8493-0487-3. Consultado o 28 de agosto de 2015.
- ↑ 5,0 5,1 Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds (en inglés). Nova York: TAB Books. p. 123. ISBN 0-8306-3018-X. Consultado o 28 de agosto de 2015.
- ↑ Colaboradores de CRC (2004). Op. cit. p. 4-19.
- ↑ Eichler, R.; Aksenov, N. V.; Belozerov, A. V.; et al. (14 de abril de 2008). "Thermochemical and Physical Properties of Element 112". Angew. Chem. Int. Edit. (en inglés) 47 (17): 3262–3266. doi:10.1002/anie.200705019.
- ↑ 8,0 8,1 Lehto, R. S. (1968). "Zinc". En Clifford A. Hampel. The Encyclopedia of the Chemical Elements (en inglés). Nova York: Reinhold Book Corporation. pp. 822–830. ISBN 0-442-15598-0.
- ↑ Scoffern, J.; Truran, W.; Clay, W.; et al. (1861). The Useful Metals and their Alloys (en inglés). Londres: Houlston and Wright. pp. 591–603. Consultado o 27 de agosto de 2015.
- ↑ Holleman, A. F.; Wiberg, E.; Wiberg, N. (1985). "Cadmium". Lehrbuch der anorganischen Chemie (en alemán) (91.ª ed.). Berlín: Walter de Gruyter. pp. 1056–1057. ISBN 3-11-007511-3.
- ↑ "Cadmium Toxicity Cover Page". Agency for Toxic Substances & Disease Registry. Consultado o 27 de agosto de 2015.
- ↑ Ingalls, W. R. (1902). "Production and Properties of Zinc". Eng. Min. J. (en inglés): 142–146. Consultado o 27 de agosto de 2015.
- ↑ Scoullos, M. J.; Vonkeman, G. H.; Thornton, I.; Makuch, Z. (2001). Mercury - Cadmium - Lead: Handbook for Sustainable Heavy Metals Policy and Regulation (en inglés). Dordrecht, Países Baixos: Kluwer Academic Publishers. ISBN 1-4020-0224-6. Consultado o 27 de agosto de 2015.
- ↑ Brady, G. S.; Clauser, H. R.; Vaccari, J. A. (2002). Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors (en inglés). Nova York: McGraw–Hill. p. 425. ISBN 0-07-136076-X. Consultado o 27 de agosto de 2015.
- ↑ Vargel, C. (2004). Corrosion of Aluminium (en inglés). Oxford: Elsevier. p. 158. ISBN 0-08-044495-4. Consultado o 27 de agosto de 2015.
- ↑ 16,0 16,1 16,2 Moss, A. (2003). "Descriptive P-Block Notes" (PDF) (en inglés). Alchemist Online. Consultado o 28 de agosto de 2015.
- ↑ Lindberg, S. E.; Stratton, W. J. (1998). "Atmospheric Mercury Speciation: Concentrations and Behavior of Reactive Gaseous Mercury in Ambient Air". Environ. Sci. Technol. (en inglés) 32 (1): 49–57. Bibcode:1998EnST...32...49L. doi:10.1021/es970546u.
- ↑ Al-Niaimi, N. S.; Hamid, H. A. (1977). "Stabilities of nickel(II), copper(II), zinc(II) and dioxouranium(II) complexes of some β-diketones". J. Inorg. Nucl. Chem. (en inglés) 39 (5): 849–852. doi:10.1016/0022-1902(77)80167-X.
- ↑ IUPAC (1997). Compendium of Chemical Terminology. Compilado por A. D. McNaught e A. Wilkinson (2.ª ed.). Oxford: Blackwell Scientific Publications. ISBN 0-9678550-9-8. doi:10.1351/goldbook. Versión XML corrixida en liña (2006-) creada por M. Nic, J. Jirat e B. Kosata; actualizacións compiladas por A. Jenkins.
- ↑ Wang, X.; Andrews, L.; Riedel, S.; Kaupp, M. (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4". Angew. Chem. Int. Edit. (en inglés) 46 (44): 8371–8375. doi:10.1002/anie.200703710.
- ↑ 21,0 21,1 21,2 21,3 21,4 Jensen, W. B. (2003). "The Place of Zinc, Cadmium, and Mercury in the Periodic Table" (PDF). J. Chem. Educ. (en inglés) 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Arquivado dende o orixinal (PDF) o 11 de xuño de 2010. Consultado o 28 de agosto de 2015.
- ↑ 22,0 22,1 22,2 22,3 Royal Society of Chemistry. "Visual Elements: Group 2–The Alkaline Earth Metals". Visual Elements (en inglés). Royal Society of Chemistry. Consultado o 13 de xaneiro de 2012.
- ↑ Kirby, H. W.; Salutsky, M. L. (1964). The Radiochemistry of Radium (en inglés). Washington D. C.: National Academies Press. Consultado o 28 de agosto de 2015.
- ↑ Gäggeler, H. W.; Türler, A. (2014). "Gas-Phase Chemistry of Superheavy Elements". En M. Schädel; D. Shaughnessy. The Chemistry of Superheavy Elements (en inglés) (2.ª ed.). Heidelberg: Springer. pp. 415–483. ISBN 978-3-642-37465-4. Consultado o 28 de agosto de 2015.
- ↑ 25,0 25,1 25,2 25,3 25,4 25,5 25,6 Hoffmann, D. C.; Lee, D. M.; Pershina, V. (2006). "Transactinide Elements and Future Elements". En L. R. Morss; N. M. Edelstein; J. Fuger. The Chemistry of the Actinide and Transactinide Elements (en inglés) 3 (3.ª ed.). Dordrecht (Países Baixos): Springer. ISBN 1-4020-3555-1. Consultado o 28 de agosto de 2015.
- ↑ 26,0 26,1 26,2 26,3 Fricke, B. (1975). "Superheavy Elements: A Prediction of Their Chemical and Physical Properties". Struct. Bond. (en inglés) 21: 89–144. doi:10.1007/BFb0116498.
- ↑ Richens, D. T. (1997). The Chemistry of Aqua Ions (en inglés). Chichester (Reino Unido): John Wiley & Sons. ISBN 0-471-97058-1. Consultado o 28 de agosto de 2015.
- ↑ Pyykkö, P. (2011). "A suggested Periodic Table up to Z ≤ 172, based on Dirac-Fock calculations on atoms and ions". Phys. Chem. Chem. Phys. (en inglés) 13: 161–168. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/C0CP01575J.
- ↑ 29,0 29,1 29,2 Fricke, B.; Greiner, W.; Waber, J. T. (1971). "The Continuation of the Periodic Table up to Z = 172. The Chemistry of Superheavy Elements". Theoret. Chim. Acta (en inglés) 21 (3): 235–260. doi:10.1007/BF01172015.
- ↑ Kratz, J. V. (5 de setembro de 2011). The Impact of Superheavy Elements on the Chemical and Physical Sciences (PDF). IV Conferencia Internacional sobre Química e Física dos Elementos Transactínidos (en inglés). Consultado o 30 de agosto de 2015.
- ↑ American Chemical Society (6 de abril de 2008). "Nuclear scientists eye future landfall on a second 'island of stability'". EurekAlert (en inglés) (American Association for the Advancement of Science). Consultado o 30 de agosto de 2015.
- ↑ Grumann, J.; Mosel, U.; Fink, B.; Greiner, W. (1969). "Investigation of the Stability of Superheavy Nuclei around Z = 114 and Z = 164". Z. Phys. (en inglés) 228 (5): 371–386. doi:10.1007/BF01406719.
- ↑ Weeks, M. E. (1932). "The Discovery of the Elements. III. Some Eighteenth-Century Metals". J. Chem. Educ. (en inglés) 9 (1): 22–30. doi:10.1021/ed009p22.
- ↑ Greenwood, N. N.; Earnshaw, A. (1997). Op. cit. p. 1201.
- ↑ Rāy, P. C. (1903). History of Hindu Chemistry (en inglés) 1 (2.ª ed.). Calcuta: The Bengal Chemical & Pharmaceutical Works. pp. 157–158. Consultado o 30 de agosto de 2015.
- ↑ Arny, H. V. (1917). Principles of Pharmacy (en inglés) (2.ª ed.). Filadelfia: W. B. Saunders Company. p. 483. Consultado o 30 de agosto de 2015.
- ↑ Agricola, G. (1912) [1556]. De Re Metallica (en inglés). H. C. Hoover e L. H. Hoover (tr.). Londres: Salisbury House. p. 409. Consultado o 30 de agosto de 2015.
- ↑ Gerhartz, W., ed. (1985). Ullmann’s Encyclopedia of Industrial Chemistry (en inglés) (5.ª ed.). Weinheim (Alemaña): VCH Verlagsgesellschaft. ISBN 3-527-20101-7.
- ↑ Emsley, J. (2001). Nature’s Building Blocks: An A–Z Guide to the Elements (en inglés). Oxford: Oxford University Press. p. 502. ISBN 0-19-850340-7. Consultado o 4 de setembro de 2015.
- ↑ Weeks, M. E. (1932). Op. cit. p. 21.
- ↑ 41,0 41,1 Warren, N. (2000). Excel Preliminary Physics: Your Step by Step Guide to Exam Success (en inglés). Sidney: Pascal Press. p. 47. ISBN 1-74020-085-3. Consultado o 4 de setembro de 2015.
- ↑ "Galvanic battery". The New International Encyclopædia (en inglés) IX (2.ª ed.). Nova York: Dodd, Mead and Company. 1928. p. 432. Consultado o 5 de setembro de 2015.
- ↑ Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochmann, M. (1999). Advanced Inorganic Chemistry (en inglés) (6.ª ed.). Nova York: John Wiley & Sons. p. 626. ISBN 0-471-19957-5.
- ↑ Kroschwitz, J. I., ed. (1994). "Cadmium". Kirk–Othmer Encyclopedia of Chemical Technology 5 (4.ª ed.). Nueva York: John Wiley & Sons.
- ↑ Hermann, K. S. L. (1818). "Noch ein Schreiben über das neue Metall". Annalen der Physik (en alemán) 59 (5): 113–116. Bibcode:1818AnP....59..113H. doi:10.1002/andp.18180590511.
- ↑ Burdun, G. D. (1958). "On the New Determination of the Meter". Measurement Techniques (en inglés) 1 (3): 259–264. doi:10.1007/BF00974680.
- ↑ Bureau International des Poids et Mesures (2006). El Sistema Internacional de Unidades (SI) (PDF) (en castelán) (8.ª ed.). Madrid: Centro Español de Metrología. p. 22. NIPO:706-08-006-3. Arquivado dende o orixinal (PDF) o 13 de abril de 2015. Consultado o 6 de setembro de 2015.
- ↑ Environnement Canada (2010). "À propos du mercure : Historique" (en francés). Gatineau (Quebec): Gouvernement du Canada. Consultado o 6 de setembro de 2015.
- ↑ Wright, D. C. (2011). The History of China (2.ª ed.). Santa Barbara (California): Greenwood. p. 49. ISBN 0-313-37748-0. Consultado o 6 de setembro de 2015.
- ↑ Hesse, R. W. (2007). Jewelrymaking through History. Westport (Connecticut): Greenwood. p. 120. ISBN 0-313-33507-9. Consultado o 6 de setembro de 2015.
- ↑ 51,0 51,1 Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Whitefish (Montana): Kessinger Publishing. pp. 7–9. ISBN 0-7661-3230-7. Consultado o 7 de setembro de 2015.
- ↑ Cox, R. (1997). The Pillar of Celestial Fire. Fairfield (Iowa): Sunstar Publishing. p. 260. ISBN 1-887472-30-4. Consultado o 7 de setembro de 2015.
- ↑ 53,0 53,1 Hofmann, S.; Ninov, V.; Heßberger, F. P.; et al. (1996). "The New Element 112". Z. Phys. A (en inglés) 354 (3): 229–230. doi:10.1007/BF02769517.
- ↑ Tatsumi, K. & Corish, J. (2010). "Name and symbol of the element with atomic number 112 (IUPAC Recommendations 2010)". Pure Appl. Chem. (en inglés) 82 (3): 753–755. doi:10.1351/PAC-REC-09-08-20. Consultado o 5 de outubro de 2021.
- ↑ Wedepohl, K. H. (1995). "The composition of the continental crust". Geochim. Cosmochim. Ac. (en inglés) 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- ↑ 56,0 56,1 Greenwood, N. N.; Earnshaw, A. (1997). Op. cit. p. 1202.
- ↑ Tolcin, A. C. (2013). "Cadmium (Cd)". En USGS National Minerals Information Center. Metal Prices in the United States Through 2010 (PDF) (en inglés). USGS. p. 22. Consultado o 11 de setembro de 2015.
- ↑ Fthenakis, V. M. (2004). "Life cycle impact analysis of cadmium in CdTe PV production". Renew. Sust. Energ. Rev. (en inglés) 8 (4): 303–334. doi:10.1016/j.rser.2003.12.001.
- ↑ 59,0 59,1 Rytuba, J. J. (2003). "Mercury from mineral deposits and potential environmental impact". Environ. Geol. (en inglés) 43 (3): 326–338. doi:10.1007/s00254-002-0629-5.
- ↑ Tolcin, A. C. (2015). "Mineral Commodity Summaries 2015: Zinc" (PDF) (en inglés). USGS. Consultado o 13 de setembro de 2015.
- ↑ Gordon, R. B.; Bertram, M.; Graedel, T. E. (31 de xaneiro de 2006). "Metal stocks and sustainability". P. Natl. Acad. Sci. USA (en inglés) 103 (5): 1209–1214. Bibcode:2006PNAS..103.1209G. PMC 1360560. PMID 16432205. doi:10.1073/pnas.0509498103.
- ↑ Cohen, D. (26 de maio de 2007). "Earth audit". New Sci. (en inglés) 194 (2605): 34–41. doi:10.1016/S0262-4079(07)61315-3.
- ↑ "Augsberg University Calculate When Our Materials Run Out - Soon". Printed Electronics World (en inglés) (IDTechEx). 4 de xuño de 2007. Arquivado dende o orixinal o 19 de outubro de 2015. Consultado o 13 de setembro de 2015.
- ↑ Brown, T. J.; Wrighton, C. E.; Raycraft, E. R.; et al. (2015). World Mineral Production 2009–2013. Londres: British Geological Survey. p. 47. Consultado o 13 de setembro de 2015.
- ↑ Tolcin, A. C. (2014). 2012 Minerals Yearbook: Zinc (PDF) (en inglés). USGS. p. 11. Consultado o 14 de setembro de 2015.
- ↑ Rosenqvist, T. (2004). Principles of Extractive Metallurgy (en inglés). Trondheim (Noruega): Tapir Academic Press. p. 7. ISBN 82-519-1922-3. Consultado o 14 de setembro de 2015.
- ↑ Porter, F. (1991). Zinc Handbook: Properties, Processing, and Use in Design (en inglés). Nova York: Marcel Dekker. p. 6. ISBN 0-8247-8340-9. Consultado o 14 de setembro de 2015.
- ↑ Bodsworth, C. (1994). The Extraction and Refining of Metals (en inglés). Boca Raton (Florida): CRC Press. p. 148. ISBN 0-8493-4433-6. Consultado o 14 de setembro de 2015.
- ↑ Gupta, C. K.; Mukherjee, T. K. (1990). Hydrometallurgy in Extraction Processes (en inglés) I. Boca Raton (Florida): CRC Press. p. 62. ISBN 0-8493-6805-7. Consultado o 14 de setembro de 2015.
- ↑ National Materials Advisory Board (1969). Trends in Usage of Cadmium (en inglés). Washington D. C.: National Research Council. pp. 1–3. Consultado o 14 de setembro de 2015.
- ↑ Vallero, D. (2008). Fundamentals of Air Pollution (en inglés). Burlington (Massachussetts): Academic Press. p. 865. ISBN 978-0-12-373615-4. Consultado o 14 de setembro de 2015.
- ↑ Barber, R. C.; Gäggeler, H. W.; Karol, P. J.; et al. (2009). "Discovery of the Element with Atomic Number 112 (IUPAC Technical Report)". Pure Appl. Chem. (en inglés) 81 (7): 1331–1343. ISSN 1365-3075. doi:10.1351/PAC-REP-08-03-05.
- ↑ Stwertka, A. (2002). A Guide to the Elements (en inglés). Nova York: Oxford University Press. p. 99. ISBN 0-19-515026-0. Consultado o 26 de setembro de 2015.
- ↑ Emsley, J. (2001). Op. cit. p. 503.
- ↑ Smith, C. J. E.; Higgs, M. S.; Baldwin, K. R. (19–20 de abril de 1999). Advances in Protective Coatings and their Application to Ageing Aircraft (PDF). New Metallic Materials for the Structure of Ageing Aircraft (en inglés). Arquivado dende o orixinal (PDF) o 04 de marzo de 2016. Consultado o 26 de setembro de 2015.
- ↑ Newman, J.; Thomas-Alyea, K. E. (2004). Electrochemical Systems (en inglés) (3.ª ed.). Hoboken (Nova Jersey): John Wiley & Sons. ISBN 0-471-47756-7. Consultado o 26 de setembro de 2015.
- ↑ "Zinc: World Mine Production (zinc content of concentrate) by Country" (PDF). 2009 Minerals Yearbook: Zinc. Washington, D.C.: United States Geological Survey. 2010. Consultado o 2010-06-06.
- ↑ 78,0 78,1 78,2 78,3 78,4 Lehto 1968, p. 829
- ↑ Bounoughaz, M.; Salhi, E.; Benzine, K.; Ghali, E.; Dalard, F. (2003). "A comparative study of the electrochemical behaviour of Algerian zinc and a zinc from a commercial sacrificial anode". Journal of Materials Science 38 (6): 1139. Bibcode:2003JMatS..38.1139B. doi:10.1023/A:1022824813564.
- ↑ Stwertka 1998, p. 99
- ↑ Besenhard, Jürgen O. (1999). Handbook of Battery Materials (PDF). Wiley-VCH. ISBN 3-527-29469-4. Consultado o 2008-10-08.
- ↑ Wiaux, J.-P.; Waefler, J.-P. (1995). "Recycling zinc batteries: an economical challenge in consumer waste management". Journal of Power Sources 57 (1–2): 61. doi:10.1016/0378-7753(95)02242-2.
- ↑ Culter, T. (1996). "A design guide for rechargeable zinc-air battery technology". Southcon/96. Conference Record: 616. ISBN 0-7803-3268-7. doi:10.1109/SOUTHC.1996.535134.
- ↑ Whartman, Jonathan; Brown, Ian. "Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses" (PDF). The 15th International Electric Vehicle Symposium. Arquivado dende o orixinal (PDF) o 12 de marzo de 2006. Consultado o 2008-10-08.
- ↑ Cooper, J. F; Fleming, 2D.; Hargrove, D.; Koopman; R.; Peterman, K. "A refuelable zinc/air battery for fleet electric vehicle propulsion". Society of Automotive Engineers future transportation technology conference and exposition. Consultado o 2008-10-08.
- ↑ Industrial inorganic pigments (3rd, completely rev. ed ed.). Weinheim: Wiley-VCH. 2005. pp. 121–123. ISBN 978-3-527-30363-2. OCLC 85820467.
- ↑ Smith C.J.E., Higgs M.S., Baldwin K.R. (20 de abril de 1999). "Advances to Protective Coatings and their Application to Ageing Aircraft" (PDF). RTO MP-25. Arquivado dende o orixinal (PDF) o 04 de marzo de 2016. Consultado o 29 de maio de 2011.
- ↑ 88,0 88,1 Scoullos, Michael J.; Vonkeman, Gerrit H.; Thornton, Iain; Makuch, Zen (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. ISBN 978-1-4020-0224-3.
- ↑ "Battery collection; recycling, nature protected". European Union. Consultado o 4 de novembro de 2008.
- ↑ FDA. "Thimerosal in Vaccines". Consultado o 25 de outubro de 2006.
- ↑ "Chlorine Online Diagram of mercury cell process". Euro Chlor. Archived from the original on 26 de xullo de 2011. Consultado o 2012-04-09.
- ↑ The CRB Commodity Yearbook (annual). 2000. p. 173. ISSN 1076-2906.
- ↑ Leopold, B. R. (2002). "Chapter 3: Manufacturing Processes Involving Mercury. Use and Release of Mercury in the United States" (PDF). National Risk Management Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. Arquivado dende o orixinal (PDF) o 21 de xuño de 2007. Consultado o 1 de maio de 2007.
- ↑ 94,0 94,1 94,2 Broadley, M. R.; White, P. J.; Hammond, J. P.; Zelko, I.; Lux, A. (2007). "Zinc in plants". New Phytologist 173 (4): 677–702. PMID 17286818. doi:10.1111/j.1469-8137.2007.01996.x.
- ↑ Prasad A. S. (2008). "Zinc in Human Health: Effect of Zinc on Immune Cells". Mol. Med. 14 (5–6): 353–7. PMC 2277319. PMID 18385818. doi:10.2119/2008-00033.Prasad.
- ↑ Sugarman B (1983). "Zinc and infection". Review of Infectious Diseases 5 (1): 137–47. PMID 6338570. doi:10.1093/clinids/5.1.137.
- ↑ Rink, L.; Gabriel, P. (2000). "Zinc and the immune system". Proc Nutr Soc 59 (4): 541–52. PMID 11115789. doi:10.1017/S0029665100000781.
- ↑ Wapnir, Raul A. (1990). Protein Nutrition and Mineral Absorption. Boca Raton, Florida: CRC Press. p. 131. ISBN 0-8493-5227-4.
- ↑ Hambidge, K. M. and Krebs, N. F. (2007). "Zinc deficiency: a special challenge". J. Nutr. 137 (4): 1101–5. PMID 17374687.
- ↑ Nogawa, Koji; Kobayashi, E; Okubo, Y & Suwazono, Y (2004). "Environmental cadmium exposure, adverse effects, and preventative measures in Japan". Biometals 17 (5): 581–587. PMID 15688869. doi:10.1023/B:BIOM.0000045742.81440.9c.
- ↑ Mozaffarian D, Rimm EB (2006). "Fish intake, contaminants, and human health: evaluating the risks and the benefits". JAMA 296 (15): 1885–99. PMID 17047219. doi:10.1001/jama.296.15.1885.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- CRC contributors (2006). David R. Lide, ed. Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida: CRC Press, Taylor & Francis Group. ISBN 978-0-8493-0487-3.
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th ed.). New York: John Wiley & Sons, Inc. ISBN 978-0-471-19957-1.
- Emsley, John (2001). "Zinc". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 499–505. ISBN 978-0-19-850340-8.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Heiserman, David L. (1992). "Element 30: Zinc". Exploring Chemical Elements and their Compounds. New York: TAB Books. ISBN 978-0-8306-3018-9.
- Lehto, R. S. (1968). "Zinc". En Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 822–830. ISBN 978-0-442-15598-8. LCCN 68-29938.
- Stwertka, Albert (1998). "Zinc". Guide to the Elements (Revised ed.). Oxford University Press. ISBN 978-0-19-508083-4.
- Weeks, Mary Elvira (1933). "III. Some Eighteenth-Century Metals". The Discovery of the Elements. Easton, PA: Journal of Chemical Education. ISBN 978-0-7661-3872-8.



