Ácido carboxílico


Os ácidos carboxílicos son un tipo de compostos caracterizados por levaren o grupo funcional carboxilo ou carboxi (–COOH ou -C(=O)OH). Este grupo está formado por un grupo carbonilo (C=O) e un grupo hidroxilo (-OH) unido ao mesmo carbono. Os ácidos carboxílicos poden representarse por R-COOH [1]. Os máis pequenos son o ácido fórmico (H-COOH) e o ácido acético (CH3-COOH), pero poden ter cadeas carbonadas moi longas, como as dalgúns ácidos graxos.
Ás veces ácido carboxílico tómase como sinónimo de ácido orgánico, pero isto non é de todo exacto, xa que o termo ácido orgánico é máis amplo. A maioría dos ácidos orgánicos son carboxílicos, pero tamén o son os ácidos sulfónicos, ácido úrico ou outros compostos con grupos desprotonables.
Os ácidos carboxílicos compórtanse como ácidos de Brønsted-Lowry porque son doantes de protóns, ao poderen desprotonizar o grupo OH do seu carboxilo. Os ácidos carboxílicos poden ter un só gupo COOH e denomínanse monocarboxílicos, ou poden ter dous grupos COOH e serían ácidos dicarboxílicos, e se teñen 3 COOH son ácidos tricarboxílicos, como o ácido cítrico etc. O ácido melítico é hexacarboxílico.
Os sales e ésteres dos ácidos carboxílicos denomínanse carboxilatos. Cando un grupo carboxilo se desprotona á súa base conxugada, fórmase un anión carboxilato. En certas circunstancias os grupos carboxilo poden descarboxilarse liberando dióxido de carbono.
Características e propiedades[editar | editar a fonte]
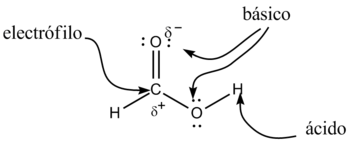
Os ácidos carboxílicos teñen propiedades ácidas. Os dous átomos de osíxeno son electronegativos e tenden a atraer aos electróns do átomo de hidróxeno do grupo hidroxilo, o que debilita o enlace, producíndose en certas condicións unha rotura heterolítica cedendo o correspondente protón, H+, e quedando o resto da molécula con carga -1 debido ao electrón que perdeu o átomo de hidróxeno, polo que a molécula queda como R-COO-.
Ademais, neste anión, a carga negativa distribúese (deslocalízase) simetricamente entre os dous átomos de osíxeno, de forma que os enlaces carbono-osíxeno adquiren un carácter de enlace parcialmente dobre.
Xeralmente os ácidos carboxílicos son ácidos febles, con só un 1% das súas moléculas disociadas para dar os correspondentes ións, a temperatura ambiente e en disolución acuosa.
Pero son máis ácidos ca outros compostos, nos que non se produce esa deslocalización electrónica, como por exemplo os alcohois. Isto débese a que a estabilización por resonancia ou deslocalización electrónica, provoca que a base conxugada do ácido sexa máis estable ca a base conxugada do alcohol e, por tanto, a concentración de protóns procedentes da disociación do ácido carboxílico sexa maior ca a concentración de protóns procedentes do alcohol; feito que se verifica experimentalmente polos seus valores relativos menores de pKa. O ión resultante, R-COOH-, noméase co sufixo "-ato".

Por exemplo, o anión procedente do ácido acético chámase ión acetato. O grupo RCOO- denomínase carboxilato.

Propiedades físicas[editar | editar a fonte]

Os ácidos de masa molar baixa (ata 10 átomos de carbono) son líquidos incoloros, de cheiro moi desagradable. O olor do vinagre débese ao ácido acético; o da manteiga rancia ao ácido butírico. O ácido caproico atópase no pelo e secrecións do gando caprino. Os ácidos C5 a C10 posúen cheiros a “cabra”. O resto son sólidos cerosos e inodoros a temperatura ambiente. Os ésteres dos ácidos carboxílicos tenden a ter bo olor e moitos utilízanse como compoñentes de perfumes.
Os seus puntos de fusión e ebulición crecen ao aumentar a masa molar.
Os ácidos inferiores son bastante solubles en auga (o acético, por exemplo, é soluble en todas as proporcións). A súa solubilidade en auga decrece a partir do ácido butírico, co aumento do carácter hidrocarbonado da molécula. Todos os ácidos carboxílicos son totalmente solubles en disolventes orgánicos. O grupo carboxilo é polar. Como para a formación de pontes de hidróxeno poden ser tanto aceptores (o C=O) como dadores (o OH), forman facilmente pontes de hidróxeno. En medios non polares os ácidos carboxílicos existen xeralmente en forma de dímeros pola súa tendencia a autoasociarse.[2]
Poden identificarse facilmente con espectroscopía de infravermellos, xa que mostran unha banda asociada coa vibración do C-O (νC=O) entre 1680 e 1725 cm−1, e unha característica subbanda νO-H na rexión entre 2500 e 3000 cm−1.[2]
Síntese[editar | editar a fonte]
Produción industrial[editar | editar a fonte]
As rutas para a produción industrial de ácidos carboxílicos difiren xeralmente das usadas a pequena escala porque requiren equipamento especializado.
- Oxidación de aldehidos con aire, utilizando catalizadores de cobalto e manganeso. Os aldehidos necesarios obtéñense facilmente a partir de alquenos por hidroformilación.
- Oxidación de hidrocarburos usando aire. Para os alcanos máis simples, o método non é selectivo. Os compostos alílicos e bencílicos sofren oxidacións máis selectivas. Os grupos alquilo nun anel bencénico oxídanse dando ácido carboxílico, calquera que sexa a lonxitude da cadea. A formación de ácido benzoico a partir do tolueno, de ácido tereftálico a partir do p-xileno, e de ácido ftálico a partir de o-xileno, son algunhas conversións ilustrativas a grande escala. O ácido acrílico xérase a partir do propeno.[3]
- Deshidroxenación de alcohois, catalizada por bases.
- A carbonilación é o método máis versátil cando vai acompañado da adición de auga. Este método é efectivo para alquenos que xeran carbocatións secundarios e terciarios, por exemplo, de isobutileno a ácido piválico. Na reacción de Koch, a adición de auga e monóxido de carbono a alquenos está catalizada por ácidos fortes. O ácido acético e o ácido fórmico son producidos pola carbonilación do metanol, levada a cabo con iodo e alcóxido, os cales actúan como promotores, e frecuentemente con altas presións de monóxido de carbono, xeralmente en varios pasos hidrolíticos adicionais, nos Proceso Monsanto e proceso Cativa. As hidrocarboxilacións implican a adición simultánea de auga e CO. Tales reaccións chámase ás veces "Química de Reppe":
- HCCH + CO + H2O → CH2=CHCO2H
- Algúns ácidos carboxílicos de cadea longa obtéñense pola hidrólise dos triglicéridos obtidos de aceites e graxas de plantas e animais. Estes métodos están relacionados á elaboración do xabón.
Métodos de laboratorio[editar | editar a fonte]
Os métodos de preparación para reaccións a pequena escala con fins de investigación, instrución, ou produción de pequenas cantidades de químicos, adoitan utilizar reactivos caros.
- A oxidación de alcohois primarios con axentes oxidantes fortes como o dicromato de potasio, o reactivo de Jones, o permanganato de potasio, ou o clorito de sodio. O método é axeitado para as condicións de laboratorio, comparado co uso industrial do aire, pero este último é máis ecolóxico, posto que orixina menos subprodutos inorgánicos, tales como óxidos de cromo ou manganeso.
- Rotura oxidativa de olefinas, por ozonólise, permanganato de potasio, ou dicromato de potasio.
- Os ácidos carboxílicos tamén poden obterse pola hidrólise dos nitrilos, ésteres, ou amidas, xeralmente con catálise ácida ou básica.
- Carbonatación dun reactivo de organolitio ou Grignard:
- RLi + CO2 RCO2Li
- RCO2Li + HCl RCO2H + LiCl
- Haloxenación de metilcetonas, seguida por hidrólise na reacción do haloformo
- A reacción de Kolbe-Schmitt, que serve de ruta de síntese de ácido salicílico, precursor da aspirina.
Reaccións menos comúns[editar | editar a fonte]
Hai moitas reaccións que orixinan ácidos carboxílicos, pero utilízanse só en casos moi específicos, ou principalmente son de interese académico:
- Desproporción dun aldehido na reacción de Cannizzaro
- Rearranxo de dicetonas, no rearranxo do ácido bencílico, que implica a xeración de ácidos benzoicos na reacción de von Richter, a partir de nitrobencenos, e na reacción de Kolbe-Schmitt, a partir de fenois.
Reaccións[editar | editar a fonte]
- Obtención de sales de ácidos carboxílicos e amidas a partir do ácido:
- Os ácidos carboxílicos reaccionan con bases para formar sales. Nestes sales o hidróxeno do grupo OH substitúese co ión dun metal, por exemplo Na+. Desta forma, o ácido acético reacciona con bicarbonato de sodio para dar acetato de sodio, dióxido de carbono e auga.
Unha vez obtido o sal, podemos quentar dito sal para que por deshidratación cheguemos á amida.[4] A reacción xeral e o seu mecanismo son os seguintes:
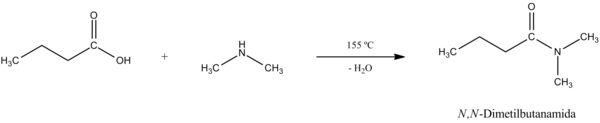

- Haloxenación na posición alfa: Chamada haloxenación de Hell-Volhard-Zelinsky ou tamén coñecida como Reacción de Hell-Volhard-Zelinsky, na que se substitúe un átomo de hidróxeno na posición alfa cun halóxeno, reacción que presenta utilidade sintética debido á introdución de grupos saíntes en posición alfa.

Os grupos carboxilos reaccionan cos grupos amino para formaren amidas. No caso de aminoácidos que reaccionan con outros aminoácidos para daren proteínas, o enlace de tipo amida que se forma é un enlace peptídico. Igualmente, os ácidos carboxílicos poden reaccionar con alcohois para daren ésteres, ou ben con haloxenuros para daren haloxenuros de ácido, ou entre si para daren anhídridos. Os ésteres, anhídridos, haloxenuros de ácido e amidas chámanse derivados de ácido.
Nomenclatura[editar | editar a fonte]
Os ácidos carboxílicos noméanse utilizando a terminación –oico ou –ico, que se une ao nome do hidrocarburo de referencia [5]:
Exemplo
CH3-CH2-CH3 propano CH3-CH2-COOH Acido propanoico (propano + oico)
Os nomes dos ácidos carboxílicos proceden do da fonte natural da que inicialmente se illaron. Clasifícanse así:
| Estrutura | Nome IUPAC | Nome común | Fonte natural |
|---|---|---|---|
| HCOOH | Ácido metanoico | Ácido fórmico | Destilación destrutiva de formigas (formica en latín) |
| CH3COOH | Ácido etanoico | Ácido acético | Fermentación do viño (vinagre) |
| CH3CH2COOH | Ácido propanoico | Ácido propiónico | Fermentación de lácteos (pion en grego) |
| CH3CH2CH2COOH | Ácido butanoico | Ácido butírico | Manteiga (butirum, en latín) |
| CH3(CH2)3COOH | Ácido pentanoico | Ácido valérico | Raíz da Valeriana officinalis |
| CH3(CH2)4COOH | Ácido hexanoico | Ácido caproico | Graxa de cabra |
Na nomenclatura da IUPAC os nomes dos ácidos carboxílicos fórmanse substituíndo a terminación “o” dos alcanos por “oico”, e antepoñendo a palabra ácido.
O esqueleto dos ácidos alcanoicos numérase asignando o número 1 ao carbono carboxílico e continuando pola cadea máis longa que inclúa o grupo COOH.
Exemplos de ácidos carboxílicos[editar | editar a fonte]
Exemplo 1
HOCH3-CH3-CH=CH-CH(CH3-CH=CH3)-CHBr-COOH
Neste composto, á parte do grupo funcional COOH, hai unha función alcohol, pero de acordo coa súa importancia o grupo COOH é o principal; polo que o grupo alcohol se nomea como un substituínte. Por tanto, o nome é ácido 3-alil-2-bromo-7-hidroxi-4-hexenoico.
Exemplo 2
Compostos con dous grupos COOH
| FÓRMULA | NOME IUPAC | NOME TRIVIAL |
|---|---|---|
| HOOC-COOH | Ac. Etanodioico | Ácido oxálico |
| HOOC-CH2-COOH | Ac. Propanodioico | Ácido malónico |
| HOOC-(CH2)2-COOH | Ac. Butanodioico | Ácido succínico |
A palabra carboxi tamén se utiliza para nomear ao grupo COOH cando na molécula hai outro grupo funcional que ten prioridade sobre el.
- HCOOH ácido fórmico (encóntrase en insectos, fórmico refírese ás formigas)
- CH3COOH ácido acético ou etanoico (presente no vinagre)
- HOOC-COOH ácido etanodioico, tamén chamado ácido oxálico,
- CH3CH2COOH ácido propanoico
- C6H5COOH ácido benzoico (o benzoato de sodio, o sal de sodio do ácido benzoico emprégase como conservante)
- Ácido láctico
- Todos os aminoácidos conteñen un grupo carboxilo e un grupo amino. Cando reacciona o grupo carboxilo dun aminoácido co grupo amino doutro fórmase un enlace amida chamado enlace peptídico. As proteínas son polímeros de aminoácidos e teñen nun extremo un grupo carboxilo terminal.
- Todos os ácidos graxos son ácidos carboxílicos. Por exemplo, os ácidos palmítico, esteárico, oleico, linoleico etcétera. Estes ácidos forman coa glicerina ésteres chamados triglicéridos.
- Os sales de ácidos carboxílicos de cadea longa empréganse como tensoactivos. Por exemplo, o estearato de sodio (octadecanoato de sodio), de fórmula CH3(CH2)16COO-Na+
- Cianoacrilato
Aplicacións[editar | editar a fonte]
Moitos ácidos carboxílicos prodúcense industrialmente a longa escala. Son tamén comúns na natureza. Utilízanse na produción de polímeros, produtos farmacéuticos, solventes, e aditivos alimentarios. Son exemplos de ácidos carboxílicos importantes industrialmente os seguintes: ácido acético (compoñente do vinagre, precursor de disolventes e pinturas), ácido acrílico e metaacrílico (precursores de polímeros e adhesivos), ácido adípico (polímeros), ácido cítrco (bebidas), ácido etilendiaminotetraacético (axente quelante), ácidos graxos (pinturas), ácido maleico (polímeros), ácido propiónico (conservante alimentario), e ácido tereftálico (polímeros).
Radical carboxilo[editar | editar a fonte]
O radical libre ·COOH (CAS# 2564-86-5) ten só unha existencia fugaz como grupo separado.[6] Mediuse a constante de disociación de ácido do ·COOH por espectroscopía de resonancia electrónica paramagnética. O valor do pKa = -0.2 ± 0.1 [7].
Notas[editar | editar a fonte]
- ↑ IUPAC GoldBook - carboxylic acids[
- ↑ 2,0 2,1 R.T. Morrison, R.N. Boyd. Organic Chemistry, 6th Ed. (1992) ISBN 0-13-643669-2.
- ↑ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a05_235 10.1002/14356007.a05_235.
- ↑ Vollhardt, K. Peter. Química Orgánica. 3ra edición. Ano 2000. Omega. Madrid. pp. 849-850. ISBN 84-282-1172-8.
- ↑ Organic Chemistry IUPAC Nomenclature. Rules C-4 Carboxylic Acids and Their Derivatives. http://www.acdlabs.com/iupac/nomenclature/79/r79_24.htm
- ↑ Milligan, D. E.; Jacox, M. E. (1971). "Infrared Spectrum and Structure of Intermediates in Reaction of OH with CO". Journal of Chemical Physics 54 (3): 927–942. doi:10.1063/1.1675022.
- ↑ Jeevarajan, A. S.; Carmichael, I.; Fessenden, R. W. (1990). "ESR Measurement of the pKa of Carboxyl Radical and Ab Initio Calculation of the C-13 Hyperfine Constant". Journal of Physical Chemistry 94 (4): 1372–1376. doi:10.1021/j100367a033.



