Cancro de mama
| Cancro de mama | |
|---|---|
| Clasificación e recursos externos | |
 Mamografía dunha mama normal (esquerda) e dunha mama con cancro (dereita, sinalado polas frechas brancas). | |
| OMIM | 114480 |
| DiseasesDB | 1598 |
| MedlinePlus | 000913 |
| eMedicine | med/3287 radio/115 plastic/521 |
Se cre que pode requirir tratamento, por favor, consúltello ao médico. | |
O cancro de mama ou carcinoma de mama é o cancro que se desenvolve no tecido mamario.[1] Entre os sinais de cancro de mama están a aparición dun nódulo na mama ou preto da mama na zona da axila, alteracións na forma ou na aparencia da mama, como retracción da mamila, pel da mama, aréola ou mamila con aparencia escamosa, vermella ou con vultos, ou mesmo sensibilidade na mamila e secreción ou perda de líquido pola mamila. En persoas coa doenza diseminada, pode verificarse tamén dor ósea, ganglios linfáticos avultados, falta de aire e ictericia.[2]
Entre os factores de risco para o desenvolvemento de cancro de mama cóntanse ser de sexo feminino, a idade, a obesidade, a falta de exercicio físico, o consumo de alcohol, a terapia hormonal substitutiva durante a menopausa, a radiación ionizante, a idade precoz da primeira menstruación, ter fillos en idade tardía ou non ter tido fillos.[3][4] Entre o 5 e o 10% dos casos son causados por xenes herdados dos pais da persoa, entre os cales están o BRCA1 e o BRCA2. O cancro da mama desenvólvese polo xeral nas células do revestimento das canles mamarias e dos lóbulos onde se produce o leite. Os cancros que se desenvolven nas canles son denominados carcinomas ductais, mentres que os que se desenvolven nos lóbulos son denominados carcinomas lobulares.[3] Existen 18 sub-tipos de cancro da mama. Algúns cancros desenvólvense a partir de condicións premalignas como o carcinoma ductal in situ.[4] A diagnose de cancro da mama é confirmado a través dunha biopsia do nódulo en cuestión. Unha vez realizada a diagnose, realízanse máis exames para determinar se o cancro se diseminou fóra da mama e a que tratamentos pode responder.[3]
A ponderación entre as vantaxes e desvantaxes do cribado do cancro de mama aínda é un tema controvertido. Unha revisión de 2013 da Cochrane afirmou que non está claro que o cribado mamográfico teña máis beneficios ou prexuízos.[5] Outra revisión de 2009 por un grupo de traballo dos Estados Unidos (US Preventive Services Task Force) atopou evidencias de beneficios en persoas de entre 40 e 70 anos de idade,[6] recomendando o cribado cada dous anos para as mulleres entre os 50 e 74 anos de idade.[7]
Como medida de prevención, en persoas con risco elevado de desenvolver cancro de mama, poden empregarse os fármacos tamoxifeno e raloxifeno. Outra medida de prevención en mulleres con risco agravado é a extirpación cirúrxica de ambas as mamas.[4] En persoas ás que lles foi diagnosticado o cancro, están dispoñíbeis unha serie de tratamentos, incluíndo cirurxía, radioterapia, terapia hormonal e terapia dirixida.[3] Dependendo do tipo de intervención necesario, a cirurxía pode conservar a mama (p.e. cuadrantectomia) ou ser realizada unha mastectomía. A reconstrución mamaria pode facerse durante a cirurxía ou nunha data posterior. Nas persoas nas que o cancro xa se diseminou para outras partes do corpo, os tratamentos están dirixidos a prolongar a vida, mellorar o conforto e a calidade de vida.[8]
O prognóstico para o cancro de mama varía en función do tipo de cancro, extensión da doenza e idade da persoa.[8] A taxa de supervivencia en países desenvolvidos é elevada,[9] sendo máis reducida nos países en vías de desenvolvemento.[4] Cando se considera todo o mundo, o cancro de mama é a causa máis común de cancro en mulleres, correspondendo o 25% de tódolos casos.[10] En 2012, foi responsábel de 1,68 millóns de casos e 522 000 mortes.[10] É máis común en países desenvolvidos[4] e é máis de 100 veces máis común en mulleres que en homes.[9][11]
Sinais e síntomas[editar | editar a fonte]

O primeiro síntoma percetíbel de cancro de mama é xeralmente a aparición dun nódulo na mama ou na zona dos ganglios linfáticos das axilas, cuxa sensación durante a palpación é diferente do tecido envolvente. Máis do 80% dos casos de cancro de mama son descubertos cando a muller sente un nódulo durante a palpación.[12] Alén dos nódulos, entre os sinais dun posíbel cancro de mama están un espesor diferente do restante tecido mamario; alteracións na forma, tamaño ou aparencia dunha mama; a retracción ou alteración de posición ou forma dunha mamila; pel da mama, aréola ou mamila con aparencia escamosa, vermella ou con vultos; secreción ou perda de líquido pola mamila; dor constante en parte da mama ou da axila e inchazón por baixo da axila ou arredor da clavícula.[3][13][14]

O carcinoma inflamatorio de mama é un tipo particular de cancro de mama cuxa diagnose é bastante difícil, xa que non se manifesta a través dun nódulo palpábel. Os síntomas poden asemellarse a unha inflamacións das mamas, incluíndo proído, dor, inchazón, inversión da mamila, calor, ton avermellado por toda a mama e textura da pel semellante a unha pela de laranxa.[12] Nalgúns casos, o cancro de mama preséntase como doenza metastática; ou sexa, cancro que se diseminou no corpo alén do órgano inicial. Os síntomas causados polo cancro de mama metastático dependen da localización das metástases. Os lugares máis comúns son os ósos, fígado, pulmóns e cerebro.[15]
A doenza de Paget de mama é unha síndrome maligna que é responsábel de entre o 1 e o 4,3% de tódolos cancros de mama. Maniféstase a través de alteracións na pel semellantes a un eccema, como ton avermellado, descoloración ou escamamento da pel da mamila. A medida que a doenza avanza, os síntomas inclúen formigueo, proído, aumento da sensibilidade e dor, podendo tamén producirse secrecións da mamila. Case a metade das mulleres diagnosticadas con doenza de Paget de mama inflamatorio tamén presentan un nódulo no peito.[16] En casos raros, aquilo que inicialmente aparenta ser un fibroadenoma (nódulo duro, móbil e non-canceroso) pode en realidade ser un tumor filoide, responsábel do 0,5% dos cancros de mama. Estes tumores fórmanse no estroma (tecido conxuntivo) da mama e son clasificados como benignos, dubidosos ou malignos.[17]
Existen tamén síntomas non específicos de cancro de mama; isto é, síntomas que tamén poden ser manifestacións doutras doenzas. A perda de peso inexplicábel pode por veces ser un sinal de cancro de mama, así como síntomas de febre e calafríos. As dores nos ósos ou articulacións, ictericia e síntomas neurolóxicos poden ser manifestacións de cancro de mama metastático.[18] A dor nas mamas é unha ferramenta pouco fidedigna para determinar a presenza ou ausencia de cancro da mama, mais pode ser indicativa doutras doenzas mamarias.[12][19][20]
A maior parte dos casos de síntomas de doenzas mamarias non implican unha diagnose de cancro. Por exemplo, só menos do 20% dos nódulos detectados son canceríxenos.[21] As doenzas benignas da mama, como a mastite e o fibroadenoma, son causas moito máis comúns dos síntomas aquí descritos. Porén, a aparición de calquera síntoma debe ser tomada en serio, xa que existe a posibilidade de que sexa cancro da mama, independentemente da idade da persoa.[22]
Factores de risco[editar | editar a fonte]
Os factores de risco para o cancro de mama poden ser divididos en dúas categorías: modificábeis e non modificábeis. Os modificábeis son comportamentos que as propias persoas poden alterar, como o consumo de bebidas alcohólicas, mentres que os non modificábeis son factores que non poden ser alterados, como a idade ou o sexo da persoa.[23] Os principais factores de risco para o cancro de mama son o sexo feminino e a progresión da idade.[24] Entre outros potenciais factores de risco están factores xenéticos, non ter tido fillos ou non ter amamantado,[25] a maior cantidade de determinadas hormonas,[26] e a obesidade, principalmente após a menopausa.[27]
Estilo de vida[editar | editar a fonte]

Fumar aumenta o risco de cancro de mama. O risco aumenta de forma proporcional á cantidade fumada e á precocidade na idade que se comezou a fumar. En fumadores veteranos, o risco é entre un 35% e un 50% maior que nos non fumadores.[28] Preto do 10% dos casos da doenza están relacionados coa ausencia de actividade física.[29] Permanecer sentado regularmente e por longos períodos de tempo está asociado a unha maior mortalidade por cancro de mama. Este risco non desaparece co exercicio regular, malia que haxa unha diminución.[30]
Existe unha relación entre a dieta e o cancro de mama. O risco da doenza é maior cunha dieta rica en graxas,[31] coa inxesta de alcohol,[32] e coa obesidade relacionada con niveis excesivos de colesterol.[33] A insuficiencia de iodo na dieta pode tamén influenciar no risco.[34]
Entre outros factores de risco están a radiación,[35] e o traballo por quendas.[36] Están tamén asociados ó aumento do risco algúns produtos químicos, como o bifenilpoliclorado, hidrocarburos aromáticos policíclicos, disolventes orgánicos[37] e determinados pesticidas.[38] Malia que a radiación recibida durante unha mamografía é unha dose moi baixa, estímase que o cribado anual entre os 40 e os 80 anos de idade é a causa de aproximadamente 225 casos fatais de cancro de mama por cada millón de mulleres.[39]
Existe unha asociación entre a contracepción hormonal e o desenvolvemento de cancro de mama durante a premenopausa,[23][40] aínda que se está a debater se o uso de contraceptivos orais causa de facto a doenza. Porén, mesmo que haxa algunha relación, o efecto global será pouco significativo.[41] Alén diso, non está claro se esa asociación continúa existindo cos contraceptivos orais de última xeración.[41] En persoas con mutacións xenéticas que causan predisposición para cancro de mama (xenes BRCA1 ou BRCA2) ou que teñen antecedentes familiares de cancro de mama, o uso de contraceptivos orais de última xeración non semella ter influencia no risco de cancro de mama.[42][43] As mutacións que poden causar cancro de mama foron asociadas experimentalmente á exposicióno a estróxenos.[44]
A relación entre a lactación e o cancro de mama aínda non está inequivocamente demostrada. Algúns estudos sinalan a existencia dunha asociación mentres que outros non o fan.[45] A comezos da década de 1980, xurdiu a hipótese de que o aborto inducido aumentaba o risco de desenvolver cancro de mama.[46] Porén, esta hipótese foi obxecto de investigación extensa nas décadas seguintes, tendo a comunidade científica concluído que nin o aborto inducido nin o aborto espontáneo están asociados a calquera aumento do risco de cancro de mama.[47]
Xenética[editar | editar a fonte]
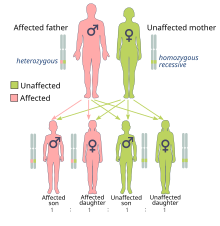
A predisposición xenética é a principal causa do 5 ó 10% de tódolos casos de cancro de mama[48] e pode ter un papel menor na maioría dos restantes casos.[49] En menos do 5% dos casos, a xenética ten un papel máis activo ó causar síndrome de cancro hereditario de mama e ovario en persoas con mutacións nos xenes BRCA1 e BRCA2.[49] Estas mutacións corresponden ó 90% do total de influencia xenética, cun risco de cancro de mama de 60 a 80% en persoas afectadas.[48] Entre outros xenes con mutacións significativas están o p53 (síndrome de Li-Fraumeni), PTEN (síndrome de Cowden), STK11 (síndrome de Peutz–Jeghers), CHEK2, ATM, BRIP1 e PALB2.[48]
En persoas con ningún, un ou dous pais afectados, o risco de cancro de mama antes dos 80 anos de idade é de 7,8%, 13,3% e 21,1%, respectivamente, sendo a mortalidade da doenza de 2,3%, 4,2% e 7,6%, tamén respectivamente.[50] En persoas cun parente en primeiro grao coa doenza, o risco de ter cancro de mama entre os 40 e 50 anos de idade é o dobre en relación ó resto da poboación.[51]
O xene GATA3 controla directamente a expresión dos receptores de estróxéno e doutros xenes asociados coa diferenciación epitelial. A perda do GATA3 provoca a perda de diferenciación e unha diagnose menos favorábel debido á invasión celular e metástase.[52]
Condicións médicas[editar | editar a fonte]
Algunhas alteracións nas mamas, como a hiperplasia ductal atípica e o carcinoma lobular in situ, que ocorren en doenzas benignas, están relacionadas co aumento do risco de cancro de mama. A diabetes pode tamén aumentar o risco da doenza.[53][54]
Fisiopatoloxía[editar | editar a fonte]

- Artigo principal: Carcinoxénese.
O cancro de mama, como calquera outro cancro, ocorre por mor dunha interacción entre factores ambientais e un hóspede xeneticamente predisposto. O cancro de mama é unha disfunción celular na que as células epiteliais medran e se multiplican de forma desordenada.[55] Malia que as células normais son quen de controlar a súa multiplicación, uníndose a outras células e quedando no seu debido lugar nos tecidos, as células canceríxenas non teñen mecanismos que impidan a súa multiplicación, non precisan unirse a outras células para sobrevivir e invaden os tecidos próximos. As células normais suicídanse cando xa non son necesarias. Até chegar o momento certo, esta morte programada é impedida por varios tipos de proteínas e vías metabólicas. Ocasionalmente, os xenes que codifican as proteínas destas vías protectoras poden sufrir mutacións, o que fai que estas proteínas alteradas convertan a célula resistente ós estímulos para cometer suicídio. Estas mutacións poden levar a un cancro. Por exemplo, nunha situación normal a proteína PTEN desliga a vía PI3K/AKT cando a célula está lista para se suicidar. Nalgúns cancros de mama, o xene da proteína PTEN atópase mutado, polo que a vía PI3K/AKT está permanentemente ligada, aumentado a resistencia ó suicidio celular (morte celular programada).[56]
O perfil xenómico é importante para caracterizar os subtipos de cancro de mama invasivo. O estróxeno é unha hormona producida principalmente polos ovarios e a placenta. Están identificados varios mecanismos polos cales esta hormona pode causar cancro de mama, incluíndo a ligazón do estradiol (E2) ós receptores de estróxeno (ER). O E2 regula o crecemento, a diferenciación celular e varios procesos fisiolóxicos, mais estes efectos son mediados polos receptores de estróxeno presentes no tecido mamario nas isoformas RE-α e RE-β. Arredor do 70% dos cancros de mama presenta niveis elevados de RE-α e niveis baixos de RE-β, o que suxire que o RE-α está asociado á carcinoxénese, mentres que o RE-β parece ter un efecto protector.[55][57][58] A proxesterona actúa nos receptores de proxesterona, cuxa expresión é estimulada polos receptores de estróxeno.[55][59] O oncoxene HER2/neu produce a proteína HER2 e codifica a glicoproteína transmembranar 185KDa. Cando é producida en baixos niveis, a proteína HER2 regula o crecemento celular normal. No 15-30% dos carcinomas invasivos de mama obsérvase a sobre-expresión ou amplificación do xene HER2.[55][60] Eventuais anomalías na sinalización dos factores de crecemento entre as células estromais e as células epiteliais poden facilitar o crecemento celular maligno.[61][62] No tecido adiposo da mama, a sobre-expresión da leptina leva ó aumento da proliferación celular e á apareción de cancro.[63]
Nos Estados Unidos, entre o 10 e o 20% das persoas con cancro de mama e cancro de ovario teñen un parente en primeiro ou segundo grao cunha destas doenzas. A tendencia familiar para desenvolver estes tipos de cancro é denominada síndrome hereditaria de cancro de mama e ovario. O caso mellor estudado é o da mutación do xene BRCA1 que confire risco de cancro de mama ó longo da vida de 60 a 85% e risco de cancro dos ovarios de 15 a 40%. Algunhas mutacións xenéticas asociadas co cancro, como é o caso dos xenes p53, BRCA1 e BRCA2, ocorren en proteínas que teñen como función corrixir erros na codificación do ADN. Estas mutacións son hereditarias ou adquiridas após o nacemento. Presumibelmente, permiten acumular mutacións posteriores, o que pode provocar división celular descontrolada e posteriormente cancro.[35][64] Porén, hai fortes evidencias de variación do risco individual para cancro de mama que van máis aló das mutacións dos xenes BRCA entre familias de portadores. Isto é causado por factores de risco non observábeis,[65] o que implica que o cancro de mama é desencadeado por factores ambientais e outras causas. A mutación hereditaria dos xenes BRCA1 ou BRCA2 pode interferir coa reparación de crosslinks (ligazóns cruzadas) do ADN e de fendas na cadea dupla de ADN.[66] Certos carcinóxenos provocan danos no ADN, como crosslinks e fendas na cadeia dupla, que frecuentemente precisan ser reparados por vías que conteñen os xenes BRCA1 e BRCA2.[67][68] Porén, as mutacións nos xenes BRCA son responsábeis de tan só o 2-3% de tódolos cancros de mama.[69]
Diagnose[editar | editar a fonte]
A consulta dun profesional de saúde e a realización de exames comeza xeralmente cando é descuberta unha masa ou calcificacións anormais nunha mamografía de cribado, ó notar un nódulo na mama ou debaixo do brazo durante o autoexame ou exame clínico ou ó notar unha mama vermella e inchada. Os exames de diagnose permiten detectar e distinguir o cancro de mama doutro tipo de lesións benignas, como simples quistes, coñecer con exactitude o estado do cancro, saber se existen metástases noutras partes do corpo fóra da mama e dos ganglios linfáticos axilares e axudar a determinar o tratamento máis eficaz.[70][71] Os exames de diagnose máis comúns son as mamografías e as biopsias. As mamografías son quen de detectar un cancro de mama, mesmo nas fases iniciais.[19] Unha biopsia consiste na recollida dunha pequena cantidade de tecido ou de células para ser observadas no microscopio e é a única forma de confirmar a diagnose de moitos tipos de cancro. Ademais da biopsia, ou cando non é posíbel realizar unha biopsia, están dispoñíbeis unha serie de exames de diagnose complementarios.[70] A combinación do exame físico, mamografía e biopsia por agulla permite diagnosticar o cancro de mama cun elevado nivel de precisión.[72]
Imaxioloxía[editar | editar a fonte]

Os exames imaxiolóxicos máis comúns son a mamografía, a ecografía e a resonancia magnética. A mamografía é o primeiro exame de diagnose cando unha muller nota síntomas dun posíbel cancro de mama, como a aparición dunha masa na mama ou descargas mamilares, ou cando unha mamografía de cribado indica calquera elemento sospeitoso. A mamografía de diagnose usa raios X para producir varias imaxes (mamogramas) que permiten detectar e observar tumores e outras irregularidades na mama que non son detectábeis só pola palpación. A ecografía usa ondas sonoras de elevada frecuencia para producir imaxes do tecido mamario e permite distinguir unha masa sólida, que pode ser cancro, dun quiste con fluído, que xeralmente non é cancro. Unha resonancia magnética usa campos magnéticos para producir imaxes do corpo de elevado detalle, podendo ser usada para medir o tamaño do tumor e avaliar a extensión da doenza alén da mama. A obtención de imaxes pode ser mellorada coa inxección dun medio de contraste.[70]
Ademais destes exames están dispoñíbeis exames complementarios como a cintigrafía ósea, a tomografía computadorizada e a tomografía por emisión de positróns. Porén, estes exames só están recomendados para doentes en estados avanzados. En casos con baixo risco de metástase, os riscos asociados con estes exames son superiores ós posíbeis beneficios, xa que estes procedementos expoñen o paciente a unha cantidade significativa de radiación ionizante.[73] A cintigrafía ósea permite detectar metástases no interior dos ósos mediante a inxección no doente dun axente radioactivo que despois é fotografado con cámaras especiais. O axente amoréase nas zonas que se encontran en cicatrización como resposta a células cancerosas, amosando áreas máis escuras na imaxe. Porén, este exame non detecta todos os cancros e a artrite avanzada ou a cicatrización dunha fractura poden xerar falsos positivos. A tomografía computadorizada permite detectar tumores nos órganos fóra da mama. A tomografía combina varias imaxes de raios X para producir unha imaxe tridimensional e bastante detallada do corpo, permitindo tamén medir o tumor e confirmar se se encontra en regresión co tratamento. A tomografía por emisión de positróns permite tamén detectar metástases en órganos fóra da mama, mediante a inxección dunha substancia azucrada na corrente sanguínea do doente. Como as células cancerosas consomen máis enerxía, as áreas de maior actividade aparecen na imaxe como puntos brillantes.[70]
Biopsia[editar | editar a fonte]
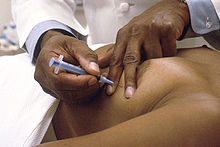
Unha biopsia consiste na recollida dunha pequena cantidade de tecido ou de células da área sospeitosa que é despois analizada no microscopio por un patólogo. A biopsia é o único exame que permite confirmar unha diagnose definitiva de cancro. Os restantes exames só suxiren a posibilidade de cancro. A maior parte dos tipos de cancro da mama son facilmente diagnosticábeis por biopsia, malia que algúns tipos raros poden precisar de exames de laboratorio especializados. Hai varios tipos de biopsias, clasificados de acordo coa técnica ou tamaño da agulla empregada. Na biopsia de diagnose, a técnica xeralmente usada é a biopsia con agulla grosa, que é inserida para recoller unha mostra de tecido da masa sospeitosa. Pode empregarse tamén a técnica de biopsia con agulla fina, na que o diámetro da agulla é menor e é recollida apenas unha mostra de células ou de líquido. A presenza de líquido transparente xeralmente indica que o nódulo non é canceríxeno. Por outra banda, se o líquido contén sangue, pode ser analizado no microscopio para detectar a presenza de células canceríxenas.[70][72]
Tamén pode ser usada a técnica de biopsia a baleiro, que extrae grandes cantidades de tecido. Cando o nódulo sospeitoso non é acessíbel á palpación e só é visíbel nunha mamografía, a biopsia pode ser guiada por mamografía, ecografía ou resonancia magnética.[70] Unha biopsia cirúrxica permite extraer unha gran cantidade de tecido. A biopsia cirúrxica pode ser incisional, na que se extrae apenas parte do tumor, ou excisional, na que o tumor é extraído por completo. Porén, este tipo de biopsia non é recomendada para a diagnose, sendo usada cando xa existe unha diagnose de cancro confirmado.[70][72]
A análise de laboratorio da mostra recollida pola biopsia permite coñecer as características do cancro e axuda a definir a mellor opción de tratamento. Entre as características, a análise determina se o tumor é invasivo ou in situ, ductal ou lobular e se o cancro se espallou para os ganglios linfáticos ou non. A análise permite tamén avaliar se o cancro é positivo a receptores hormonais (ER+ e PR+), determinar o risco de recorrencia da doenza e cal é o tratamento con mellor probabilidade de diminuír ese risco, e se é positivo ó xene do receptor-2 do factor de crecemento epidérmico humano (HER2+), o que permite saber se o tratamento con anticorpos é eficaz. A partir da biopsia, determínase o grao do tumor, ou sexa, como de diferentes son as células cancerosas das células normais e se elas apararentan medrar amodo ou axiña.[70]
Análises de sangue[editar | editar a fonte]
As análises de sangue permiten facer varios exames. Un hemograma permite contabilizar o número de diferentes células no sangue, como eritrocitos e leucocitos, garantindo que a medula ósea funciona correctamente. A análise bioquímica permite avaliar se os minerais no corpo, como calcio e potasio, ou as enzimas teñen valores anormais, o que pode significar que o cancro presenta metástases. Porén, hai numerosas condicións non cancerosas que poden interferir con estes exames. A presenza do enzima fosfatase alcalina está asociada á diseminación da doenza no fígado, ósos ou ductos biliares. Niveis elevados de calcio no sangue poden significar que o cancro se diseminou polos ósos. Niveis elevados de bilirrubina e das enzimas alanina aminotransferase (ALT) e aspartato aminotransferase (AST) poden ser un sinal de que o cancro se espallou polo fígado. Os exames de hepatite permiten avaliar se a persoa estivo exposta anteriormente a hepatite B ou C, podendo así precisar de medicación especial en caso de quimioterapia para evitar lesións no fígado. Os exames ós marcadores tumorais detectan a presenza de proteínas de tumor no sangue.[70]
Clasificación[editar | editar a fonte]
Existen varios sistemas para clasificar os diferentes tipos de cancro de mama. A clasificación dentro de cada un destes sistemas influencia a escolla do tratamento e o prognóstico da doenza. A descrición dun cancro de mama deberá preferencialmente incluír todos os aspectos. Unha clasificación completa abrangue o tipo histopatolóxico, grao, estadificación, estado dos receptores hormonais e a presenza ou ausencia de determinados xenes.[74]
Tipos histopatolóxicos[editar | editar a fonte]

O cancro de mama pode ser clasificado de acordo coa súa aparencia histolóxica. A maior parte dos tumores malignos de mama ten orixe en carcinomas no tecido epitelial. Os carcinomas de mama, malia que moitas veces discutidos na calidade dunha única doenza, son en realidade un grupo diversificado de lesións que diferen entre si na aparencia no microscopio e no comportamento biolóxico. A súa clasificación depende das características citolóxicas das lesións, do tipo de receptores que as células presentan e da súa velocidade de proliferación, e non da localización no sistema ductal-lobular mamario.[75] Cando o crecemento das células premalignas está restrinxido a un determinado compartimento, sen invadir o tecido envolvente, denomínase "carcinoma in situ". Polo contra, cando o carcinoma non se restrinxe ó compartimento inicial denomínase "carcinoma invasivo".[76]
Os dous tipos de carcinomas de mama máis comúns son os carcinomas ductais e os carcinomas lobulares. Os carcinomas ductais son a causa máis común da doenza, responsábeis do 76% das diagnoses, mentres que os lobulares son a segunda causa máis común co 8%.[75] Os carcinomas ductais tñen a súa orixe nas células que revisten os ductos mamarios e divídense en carcinomas ductais in situ, un tumor premaligno situado apenas no ducto, e carcinomas ductais invasivos, un cancro invasivo que xa se diseminou para o exterior do ducto. Os carcinomas lobulares teñen a súa orixe nos lobos mamarios e divídense en carcinomas lobulares in situ, unha lesión premaligna situada apenas nos lobos, e carcinomas lobulares invasivos, un cancro invasivo que xa se diseminou por fóra dos lobos. Malia que o carcinoma lobular in situ non é considerado cancro, a súa presenza é un factor de risco para desenvolver cancro da mama maligno.[77]
O carcinoma inflamatorio de mama é un tipo de cancro agresivo e de crecemento rápido responsábel do 1-5% de tódolos cancros de mama. A doenza de Paget de mama é un tipo de cancro que ten a súa orixe nos ductos da mamila. Malia que polo xeral é in situ, tamén pode ser invasivo. Entre os tipos menos comúns ou raros de carcinomas de mama están o carcinoma medular de mama, carcinoma mucinoso, carcinoma tubular, carcinoma metaplásico e carcinoma papilar.[75][77]
Grao[editar | editar a fonte]
A avaliación do grao histolóxico compara a aparencia das células canceríxenas coa aparencia do tecido mamario normal. Canto máis se aproximen as células cancerosas por riba do normal, menor será o seu crecemento e mellor será o seu prognóstico. Se as células non foron ben diferenciadas, son inmaturas, divídense máis axiña e tenden a diseminarse. As células normais dun órgano como a mama tórnanse diferenciadas, o que significa que asumen determinadas formas de acordo coa súa función nese órgano. Porén, as células canceríxenas perden esta diferenciación e, no canto de se aliñaren de forma organizada para formar as canles mamarias, comezan a dividirse de xeito descontrolado e o seu núcleo deixa de ser uniforme. O sistema máis amplamente usado para clasificar o grao histolóxico é a escala de Nottingham. Os tumores son clasificados en ben diferenciados (grao 1), moderadamente diferenciados (grao 2) e pouco diferenciados (grao 3). Os cancros con menor diferenciación foron asociados a un prognóstico menos favorábel.[78]
Estado dos receptores hormonais e HER2[editar | editar a fonte]
As células posúen receptores hormonais na superficie, no citoplasma e no núcleo. Os mensaxeiros químicos, como as hormonas, líganse a estes receptores para controlar as funcións celulares. No caso das células de cancro de mama, durante a biopsia avalíase se as células posúen dous receptores específicos, os receptores de estroxeno (ER) e de proxesterona (PR), así como se as células teñen ou non proteína HER2 en excesso ou copias extra do xene HER2. Conforme as células posúan ou non estes biomarcadores, o cancro é denominado ER positivo (ER+), ER negativo (ER-), PR positivo (PR+), PR negativo (PR-), HER2 positivo (HER2+) ou HER2 negativo (HER2-). Esta clasificación é fundamental para determinar o tipo de tratamento, xa que cada tipo responde a tratamentos diferentes.[74]
Cando a biopsia detecta receptores hormonais de estróxeno ou proxesterona nas células cancerosas, o tumor é clasificado como "sensíbel a hormonas" (RE+ ou RP+). Estes cancros poden ser tratados con terapia hormonal, a cal diminúe os niveis de estróxeno ou bloquea os receptores de estróxeno. Este tipo de cancro é máis común após a menopausa, tende a crecer máis lentamente que os restantes tipos e presenta mellor prognóstico a curto prazo, malia que haxa maior probabilidade de regresar a longo prazo. Cando non son detectados receptores hormonais, o cancro está clasificado como "non sensíbel a hormonas" (RE-, RP-) e non pode ser tratado con terapia hormonal.[74][79]
Os cancros cuxas células presentan exceso de HER2 ou copias extra do xene HER2 son denominados "HER positivos" (HER+). Este tipo de cancros tenden a ser máis agresivos, mais poden ser tratados con fármacos que teñen por obxectivo a HER2, como o anticorpo monoclonal trastuzumab. Cando as células non posúen nin receptores hormonais nin exceso de HER2 (ER-, PR-, HER2-), o cancro está clasificado como "basaloide" ou "triplo negativo". Este tipo de cancro tende a crecer máis rapidamente que os restantes e, como non teñen receptores hormonais, a terapia hormonal é ineficaz. Cando o cancro é simultaneamente sensíbel a hormonas e presenta HER2 en exceso, denomínase "triplo positivo" e pode ser tratado con fármacos hormonais e fármacos que teñen por obxectivo a HER2.[74][80]
Estadificación[editar | editar a fonte]
A estadificación do cancro baséase na avaliación da localización, dimensión e extensión do tumor, se existe diseminación nos ganglios linfáticos e se existen metástases noutras partes do corpo. A determinación do estado faise despois da avaliación do tumor mediante exames médicos. Coñecer o estado permite escoller a opción de tratamento máis axeitada e mellorar o prognóstico da doenza. O sistema de estadificación de cancro de mama máis usado é o sistema TNM. Este sistema avalía o tamaño e localización do tumor principal (T), o grao de propagación nos ganglios linfáticos (N) e metástases á distancia (M). A descrición de cada parámetro difere conforme o tipo de cancro. Os resultados da avaliación destes tres parámetros son entón combinados para determinar o estado do cancro desa persoa.[81]
O parámetro T, seguido de letras ou un número entre 0 e 4, avalía o tamaño e localización do tumor. Os estados T0 e Tis son situacións pre-cancro. Nos estados T1 a T3 o tumor aínda se encontra restrinxido á mama e ós ganglios linfáticos rexionais. O parámetro N refírese á avaliación dos nódulos ou ganglios linfáticos. No caso do cancro de mama, os ganglios rexionais son os que se encontran na axila, superiores e inferiores á clavícula e inferiores ó esterno, sendo todos os restantes denominados "distantes". Cando os ganglios son avaliados antes da cirurxía pode ser engadir o sufixo "c" (clínico); cando son avaliados na cirurxía, de forma máis precisa, pode engadirse o sufixo "p" (patolóxico). O parámetro M refírese á avaliación das metástases, ou sexa, se o cancro se espallou para outras partes do corpo.[81][82][83]
| T: Tamaño e localización do tumor primario[81][82][83] | ||
|---|---|---|
| T0 | Non hai evidencias de tumor primario. | |
| Tis | Carcinoma in situ, unha condición premaligna na que o tumor está limitado ós ductos ou lóbulos do tecido mamario e aínda non se propagou para os tecidos circundantes. Existen tres tipos de carcinomas in situ: "Tis (DCIS)", ou carcinoma ductal in situ, un cancro non invasivo mais que se non é extirpado pode volverse maligno; "Tis (LCIS)", ou carcinoma lobular in situ, que son células anormais nos lóbulos ou glándulas mamarias que, malia non ser cancro, pode converterse en maligno; e finalmente "Tis Paget", ou doenza de Paget de mama unha forma rara e non invasiva de cancro das células da pel da mamila. | |
| T1 | A parte invasiva do tumor de mama mide até 20 mm na maior extensión. | |
| T2 | A parte invasiva do tumor de mama mide entre 20 e 50 mm. | |
| T3 | A parte invasiva do tumor de mama mide máis de 50 mm. | |
| T4 | Un dos seguintes grupos: | T4a: o tumor xa creceu alén da parede torácica. |
| T4b: o tumor xa creceu até a pel. | ||
| T4c: o cancro xa se encontra tanto na parede torácica como na pel. | ||
| T4d: Carcinoma inflamatorio de mama | ||
| N: Ganglios linfáticos | ||
|---|---|---|
| N0 | Non hai evidencias de cancro nos ganglios linfáticos. | |
| N0(i+) | Obsérvanse áreas moi pequenas de células tumorais illadas (<0,2 mm ou <200 células). | |
| N1mic | Ou micrometástase, significa que o cancro nos ganglios linfáticos das axilas é maior de 0,2 mm, mais menor de 2 mm e só é posíbel ser observado no microscopio. | |
| N2 | O cancro propagouse a entre 4 e 9 ganglios da axila ou sobre o brazo ("N2a") ou para os ganglios internos da mama sen que estea presente nos da axila ("N2b"). | |
| N3 | Pode significar que o cancro se propagou a 10 ou máis ganglios linfáticos sobre o brazo, sobre a clavícula ou sobre o esterno ("N3a"); para os ganglios internos da mama e axilares ("N3b"); ou para os ganglios situados por enriba da clavícula ("N3c"). | |
| M: Metástases | ||
|---|---|---|
| M0 | A doenza aínda non ten metástases | |
| M0 (i+) | Malia que non haxa evidencias clínicas ou radiográficas de metástases, existen evidencias microscópicas de células tumorais no sangue, medula ósea ou outros ganglios linfáticos. | |
| M1 | Hai evidencias de metástases e existen células de cancro de mama a medrar noutros órganos. | |
O estado do cancro de mama é determinado a través da combinación dos parámetros T, N e M.:
| Estados do Cancro de Mama[81] | |||
|---|---|---|---|
| Estado | Imaxe | Avaliación TNM | Descrición |
| Estado 0 | 
|
Tis, N0, M0 (carcinoma ductal in situ) | A doenza atópase restrinxida ós ductos e lóbulos do tecido mamario e aínda non se propagou ó tecido envolvente. Tamén se denomina cancro non invasivo. |

|
Tis, N0, M0 (carcinoma lobular in situ) | ||
| Estado 1A | 
|
T1, N0, M0 | Tumor pequeno, invasivo, mais que aínda non se espallou nos ganglios linfáticos. |
| Estado 1B | 
|
T0 ou T1, N1mic, M0 | O cancro espallouse só nos ganglios linfáticos e é maior de 0,2 mm e menor que 2 mm. Non existen evidencias de tumor na mama ou o tumor é menor ou igual a 20 mm. |
| Estado 2A | 
|
T0, N1, M0 | Non hai evidencias de tumor na mama pero o cancro espallouse nos ganglios linfáticos axilares, mais non noutras partes do corpo. |
| T1, N1, M0 | O tumor é igual ou menor a 20 mm e espallouse nos ganglios linfáticos axilares. | ||

|
T2, N0, M0 | O tumor é maior de 20 mm e menor de 50 mm e aínda non se espallou nos ganglios linfáticos axilares. | |
| Estado 2B | 
|
T2, N1, M0 | O tumor é maior de 20 mm, menor de 50 mm e espallouse nun ou até tres ganglios linfáticos axilares. |

|
T3, N0, M0 | O tumor é maior de 50 mm, mais aínda non se espallou nos ganglios linfáticos axilares. | |
| Estado 3A | 
|
T0, T1, T2 ou T3, N2, M0 | Cancro de calquera tamaño que se espallou a 4 ou até 9 ganglios linfáticos axilares, mais non a outras partes do corpo. |

|
T3, N1, M0 | Pode tamén corresponder a un tumor maior de 50 mm que se espallou nun ou até tres ganglios linfáticos. | |
| Estado 3B | 
|
T4; N0, N1 ou N2; M0 | O tumor espallouse na parede torácica ou causou inflamación ou ulceración da mama ou foi diagnosticado carcinoma inflamatorio da mama. Pode ou non terse espallado nos ganglios linfáticos por baixo do brazo, mais aínda non existe metástases. |
| Estado 3C | calquera T, N3, M0 | O tumor de calquera tamaño que aínda non teña metástases mais que se teña espallado a 10 ou máis ganglios linfáticos axilares ou para os ganglios do grupo N3. | |
| Estado 4 (metastático) | 
|
calquera T, calquera N, M1 | Tumor de calquera tamaño que se teña espallado a outros órganos, como os ósos, pulmóns, cerebro, fígado, ganglios linfáticos distantes ou parede torácica. |
Prevención[editar | editar a fonte]
Estilo de vida[editar | editar a fonte]
O risco de cancro de mama pode ser diminuído mantendo un peso saudábel, limitando a inxestión de alcohol, amamantando os fillos e praticando actividade física regular e un estilo de vida activo. O conxunto destas medidas pode previr até o 42% dos cancros de mama.[84] O exercicio físico moderado, como a camiñada vigorosa, presenta beneficios en todas as franxas de idade, incluíndo as mulleres após a menopausa.[84][85] O consumo de ácidos graxos polinsaturados omega-3 e o consumo significativo de alimentos a base de soia aparenta diminuír o risco de cancro de mama.[86][87] Ademais diso, as medidas que animan a facer actividade física regular e a diminuición da obesidade teñen tamén outros beneficios, como a diminución do risco de doenza cardiovascular e diabetes.[23]
Mastectomia profilática[editar | editar a fonte]
A mastectomía profilática, ou preventiva, é a extirpación das dúas mamas antes de calquera diagnóstico de cancro ou a aparición de nódulos ou lesións sospeitosas. Esta medida pode ser considerada en persoas con mutacións nos xenes BRCA1 e BRCA2, as cales están asociadas a un risco moito maior dunha eventual diagnose de cancro de mama.[88][89] Non hai evidencias suficientemente fortes que apoien este procedemento noutras persoas alén daquelas en maior risco. A realización de tests xenéticos BRCA está recomendada só a persoas con elevado risco familiar e após aconsellamento. Non está recomendada a súa realización de rutina, xa que existen moitas formas diferentes de alteracións nos xenes BRCA, dende polimorfismos inofensivos até mutacións perigosas, e o efecto da maior parte destas alteracións aínda é incerto. Os tests en persoas de baixo risco teñen unha elevada probabilidade de presentar falsos positivos. Tampouco está claro se a extirpación da segunda mama en persoas que tiveran cancro na outra ten beneficios.[90][91]
Fármacos[editar | editar a fonte]
Os moduladores selectivos do receptor de estróxeno, como o tamoxifeno, diminúen o risco de cancro de mama, mais aumentam o risco de tromboembolia e cancro endometrial.[92][93] É unha opción dispoñíbel para prevención de cancro de mama en mulleres de elevado risco, mais non está recomendada a súa utilización en mulleres de risco moderado.[94] O beneficio destes medicamentos na prevención do cancro de mama esténdese por cinco anos após a interrupción do tratamento.[93]
Rastrexo[editar | editar a fonte]


Cando os tumores son suficientemente grandes para seren sentidos a través de palpación, é provábel que xa se teñan espallado alén da mama. Os exames de rastrexo permiten detectar a presenza de cancro antes de haber manifestación de sinais ou síntomas e cando o tumor aínda se encontra restrinxido na mama. Canto antes sexa detectado un cancro e antes comece o tratamento, mellor é o prognóstico.[95][96] As direccións de saúde de moitos países recomendan o rastrexo regular de cancro de mama. Nos Estados Unidos, está recomendada a realización dunha mamografía cada dous anos en mulleres entre os 50 e os 74 anos de idade.[7] Na Unión Europea, a maior parte dos países recomenda a realización de mamografías de rastrexo cada dous anos entre os 50 e 69 anos.[97] As mesmas recomendacións alertan que a realización de mamografías en intervalos menores aumenta o risco de cancro de mama inducido por radiación, ademais de ansiedade e cirurxías innecesarias.[98]
A mamografía usa raios X para examinar a mama e detectar eventuais formacións ou nódulos sospeitosos. Durante o exame, a mama é comprimida e un técnico obtén imaxes de varios ángulos. Unha mamografía xeral obtén imaxes da totalidade da mama, mentres que unha mamografía de diagnose céntrase nunha área sospeitosa ou nun nódulo específico.[99] Cando se observan sinais sospeitosos, a muller é xeralmente convocada para unha segunda mamografía ou para a realización dunha biopsia. O prazo entre as dúas mamografías pode ser de até seis meses, de xeito que se poida observar un eventual crecemento da lesión sospeitosa.[100] Malia que a espera pode causar ansiedade, a maior parte das lesións sospeitosas acaban por resultar falsos positivos.[101] Un de cada catro cancros detectados por mamografía son pseudocancros, o que corresponde a un sobrediagnóstico do 25%.[102][103] Aínda se descoñece se a resonancia magnética é un método que presenta mais beneficios ou prexuízos cando se compara coa mamografía convencional.[104]
Os exames de mama poden ser realizados pola propia muller (autoexame de mama) ou por un profesional de saúde (exame clínico) e envolven a palpación da mama para sentir a presenza de nódulos ou outras situacións sospeitosas.[95] Porén, malia seren bastante recomendados no pasado, as evidencias actuais non apoian a eficacia dos autoexames de mama, xa que no momento en que un nódulo é suficientemente grande para ser sentido na palpación, é probábel que xa se teña desenvolvido ó longo de varios anos e que teña unha dimensión que permita ser descuberta mesmo sen exame.[7][105][106] O autoexame de mama non está asociado a unha diminución da mortalidade, estando ó mesmo tempo asociado a prexuízos en termos de falsos positivos e aumento do número de biopsias innecesarias.[107] No presente, moitas organizacións científicas, entre as cales a Organización Mundial da Saúde, non recomendan a utilización do autoexame de mama como método eficaz de rastrexo en mulleres de baixo risco e foi eliminado das recomendacións das autoridades de saúde pública de varios países.[108][109][110] Porén, a recomendación da realización de autoexame da mama mantense no caso das mulleres con alto risco (portadoras de mutacións nos xenes BRCA1 e BRCA2).[111]
En 2013, a Colaboración Cochrane concluíu que as evidencias de mellor calidade non demonstran que a mamografía de rastrexo diminúa a mortalidade específica do cancro de mama nin a mortalidade por calquera causa.[5] Cando están incluídos tamén os ensaios con menor rigor, verifícase unha redución da mortalidade por cancro de mama do 0,05% (diminución de 1 en 2000 mortes por cancro de mama ó longo de dez anos ou unha diminución relativa do 15%).[5] Por outra banda, o rastrexo ó longo de dez anos aumenta nun 30% o número de sobrediagnoses e sobretratamentos (3 a 14 por 1000) e máis da metade das persoas terán polo menos un exame falso positivo.[5][112][113] Isto levou a cuestionar os beneficios da mamografía de rastrexo.[5][113]
Tratamento[editar | editar a fonte]
O tratamento do cancro de mama depende de varios factores, incluíndo o estado do cancro e a idade da persoa. A medida que o prognóstico é gradualmente menos favorábel e o risco de nova ocorrencia maior, son utilizados tratamentos cada vez máis agresivos.[114] O cancro de mama é xeralmente tratado con cirurxía, a cal pode ser seguida por quimioterapia ou radioterapia. É preferíbel unha abordaxe multidisciplinar.[115] Os cancros con receptores de hormonas positivos son moitas veces tratados con terapia de bloqueo hormonal ó longo de varios anos. Nalgúns casos de cancro metastático ou outros estados avanzados poden ser usados anticorpos monoclonais ou outros tratamentos inmunoterapéuticos.[116]
Cirurxía[editar | editar a fonte]

A cirurxía implica a extirpación física do tumor, xeralmente con algo do tecido adxacente. Durante a cirurxía poden realizarse biopsias nos ganglios linfáticos. Entre as cirurxías comúns están:[114]
- Mastectomía: Extirpación completa da mama.
- Cuadrantectomía: Extirpación dun cuarto da mama.
- Lumpectomía: Extirpación dunha pequena parte da mama.
Unha vez eliminado o tumor, é posíbel realizar unha cirurxía de reconstrución de mama para mellorar a aparencia estética da zona tratada. En alternativa, algunhas mulleres usan próteses mamarias para simular a mama por baixo da roupa.[114]
Radioterapia[editar | editar a fonte]


A radioterapia é xeralmente realizada após a intervención cirúrxica. Esta terapia consiste na emisión de radiación ionizante para a rexión onde se formou o tumor e ganglios linfáticos rexionais, co obxectivo de destruír eventuais células tumorais microscopicas que poidan ter quedado.[117][118] A radioterapia pode ser externa ou interna. Nalgúns casos, pode ser realizada ó mesmo tempo que a operación (radioterapia interoperatoria). A radioterapia interoperatoria dirixida aparenta ter o mesmo grao de eficacia, após catro anos, que varias semanas de radioterapia externa.[119]
Medicación[editar | editar a fonte]
Os fármacos usados após e en conxunto coa cirurxía son denominados terapia adxuvante. A quimioterapia ou outros tipos de terapia usados antes da cirurxía son denominados terapia neoadxuvante. Existen tres principais grupos de medicamentos usados para o tratamento adxuvante do cancro de mama: axentes de bloqueo hormonal, quimioterapia e anticorpos monoclonais.[114]
Hormonoterapia[editar | editar a fonte]
Algúns cancros de mama necesitan de determinadas hormonas para continuar a medrar. Este tipo de cancro pode ser identificado pola presenza na súa superficie de receptores hormonais, como receptores de estróxeno (ER+) e de proxesterona (PR+). Os cancros ER+ poden ser tratados con fármacos que bloquean eses receptores, como o tamoxifeno, ou que bloquean a produción de estróxeno como un inhibidor da aromatase, como o anastrozol. O uso de tamoxifeno é recomendado ó longo dun período de dez anos.[120][121] Os inhibidores da aromatase son axeitados só para mulleres após a menopausa, grupo en que aparentan ser superiores ó tamoxifeno.[122] Isto acontece porque a aromatase activa nas mulleres posmenopausa é diferente da forma prevalente nas mulleres premenopausa, polo que estes axentes son ineficaces en inhibir a arometase predominante antes da menopausa.[123]
Quimioterapia[editar | editar a fonte]
A quimioterapia é predominantemente usada en casos de cancro de mama entre os estados 2 e 4, sendo particularmente beneficioso na doenza con receptores de estróxeno negativos (ER-). Os medicamentos de quimioterapia son administrados en combinacións e xeralmente ó longo dun período de 3-6 meses. Un dos réximes máis comúns, denominado "AC", combina ciclofosfamida con doxorrubicina. Ás veces, engádese unha taxina como o docetaxel, sendo entón denominado "CAT". Outro tratamento común é o réxime de ciclofosfamida, metotrexato e 5-fluorouracil (CMF). No entanto, este réxime é mais nocivo para os ovarios do que os réximes baseados en antraciclinas. O réxime máis usado no presente é a combinación de 5-fl-epirubicina-ciclofosfamida. Os axentes alquilantes como a ciclofosfamida son bastante tóxicos para o ovario, polo que son xeralmente usados agonistas da GnRH para bloquear o ovario e preservar a súa función.[124]
Inmunoterapia[editar | editar a fonte]
O trastuzumab é un anticorpo monoclonal do HER2 – un receptor celular que é particularmente activo en células do cancro de mama. Este fármaco mellorou a supervivencia a cinco anos sen novas ocorrencias da doenza para preto do 87% (supervivencia xeral de 95%) en cancros de mama HER2+ de estado 1-3-[125] Cando é estimulado por determinados factores de crecemento, o HER2 causa crecemento e división celular, mais na ausencia deses factores a célula normalmente para de medrar. Entre o 25% e o 30% dos cancros de mama superexpresan o xene HER2 ou o seu produto proteico.[126] Esta superexpresión do HER2 no cancro de mama está asociada ó aumento da recorrencia da doenza e prognóstico menos favorábel. Cando o trastuzumab se liga ó HER2 nas células cancerosas que superexpersan o receptor, o medicamento impide que os factores de crecemento sexan quen de se ligar e estimular os receptores, bloqueando así o crecemento das células cancerosas. Porén, o trastuzumab é significativamente caro e pode causar efectos secundarios graves, con preto do 2% das persoas tratadas manifestando problemas cardíacos significativos.[127]
Prognóstico[editar | editar a fonte]

O prognóstico é xeralmente dado para a probabilidade de supervivencia libre de progresión (progression free survival ou PFS) ou supervivencia libre de doenza (disease free survival ou DFS). Estas probabilidades baséanse na experiencia con pacientes de cancro de mama con classificacións idénticas. Un prognóstico é unha estimación, xa que pacientes coa mesma clasificación sobreviven diferentes períodos de tempo e as clasificacións non son sempre precisas. A supervivencia é xeralmente determinada pola forma dun número medio de meses ou anos que a metade dos pacientes sobrevivirá, ou a porcentaxe de pacientes que continuaron vivos despois de 1, 5, 15 e 20 anos. O prognóstico é importante para tomar decisións durante o tratamento, xa vez que ós pacientes con mellor prognóstico ofrécenselles tratamentos menos invasivos, como a lumpectomia, radioterapia e hormonoterapia, mentres que ós pacientes con peor prognóstico ofrécenselles tratamentos máis agresivos, como mastectomía extensa e quimioterapia.[128]
Factores prognósticos[editar | editar a fonte]
O estado do cancro de mama é o compoñente máis importante dos sistemas de clasificación do cancro de mama, xa que é o que ten maior influencia no prognóstico. A estadificación ten en consideración o tamaño, o tecido envolvente local, o estado dos ganglios linfáticos e se existen ou non metástases. Canto máis avanzado sexa o estado do diagnóstico, máis desfavorábel é o prognóstico. A invasividade e agresividade das células cancerosas fan aumentar o estado, mentres que a presenza de áreas sen cancro e comportamento celular próximo do normal (grao) fan diminuír o estado. O tamaño non é un factor a non ser que o cancro sexa invasivo.[129][130]
- Os cancros de estado 1 e os carcinomas ductais e lobulares in situ teñen un excelente prognóstico e son xeralmente tratados con lumpectomía e, ás veces, radioterapia.[131] Os cancros HER2+ son xeralmente tratados cun réxime de trastuzumab.[132] A quimioterapia é pouco común noutro tipo de cancros de estado 1.
- Os cancros de estado 2 e 3 presentan un prognóstico progresivamente desfavorábel e maior risco de recorrencia. Son xeralmente tratados con cirurxía (lumpectomía ou mastectomía con ou sen extracción dos ganglios linfáticos), quimioterapia (con trastuzumab en cancros HER2+) e ás veces radioterapia (particularmente en tumores de gran dimensión, múltiples nódulos positivos ou lumpectomía).[130]
- O cancro metastático de estado 4 presenta un prognóstico pouco favorábel e é tratado con varias combinacións de cirurxía, radioterapia, quimioterapia e terapias dirixidas. A taxa de supervivencia ós dez anos é de 5% sen tratamento e 10% con tratamento axeitado.[130]
As mulleres máis novas tenden a presentar peor prognóstico que as mulleres posmenopausa debido a diversos factores. As súas mamas poden sufrir alteracións debido ó ciclo menstrual ou poden estar amamantando nenos, o que volve máis difícil á muller decatarse de alteracións sospeitosas. Polo xeral, cando o cancro é diagnosticado en mulleres novas, xa se encontra nun estado máis avanzado. Poden tamén existir factores biolóxicos que aumentan o risco de recorrencia en mulleres máis novas.[133]
A elevada densidade da mama en mamografía, que é un marcador de risco para desenvolver cancro de mama, pode non significar un aumento do risco de morte entre pacientes de cancro.[134]
Mentres que o cancro de mama en homes é xeralmente detectado en estados avanzados, o prognóstico é moitas veces pouco favorábel.[135]
Contracepción[editar | editar a fonte]
En superviventes de cancro de mama, a primeira escolla de contracepción deben ser métodos non hormonais. Os métodos baseados en proxestáxenos, como o Depo Provera, o dispositivo intrauterino con proxesterona ou a pílula de proxestáxeno só posibelmente aumentan o risco de recorrencia do cancro, malia que esa posibilidade aínda estea pouco estudada. Porén, poden ser usados se os beneficios son superiores ó posíbel risco.[136]
Menopausa[editar | editar a fonte]
En superviventes de cancro de mama, recoméndase considerar primeiro opcións non hormonais para os efectos da menopausa, como os bifosfonatos ou moduladores selectivos do receptor de estróxeno para a osteoporose, ou estróxenos vaxinais para síntomas locais. Os estudos observacionais de terapia de substitución hormonal após o cancro de mama son polo xeral positivos. No caso de que sexa necesaria a substitución hormonal, a terapia exclusiva de estróxeno ou terapia de estróxeno cun dispositivo intrauterino de proxestáxeno poden ser opcións máis seguras que a terapia sistémica combinada.[137]
Aspectos psicolóxicos[editar | editar a fonte]
O diagnóstico, síntomas e tratamento do cancro ten un impacto emocional profundo. O cancro e o tratamento poden provocar alteracións na aparencia da persoa, como perda de cabelo, gañar ou perder peso, cicatrices cirúrxicas, exantemas, perda dunha mama e cansazo que pode eliminar a motivación de realizar actividades das que anteriormente se gozaba. Moitos hospitais están asociados a grupos de apoio para o cancro, que achegan axuda e consello ós pacientes. Moitas das alteracións desaparecen ou melloran após o tratamento. A cosmética e a cirurxía reconstrutiva poden axudar as persoas a lidar mellor coas alteracións físicas. O diálogo con outros pacientes, superviventes de cancro ou grupos de apoio axuda a aceptar mellor as alteracións co corpo. A actividade física ofrece enerxía e axuda a persoa a sentirse mellor durante o tratamento.[138]
Non todos os pacientes viven a doenza da mesma maneira. Algúns factores, como a idade, poden ter un impacto significativo na forma na que a persoa reacciona a un diagnóstico de cancro da mama. As mulleres novas teñen que enfrontarse a miúdo cunha posible menopausa precoz inducida por moitos dos réximes de quimioterapia usados no tratamento, particularmente aqueles que usan hormonas que suprimen a función dos ovarios.[139] Moitas persoas con cancro presentan síntomas de ansiedade, alimentadas pola incerteza do diagnóstico, medo á morte pola doenza e receo ó tratamento. A ansiedade pode agravar os efectos secundarios do tratamento, como a fatiga, volver a persoa dependente ou alterar a relación coa familia e amigos. A ansiedade pode ser xestionada con consello psicolóxico, técnicas de relaxación ou medicación.[140]
Epidemioloxía[editar | editar a fonte]

sen datos <2 2–4 4–6 6–8 8–10 10–12 | 12–14 14–16 16–18 18–20 20–22 >22 |
O cancro de mama é o segundo cancro máis común en todo o mundo e o cancro máis común entre mulleres, tanto en países desenvolvidos como en países en vías de desenvolvemento. Estímase que en 2012 foron diagnosticados 1,67 millóns de novos casos, o que corresponde co 25% de tódolos diagnósticos de cancro. A incidencia entre as varias rexións do mundo varía significativamente, dende 19,3 casos por 100 000 habitantes na África Oriental até 89,7 na Europa Occidental.[142] Globalmente, o cancro de mama é a quinta causa de morte por cancro, sendo responsábel de 522 000 mortes en 2012. En países desenvolvidos, é a segunda causa de morte por cancro (198 000 mortes, ou 15,4%), só detrás do cancro de pulmón. A mortalidade varía entre 6 mortes por cada 100 000 persoas en Extremo Oriente e 20 por cada 100 000 na África Occidental. A amplitude da mortalidade entre as rexións do mundo é menor da incidencia debido á mellor supervivencia que se rexista en países desenvolvidos.[143] As baixas taxas de supervivencia nos países en desenvolvemento son causadas pola inexistencia de programas de rastrexo precoz e falta de diagnóstico e instalacións axeitadas.[142]
O número de casos en todo o mundo medrou significativamente dende a década de 1970, un fenómeno parcialmente atribuído ós modernos estilos de vida.[144][145] O cancro de mama está fortemente relacionado coa idade, e só o 5% de tódolos casos ocorren en mulleres de menos de 40 anos.[146] No ano 2011, rexistráronse 41 000 diagnoses novas en Inglaterra, e arredor do 80% destes casos eran mulleres de 50 ou máis anos[147] Baseándose nos datos estatísticos dos Estados Unidos en 2015, hai unhas 2,8 millóns afectadas por cancro de mama.[148] Nos Estados Unidos, a incidencia axustada á idade de cancro de mama por cada 100 000 mulleres acadou os 102 casos por ano na década de 1970, medrando até os 141 a finais da década de 1990. Dende entón diminiuiu, chegando a 125 dende 2003.[149]
Historia[editar | editar a fonte]

Malia que o cancro de mama é coñecido dende a Antigüidade, até o século XIX era pouco común. O embarazo e a lactación precoces probabelmente contribuíron á reducida prevalencia de cancro entre as mulleres que sobrevivían até a media idade e a maior parte das mulleres morría demasiadamente cedo para desenvolver cancro. Porén, a mellora significativa da hixiene e do control de doenzas infecciosas nese século provocou un aumento significativo da esperanza de vida e, á súa vez, o aumento do número de casos.[150]
Debido á súa visibilidade, o cancro de mama é a forma de cancro que máis frecuentemente é descrita en documentos antigos. A pesar de que as autopsias eran pouco comúns, os cancros dos órganos internos raramente eran observados na medicina da antigüidade. Porén, o cancro de mama podía ser facilmente sentido a través da pel e, en estados avanzados, moitas veces desenvolvía lesións, volvíase necrótico e ulceraba pola pel.[151] A máis antiga descrición do cancro de mama data da VI dinastía exipcia[152] O primeiro rexistro dunha mastectomía data do ano 548 d.C., cando foi proposta por Aecio de Amida á emperatriz Teodora.[151] A medicina primitiva, dende a antigüidade grega até ao século XVII, baseábase no humorismo e afirmaba que o cancro de mama era causado por desiquilibrios nos fluídos esenciais que controlaban o corpo, especialmente polo exceso de bile negra.[153] Moitos pacientes vían o cancro como castigo divino.[154] No século XVIII comezaron propoñerse varias explicacións, dende a falta de actividade sexual até o exceso de actividade sexual, lesións físicas no peito, coagulación de leite na mama e varias formas de bloqueos linfáticos, ora internos ora debido a vestiario moi apertado.[150][153]
Só cando no século XVII se comezou a comprender o sistema circulatorio, os médicos puideron associar a diseminación do cancro de mama ós ganglios linfáticos na axila. O cirurxián francés Jean-Louis Petit (1674–1750) e máis tarde o escocés Benjamin Bell (1749–1806) foron os primeiros en eliminar con éxito os ganglios linfáticos, tecido mamario e o músculo adxacente. O seu traballo foi continuado William Stewart Halsted, que comexou a realizar mastectomías radicais en 1882, apoiado polo progreso na tecnoloxía de cirurxía, como a asepsia e a anestesia. Esta técnica radical moitas veces supoñía eliminar as dúas mamas, os ganglios linfáticos e os músculos adxacentes. Isto provocaba dor e incapacidade a longo prazo, mais era visto como un mal necesario para impedir que o cancro volvese a producirse.[155] Antes da aparición das mastectomías radicais, a supervivencia a 10 anos era de apenas o 10%, tendo aumentado até o 50%.[156] En base ó traballo de Halsted, Jerome Urban promoveu cirurxías aínda máis radicais coa eliminaión de maior cantidade de tecido. Esta técnica continuou a ser usada até 1963, cando se demostrou que as taxas de supervivencia a dez anos eran idénticas á mastectomía de Halsted.[155] Os sistemas de clasificación en estados para o cancro de mama comezaron a ser desenvolvidos nas décadas de 1920 e 1930.[155]
Malia que as mastectomías radicais mantivéronse como o procedemento padrón en América do Norte até a década de 1970, en Europa comezaron a adoptarse medidas que conservasen a maior parte do tecido dende a década de 1950, complementadas por radioterapia.[155] Unha das explicacións para esta diferenza está na proporción entre sexos na época: mentres que en América do Norte as mulleres cirurxiás representaben menos do 1% da clase, no corpo clínico oncolóxico dalgúns hospitais de Europa a metade do equipo estaba constituído por mulleres.[155] Durante a década de 1970, a nova comprensión sobre as metástases permitiu ver o cancro como unha doenza non só localizada, senón tamén sistémica, chegando a desenvolverse novos procedementos que se probaron da mesma eficacia, como a quimioterapia moderna.[157] Na década de 1980, varios estudos non controlados suxeriron que complementar a radioterapia con transplantes de medula ósea podería ser eficaz no tratamento de cancros duros, o que máis tarde se demostrou como falso e especulativo. Porén, entre finais da década de 1980 e 1998 realizáronse milleiros de transplantes, os cales teñen diversos efectos adversos graves e taxas de mortalidade de 3 a 15%. En 2002, concluíuse que a terapia hormonal de substitución aumentaba significativamente o risco de cancro de mama.[158][159]
Sociedade e cultura[editar | editar a fonte]
Até comezos do século XX, o cancro de mama era considerado unha fatalidade sen cura. Pouco podía facerse coas técnicas cirúrxicas primitivas, polo que as mulleres adoitaban sufrir en silencio e vergoña, no canto de procurar axuda. Cando o progreso na cirurxía mellorou a supervivencia do cancro, as mulleres comezaron a tomar conciencia da doenza e da posibilidade de tratamento. Unha das primeiras campañas organizadas de sensibilización da opinión pública – Women's Field Army – tivo lugar nos Estados Unidos entre as décadas de 1930 e 1940. En 1952, xurdiu o primeiro grupo de axuda mutua, denominado "Reach to Recovery", que promovía o contacto entre pacientes e superviventes de cancro.[160]
Os movementos de apoio e sensibilización para o cancro da mama das décadas de 1980 e 1990 xurdiron a partir dos movementos feministas e movementos para a saúde da muller do século XX.[161] Esta serie de campañas políticas e educativas, en parte inspirada pola eficacia das campañas de sensibilización para a SIDA, contribuíu na aceptación xeneralizada da importancia dunha segunda opinión antes dunha cirurxía, a opción por cirurxías menos invasivas, a creación de grupos de apoio e outros progresos nos cuidados ó paciente.[162]
O 19 de outubro celébrase o Día Mundial do Cancro de Mama, precedido por uns poucos días, o 13 de outubro, polo Día Mundial do Cancro de Mama Metastásico.[163]
Lazo rosa[editar | editar a fonte]
- Artigo principal: Lazo rosa.

O lazo rosa é o símbolo máis prominente do movemento de sensibilización para o cancro de mama. Os lazos, que poden ser producidos sen grandes custos, son frecuentemente vendidos para a recadación de fondos. Poden ser usados para homenaxear as persoas a quen lles foi diagnosticado cancro ou para identificar produtos que o fabricante pretenda vender a consumidores sensíbeis para a cuestión do cancro de mama.[164] O lazo rosa está asociado á xenerosidade individual, fe no progreso científico e a unha actitude proactiva, encoraxando os consumidores a enforcarse na perspectiva positiva dunha eventual cura para o cancro.[165]
Por outra banda, o lazo rosa foi criticado polos que consideran esta práctica un activismo de sofá, sen ningún efecto práctico positivo. Tamén foi criticado como hipocrisía, xa que algunhas das mesmas persoas, empresas ou organización que usan o lazo de cor rosa para demostrar solidariedade coas mulleres con cancro, ó mesmo tempo opóñense a medidas realmente eficaces, como dereitos dos pacientes e medidas de combate á polución atmosférica.[166][167] Os críticos argumentan que a natureza optimista dos lazos rosa e o consumo de produtos desa cor distrae a sociedade da ausencia de progreso na prevención e cura da doenza.[168] O lazo é tamén criticado por reforzar os estereotipos de xénero e obxectificar a muller e os seus seos.[169]
Impacto económico[editar | editar a fonte]
En comparanza con outras doenzas ou outros cancros, o cancro de mama recibe unha cantidade relativamente maior de recursos e atención das entidades públicas[170] e maior cobertura dos medios en relación a outros cancros de igual prevalencia.[171] Unha das consecuencias desta elevada visibilidade é que por veces os resultados estatísticos poden ser interpretados de forma incorrecta. Por exemplo, a afirmación de que unha de cada oito mulleres será diagnosticada con cancro da mama ó longo da vida depende da asunción irrealista de que ningunha muller morrerá por mor doutra doenza antes dos 95 anos.[172] En 2009, o custo económico do cancro na Unión Europea foi de 126 mil millóns de euros, dos cales o 12% (15 mil millóns) foron destinados ó cancro de mama. Os custos directos de tratamento corresponden ó 40% destes valores.[173]
No embarazo[editar | editar a fonte]
O cancro de mama asociado á gravidez é aquel que é diagnosticado durante o embarazo ou no primeiro ano posparto. É a neoplasia máis común durante a xestación e é cada vez máis frecuente a medida que a idade media da maternidade é cada vez máis avanzada. A maioría son carcinomas ductais invasivos (80-100%), pouco diferenciados, de grandes dimensións, con invasión linfática e vascular e negativos para os receptores de estróxeno. A maioría (53,3%) dos casos son diagnosticados no posparto. O cancro de mama asociado ó embarazo ocorre nun caso de cada 3 000-10 000 e corresponde a entre o 0,2% e o 3,8% de tódolos diagnósticos de cancro de mama.[174]
O diagnóstico de cancro durante o embarazo é máis difícil por mor do aumento de tamaño das glándulas mamarias inducido polo estado hormonal. Na maioría das embarazadas, a mamografía amosa unha glándula mamaria moi densa, heteroxénea e nodular, o que diminúe significativamente a sensibilidade deste exame. Isto fai que os nódulos sexan subvalorizados, atribuídos a alteracións benignas ou a incomodidades normais da gravidez,[174][175] e fai que o cancro sexa descuberto nun estado máis avanzado. Algunhas técnicas de imaxioloxía, como a resonancia magnética, a ecografía e a mamografía con protección do feto son seguras durante a gravidez, mentres que outras, como a TEP, non o son.[176]
O tratamento é xeralmente o mesmo que para mulleres non embarazadas. Nalgúns casos, o tratamento é adiado para despois do parto, sobre todo se o cancro é detectado nunha fase avanzada do embarazo. As inducións de parto para dar inicio ó tratamento son pouco comúns. A cirurxía é xeralmente considerada segura, malia que se evite a radioterapia. Moitos fármacos usados en quimioterapia non son administrados durante o primeiro trimestre por mor do risco de doenzas conxénitas e aborto espontáneo. A realización dun aborto non é precisa e non aumenta a probabilidade de cura ou supervivencia da nai. No posparto, a radioterapia pode interferir na capacidade de lactación da nai, xa que diminúe a capacidade de produción de leite e aumenta o risco de mastite, e os fármacos de quimioterapia poden pasar ó bebé a través do leite.[176]
Notas[editar | editar a fonte]
- ↑ National Cancer Institute (2014). "Breast Cancer". Consultado o 29 de xuño de 2014.
- ↑ Saunders, Christobel; Jassal, Sunil (2009). Breast cancer. Oxford: Oxford University Press. p. Capítulo 13. ISBN 978-0-19-955869-8.
- ↑ 3,0 3,1 3,2 3,3 3,4 National Cancer Insitute (2014). "Breast Cancer Treatment". Consultado o 29 de xuño de 2014.
- ↑ 4,0 4,1 4,2 4,3 4,4 International Agency for Research on Cancer (2014). Organización Mundial da Saúde, ed. World Cancer Report 2014. pp. Capítulo 5.2. ISBN 92-832-0429-8.
- ↑ 5,0 5,1 5,2 5,3 5,4 Gøtzsche, PC; Jørgensen KJ (2013). "Screening for breast cancer with mammography.". The Cochrane database of systematic reviews 6. pp. CD001877. PMID 23737396. doi:10.1002/14651858.CD001877.pub5.
- ↑ Nelson, HD; Tyne, K; Naik, A; Bougatsos, C; Chan, B; Nygren, P; Humphrey, L (2009). "Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force". PMID 20722173.
- ↑ 7,0 7,1 7,2 US Preventative Services Task Force (2009). "Screening for Breast Cancer". Arquivado dende o orixinal o 02 de xaneiro de 2013. Consultado o 24 de decembro de 2012.
- ↑ 8,0 8,1 National Cancer Institute (2014). "Breast Cancer Treatment". Consultado o 29 de xuño de 2014.
- ↑ 9,0 9,1 International Agency for Research on Cancer (2008). "World Cancer Report" (PDF). Arquivado dende o orixinal (PDF) o 20 de xullo de 2011. Consultado o 26 de febreiro de 2011.
- ↑ 10,0 10,1 Organización Mundial da Saúde, ed. (2014). World Cancer Report 2014. pp. Capítulo 1.1. ISBN 92-832-0429-8.
- ↑ National Cancer Institute (2014). "Male Breast Cancer Treatment". Consultado o 29 de xuño de 2014.
- ↑ 12,0 12,1 12,2 Merck Manual (2003). "Breast Disorders: Breast Cancer". Consultado o 5 de febreiro de 2008.
- ↑ Liga Portuguesa contra o Cancro (2015). "Sinais e sintomas do cancro da mama". Arquivado dende o orixinal o 09 de setembro de 2015. Consultado o 23 de agosto de 2015.
- ↑ Watson, M (2008). "Assessment of suspected cancer". InnoAiT 1 (2). pp. 94–107. doi:10.1093/innovait/inn001.
- ↑ Lacroix, M (2006). Bioscientifica, ed. "Significance, detection and markers of disseminated breast cancer cells". Endocrine-related Cancer 13 (4): 1033–67. PMID 17158753. doi:10.1677/ERC-06-0001.
- ↑ Karakas, C (2011). "Paget's disease of the breast". Journal of carcinogenesis 10: 31. PMC 3263015. PMID 22279416. doi:10.4103/1477-3163.90676.
- ↑ Finocchi, L; Covarelli P, Rulli A, Servoli A, Noya G (2008). "Bilateral phylloid cystosarcoma of the breast: a case report and review of the literature". Chirurgia Italiana 60: 867–872. PMID 19256279.
- ↑ National Cancer Institute (2004). "Metastatic Cancer: Questions and Answers". Arquivado dende o orixinal o 27 de agosto de 2008. Consultado o 6 de febreiro de 2008.
- ↑ 19,0 19,1 American Cancer Society (2007). "Cancer Facts & Figures 2007" (PDF). Arquivado dende o orixinal (PDF) o 10 de abril de 2007. Consultado o 26 de abril de 2007.
- ↑ eMedicine (2006). "Breast Cancer Evaluation". Arquivado dende o orixinal o 12 de febreiro de 2008. Consultado o 5 de febreiro de 2008.
- ↑ McCann, Judith A. Shilling (2008). Lippincott Williams & Wilkins, ed. Nursing. Ambler. p. 99. ISBN 978-1-58255-668-0.
- ↑ Merck Manual (2003). "Breast Disorders: Overview of Breast Disorders". Arquivado dende o orixinal o 03 de outubro de 2011. Consultado o 5 de febreiro de 2008.
- ↑ 23,0 23,1 23,2 Hayes, James; Ricahrdson, Ann; Frampton, Chris (2013). "Population attributable risks for modifiable lifestyle factors and breast cancer in New Zealand women". IMJ 43 (11): 1198–1204. PMID 23910051. doi:10.1111/imj.12256.
- ↑ Reeder, JG; Vogel VG (2008). "Breast cancer prevention.". Cancer treatment and research 141: 149–64. PMID 18274088. doi:10.1007/978-0-387-73161-2_10.
- ↑ Collaborative Group on Hormonal Factors in Breast Cancer (2002). "Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease.". Lancet 360 (9328): 187–95. doi:10.1016/S0140-6736(02)09454-0.
- ↑ Yager, JD; Davidson NE (2006). "Estrogen carcinogenesis in breast cancer". New Engl J Med 354 (3): 270–82. PMID 16421368. doi:10.1056/NEJMra050776.
- ↑ Carroll, KK (1998). "Obesity as a risk factor for certain types of cancer". Lipids 33 (11): 1055–1059. doi:10.1007/s11745-998-0305-8.
- ↑ Johnson, KC; Miller AB, Collishaw NE, Palmer JR, Hammond SK, Salmon AG, Cantor KP, Miller MD, Boyd NF, Millar J, Turcotte F (2011). "Active smoking and secondhand smoke increase breast cancer risk: the report of the Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk (2009).". Tobacco control 20 (1): e2. PMID 21148114. doi:10.1136/tc.2010.035931.
- ↑ Lee, IM; Shiroma EJ, Lobelo F, Puska P, Blair SN, Katzmarzyk PT (2012). "Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy". The Lancet 380 (9838): 219–29. PMC 3645500. PMID 22818936. doi:10.1016/S0140-6736(12)61031-9.
- ↑ Biswas, A; Oh PI, Faulkner GE, Bajaj RR, Silver MA, Mitchell MS, Alter DA (2015). "Sedentary Time and Its Association With Risk for Disease Incidence, Mortality, and Hospitalization in Adults: A Systematic Review and Meta-analysis". Annals of Internal Medicine 162 (2): 123–32. PMID 25599350. doi:10.7326/M14-1651.
- ↑ Blackburn, GL; Wang KA (2007). "Dietary fat reduction and breast cancer outcome: results from the Women's Intervention Nutrition Study (WINS).". The American journal of clinical nutrition 86 (3): s878–81. PMID 18265482.
- ↑ Boffetta, P; Hashibe M, La Vecchia C, Zatonski W, Rehm J (2006). "The burden of cancer attributable to alcohol drinking". International Journal of Cancer 119 (4): 884–7. PMID 16557583. doi:10.1002/ijc.21903.
- ↑ Kaiser, J (2013). "Cancer. Cholesterol forges link between obesity and breast cancer.". Science 342 (6162): 1028. PMID 24288308. doi:10.1126/science.342.6162.1028.
- ↑ Aceves, C; Anguiano B, Delgado G (2005). "Is iodine a gatekeeper of the integrity of the mammary gland?". Journal of Mammary Gland Biology and Neoplasia 10 (2): 189–96. PMID 16025225. doi:10.1007/s10911-005-5401-5.
- ↑ 35,0 35,1 American Cancer Society (2005). "Breast Cancer Facts & Figures 2005–2006" (PDF). Arquivado dende o orixinal (PDF) o 13 de xuño de 2007. Consultado o 26 de abril de 2007.
- ↑ Wang, XS; Armstrong ME, Cairns BJ, Key TJ, Travis RC (2011). "Shift work and chronic disease: the epidemiological evidence.". Occupational medicine (Oxford, England) 61 (2): 78–89. PMC 3045028. PMID 21355031. doi:10.1093/occmed/kqr001.
- ↑ Brody, JG; Rudel RA, Michels KB, Moysich KB, Bernstein L, Attfield KR, Gray S (2007). "Environmental pollutants, diet, physical activity, body size, and breast cancer: where do we stand in research to identify opportunities for prevention?". Cancer 109 (12 Suppl): 2627–34. PMID 17503444. doi:10.1002/cncr.22656.
- ↑ Ferro, Roberto (2012). "Pesticides and Breast Cancer". Advances in Breast Cancer Research 1 (3): 30–35. doi:10.4236/abcr.2012.13005.
- ↑ Hendrick, RE (2010). "Radiation doses and cancer risks from breast imaging studies.". Radiology 257 (1): 246–53. PMID 20736332. doi:10.1148/radiol.10100570.
- ↑ Kahlenborn, C; Modugno F, Potter DM, Severs WB (2006). "Oral contraceptive use as a risk factor for premenopausal breast cancer: a meta-analysis.". Mayo Clinic proceedings 81 (10): 1290–302. PMID 17036554. doi:10.4065/81.10.1290.
- ↑ 41,0 41,1 Casey, PM; Cerhan JR, Pruthi S (2008). "Oral contraceptive use and risk of breast cancer.". Mayo Clinic proceedings 83 (1): 86–90. PMID 18174010. doi:10.4065/83.1.86.
- ↑ Iodice, S; Barile M, Rotmensz N, Feroce I, Bonanni B, Radice P, Bernard L, Maisonneuve P, Gandini S (2010). "Oral contraceptive use and breast or ovarian cancer risk in BRCA1/2 carriers: a meta-analysis.". European journal of cancer 46 (12): 2275–84. PMID 20537530. doi:10.1016/j.ejca.2010.04.018.
- ↑ Gaffield, ME; Culwell KR, Ravi A (2009). "Oral contraceptives and family history of breast cancer.". Contraception 80 (4): 372–80. PMID 19751860. doi:10.1016/j.contraception.2009.04.010.
- ↑ Cavalieri E, Chakravarti D, Guttenplan J, Hart E, Ingle J, Jankowiak R, Muti P, Rogan E, Russo J, Santen R, Sutter T (agosto de 2006). "Catechol estrogen quinones as initiators of breast and other human cancers: implications for biomarkers of susceptibility and cancer prevention". Biochimica et Biophysica Acta 1766 (1): 63–78. PMID 16675129. doi:10.1016/j.bbcan.2006.03.001.
- ↑ Yang, L; Jacobsen KH (2008). "A systematic review of the association between breastfeeding and breast cancer.". Journal of Women's Health 17 (10): 1635–45. PMID 19049358. doi:10.1089/jwh.2008.0917.
- ↑ Russo, J; Russo IH (1980). "Susceptibility of the mammary gland to carcinogenesis. II. Pregnancy interruption as a risk factor in tumor incidence". Am J Pathol 100 (2): 505–506. PMC 1903536. PMID 6773421.
In contrast, abortion is associated with increased risk of carcinomas of the breast. The explanation for these epidemiologic findings is not known, but the parallelism between the DMBA-induced rat mammary carcinoma model and the human situation is striking. ... Abortion would interrupt this process, leaving in the gland undifferentiated structures like those observed in the rat mammary gland, which could render the gland again susceptible to carcinogenesis.
- ↑ Beral, V; Bull D, Doll R, Peto R, Reeves G (2004). "Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83?000 women with breast cancer from 16 countries.". Lancet 363 (9414): 1007–16. PMID 15051280. doi:10.1016/S0140-6736(04)15835-2.
- ↑ 48,0 48,1 48,2 Gage, M; Wattendorf D, Henry LR (2012). "Translational advances regarding hereditary breast cancer syndromes". Journal of surgical oncology 105 (5): 444–51. PMID 22441895. doi:10.1002/jso.21856.
- ↑ 49,0 49,1 Pasche, Boris (2010). Springer, ed. Cancer Genetics (Cancer Treatment and Research). Berlín. pp. 19–20. ISBN 1-4419-6032-5.
- ↑ "Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease.". Lancet 358 (9291): 1389–99. 2001. PMID 11705483. doi:10.1016/S0140-6736(01)06524-2.
- ↑ Nelson, HD; Zakher B, Cantor A, Fu R, Griffin J, O'Meara ES, Buist DS, Kerlikowske K, van Ravesteyn NT, Trentham-Dietz A, Mandelblatt JS, Miglioretti DL (2012). "Risk factors for breast cancer for women aged 40 to 49 years: a systematic review and meta-analysis.". Annals of Internal Medicine 156 (9): 635–48. PMC 3561467. PMID 22547473. doi:10.1059/0003-4819-156-9-201205010-00006.
- ↑ Kouros-Mehr H, Kim JW, Bechis SK, Werb Z (abril de 2008). "GATA-3 and the regulation of the mammary luminal cell fate.". Current opinion in cell biology 20 (2): 164–70. PMC 2397451. PMID 18358709. doi:10.1016/j.ceb.2008.02.003.
- ↑ Afonso, N; Bouwman D (2008). "Lobular carcinoma in situ". Eur. J. Cancer Prev. 17 (4): 312–6. PMID 18562954. doi:10.1097/CEJ.0b013e3282f75e5d.
- ↑ Anothaisintawee, T; Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, Hirunpat S, Woodtichartpreecha P, Boonlikit S, Teerawattananon Y, Thakkinstian A (2013). "Risk factors of breast cancer: a systematic review and meta-analysis". Asian Pacific Journal of Public Health 25 (5): 368–387. PMID 23709491. doi:10.1177/1010539513488795.
- ↑ 55,0 55,1 55,2 55,3 Ribeiro, Joana Inácio (2014). Faculdade de Ciências e Tecnologias da Saúde, ed. Carcinoma mamário: estado da arte (PDF). Lisboa.
- ↑ Adrian Lee; Carlos Arteaga (14 de decembro de 2009). 32nd Annual CTRC-AACR San Antonio Breast Cancer Symposium: Sunday Morning Year-End Review (PDF). Arquivado dende o orixinal (PDF) o 13 de agosto de 2013. Consultado o 03 de abril de 2018.
- ↑ Williams C, Edvardsson K, Lewandowski SA, Stram A, Gustafsson JA. (2008). "A genome-wide study of the repressive effects of estrogen receptor beta on estrogen receptor alpha signaling in breast cancer cells.". Oncogene (27): 1019–1032.
- ↑ Dias, Ana Margarida de Azevedo (2010). Faculdade de Farmácia da Universidade do Porto, ed. Inibidores da aromatase e cancro da mama: Avaliação biológica de novas moléculas esteroides.
- ↑ Cunha S, Gano L, Morais GR, Thiemann T, Oliveira MC (2013). "Progesterone receptor targeting with radiolabelled steroids: an approach in predicting breast cancer response to therapy". J Steroid Biochem Mol Biol. (137): 223–41. doi:10.1016/j.jsbmb.2013.04.003.
- ↑ Saudade André, Ana Raquel Tomás, Ricardo Fonseca (2005). "Carcinoma da Mama: Determinação da Amplificação do HER2 por Hibridação in situ de Fluorescência (FISH)". Acta Med Port (18): 417–422.
- ↑ Haslam SZ, Woodward TL (xuño de 2003). "Host microenvironment in breast cancer development: epithelial-cell-stromal-cell interactions and steroid hormone action in normal and cancerous mammary gland.". Breast Cancer Res. 5 (4): 208–15. PMC 165024. PMID 12817994. doi:10.1186/bcr615.
- ↑ Wiseman BS, Werb Z (maio de 2002). "Stromal effects on mammary gland development and breast cancer". Science 296 (5570): 1046–9. PMC 2788989. PMID 12004111. doi:10.1126/science.1067431.
- ↑ Jardé T, Perrier S, Vasson MP, Caldefie-Chézet F (xaneiro de 2011). "Molecular mechanisms of leptin and adiponectin in breast cancer". Eur. J. Cancer 47 (1): 33–43. PMID 20889333. doi:10.1016/j.ejca.2010.09.005.
- ↑ Dunning AM, Healey CS, Pharoah PD, Teare MD, Ponder BA, Easton DF (outubro de 1999). "A systematic review of genetic polymorphisms and breast cancer risk". Cancer Epidemiology, Biomarkers & Prevention 8 (10): 843–54. PMID 10548311.
- ↑ Begg CB, Haile RW, Borg A, Malone KE, Concannon P, Thomas DC, Langholz B, Bernstein L, Olsen JH, Lynch CF, Anton-Culver H, Capanu M, Liang X, Hummer AJ, Sima C, Bernstein JL (xaneiro de 2008). "Variation of breast cancer risk among BRCA1/2 carriers". JAMA 299 (2): 194–201. PMC 2714486. PMID 18182601. doi:10.1001/jama.2007.55-a.
- ↑ Patel KJ, Yu VP, Lee H, Corcoran A, Thistlethwaite FC, Evans MJ, Colledge WH, Friedman LS, Ponder BA, Venkitaraman AR (febreiro de 1998). "Involvement of Brca2 in DNA repair". Mol. Cell 1 (3): 347–57. PMID 9660919. doi:10.1016/S1097-2765(00)80035-0.
- ↑ Marietta C, Thompson LH, Lamerdin JE, Brooks PJ (maio de 2009). "Acetaldehyde stimulates FANCD2 monoubiquitination, H2AX phosphorylation, and BRCA1 phosphorylation in human cells in vitro: implications for alcohol-related carcinogenesis". Mutat. Res. 664 (1–2): 77–83. PMC 2807731. PMID 19428384. doi:10.1016/j.mrfmmm.2009.03.011.
- ↑ Theruvathu JA, Jaruga P, Nath RG, Dizdaroglu M, Brooks PJ (2005). "Polyamines stimulate the formation of mutagenic 1,N2-propanodeoxyguanosine adducts from acetaldehyde". Nucleic Acids Res. 33 (11): 3513–20. PMC 1156964. PMID 15972793. doi:10.1093/nar/gki661.
- ↑ Wooster R, Weber BL (xuño de 2003). "Breast and ovarian cancer". N. Engl. J. Med. 348 (23): 2339–47. PMID 12788999. doi:10.1056/NEJMra012284.
- ↑ 70,0 70,1 70,2 70,3 70,4 70,5 70,6 70,7 70,8 American Society of Clinical Oncology, ed. (febreiro de 2016). "Diagnosis". Consultado o 29 de maio de 2016.
- ↑ Saslow, D; Hannan J, Osuch J, Alciati MH, Baines C, Barton M, Bobo JK, Coleman C, Dolan M, Gaumer G, Kopans D, Kutner S, Lane DS, Lawson H, Meissner H, Moorman C, Pennypacker H, Pierce P, Sciandra E, Smith R, Coates R (2004). "Clinical breast examination: practical recommendations for optimizing performance and reporting". CA: a cancer journal for clinicians 54 (6): 327–344. PMID 15537576. doi:10.3322/canjclin.54.6.327.
- ↑ 72,0 72,1 72,2 Yu, YH; Liang C, Yuan XZ (2010). "Diagnostic value of vacuum-assisted breast biopsy for breast carcinoma: a meta-analysis and systematic review.". Breast cancer research and treatment 120 (2): 469–79. PMID 20130983. doi:10.1007/s10549-010-0750-1.
- ↑ Carlson, RW; Allred DC, Anderson BO, Burstein HJ, Carter WB, Edge SB, Erban JK, Farrar WB, Goldstein LJ, Gradishar WJ, Hayes DF, Hudis CA, Jahanzeb M, Kiel K, Ljung BM, Marcom PK, Mayer IA, McCormick B, Nabell LM, Pierce LJ, Reed EC, Smith ML, Somlo G, Theriault RL, Topham NS, Ward JH, Winer EP, Wolff AC (2009). "Breast cancer. Clinical practice guidelines in oncology". Journal of the National Comprehensive Cancer Network : JNCCN 7 (2): 122–192. PMID 19200416.
- ↑ 74,0 74,1 74,2 74,3 American Cancer Society, ed. (4 de maio de 2016). "How is breast cancer classified?". Arquivado dende o orixinal o 22 de xuño de 2016. Consultado o 21 de xuño de 2016.
- ↑ 75,0 75,1 75,2 Li CI; Uribe DJ; Daling JR (2005). "Clinical characteristics of different histologic types of breast cancer.". Br J Cancer 93 (9): 1046. doi:10.1038/sj.bjc.6602787.
- ↑ Merck Manual (2015). "Breast Cancer". Consultado o 26 de agosto de 2015.
- ↑ 77,0 77,1 American Society of Clinical Oncology, ed. (febreiro de 2016). "Overview". Consultado o 30 de maio de 2016.
- ↑ Elston, CW; Ellis IO (1991). "Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up". Histopathology 19 (5): 403–10. PMID 1757079. doi:10.1111/j.1365-2559.1991.tb00229.x.
- ↑ Bouche, Gauthier; Piccart, Martine; Pestalozzi, Bernhard; Catane, Raphael (2013). Anticancer Fund, ed. Cancro da Mama: Um Guia Para o Doente (PDF) (3ª ed.). p. 12. Arquivado dende o orixinal (PDF) o 06 de setembro de 2015. Consultado o 05 de abril de 2018.
- ↑ Magno Belém Cirqueira, Marise Amaral Rebouças Moreira, Leonardo Ribeiro Soares, Ruffo Freitas-Júnior (2011). "Subtipos moleculares do câncer de mama" (PDF). FEMINA (revisão) 39 (10): 499–503.
- ↑ 81,0 81,1 81,2 81,3 American Society of Clinical Oncology, ed. (febreiro de 2016). "Breast Cancer: Stages". Consultado o 19 de maio de 2016.
- ↑ 82,0 82,1 American Society of Clinical Oncology, ed. (febreiro de 2016). "Breast Cancer: Stages". Consultado o 9 de maio de 2016.
- ↑ 83,0 83,1 Cancer Research UK (ed.). "Breast Cancer Staging". Arquivado dende o orixinal o 16 de maio de 2016. Consultado o 19 de maio de 2016.
- ↑ 84,0 84,1 Marmot, M; Atinmo, T; Byers, T; Chen, J; Hirohata, T; Jackson, A; James, W; Kolonel, L; Kumanyika, S; Leitzmann, C; Mann, J; Powers, H; Reddy, K; Riboli, E; Rivera, JA; Schatzkin, A; Seidell, J; Shuker, D; Uauy, R; Willett, W; Zeisel, S (2007). AICR, ed. Food, Nutrition, Physical Activity, and the Prevention of Cancer: A Global Perspective (PDF). World Cancer Research Fund / American Institute for Cancer Research (AICR) Expert Reports 2. Washington, DC. ISBN 9780972252225. Arquivado dende o orixinal (PDF) o 07 de maio de 2016. Consultado o 06 de abril de 2018.
- ↑ Eliassen, AH; Hankinson SE, Rosner B, Holmes MD, Willett WC (2010). "Physical activity and risk of breast cancer among postmenopausal women". Arch. Intern. Med. 170 (19): 1758–64. PMC 3142573. PMID 20975025. doi:10.1001/archinternmed.2010.363.
- ↑ Zheng, JS; Hu XJ, Zhao YM, Yang J, Li D (2013). "Intake of fish and marine n-3 polyunsaturated fatty acids and risk of breast cancer: meta-analysis of data from 21 independent prospective cohort studies". BMJ 346: f3706. PMID 23814120. doi:10.1136/bmj.f3706.
- ↑ Wu, AH; Yu, MC; Tseng, CC; Pike, MC (2008). "Epidemiology of soy exposures and breast cancer risk.". British journal of cancer 98 (1): 9–14. PMID 18182974. doi:10.1038/sj.bjc.6604145.
- ↑ Hartmann, LC; Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB (1999). "Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer". N Engl J Med 340 (2): 77–84. PMID 9887158. doi:10.1056/NEJM199901143400201.
- ↑ Meijers-Heijboer, H; van Geel B, van Putten WL, Henzen-Logmans SC, Seynaeve C, Menke-Pluymers MB, Bartels CC, Verhoog LC, van den Ouweland AM, Niermeijer MF, Brekelmans CT, Klijn JG (2001). "Breast cancer after prophylactic bilateral mastectomy in women with BRCA1 and BRCA2 mutations". N Engl J Med 345 (3): 159–164. PMID 11463009. doi:10.1056/NEJM200107193450301.
- ↑ Lostumbo, L; Carbine, NE; Wallace, J (2010). "Prophylactic mastectomy for the prevention of breast cancer.". The Cochrane database of systematic reviews (11): CD002748. PMID 21069671. doi:10.1002/14651858.CD002748.pub3.
- ↑ Moyer, VA; U.S. Preventive Services Task Force (2013). "Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement". Annals of Internal Medicine 160: 271–281. doi:10.7326/M13-2747.
- ↑ Nelson, HD; Smith ME, Griffin JC, Fu R (2013). "Use of medications to reduce risk for primary breast cancer: a systematic review for the U.S. Preventive Services Task Force.". Annals of Internal Medicine 158 (8): 604–14. PMID 23588749. doi:10.7326/0003-4819-158-8-201304160-00005.
- ↑ 93,0 93,1 Cuzick, J; Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL (2013). "Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data". The Lancet 381 (9880): 1827–34. PMID 23639488. doi:10.1016/S0140-6736(13)60140-3.
- ↑ Moyer, VA (2013). "Medications for Risk Reduction of Primary Breast Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement.". Annals of Internal Medicine. PMID 24061472. doi:10.7326/0003-4819-159-10-201311190-00718.
- ↑ 95,0 95,1 Centers for Disease Control and Prevention. "Screening".
- ↑ American Cancer Society, ed. (4 de maio de 2016). "Can breast cancer be found early?". Arquivado dende o orixinal o 15 de xuño de 2016. Consultado o 23 de xuño de 2016.
- ↑ Biesheuvel, C; Weigel S, Heindel W (2011). "Mammography Screening: Evidence, History and Current Practice in Germany and Other European Countries.". Breast care (Basel, Switzerland) 6 (2): 104–109. PMID 21673820. doi:10.1159/000327493.
- ↑ United States Preventive Services Task Force. "Breast Cancer: Screening". Arquivado dende o orixinal o 16 de xuño de 2013. Consultado o 28 de agosto de 2015.
- ↑ WebMD. "Breast Cancer and Mammograms". Consultado o 24 de decembro de 2012.
- ↑ Croswell JM, Kramer BS, Kreimer AR (2009). "Cumulative incidence of false-positive results in repeated, multimodal cancer screening". Annals of Family Medicine 7 (3): 212–22. PMC 2682972. PMID 19433838. doi:10.1370/afm.942.
- ↑ Smith-Bindman R, Ballard-Barbash R, Miglioretti DL, Patnick J, Kerlikowske K (2005). "Comparing the performance of mammography screening in the USA and the UK". Journal of Medical Screening 12 (1): 50–4. PMID 15814020. doi:10.1258/0969141053279130.
- ↑ Welch, H Gilbert (2006). "Ramifications of screening for breast cancer". British Medical Journal 332 (7543). PMC 1410868. doi:10.1136/bmj.332.7543.727.
- ↑ Aschwanden, Christie (2007). Los Angeles Times, ed. "The trouble with mammograms". Consultado o 3 de setembro de 2015.
- ↑ "Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement.". Annals of internal medicine 151 (10): 716–26, W–236. 2009. PMID 19920272. doi:10.1059/0003-4819-151-10-200911170-00008. Arquivado dende o orixinal o 02 de xaneiro de 2013. Consultado o 03 de abril de 2018.
- ↑ Kösters, JP; Gøtzsche PC (2003). "Regular self-examination or clinical examination for early detection of breast cancer.". Cochrane Database Syst Rev (2): CD003373. PMID 12804462. doi:10.1002/14651858.CD003373.
- ↑ Nelson HD, Tyne K, Naik A; et al. (2009). Agency for Healthcare Research and Quality (US), ed. Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force. Rockville.
- ↑ Kösters JP, Gøtzsche PC (2003). "Regular self-examination or clinical examination for early detection of breast cancer". Cochrane Database Syst Rev (2): CD003373. PMID 12804462. doi:10.1002/14651858.CD003373.
- ↑ José Agostinho Santos (2013). "Auto-exame da mama no rastreio do cancro mamário: soma-se a evidência, apaga-se a incerteza" (PDF). Acta Obstet Ginecol Port 7 (2): 113–117.
- ↑ Saslow D, Hannan J, Osuch J; et al. (2004). "Clinical breast examination: practical recommendations for optimizing performance and reporting". CA Cancer J Clin 54 (6): 327–44. PMID 15537576. doi:10.3322/canjclin.54.6.327.
- ↑ Nelson HD, Tyne K, Naik A; et al. (2009). Agency for Healthcare Research and Quality, ed. "Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force". Evidence Syntheses (74)..
- ↑ João Moura Pereira (ed.). Cancro da Mama: Protocolo de diagnóstico, terapêutica e seguimento (PDF). IPO Coimbra. p. 50. Arquivado dende o orixinal (PDF) o 04 de agosto de 2016. Consultado o 07 de abril de 2018.
- ↑ Welch, HG, Passow HJ (2013). "Quantifying the Benefits and Harms of Screening Mammography.". JAMA internal medicine 174 (3): 448–54. PMID 24380095. doi:10.1001/jamainternmed.2013.13635.
- ↑ 113,0 113,1 Gøtzsche, PC; Nielsen M (2011). "Screening for breast cancer with mammography". Cochrane Database Syst Rev (1): CD001877. PMID 21249649. doi:10.1002/14651858.CD001877.pub4.
- ↑ 114,0 114,1 114,2 114,3 American Society of Clinical Oncology, ed. (febreiro de 2016). "Breast Cancer - Treatment Options". Consultado o 9 de maio de 2016.
- ↑ Saini, KS; Taylor C, Ramirez AJ, Palmieri C, Gunnarsson U, Schmoll HJ, Dolci SM, Ghenne C, Metzger-Filho O, Skrzypski M, Paesmans M, Ameye L, Piccart-Gebhart MJ, de Azambuja E (2011). "Role of the multidisciplinary team in breast cancer management: results from a large international survey involving 39 countries". Annals of Oncology 23 (4): 853–9. PMID 21821551. doi:10.1093/annonc/mdr352.
- ↑ American Society of Clinical Oncology (ed.). "Breast Cancer Treatment". Consultado o 27 de xuño de 2016.
- ↑ Massarut, S; Baldassare G, Belleti B, Reccanello S, D'Andrea S, Ezio C, Perin T, Roncadin M, Vaidya JS (2006). "Intraoperative radiotherapy impairs breast cancer cell motility induced by surgical wound fluid". J Clin Oncol 24 (18S): 10611. Arquivado dende o orixinal o 12 de xaneiro de 2012. Consultado o 09 de abril de 2018.
- ↑ Belletti, B; Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, Berton S, Perin T, Candiani E, Reccanello S, Veronesi A, Canzonieri V, Trovò MG, Zaenker KS, Colombatti A, Baldassarre G, Massarut S (2008). "Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding". Clin. Cancer Res. 14 (5): 1325–32. PMID 18316551. doi:10.1158/1078-0432.CCR-07-4453.
- ↑ Vaidya, JS; Joseph DJ, Tobias JS, Bulsara M, Wenz F, Saunders C, Alvarado M, Flyger HL, Massarut S, Eiermann W, Keshtgar M, Dewar J, Kraus-Tiefenbacher U, Sütterlin M, Esserman L, Holtveg HM, Roncadin M, Pigorsch S, Metaxas M, Falzon M, Matthews A, Corica T, Williams NR, Baum M (2010). "Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomised, non-inferiority phase 3 trial". Lancet 376 (9735): 91–102. PMID 20570343. doi:10.1016/S0140-6736(10)60837-9.
- ↑ Burstein, HJ; Temin, S; Anderson, H; Buchholz, TA; Davidson, NE; Gelmon, KE; Giordano, SH; Hudis, CA; Rowden, D; Solky, AJ; Stearns, V; Winer, EP; Griggs, JJ (2014). "Adjuvant Endocrine Therapy for Women With Hormone Receptor-Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Focused Update.". Journal of clinical oncology : official journal of the American Society of Clinical Oncology 32 (21): 2255–69. PMID 24868023. doi:10.1200/JCO.2013.54.2258.
- ↑ Bao, Ting; Rudek, Michelle A (2011). "The Clinical Pharmacology of Anastrozole". European Oncology & Haematology 7 (2): 106–8. doi:10.17925/EOH.2011.07.02.106. Arquivado dende o orixinal o 19 de abril de 2012. Consultado o 09 de abril de 2018.
- ↑ EBCTCG, Early Breast Cancer Trialists' Collaborative Group (2015). "Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials". The Lancet. doi:10.1016/S0140-6736(15)61074-1.
- ↑ Petit, T; Dufour P, Tannock I (2011). "A critical evaluation of the role of aromatase inhibitors as adjuvant therapy for postmenopausal women with breast cancer". Endocr. Relat. Cancer 18 (3): R79–89. PMID 21502311. doi:10.1530/ERC-10-0162.
- ↑ Pereira, João Moura; et al. (2012). Instituto Português de Oncologia de Coimbra, ed. Cancro da Mama: Protocolo de diagnóstico, terapêutica e seguimento (PDF). Arquivado dende o orixinal (PDF) o 04 de agosto de 2016. Consultado o 07 de abril de 2018.
- ↑ Jahanzeb, M (2008). "Adjuvant trastuzumab therapy for HER2-positive breast cancer". Clin. Breast Cancer 8 (4): 324–33. PMID 18757259. doi:10.3816/CBC.2008.n.037.
- ↑ NCBI, National Center for Biotechnology Information (2015). "ERBB2 erb-b2 receptor tyrosine kinase 2 Homo sapiens (human)". Consultado o 28 de agosto de 2015.
- ↑ Herceptin.com (ed.). "Herceptin (trastuzumab) Adjuvant HER2+ Breast Cancer Therapy Pivotal Studies and Efficacy Data". Arquivado dende o orixinal o 18 de xullo de 2011. Consultado o 8 de maio de 2010.
- ↑ Breast Cancer Care UK (ed.). "Prognosis". Consultado o 27 de xuño de 2016.
- ↑ Por exemplo, un carcinoma ductal in situ que envolve toda a mama continúa a ser estado cero e a ter un excelente prognóstico, con supervivencia livre de doenza de preto de 98%.
- ↑ 130,0 130,1 130,2 Kosir, Mary Ann (2013). Manual Merck, ed. "Breast Cancer: Breast Disorders: Merck Manual Professional". Consultado o 30 de agosto de 2015.
- ↑ NCI, National Cancer Institute and the National Research Center for Women & Families (2004). "Surgery Choices for Women with Early Stage Breast Cancer" (PDF). Arquivado dende o orixinal (PDF) o 13 de agosto de 2013. Consultado o 30 de agosto de 2015.
- ↑ Gonzalez-Angulo, AM; Litton JK, Broglio KR, Meric-Bernstam F, Rakkhit R, Cardoso F, Peintinger F, Hanrahan EO, Sahin A, Guray M, Larsimont D, Feoli F, Stranzl H, Buchholz TA, Valero V, Theriault R, Piccart-Gebhart M, Ravdin PM, Berry DA, Hortobagyi GN (2009). "High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller". J. Clin. Oncol. 27 (34): 5700–6. PMC 2792998. PMID 19884543. doi:10.1200/JCO.2009.23.2025.
- ↑ Peppercorn, J (2009). "Breast Cancer in Women Under 40". Oncology 23 (6): 465–474.
- ↑ Gierach, GL; Ichikawa L, Kerlikowske K, Brinton LA, Farhat GN, Vacek PM, Weaver DL, Schairer C, Taplin SH, Sherman ME (2012). "Relationship between mammographic density and breast cancer death in the Breast Cancer Surveillance Consortium". Journal of National Cancer Institute 104 (16): 1218–27. PMID 22911616. doi:10.1093/jnci/djs327.
- ↑ Klein, Judith; Ji M, Rea NK, Stoodt G (2011). "Differences in male breast cancer stage, tumor size at diagnosis, and survival rate between metropolitan and nonmetropolitan regions". Am J Mens Health. 5 (5): 430–7. doi:10.1177/1557988311400403.
- ↑ McNaught J, Reid RL, Provencher DM (xullo de 2006). "Progesterone-only and non-hormonal contraception in the breast cancer survivor: Joint Review and Committee Opinion of the Society of Obstetricians and Gynaecologists of Canada and the Society of Gynecologic Oncologists of Canada". J Obstet Gynaecol Can 28 (7): 616–39. PMID 16924781.
- ↑ The Royal Australian and New Zealand College of Obstetricians and Gynaecologists (novembro de 2014). "Management of the menopause after breast cancer". C-Gyn 15. Arquivado dende o orixinal o 07 de abril de 2016. Consultado o 09 de abril de 2018.
- ↑ American Society of Clinical Oncology (ed.). "Self Image and Cancer". Consultado o 21 de maio de 2016.
- ↑ Pritchard, KI (2009). "Ovarian Suppression/Ablation in Premenopausal ER-Positive Breast Cancer Patients". Oncology 23 (1).
- ↑ American Society of Clinical Oncology (ed.). "Anxiety". Consultado o 21 de maio de 2016.
- ↑ OMS, Organização Mundial de Saúde (201). "WHO Disease and injury country estimates". Consultado o 30 de agosto de 2015.
- ↑ 142,0 142,1 Organización Mundial da Saúde (ed.). "Breast cancer burden". Arquivado dende o orixinal o 06 de setembro de 2015. Consultado o 18 de maio de 2016.
- ↑ OMS, Organización Mundial da Saúde (2012). Who.int, ed. "Breast Cancer: Estimated Incidence, Mortality and Prevalence Worldwide in 2012". Consultado o 30 de agosto de 2015.
- ↑ Laurance, Jeremy (29 de setembro de 2006). The Independent, ed. "Breast cancer cases rise 80% since Seventies". London. Arquivado dende o orixinal o 25 de abril de 2008. Consultado o 9 de outubro de 2006.
- ↑ Imaginis Corporation, ed. (2006). "Breast Cancer: Statistics on Incidence, Survival, and Screening". Arquivado dende o orixinal o 24 de outubro de 2006. Consultado o 9 de outubro de 2006.
- ↑ Breast Cancer: Breast Cancer in Young Women WebMD. Consultado o 9 de setembro de 2009
- ↑ Nearly 85% of women diagnosed with breast cancer now survive for 5 year or more Office for National Statistics, 2013
- ↑ McGuire, A; Brown, JA; Malone, C; McLaughlin, R; Kerin, MJ (22 de maio de 2015). "Effects of age on the detection and management of breast cancer.". Cancers 7 (2): 908–29. PMC 4491690. PMID 26010605. doi:10.3390/cancers7020815.
- ↑ Cancer Stat Facts: Female Breast Cancer, U.S. National Cancer Institute, consultado o 16 de febreiro de 2018
- ↑ 150,0 150,1 Aronowitz, Robert A. (2007). Unnatural history: breast cancer and American society. Cambridge: Cambridge University Press. pp. 22–24. ISBN 0-521-82249-1.
- ↑ 151,0 151,1 Olson, James Stuart (2002). Bathsheba's breast: women, cancer & history. Baltimore: The Johns Hopkins University Press. pp. 9–13. ISBN 0-8018-6936-6.
- ↑ Reuters (2015). "Oldest evidence of breast cancer found in Egyptian skeleton". Arquivado dende o orixinal o 27 de marzo de 2015. Consultado o 25 de marzo de 2015.
- ↑ 153,0 153,1 Olson 2002, pp. 32–33
- ↑ Yalom, Marilyn (1997). A history of the breast. Nova York: Alfred A. Knopf. p. 234. ISBN 0-679-43459-3.
- ↑ 155,0 155,1 155,2 155,3 155,4 Olson 2002, pp. 102–6
- ↑ Olson 2002, p. 1
- ↑ Lacroix, Marc (2011). A Concise History of Breast Cancer. Estados Unidos: Nova Science Publishers. pp. 59–68. ISBN 978-1-61122-305-7.
- ↑ Sulik, Gayle A. (2010). Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health. Oxford University Press. pp. 200–3. ISBN 0-19-974045-3. OCLC 535493589.
- ↑ Rettig, Richard A.; Peter D. Jacobson, Cynthia M. Farquhar, Wade M. Aubry (2007). False Hope: Bone Marrow Transplantation for Breast Cancer. Nova York: Oxford University Press. ISBN 978-0-19-518776-2.
- ↑ Sulik 2010, pp. 37–38
- ↑ Sulik 2010, p. 4
- ↑ Riter, Bob (2010). Cancer Resource Center of the Finger Lakes, ed. "History of Breast Cancer Advocacy". Arquivado dende o orixinal o 23 de xuño de 2013. Consultado o 29 de xuño de 2013.
- ↑ "Cáncer de Mama Mestatásico: el cáncer invisible". sespm.es. Consultado o 7 de xullo de 2021.
- ↑ Sulik 2010, pp. 27–72
- ↑ Sulik 2010, pp. 359–361
- ↑ Sulik 2010, pp. 366–8
- ↑ Landeman, Anne (2001). Center for Media and Democracy, ed. "Pinkwashing: Can Shopping Cure Breast Cancer?".
- ↑ Sulik 2010, pp. 365–6
- ↑ Sulik 2010, pp. 372–4
- ↑ Browne, Anthony (2001). The Guardian, ed. "Cancer bias puts breasts first". Londres.
- ↑ Arnst, Catherine (2007). Bloomberg Businessweek, ed. "A Gender Gap in Cancer". ISSN 0007-7135.
- ↑ Olson 2002, pp. 199–200
- ↑ Ramon Luengo-Fernandez, Jose Leal, Alastair Gray, Richard Sullivan (2013). "Economic burden of cancer across the European Union: a population-based cost analysis". The Lancet Oncology 14 (12): 1165–1174. doi:10.1016/S1470-2045(13)70442-X.
- ↑ 174,0 174,1 Araújo, Andreia Monteiro; Centeno, Mónica (2010). "Cancro da mama associado à gravidez" (PDF). Acta Obstet Ginecol Port 4 (1): 44–52.
- ↑ Azim, HA; Santoro, L; Russell-Edu, W; Pentheroudakis, G; Pavlidis, N; Peccatori, FA (2012). "Prognosis of pregnancy-associated breast cancer: a meta-analysis of 30 studies.". Cancer treatment reviews 38 (7): 834–42. PMID 22785217.
- ↑ 176,0 176,1 Yarbro, Connie Henke; Wujcik, Debra; Gobel, Barbara Holmes (2011). Cancer nursing: principles and practice (7ª ed.). Jones & Bartlett Publishers. pp. 901–905. ISBN 978-1-4496-1829-2.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Cancro de mama |

