Leptina

Leptina
| |
| Identificadores | |
| Símbolo | LEP |
| Símbolos alt. | OB; OBS; FLJ94114 |
| Entrez | 3952 |
| HUGO | 6553 |
| OMIM | |
| RefSeq | NM_000230 |
| UniProt | P41159 |
| Outros datos | |
| Locus | Cr. 7 q31 |
Receptor de leptina (OB-R)
| |
| Identificadores | |
| Símbolo | LEPR |
| Símbolos alt. | OBR; CD295 |
| Entrez | 3953 |
| HUGO | 6554 |
| OMIM | |
| RefSeq | NM_002303 |
| UniProt | P48357 |
| Outros datos | |
| Locus | Cr. 1 p31 |

A leptina (do grego λεπτός leptos 'delgado') é unha hormona polipeptídica de 16 kDa que desempeña un importante papel na regulación da captación e consumo de enerxía no organismo, incluíndo a regulación do apetito e o metabolismo. É unha das hormonas máis importantes segregadas polo tecido adiposo.[2] Nos humanos o xene da leptina é o Ob(Lep) (Ob de obeso, Lep de leptina), que está localizado no cromosoma 7.[3]
Descubrimento
[editar | editar a fonte]Os efectos da leptina observáronse ao estudar ratos obesos mutantes que se orixinaron aleatoriamente nunha colonia de ratos do Laboratorio Jackson en 1950.[4] Estes ratos eran moi obesos e alimentábanse en exceso. Finalmente, encontráronse varias estirpes de ratos de laboratorio que eran homocigotas para mutacións dun só xene que lles causaba a obesidade, e podían ser de dúas clases: "ob/ob", que tiñan mutacións no xene para a proteína leptina, e "db/db", que tiñan mutacións para o xene do receptor da leptina. Cando un rato ob/ob era tratado con inxeccións de leptina, perdían o seu exceso de graxa e volvían a ter un peso normal.
Despois do descubrimento destes ratos chegou o descubrimento da leptina. A leptina foi descuberta en 1994 por Jeffrey M. Friedman na Universidade Rockefeller e Douglas L. Coleman ao estudaren ditos ratos.[5]
Biosíntese
[editar | editar a fonte]A leptina humana é unha proteína de 167 aminoácidos. Prodúcese principalmente nos adipocitos do tecido adiposo branco, e o nivel da leptina circulante no sangue é proporcional á cantidade total de graxa corporal.
Ademais de no tecido adiposo branco, cantidades menores de leptina poden producirse no tecido adiposo castaño, placenta (no sincitiotrofoblasto), ovarios, músculo esquelético, estómago (na parte máis profunda das glándulas fúndicas), células epiteliais mamarias, medula ósea, hipófise (ou pituitaria), e fígado.[6] Tamén se descubriu que a leptina poden producila as células principais gástricas e as células P/D1 do estómago.[7]
Funcións
[editar | editar a fonte]A leptina actúa sobre receptores do hipotálamo, o que causa unha inhibición do apetito de tres maneiras: (1) contrarrestando os efectos do neuropéptido Y (un potente estimulador da alimentación segregado polas células do intestimo e hipotálamo); (2) contrarrestando os efectos da anandamida (outro potente estimulador da alimentación que se une aos mesmos receptores cá THC), e (3) promovendo a síntese de α-MSH, un supresor do apetito.
Esta inhibición do apetito a longo prazo, contrasta coa rápida inhibición do apetito causada pola colecistoquinina (CCK) e a supresión máis lenta da fame entre comidas mediada polo PYY3-36. A ausencia de leptina (ou do seu receptor) orixina unha inxesta incontrolada de comida e causa obesidade. Varios estudos indicaron que o xaxún ou seguir unha dieta moi baixa en calorías fai diminuír os niveis de leptina.[8] A curto prazo a leptina podería ser un indicador do equilibrio enerxético. Este sistema é máis sensible á fame ca á sobrealimentación; os niveis de leptina cambian máis cando a inxesta da comida decrece ca cando se incrementa.[9] A dinámica da leptina debida a un cambio agudo no equilibrio enerxético podería estar relacionada co apetito e eventualmente coa inxestión de comida. Aínda que isto é unha hipótese nova, hai xa algúns datos que a apoian.[10][11]
Hai algunha controversia con respecto á regulación da leptina pola melatonina durante a noite. Un grupo de investigación suxeriu que o aumento dos niveis de melatonina causan un decremento da leptina.[12] Pero en 2004, investigadores brasileiros atoparon que a melatonina incrementa os niveis de leptina en presenza de insulina, o que causa unha diminución do apetito durante o sono.[13]
Ratos con diabetes tipo 1 tratados con leptina só ou con leptina e insulina melloraron máis a súa saúde (o azucre sanguíneo non flutuaba tanto; os niveis de colesterol diminuíron; os ratos formaron menos graxa corporal) do que os ratos tratados só con insulina, o que abre a posibilidade dun novo tratamento para a diabetes.[14]
Sinal de adiposidade
[editar | editar a fonte]Actualmente, só a leptina e a insulina se sabe que actúan como sinal de adiposidade. En xeral,
- A leptina circula a niveis directamente proporcionais á cantidade de graxa corporal.
- Entra no sistema nervioso central en proporción á súa concentración no plasma sanguíneo.
- Os seus receptores atopáronse nas neuronas do cerebro implicadas na regulación da inxestión e gasto de enerxía.
- Controla a inxestión de enerxía actuando sobre os receptores no hipotálamo mediobasal.[15]
Interacción coa amilina
[editar | editar a fonte]A coadministración de dúas hormonas que interveñen no control do peso corporal como son a amilina (producida polas células beta do páncreas) e a leptina (producida polos adipocitos), orixina unha sostida perda de peso específica das graxas, en modelos animais de obesidade resistentes á leptina.[16]
Saciedade
[editar | editar a fonte]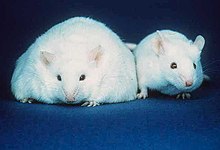
A leptina únese ás neuronas do neuropéptido Y (NPY) do núcleo arqueado facendo que decreza a actividade desas neuronas. A leptina indica ao cerebro que o corpo xa ten alimento dabondo, producindo unha sensación de saciedade. Un pequeno grupo de seres humanos posùe mutacións homocigóticas para o xene da leptina que orixinan un constante desexo de comer, causando unha severa obesidade. Esta condición pode ser tratada con certo éxito coa administración de leptina recombinante humana.[17] Porén, os amplos ensaios clínicos realizados utilizando a leptina recombinante humana como axente terapéutico para tratar a obesidade humana non foron concluíntes, porque só os suxeitos máis obesos aos que se lle dera as doses máis altas de leptina exóxena experimentaron unha perda de peso estatisticamente significativa. A conclusión foi que se necesitan doses grandes e frecuentes para proporcionar só beneficios modestos debido á baixa vida media da leptina circulante, a súa baixa potencia e escasa solubilidade. Ademais, estas inxeccións causaron que algúns participantes tivesen que abandonar o estudo debido á aparición de respostas inflamatorias na pel no lugar de inxección. Algúns destes problemas poden aliviarse usando unha forma de leptina chamada Fc-leptina, que leva un fragmento Fc da cadea de inmunoglobulina gamma fusionado no extemo N-terminal. Esta fusión Fc-leptina probouse experimentalmente que é moi soluble, máis potente bioloxicamente, e ten unha vida media no soro sanguíneo moito maior. Como resultado, comprobuse que a Fc-leptina pode tratar con éxito a obesidade tanto en ratos deficientes en leptina coma en normais, pero non se probou en seres humanos. Isto fai que a Fc-leptina sexa un tratamento potencial para a obesidade nos humanos.[18][19][20] Os niveis de leptina circulante informan ao cerebro sobre a enerxía almacenada para que poida regular o apetito e o metabolismo. A leptina funciona inhibindo a actividade das neuronas que conteñen o neuropéptido Y (NPY) e o péptido relacionado con agouti (AgRP), e incrementando a actividade das neuronas que expresan a hormona estimulante dos melanocitos α (α-MSH). As neuronas NPY son un elemento chave na regulación do apetito; a inxección de pequenas doses de neuropéptido Y no cerebro dos animais experimentais estimula a alimentación, e a destrución selectiva das neuronas NPY no rato fai que se volvan anoréxicos. Reciprocamente, a α-MSH é un mediador importante da saciedade, e as diferenzas no xene do receptor sobre o que actúa a α-MSH no cerebro están ligadas á obesidade en humanos.
Sistema circulatorio
[editar | editar a fonte]O papel da leptina e os receptores da leptina na modulación da actividade das células T no sistema inmunitario estudouse nos ratos. Modula a resposta inmune á aterosclerose, e a alteración desta regulación é un factor que predispón á aterosclerose en pacientes obesos.[21]
A leptina promove a anxioxénese ao incrementar os niveis do factor de crecemento endotelial vascular (VEGF).
Nalgúns estudos epidemiolóxicos, a hiperleptinemia considérase un factor de risco. Porén, varios experimentos recentes en animais demostraron que a hiperleptinemia sistémica producida por infusión ou pola transferencia de xenes adenoviral fai decrecer a presión sanguínea nas ratas.[22][23]
Actividade do surfactante pulmonar
[editar | editar a fonte]Nos pulmóns fetais, a leptina indúcese nos fibroblastos intersticiais alveolares ("lipofibroblastos") pola acción do PTHrP segregado polo epitelio alveolar formador (endoderma) durante o estiramento moderado. A leptina do mesénquima, á súa vez, actúa sobre o epitelio no receptor de leptina dos pneumocitos alveolares de tipo II e induce a expresión do surfactante pulmonar, o cal é unha das principais misións destes pneumocitos tipo II.[24]
Reprodución
[editar | editar a fonte]Nos ratos, a leptina requírese tamén para a fertilidade de machos e femias. A leptina ten un efecto menor nos humanos nese aspecto. Nos mamíferos, os ciclos ovulatorios nas femias están ligados ao balance de enerxía (positivo ou negativo dependendo de se a femia está gañando ou perdendo peso) e ao fluxo de enerxía (cantidade de enerxía producida e gastada) en moita maior medida ca ao estado enerxético (niveis de graxa). Cando o balance de enerxía é moi negativo (o que significa que a muller está pasando fame) ou o fluxo de enerxía é moi alto (o que significa que unha muller está facendo moitísimo exercicio, pero ao mesmo tempo consumindo calorías dabondo), os ciclos ováricos paran e as mulleres deixan de menstruar. Só se a femia ten unha porcentaxe de graxa corporal extremadamente baixa, o estado enerxético afectará á menstruación. Algúns estudos indicaron que os niveis de leptina que están fóra dun rango ideal poden ter un efecto negativo na calidade dos óvulos e no desenlace durante unha fecundación in vitro.[25]
Os adipocitos do corpo, en condicións normais, son responsables da produción constante e liberación de leptina. Esta pode tamén producirse na placenta.[26] Os niveis de leptina aumentan durante o embarazo e caen despois do parto. A leptina tamén se expresa nas membranas fetais e no tecido uterino. As contraccións uterinas son inhibidas pola leptina.[27]
Hai tamén evidencias de que a leptina xoga un papel na hiperémese gravídica (mareos matinais graves do embarazo),[28] na síndrome do ovario policístico[29] (aínda que non todos os estudos concordan) e unha investigación de 2007 suxire que a leptina hipotalámica está implicada no crecemento dos ósos.[30]
Efectos sobre os ósos
[editar | editar a fonte]O feito de que a leptina, unha hormona liberada no tecido adiposo, pode regular a masa ósea fíxose notorio no ano 2000.[31] Hoxe está ben establecido que a leptina pode afectar ao metabolismo dos ósos por sinalización directa desde o cerebro e que aínda que a leptina actúa reducindo o óso esponxoso, á vez incrementa o óso compacto. Presentáronse varias teorías sobre a dicotomía entre óso esponxoso e compacto, como unha recente teoría que di que o incremento de leptina durante a obesidade pode representar un mecanismo para aumentar o tamaño do óso e a resistencia do óso para soportar o incremento do peso corporal.[32]
O metabolismo óseo está baixo control directo do cerebro e hai fibras nerviosas no tecido óseo.[33] Atopáronse no óso varias moléculas sinalizadoras do cerebro (neuropéptidos e neurotransmisores), como a adrenalina, noradrenalina, serotonina, péptido relacionado co xene da calcitonina, péptido intestinal vasoactivo e o neuropéptido Y.[33][34] Esta evidencia apoia a existencia dun sistema de sinalización directa entre o cerebro e o óso que suxire que estas moléculas están directamente implicadas na regulación do metabolismo óseo. A leptina, unha vez liberada do tecido adiposo, pode cruzar a barreira hematoencefálica e unirse aos seus receptores no cerebro, onde actúa por medio do sistema nervioso simpático regulando o metabolismo óseo.[35] É tamén posible que, ademais dos seus efectos exercidos por mediación do cerebro, a leptina poida actuar directamente sobre as células óseas regulando o seu metabolismo. En realidade, a leptina probsblemente sinaliza ao óso a múltiples niveis. Como resultado a utilidade clínica da leptina para o tratamento das doenzas óseas permanece aberto e estase a investigar.
Importancia clínica
[editar | editar a fonte]A leptina foi considerada tradicionalmente como un vínculo entre a masa graxa corporal, a inxesta de alimentos e o gasto de enerxía. Esta idea xurdiu orixinalmente dos descubrimentos feitos en estudos con animais, pero a súa aplicación para describir o seu funcionamento en humanos foi posta en dúbida.[36] Nos humanos, hai moitos exemplos onde a leptina se afasta do seu papel estrito de comunicar o estado nutricional do corpo ao cerebro e xa non se correlaciona cos niveis de graxa corporal:
- O nivel de leptina decrece despois dun xaxún de curta duración (24–72 horas), mesmo cando non se observan cambios na masa de graxa.[37]
- En pacientes obesos con apnea do sono obstrutiva, os niveis de leptina están incrementados, pero descenden despois da aplicación dunha presión de aire nas vías aéreas continuamente positiva, que facilita a respiración.[38][39] En individuos non obesos un sono reparador (é dicir, 8–12 horas de sono ininterrompido) poden incrementar a leptina a niveis normais.
- O nivel sérico de leptina redúcese pola deprivación do sono.[40][41] Porén, un estudo recente mostrou que a deprivación do sono estaba ligada con altos niveis de leptina.
- O nivel de leptina está incrementado pola percepción de estrés emocional.[42]
- O nivel de leptina diminúecando se incrementa o de testosterona e aumenta cando se incrementa o de estróxenos.[43]
- O nivel de leptina redúcese cronicamente polo exercicio físico.[44]
Marcador inflamatorio
[editar | editar a fonte]Os factores que afectan agudamente aos niveis de leptina son tamén factores que inflúen noutros marcadores de inflamación, como testosterona, sono, estrés emocional, restrición calórica, e niveis de graxa corporal. Aínda que está ben establecido que a leptina está implicada na regulación da resposta inflamatoria,[45][46][47] teorizouse ademais que o papel da leptina como marcador inflamatorio é responder especificamente a citocinas inflamatorias derivadas do tecido adiposo.
En termos estruturais e funcionais, a leptina parécese á IL-6 e é un membro da superfamilia das citocinas.[1][46][48] A leptina circulante parece afectar ao eixe hipotalámico-hipofisario-adrenal, o que suxire un papel para a leptina na resposta ao estrés.[49] As concentracións elevadas de leptina están asociadas con elevados recontos de glóbulos brancos sanguíneos tanto en homes coma en mulleres.[50]
De xeito similar ao observado na inflamación crónica, os niveis de leptina elevados cronicamente están asociados coa obesidade, exceso de alimentación, e enfermidades relaciondas coa inflamación como a hipertensión arterial, síndrome metabólica, e enfermidade cardiovascular. Porén, como a leptina está asociada coa masa graxa corporal, é interesante que o tamaño dos adipocitos, e o acto de sobrealimentarse, non é afectado polo exercicio (por comparación, a IL-6 libérase en resposta ás contraccións musculares). Así, especúlase que a leptina responde especificamente á inflamación derivada do tecido adiposo.[51] A leptina é un factor proanxioxéenico, proinflamatorio e mitoxénico, e as súas accións refórzanse por medio de interaccións coa familia das citocinas IL-1 no cáncer.[52]
Os incrementos nos niveis de leptina (en responsta á inxesta calórica) funcionan como un mecanismo agudo de resposta proinflamatoria que prevén o estrés celular excesivo inducido pola sobrealimentación. Cando unha inxesta alta en calorías supera a capacidade dos adipocitos de hipertrofiarse ou de aumentar en número ao mesmo ritmo cá inxesta calórica, a conseguinte resposta ao estrés produce inflamación a nivel celular e almacenamento de graxa ectópico, é dicir, almacenamento pouco saudable de graxa nos órganos internos, arterias, e músculo. A insulina increméntase en resposta á carga calórica que provoca un incremento da leptina dependente da dose, un efecto potenciado polos elevados niveis de cortisol.[53] (Esta relación insulina-leptina é notablemente similar aos efectos da insulina sobre o incremento da expresión do xene da IL-6 e da secreción polos preadipocitos dun modo dependente da dose e tempo.)[54] Ademais, observouse que as concentracións de leptina plasmática increméntanse gradualmente cando se administra acipimox para previr a lipólise, a pesar de que se siga dieta hipocalórica con perda de peso.[55] Estes datos parecen demostrar que as altas cargas calóricas que exceden as capacidades de almacenamento dos adipocitos levan a respostas de estrés que inducen un incremento da leptina, a cal despois opera como unha sinalización derivada da inflamación adiposa para cesar a inxestión de comida e así previr que a inflamación derivada do tecido adiposo chegue a niveis elevados. Esta resposta pode despois protexer contra o nocivo proceso do almacenamento de graxa ectópico, que quizais explica a conexión entre os niveis elevados crónicos de leptina e o almacenamento de graxa ectópico nos individuos obesos.
Obesidade e resistencia á leptina
[editar | editar a fonte]Aínda que a leptina é unha molécula circulante que reduce o apetito, as persoas obesas xeralmente presentan unha concentración de leptina circulante infrecuentemente alta.[56] Estas persoas dise que son resistentes aos efectos da leptina, de forma similar a como as persoas con diabetes de tipo 2 son resistentes á insulina. As concentracións altas persistentes de leptina procedentes dos seus depósitos adiposos acrecentados orixina unha desensibilización á leptina. A vía do control da leptina nas persoas obesas podería ser defectuosa ao chegar a certo punto polo que o corpo non percibe correctamente a sensación de saciedade despois dunha comida.
Algúns investigadores intentaron explicar o fracaso da leptina á hora de controlar a obesidade nos humanos modernos como un trastorno metabólico, causado posiblemente por algún nutriente específico ou combinación de nutrientes que non estaban presentes ou non eran comúns na dieta prehistórica. Algúns propuxeron como nutrientes "ruíns" as lectinas [57] e a frutosa.[58]
Propúxose unha teoría da proporción sinal-ruído para explicar o fenómeno da resistencia á leptina.[36] Nos individuos saudables, os niveis basais de leptina están entre 1-5 ng/dL nos homes e 7-13 ng/dL nas mulleres.[36] Unha gran inxesta de calorías dispara a resposta da leptina, que reduce a fame, e así prevén unha sobrecarga da resposta inflamatoria inducida pola inxesta calórica. Teorizouse que, nos individuos obesos, a resposta da leptina á inxesta calórica está amortecida debido á hiperlectinemia de baixo grao crónica, que diminúe a proporción sinal-ruído de modo que as respostas agudas á leptina teñen menos efecto.
Aínda que a resistencia á leptina se describe ás veces como un trastorno metabólico que contribúe á obesidade, de modo similar a como a resistencia á insulina se describe como un trastorno metabólico que ten o potencial de progresar orixinando diabetes tipo 2, non é seguro que isto sexa certo na maioría dos casos. O simple feito de que a resistencia á leptina sexa extremadamente común nos individuos obesos suxire que pode ser simplemente unha adaptación ao exceso de peso corporal. Propúxose que o principa papel fisiolóxico da leptina non é o de ser un “sinal de saciedade” que evita a obesidade nos momentos de exceso enerxético, senón un “sinal de fame” que mantén uns depósitos axeitados de graxas para a supervivencia durante os tempos de déficit enerxético,[59][60] e que a resistencia á leptina nos individuos con sobrepeso é unha característica normal da fisioloxía dos mamíferos, que posiblemente lles confire unha vantaxe para a supervivencia.[61]
Unha forma diferente de resistencia á leptina (en combinación coa resistencia á insulina e o aumento de peso) orixinase doadamente nos animais de laboratorio, como as ratas, en canto se lles dá acceso ilimitado a alimentos apetitosos ricos en enerxía,[62] e pode reverterse cando eses animais son postos de novo a unha dieta baixa en calorías.[63] Iso, tamén, pode ter unha vantaxe evolutiva: "a capacidade de almacenar eficientemente a enerxía durante períodos de esporádica abundancia de alimentos representaba unha vantaxe para a supervivencia nas sociedades ancestrais sometidas a períodos de fame." [64] A combinación de dous mecanismos (un que suspende temporalmente a acción da leptina cando hai abundancia de alimentos de alta calidade, e o outro, que amortece os procesos que poderían levar de novo ao corpo ao seu peso "normal"), poderían explicar a epidemia de obesidade actual sen recorrer a falar de trastornos metabólicos ou de nutrientes "ruíns".
Interaccións coa frutosa
[editar | editar a fonte]Un estudo publicado suxire que o consumo de grandes cantidades de frutosa causa resistencia á leptina e unha elevación dos triglicéridos en ratas. As ratas que consomen unha dieta alta en frutosa despois comen máis e gañan máis peso cós animais de control cando son alimentados cunha dieta rica en graxas e moi calórica.[65][66][67] Porén, estes estudos non controlan a inxestión doutros monosacáridos ou polisacáridos, polo que a resistencia á leptina pode ser un resultado da dieta que contén altos índices de sacáridos (refrescos, doces, e outros alimentos que facilmente liberan azucres).
Mecanismo de acción
[editar | editar a fonte]A leptina interacciona con seis tipos de receptores (Ob-Ra–Ob-Rf, ou LepRa-LepRf) que están codificados por un só xene, o LEPR.[68] Ob-Rb é a única isoforma do receptor que pode facer a sinalización intracelular por medio das vías de transdución de sinais JAK-STAT e MAPK,[69] e está presente nos núcleos hipotalámicos.[70]
Non se sabe se a leptina pode cruzar a barreira hematoencefálica para acceder ás neuronas receptoras, porque esta barreira está atenuada na área da eminencia media, preto de onde están as neuronas NPY do núcleo arqueado. En xeral, pénsase que a leptina podería entrar no cerebro no plexo coroide, onde hai unha intensa expresión dunha forma do receptor de leptina que podería actuar como mecanismo de transporte.
Unha vez que a leptina se uniu ao receptor Ob-Rb, activa o stat3, que se fosforila e viaxa ao núcleo, onde se cre que provoca cambios na expresión xenética. Un dos efectos sobre a expresión xenética é a regulación á baixa da expresión dos endocannabinoides, responsables do incremento do apetito [71]. Hai outras vías intracelulares activadas pola leptina, pero sábese menos sobre como funcionan neste sistema. En resposta á leptina, as neuronas receptoras remodélanse, cambiando o número e tipos de sinapses que reciben.
Tamén hai certa aceptación de que a acción da leptina é máis descentralizxada do que previamente se asumía. Ademais da súa acción endócrina a distancia (desde o tecido adiposo ao cerebro), a leptina tamén actúa como un mediador parácrino.[6]
Metreleptina
[editar | editar a fonte]Un análogo da leptina humana chamado metreleptina está baixo investigación para o tratamento da diabetes e a hipertrigliceridemia, en pacientes con formas raras de lipodistrofia, síndromes caracterizadas por anormalidades na distribución do tecido adiposo, e anormalidades metabólicas graves. Nun longo estudo de tres anos coa metreleptina en pacientes de lipodistrofia organizado polos Institutos Nacionais da Saúde (NIH) dos Estados Unidos, o tratamento con metreleptina foi asociado cunha diminución significativa da glicosa sanguínea e de triglicéridos.[72] Actualmente estase a estudar se a metreleptina pode utilizarse para mellorar o tratamento da diabetes tipo 1.[73]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Zhang F; Basinski MB; Beals JM; et al. (1997). "Crystal structure of the obese protein leptin-E100". Nature 387 (6629): 206–9. PMID 9144295. doi:10.1038/387206a0.
- ↑ Brennan AM, Mantzoros CS (2006). "Drug Insight: the role of leptin in human physiology and pathophysiology--emerging clinical applications". Nat Clin Pract Endocrinol Metab 2 (6): 318–327. PMID 16932309. doi:10.1038/ncpendmet0196.
- ↑ GreGreen ED, Maffei M, Braden VV, Proenca R, DeSilva U, Zhang Y, Chua SC Jr, Leibel RL, Weissenbach J, Friedman JM (1995). "The human obese (OB) gene: RNA expression pattern and mapping on the physical, cytogenetic, and genetic maps of chromosome 7". Genome Res. 5 (1): 5–12. PMID 8717050. doi:10.1101/gr.5.1.5.
- ↑ Ingalls AM, Dickie MM, Snell GD (1950). "Obese, a new mutation in the house mouse". J. Hered. 41 (12): 317–8. PMID 14824537.
- ↑ Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM (1994). "Positional cloning of the mouse obese gene and its human homologue". Nature 372 (6505): 425–432. PMID 7984236. doi:10.1038/372425a0.
- ↑ 6,0 6,1 Margetic S, Gazzola C, Pegg GG, Hill RA (2002). "Leptin: a review of its peripheral actions and interactions". Int. J. Obes. Relat. Metab. Disord. 26 (11): 1407–1433. PMID 12439643. doi:10.1038/sj.ijo.0802142.
- ↑ Bado A, Levasseur S, Attoub S, Kermorgant S, Laigneau JP, Bortoluzzi MN, Moizo L, Lehy T, Guerre-Millo M, Le Marchand-Brustel Y, Lewin MJ (1998). "The stomach is a source of leptin". Nature 394 (6695): 790–793. PMID 9723619. doi:10.1038/29547.
- ↑ Os estudos inclúen:
- Dubuc G, Phinney S, Stern J, Havel P (1998). "Changes of serum leptin and endocrine and metabolic parameters after 7 days of energy restriction in men and women". Metab. Clin. Exp. 47 (4): 429–34. PMID 9550541. doi:10.1016/S0026-0495(98)90055-5.
- Pratley R, Nicolson M, Bogardus C, Ravussin E (1997). "Plasma leptin responses to fasting in Pima Indians". Am. J. Physiol. 273 (3 Pt 1): E644–9. PMID 9316457.
- Weigle D, Duell P, Connor W, Steiner R, Soules M, Kuijper J (1997). "Effect of fasting, refeeding, and dietary fat restriction on plasma leptin levels". J. Clin. Endocrinol. Metab. 82 (2): 561–565. PMID 9024254. doi:10.1210/jc.82.2.561.
- ↑ Chin-Chance C, Polonsky K, Schoeller D (2000). "Twenty-four-hour leptin levels respond to cumulative short-term energy imbalance and predict subsequent intake". J. Clin. Endocrinol. Metab. 85 (8): 2685–2691. PMID 10946866. doi:10.1210/jc.85.8.2685.
- ↑ Keim N, Stern J, Havel P (1998). "Relation between circulating leptin concentrations and appetite during a prolonged, moderate energy deficit in women". Am. J. Clin. Nutr. 68 (4): 794–801. PMID 9771856.
- ↑ Mars M, de Graaf C, de Groot C, van Rossum C, Kok F (2006). "Fasting leptin and appetite responses induced by a 4-day 65%-energy-restricted diet". International journal of obesity (Lond) 30 (1): 122–128. PMID 16158086. doi:10.1038/sj.ijo.0803070.
- ↑ Kus I; Sarsilmaz M; Colakoglu N; et al. (2004). "Pinealectomy increases and exogenous melatonin decreases leptin production in rat anterior pituitary cells: an immunohistochemical study". Physiological research / Academia Scientiarum Bohemoslovaca 53 (4): 403–8. PMID 15311999.
- ↑ Alonso-Vale MI, Andreotti S, Peres SB, Anhê GF, das Neves Borges-Silva C, Neto JC, Lima FB (2005). "Melatonin enhances leptin expression by rat adipocytes in the presence of insulin". Am. J. Physiol. Endocrinol. Metab. 288 (4): E805–E812. PMID 15572654. doi:10.1152/ajpendo.00478.2004.
- ↑ Wang MY, Chen L, Clark GO, Lee Y, Stevens RD, Ilkayeva OR, Wenner BR, Bain JR, Charron MJ, Newgard CB, Unger RH (2010). "Leptin therapy in insulin-deficient type I diabetes". Proc. Natl. Acad. Sci. U.S.A. 107 (11): 4813–4819. PMC 2841945. PMID 20194735. doi:10.1073/pnas.0909422107. Resumo divulgativo – medicinenet.com.
- ↑ Williams KW, Scott MM, Elmquist JK (2009). "From observation to experimentation: leptin action in the mediobasal hypothalamus". Am. J. Clin. Nutr. 89 (3): 985S–990S. PMC 2667659. PMID 19176744. doi:10.3945/ajcn.2008.26788D.
- ↑ Roth JD, Roland BL, Cole RL, Trevaskis JL, Weyer C, Koda JE, Anderson CM, Parkes DG, Baron AD (2008). "Leptin responsiveness restored by amylin agonism in diet-induced obesity: evidence from nonclinical and clinical studies". Proc. Natl. Acad. Sci. U.S.A. 105 (20): 7257–7262. PMC 2438237. PMID 18458326. doi:10.1073/pnas.0706473105.
- ↑ Gibson WT, Farooqi IS, Moreau M, DePaoli AM, Lawrence E, O'Rahilly S, Trussell RA (2004). "Congenital leptin deficiency due to homozygosity for the Delta133G mutation: report of another case and evaluation of response to four years of leptin therapy". J. Clin. Endocrinol. Metab. 89 (10): 4821–4826. PMID 15472169. doi:10.1210/jc.2004-0376.
- ↑ Friedman JM, Halaas JL (1998). "Leptin and the regulation of body weight in mammals". Nature 395 (6704): 763–770. PMID 9796811. doi:10.1038/27376.
- ↑ Heymsfield SB, Greenberg AS, Fujioka K, Dixon RM, Kushner R, Hunt T, Lubina JA, Patane J, Self B, Hunt P, McCamish M (1999). "Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial". JAMA 282 (16): 1568–1575. PMID 10546697. doi:10.1001/jama.282.16.1568.
- ↑ Lo KM, Zhang J, Sun Y, Morelli B, Lan Y, Lauder S, Brunkhorst B, Webster G, Hallakou-Bozec S, Doaré L, Gillies SD (2005). "Engineering a pharmacologically superior form of leptin for the treatment of obesity". Protein Eng. Des. Sel. 18 (1): 1–10. PMID 15790575. doi:10.1093/protein/gzh102.
- ↑ Taleb S, Herbin O, Ait-Oufella H, Verreth W, Gourdy P, Barateau V, Merval R, Esposito B, Clément K, Holvoet P, Tedgui A, Mallat Z. (2007). "Defective leptin/leptin receptor signaling improves regulatory T cell immune response and protects mice from atherosclerosis". Arterioscler Thromb Vasc Biol. 27 (12): 2691–2698. PMID 17690315. doi:10.1161/ATVBAHA.107.149567.
- ↑ Zhang W, Telemaque S, Augustyniak R, Anderson P, Thomas G, An J, Wang Z, Newgard C, Victor R. (2010). "Adenovirus-mediated leptin expression normalises hypertension associated with diet-induced obesity". J Neuroendocrinol. 22 (3): 175–180. PMID 20059648. doi:10.1111/j.1365-2826.2010.01953.x.
- ↑ Knight W, Seth R, Boron J, Overton J. (2009). "Short-term physiological hyperleptinemia decreases arterial blood pressure". Regul Pept. 154 (1–3): 60–68. PMID 19323984. doi:10.1016/j.regpep.2009.02.001.
- ↑ John S. Torday, Virender K. Rehan (2006). "Up-regulation of fetal rat lung parathyroid hormone-related protein gene regulatory network down-regulates the Sonic Hedgehog/Wnt/betacatenin gene regulatory network". Pediatr. Res. 60 (4): 382–388. PMID 16940239. doi:10.1203/01.pdr.0000238326.42590.03. — published online before print as DOI 10.1203/01.pdr.0000238326.42590.03
- ↑ Anifandis G, Koutselini E, Louridas K, Liakopoulos V, Leivaditis K, Mantzavinos T, Sioutopoulou D, Vamvakopoulos N (2005). "Estradiol and leptin as conditional prognostic IVF markers". Reproduction 129 (4): 531–534. PMID 15798029. doi:10.1530/rep.1.00567.
- ↑ Zhao J, Townsend KL, Schulz LC, Kunz TH, Li C, Widmaier EP (2004). "Leptin receptor expression increases in placenta, but not hypothalamus, during gestation in Mus musculus and Myotis lucifugus". Placenta 25 (8–9): 712–722. PMID 15450389. doi:10.1016/j.placenta.2004.01.017.
- ↑ Moynihan AT, Hehir MP, Glavey SV, Smith TJ, Morrison JJ (2006). "Inhibitory effect of leptin on human uterine contractility in vitro". Am. J. Obstet. Gynecol. 195 (2): 504–509. PMID 16647683. doi:10.1016/j.ajog.2006.01.106.
- ↑ Aka N, Atalay S, Sayharman S, Kiliç D, Köse G, Küçüközkan T (2006). "Leptin and leptin receptor levels in pregnant women with hyperemesis gravidarum". The Australian & New Zealand journal of obstetrics & gynaecology 46 (4): 274–277. PMID 16866785. doi:10.1111/j.1479-828X.2006.00590.x.
- ↑ Cervero A, Domínguez F, Horcajadas JA, Quiñonero A, Pellicer A, Simón C (2006). "The role of the leptin in reproduction". Curr. Opin. Obstet. Gynecol. 18 (3): 297–303. PMID 16735830. doi:10.1097/01.gco.0000193004.35287.89.
- ↑ Iwaniec UT, Boghossian S, Lapke PD, Turner RT, Kalra SP (2007). "Central leptin gene therapy corrects skeletal abnormalities in leptin-deficient ob/ob mice". Peptides 28 (5): 1012–1019. PMC 1986832. PMID 17346852. doi:10.1016/j.peptides.2007.02.001.
- ↑ Ducy P, Amling M, Takeda S, Priemel M, Schilling AF, Beil FT, Shen J, Vinson C, Rueger JM, Karsenty G (2000). "Leptin inhibits bone formation through a hypothalamic relay: a central control of bone mass". Cell 100 (2): 197–207. PMID 10660043. doi:10.1016/S0092-8674(00)81558-5.
- ↑ Hamrick MW, Ferrari SL (2008). "Leptin and the sympathetic connection of fat to bone". Osteoporos Int 19 (7): 905–912. PMID 17924050. doi:10.1007/s00198-007-0487-9.
- ↑ 33,0 33,1 Allison SJ, Herzog H (2006). "NPY and bone". EXS (95): 171–82. PMID 16383006.
- ↑ Gordeladze JO, Reseland JE (2003). "A unified model for the action of leptin on bone turnover". J. Cell. Biochem. 88 (4): 706–712. PMID 12577304. doi:10.1002/jcb.10385.
- ↑ Takeda S, Elefteriou F, Levasseur R, Liu X, Zhao L, Parker KL, Armstrong D, Ducy P, Karsenty G (2002). "Leptin regulates bone formation via the sympathetic nervous system". Cell 111 (3): 305–317. PMID 12419242. doi:10.1016/S0092-8674(02)01049-8.
- ↑ 36,0 36,1 36,2 Pilon B. "Leptin and Inflammation | Inflammation Theory". Press75.com. Arquivado dende o orixinal o 08 de abril de 2012. Consultado o 2011-04-19.
- ↑ Chan JL, Heist K, DePaoli AM, Veldhuis JD, Mantzoros CS (2003). "The role of falling leptin levels in the neuroendocrine and metabolic adaptation to short-term starvation in healthy men". J. Clin. Invest. 111 (9): 1409–1421. PMC 154448. PMID 12727933. doi:10.1172/JCI17490.
- ↑ Zirlik S, Hauck T, Fuchs FS, Neurath MF, Konturek PC, Harsch IA (2011). "Leptin, Obestatin and Apelin levels in patients with obstructive sleep apnoea syndrome". Med. Sci. Monit. 17 (3): CR159–64. PMID 21358603.
- ↑ Harsch IA, Konturek PC, Koebnick C, Kuehnlein PP, Fuchs FS, Pour Schahin S, Wiest GH, Hahn EG, Lohmann T, Ficker JH (2003). "Leptin and ghrelin levels in patients with obstructive sleep apnoea: effect of CPAP treatment". Eur. Respir. J. 22 (2): 251–257. PMID 12952256. doi:10.1183/09031936.03.00010103.
- ↑ Seaborg, E (2007). "Growing evidence links too little sleep to obesity and diabetes". Endocrine News: 14–15.
- ↑ Knutson KL, Spiegel K, Penev P, Van Cauter E (2007). "The metabolic consequences of sleep deprivation". Sleep Med Rev 11 (3): 163–178. PMC 1991337. PMID 17442599. doi:10.1016/j.smrv.2007.01.002.
- ↑ Otsuka R, Yatsuya H, Tamakoshi K, Matsushita K, Wada K, Toyoshima H (2006). "Perceived psychological stress and serum leptin concentrations in Japanese men". Obesity (Silver Spring) 14 (10): 1832–1838. PMID 17062814. doi:10.1038/oby.2006.211.
- ↑ Ahima RS, Flier JS (2000). "Leptin". Annu. Rev. Physiol. 62: 413–437. PMID 10845097. doi:10.1146/annurev.physiol.62.1.413.
- ↑ de Salles BF, Simão R, Fleck SJ, Dias I, Kraemer-Aguiar LG, Bouskela E (2010). "Effects of resistance training on cytokines". Int J Sports Med 31 (7): 441–450. PMID 20432196. doi:10.1055/s-0030-1251994.
- ↑ Lord GM, Matarese G, Howard JK, Baker RJ, Bloom SR, Lechler RI (1998). "Leptin modulates the T-cell immune response and reverses starvation-induced immunosuppression". Nature 394 (6696): 897–901. PMID 9732873. doi:10.1038/29795.
- ↑ 46,0 46,1 Fantuzzi G, Faggioni R (2000). "Leptin in the regulation of immunity, inflammation, and hematopoiesis". J. Leukoc. Biol. 68 (4): 437–46. PMID 11037963.
- ↑ Caldefie-Chezet F, Poulin A, Tridon A, Sion B, Vasson MP (2001). "Leptin: a potential regulator of polymorphonuclear neutrophil bactericidal action?". J. Leukoc. Biol. 69 (3): 414–8. PMID 11261788.
- ↑ Madej T, Boguski MS, Bryant SH (1995). "Threading analysis suggests that the obese gene product may be a helical cytokine". FEBS Lett. 373 (1): 13–18. PMID 7589424. doi:10.1016/0014-5793(95)00977-H.
- ↑ Heiman ML, Ahima RS, Craft LS, Schoner B, Stephens TW, Flier JS (1997). "Leptin inhibition of the hypothalamic-pituitary-adrenal axis in response to stress". Endocrinology 138 (9): 3859–3863. PMID 9275075. doi:10.1210/en.138.9.3859.
- ↑ Mabuchi T, Yatsuya H, Tamakoshi K, Otsuka R, Nagasawa N, Zhang H, Murata C, Wada K, Ishikawa M, Hori Y, Kondo T, Hashimoto S, Toyoshima H (2005). "Association between serum leptin concentration and white blood cell count in middle-aged Japanese men and women". Diabetes Metab. Res. Rev. 21 (5): 441–447. PMID 15724240. doi:10.1002/dmrr.540.
- ↑ Hamilton BS, Paglia D, Kwan AY, Deitel M (1995). "Increased obese mRNA expression in omental fat cells from massively obese humans". Nat. Med. 1 (9): 953–956. PMID 7585224. doi:10.1038/nm0995-953.
- ↑ Perrier S, Caldefie-Chezet F, Vasson MP. (2009) L-1 family in breast cancer: potential interplay with leptin and other adipocytokines. FEBS Lett. 583(2):259-65>http://www.ncbi.nlm.nih.gov/pubmed/19111549
- ↑ Wabitsch M, Jensen PB, Blum WF, Christoffersen CT, Englaro P, Heinze E, Rascher W, Teller W, Tornqvist H, Hauner H (1996). "Insulin and cortisol promote leptin production in cultured human fat cells". Diabetes 45 (10): 1435–1438. PMID 8826983. doi:10.2337/diabetes.45.10.1435.
- ↑ LaPensee CR, Hugo ER, Ben-Jonathan N (2008). "Insulin stimulates interleukin-6 expression and release in LS14 human adipocytes through multiple signaling pathways". Endocrinology 149 (11): 5415–5422. PMC 2584585. PMID 18617614. doi:10.1210/en.2008-0549.
- ↑ Worm D, Vinten J, Vaag A, Henriksen JE, Beck-Nielsen H (2000). "The nicotinic acid analogue acipimox increases plasma leptin and decreases free fatty acids in type 2 diabetic patients". Eur. J. Endocrinol. 143 (3): 389–395. PMID 11022182. doi:10.1530/eje.0.1430389.
- ↑ Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Bauer TL (1996). "Serum immunoreactive-leptin concentrations in normal-weight and obese humans". N. Engl. J. Med. 334 (5): 292–295. PMID 8532024. doi:10.1056/NEJM199602013340503.
- ↑ Tommy Jönsson; et al. (2005). "Agrarian diet and diseases of affluence--do evolutionary novel dietary lectins cause leptin resistance?". BMC Endocrine Disorders 5: 10. PMC 1326203. PMID 16336696. doi:10.1186/1472-6823-5-10.
- ↑ Alexandra Shapiro; et al. (2008). "Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding". American journal of physiology. Regulatory, integrative and comparative physiology 295 (5): R1370–R1375. PMC 2584858. PMID 18703413. doi:10.1152/ajpregu.00195.2008. Arquivado dende o orixinal o 31 de marzo de 2013. Consultado o 09 de agosto de 2012.
- ↑ Ashwini Oswal and Giles Yeo (2010). "Leptin and the Control of Body Weight: A Review of Its Diverse Central Targets, Signaling Mechanisms, and Role in the Pathogenesis of Obesity". Obesity 18 (2): 221–229. PMID 19644451. doi:10.1038/oby.2009.228.
- ↑ "The effects of high fat diets on the blood–brain barrier transport of leptin: Failure or adaptation?" (PDF). Arquivado dende o orixinal (PDF) o 25 de novembro de 2011. Consultado o 09 de agosto de 2012.
- ↑ Myers MG, Cowley MA, Münzberg H (2008). "Mechanisms of leptin action and leptin resistance". Annu. Rev. Physiol. 70: 537–556. PMID 17937601. doi:10.1146/annurev.physiol.70.113006.100707.
- ↑ Wang J, Obici S, Morgan K, Barzilai N, Feng Z, Rossetti L (2001). "Overfeeding rapidly induces leptin and insulin resistance". Diabetes 50 (12): 2786–2791. PMID 11723062. doi:10.2337/diabetes.50.12.2786.
- ↑ Enriori PJ, Evans AE, Sinnayah P, Jobst EE, Tonelli-Lemos L, Billes SK, Glavas MM, Grayson BE, Perello M, Nillni EA, Grove KL, Cowley MA (2007). "Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons". Cell Metab. 5 (3): 181–194. PMID 17339026. doi:10.1016/j.cmet.2007.02.004.
- ↑ Obici, S; Rossetti, L (2003). "Minireview: Nutrient Sensing and the Regulation of Insulin Action and Energy Balance". Endocrinology 144 (12): 5172–5178. PMID 12970158. doi:10.1210/en.2003-0999. Arquivado dende o orixinal o 19 de agosto de 2010. Consultado o 09 de agosto de 2012.
- ↑ "Fructose Sets Table For Weight Gain Without Warning". Science News. Science Daily. 2008-10-19. Consultado o 2008-11-15.
- ↑ Vasselli JR (2008). "Fructose-induced leptin resistance: discovery of an unsuspected form of the phenomenon and its significance. Focus on "Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding," by Shapiro et al". Am. J. Physiol. Regul. Integr. Comp. Physiol. 295 (5): R1365–R1369. PMID 18784330. doi:10.1152/ajpregu.90674.2008.
- ↑ Shapiro A, Mu W, Roncal C, Cheng KY, Johnson RJ, Scarpace PJ (2008). "Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding". Am. J. Physiol. Regul. Integr. Comp. Physiol. 295 (5): R1370–R1375. PMC 2584858. PMID 18703413. doi:10.1152/ajpregu.00195.2008.
- ↑ Wang MY, Zhou YT, Newgard CB, Unger RH (1996). "A novel leptin receptor isoform in rat". FEBS Lett. 392 (2): 87–90. PMID 8772180. doi:10.1016/0014-5793(96)00790-9.
- ↑ Malendowicz W, Rucinski M, Macchi C, Spinazzi R, Ziolkowska A, Nussdorfer GG, Kwias Z (2006). "Leptin and leptin receptors in the prostate and seminal vesicles of the adult rat". Int. J. Mol. Med. 18 (4): 615–8. PMID 16964413.
- ↑ "LepRb antibody (commercial site)". Arquivado dende o orixinal o 14 de xullo de 2011. Consultado o 09 de agosto de 2012.
- ↑ Di Marzo V, Goparaju SK, Wang L, Liu J, Bátkai S, Járai Z, Fezza F, Miura GI, Palmiter RD, Sugiura T, Kunos G. Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature. 2001 Apr 12;410(6830):822-5. PMID 11298451 [1]
- ↑ "Amylin to Present Data Showing Investigational Metreleptin Treatment Led to Long-Term Improvements in Diabetes and Lipid Control in Patients with Lipodystrophy". Press Release. Amylin Pharmaceuticals. 2011-04-15. Consultado o 2011-10-27.[Ligazón morta]
- ↑ "JDRF & Amylin Partner to Investigate Therapy to Improve Blood Glucose Control". Press Release. JDRF. Arquivado dende o orixinal o 21 de setembro de 2012. Consultado o 09 de agosto de 2012.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Leptina |
Bibliografía
[editar | editar a fonte]- Torday JS, Sun H, Wang L, Torres E, Sunday ME, Rubin LP (2002). "Leptin mediates the parathyroid hormone-related protein paracrine stimulation of fetal lung maturation". Am. J. Physiol. Lung Cell Mol. Physiol. 282 (3): L405–10. PMC 2942763. PMID 11839533.
- Torday JS, Rehan VK (2002). "Stretch-stimulated surfactant synthesis is coordinated by the paracrine actions of PTHrP and leptin". Am. J. Physiol. Lung Cell Mol. Physiol. 283 (1): L130–5. PMID 12060569. doi:10.1152/ajplung.00380.2001. Arquivado dende o orixinal o 19 de decembro de 2011. Consultado o 09 de agosto de 2012.
- Dubey L, Hesong Z (2006). "Role of leptin in atherogenesis". Exp Clin Cardiol 11 (4): 269–75. PMC 2274849. PMID 18651016.
- Friedman JM, Halaas JL (1998). "Leptin and the regulation of body weight in mammals". Nature 395 (6704): 763–770. PMID 9796811. doi:10.1038/27376.
- Prolo P, Wong ML, Licinio J (1999). "Leptin". Int. J. Biochem. Cell Biol. 30 (12): 1285–1290. PMID 9924798. doi:10.1016/S1357-2725(98)00094-6.
- Heshka JT, Jones PJ (2001). "A role for dietary fat in leptin receptor, OB-Rb, function". Life Sci. 69 (9): 987–1003. PMID 11508653. doi:10.1016/S0024-3205(01)01201-2.
- Janeckova R (2002). "The role of leptin in human physiology and pathophysiology". Physiological research / Academia Scientiarum Bohemoslovaca 50 (5): 443–59. PMID 11702849.
- Lee DW, Leinung MC, Rozhavskaya-Arena M, Grasso P (2002). "Leptin and the treatment of obesity: its current status". Eur. J. Pharmacol. 440 (2–3): 129–139. PMID 12007531. doi:10.1016/S0014-2999(02)01424-3.
- Al-Daghri N, Bartlett WA, Jones AF, Kumar S (2002). "Role of leptin in glucose metabolism in type 2 diabetes". Diabetes, obesity & metabolism 4 (3): 147–155. PMID 12047393. doi:10.1046/j.1463-1326.2002.00194.x.
- Sabath Silva EF (2002). "[Leptin]". Rev. Invest. Clin. 54 (2): 161–5. PMID 12053815.
- Thomas T, Burguera B (2003). "Is leptin the link between fat and bone mass?". J. Bone Miner. Res. 17 (9): 1563–1569. PMID 12211425. doi:10.1359/jbmr.2002.17.9.1563.
- Kraemer RR, Chu H, Castracane VD (2002). "Leptin and exercise". Exp. Biol. Med. (Maywood) 227 (9): 701–8. PMID 12324651.
- Waelput W, Brouckaert P, Broekaert D, Tavernier J (2003). "A role for leptin in the systemic inflammatory response syndrome (SIRS) and in immune response". Current drug targets. Inflammation and allergy 1 (3): 277–289. PMID 14561193. doi:10.2174/1568010023344634.
- Stenvinkel P, Pecoits-Filho R, Lindholm B (2004). "Leptin, ghrelin, and proinflammatory cytokines: compounds with nutritional impact in chronic kidney disease?". Advances in renal replacement therapy 10 (4): 332–345. PMID 14681862. doi:10.1053/j.arrt.2003.08.009.
- Cohen P, Ntambi JM, Friedman JM (2004). "Stearoyl-CoA desaturase-1 and the metabolic syndrome". Curr. Drug Targets Immune Endocr. Metabol. Disord. 3 (4): 271–280. PMID 14683458. doi:10.2174/1568008033340117.
- Sahu A (2004). "Leptin signaling in the hypothalamus: emphasis on energy homeostasis and leptin resistance". Frontiers in neuroendocrinology 24 (4): 225–253. PMID 14726256. doi:10.1016/j.yfrne.2003.10.001.
- Elefteriou F, Karsenty G (2004). "[Bone mass regulation by leptin: a hypothalamic control of bone formation]". Pathol. Biol. 52 (3): 148–153. PMID 15063934. doi:10.1016/j.patbio.2003.05.006.
- Blüher S, Mantzoros CS (2004). "The role of leptin in regulating neuroendocrine function in humans". J. Nutr. 134 (9): 2469S–2474S. PMID 15333744.
- Farooqi S, O'Rahilly S (2007). "Genetics of obesity in humans". Endocr. Rev. 27 (7): 710–18. PMID 17122358. doi:10.1210/er.2006-0040.
- Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Bauer TL (1996). "Serum immunoreactive-leptin concentrations in normal-weight and obese humans". N. Engl. J. Med. 334 (5): 292–5. PMID 8532024. doi:10.1056/NEJM199602013340503.
Ligazóns externas
[editar | editar a fonte]- Leptin in a bulletin by the Howard Hughes Medical Institute (HHMI)
- Leptin/ghrelin and their role in obesity from hungerhormones.com, a weight control website
- Leptina na Colorado State University
- Leptin at 3Dchem.com, descrición e estrutura
