Xenómica
A xenómica é o conxunto de ciencias e técnicas dedicadas ao estudo integral do funcionamento, o contido, a evolución e a orixe dos xenomas. É unha das áreas máis vangardistas da bioloxía. A xenómica usa coñecementos derivados de distintas ciencias como a bioloxía molecular, a bioquímica, a informática, a estatística, as matemáticas, a física etc.
Moitas veces, a palabra xenómica úsase como sinónimo doutras áreas de estudo relacionadas coas ciencias ómicas, como a proteómica e a transcriptómica, por exemplo.
As ciencias xenómicas tiveron un importante pulo nos últimos anos, sobre todo grazas ás tecnoloxías avanzadas de secuenciación de ADN, aos avances en bioinformática, e ás técnicas cada vez máis sofisticadas para realizar análises de xenomas completos. O desenvolvemento da xenómica contribuíu ao avance de distintos campos da ciencia como a medicina, a agricultura etc; grazas ao descubrimento de secuencias de xenes necesarias para a produción de proteínas de importancia médica e á comparación de secuencias xenómicas de distintos organismos. Por exemplo en varios países como os Estados Unidos, a Unión Europea e o Xapón realizáronse enormes proxectos para secuenciar o xenoma de diversos organismos modelo. Probablemente o máis coñecido é o Proxecto Xenoma Humano. Na actualidade cóntase ademais con importantes servidores de acceso público, como o do NCBI (National Center for Biotechnology Information), que permiten que calquera usuario con conexión a Internet acceda á secuencia completa do xenoma de decenas de organismos e ás secuencias de centos de miles de xenes de distintos organismos.
Diferenzas da xenómica con outras pólas da bioloxía
[editar | editar a fonte]A diferenza da xenética clásica, que a partir dun fenotipo (xeralmente mutante) procura o ou os xenes responsables de dito fenotipo, a xenómica ten como obxectivo predicir a función dos xenes a partir da súa secuencia ou das súas interaccións con outros xenes. Así, a xenómica ten un enfoque distinto para responder preguntas biolóxicas cando se compara con outras pólas da bioloxía máis tradicionais. En lugar do enfoque reducionista máis comunmente usado noutras ramas como son a bioloxía molecular ou a bioquímica, a xenómica trata estes problemas de maneira global. No caso do estudo puro de xenomas, a secuenciación dun xenoma xera información sobre todos os xenes presentes nun xenoma. Distintas características dos xenes como a posición no xenoma, a conservación dos xenes observada entre distintas especies e as predicións da estrutura das proteínas ou o ARN codificados permiten inferir a función dalgúns dos xenes estudados. Na xenómica aplicada a estudos de transcriptómica estúdanse os patróns de expresión de distintos xenes a unha escala global (véxase Chip de ADN, PCR en tempo real). Desta forma é posible suxerir posibles funcións e interaccións de xenes observadas nun punto no tempo.
Os estudos xenómicos caracterízanse pola súa interdisciplinariedade, debido a que o gran número de datos xerados nun estudo deste tipo require combinar tanto coñecementos biolóxicos coma estatísticos e informáticos.
Por outra parte, os estudos en xenómica utilizan unha estratexia Top-down para analizar preguntas en bioloxía. Con este enfoque, primeiro obsérvase o comportamento global de moitos xenes ou biomoléculas nun organismo (ARN mensaxeiro, proteínas, metabolitos etc.) e chégase finalmente a conclusións máis particulares que concirnen só a algunhas biomoléculas. Deste xeito, a aplicación das ciencias xenómicas permite abordar preguntas de grande importancia en bioloxía que requiren unha comprensión global do problema. Por exemplo, para o estudo de distintas doenzas xenéticas complexas cómpre dispoñer dunha lista completa dos xenes participantes e logo estudar as súas interaccións. Para entendermos a evolución dos xenomas tamén hai que dispoñer de secuencias completas para que se poidan así inferir os distintos eventos que puideron dar lugar ao estado actual do xenoma.
Para abordar distintos problemas biolóxicos as ciencias xenómicas subidivídense en distintas áreas de coñecemento, por exemplo a xenómica funcional, a xenómica estrutural e a xenómica comparada.
Áreas de investigación
[editar | editar a fonte]Xenómica funcional
[editar | editar a fonte]- Artigo principal: Xenómica funcional.
A xenómica funcional é unha rama da bioloxía molecular que ten como obxectivo facer uso da enorme cantidade de datos obtidos nos proxectos xenómicos (como os proxectos de secuenciación de xenomas) para describir as funcións dos xenes (e proteínas) e as interaccións. A xenómica funional céntrase nos aspectos dinámicos como a transcrición, tradución, e interaccións proteína-proteína, pero non en aspectos estáticos da información xenómica como a secuencias de ADN ou as estruturas. A xenómica funcional trata de responder cuestións sobre o funcionamento do ADN a nivel de xenes, os transcritos de ARN, e produtos proteicos. Unha característica clave dos estudos de xenómica funcional é a súa estratexia de considerar o xenoma completo para resolver estas cuestións, o que xeralmente implica métodos de alto rendemento en vez da aproximación á cuestión máis tradicional “xene por xene”. A xenómica funcional preocúpase de estudar os patróns de expresión xénica en diversas condicións. As ferramentas máis importantes usadas son as micromatrices e a bioinformática.
Xenómica estrutural
[editar | editar a fonte]- Artigo principal: Xenómica estrutural.
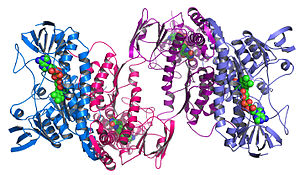
A xenómica estrutural trata de describir a estrutura tridimensional de todas as proteínas codificadas nun xenoma.[1][2] Esta estratexia baseada no xenoma permite ter un método de alto rendemento para determinar as estruturas por unha combinación de estratexias de modelación e experimentais. A principal diferenza entre a xenómica estrutural e a predición estrutural tradicional é que a xenómica estrutural trata de determinar a estrutura de todas as proteínas codificadas polo xenoma, en vez de centrarse nunha proteína determinada. Cando se dispón de secuencias de xenomas completos, a predición de estruturas pode facerse máis rapidamente por medio da combinación de métodos de modelaxe e experimentais, especialmente debido a que a dispoñibilidade dun gran número de xenomas secuenciados e estruturas das proteínas resoltas previamente permite aos científicos modelizar a estrutura da proteína sobre a base das estruturas de homólogos previamente resoltos. A xenómica estrutural implica usar moitas estratexias posibles para a determinación da estrutura, como métodos experimentais utilizando secuencias xenómicas ou modelizacións baseadas na secuencia ou homoloxía estrutural dunha proteína de estrutura coñecida ou baseada en principios físicos e químicos para unha proteína sen ningunha homoloxía con ningunha estrutura coñecida. Ao contrario da bioloxía estrutural tradicional, a determinación da estrutura dunha proteína por medio da xenómica estrutural a miúdo (pero non sempre) faise antes de que se saiba algo sobre a función exercida pola proteína. Isto formula novos retos para a bioinformática estrutural, é dicir, determinar a función da proteína a partir da súa estrutura tridimensional.[3]
Epixenómica
[editar | editar a fonte]- Artigos principais: Epixenética e Epixenómica.
A epixenómica é o estudo do conxunto completo de modificacións epixenéticas sobre o material xenético dunha célula, coñecido como epixenoma.[4] As modificacións epixenéticas son modificacións reversibles no ADN celular ou nas histonas que afecta á expresión xénica sen alterar a secuencia de ADN. Dúas das modificacións epixenéticas mellor caracterizadas son a metilación do ADN e a modificación de histonas. As modificacións epixenéticas xogan un importante papel na expresión xénica e regulación, e están implicadas en numerosos procesos celulares como a diferenciación e desenvolvemento e na xénese de tumores.[4] O estudo da epixenética a niverl global fíxose posible só recentemente por medio da adaptación de ensaios de alto rendemento xenómicos.[5]
Metaxenómica
[editar | editar a fonte]
- Artigo principal: Metaxenómica.
A metaxenómica é o estudo dos metaxenomas, é dicir, o material xenético recollido directamente de mostras ambientais. Este amplo campo pode denominarse tamén xenómica ambiental, ecoxenómica ou xenómica das comunidades. Mentres que a microbioloxía tradicional e a secuenciación xenómica microbiana dependían de cultivos clonais, as primeiras secuenciacións de xenes ambientais clonaban xenes específicos (xeralmente o xene do ARNr 16S) para obter un perfil de diversidade nunha mostra natural. Estes traballos indican que a gran maioría da biodiversidade microbiana fora pasada por alto nos métodos baseados en cultivos microbiolóxicos.[6] Estudos recentes usan a secuenciación de Sanger de "escopeta" ou a pirosecuenciación masivamente paralela para conseguir mostras en gran medida non nesgadas de todos os xenes de todos os membros das comunidades mostreadas.[7] Debido ao seu poder para revelar a diversidade previamente agochada da vida microscópica, a metaxenómica ofrece unha poderosa lente para ver o mundo microbiano que ten o potencial de revolucionar o coñecemento de todo o mundo vivo.[8][9]
Estudo de sistemas
[editar | editar a fonte]Virus e bacteriófagos
[editar | editar a fonte]Os bacteriófagos xogaron e seguen xogando un papel clave na xenética bacteriana e na bioloxía molecular. Historicamente, foron usados para definir a estrutura dos xenes e a regulación xénica. Ademais, o primeiro xenoma que foi secuenciado foi o dun bacteriófago. Porén, a investigación en bacteriófagos non levou á revolución xenómica, que está claramente dominada pola xenómica bacteriana. O estudo dos xenomas de bacteriófagos só se fixo importante moi recentemente, o que permitiu aos investigadores comprender os mecanismos que subxacen na evolución dos fagos. As secuencias de xenomas de bacteriófagos poden obterse por medio da secuenciación directa de bacteriófagos illados, pero poden tamén ser derivados de partes dos xenomas microbianos. A análise de xenomas bacterianos mostrou que unha cantidade substancial de ADN microbiano consta de secuencias de profagos e de elementos similares a profagos.[10] Unha base de datos detallada minando estas secuencias ofrece unha visión do papel dos profagos na formación do xenoma bacteriano.[11][12]
Cianobacterias
[editar | editar a fonte]Como exemplo dos grandes avances realizados na xenómica bacteriana, pódese mencionar o caso das cianobacterias. Actualmente hai 24 cianobacterias ás que se secuenciou totalmente o xenoma. Delas, 15 proceden de ambientes mariños, pero hai moitos outros proxectos en marcha para secuenciar máis especies e tamén bacteriófagos que infectan a esas especies. Deste modo, o crecente corpo de información xenómica pode tamén ser utilizado de modo máis xeral para resolver problemas globais, aplicando un enfoque comparativo. Algúns dos progresos realizados neste campo son a identificación de xenes de ARNs reguladores, avances no estudo da orixe evolutiva da fotosíntese, ou a estimación da contribución da transferencia horizontal de xenes aos xenomas que foron analizados.[13]
Xenómica humana
[editar | editar a fonte]- Artigo principal: Xenoma humano.
O Proxecto Xenoma Humano serviu para obter a secuencia completa do xenoma humano. En 2012, secuenciáranse completamente miles de xenomas humanos individuais, e moitos máis foran mapados a baixos niveis de resolución. Os datos resultantes son utilizados en todo o mundo en ciencias biomédicas, antropoloxía, ciencias forenses e outras disciplinas. Hai unha grande expectativa de que os estudos xenómicos leven a avances no diagnóstico e tratamento de doenzas, e en moitos campos da bioloxía, incluíndo a evolución humana. Estímase que o xenoma humano contén entre 20.000 e 25.000 xenes codificantes de proteínas. Aínda haberá que realizar moito traballo para dilucidar as funcións biolóxicas das proteínas e produtos de ARN dos xenes e para descubrir as funcións de moitas porcións non codificantes do ADN, que supoñen a gran maioría do noso xenoma.
Aplicacións da xenómica
[editar | editar a fonte]Existen moitas áreas relacionadas coa xenómica que se foron desenvolvendo ao longo dos anos, algunhas das máis importantes polo seu potencial tanto económico coma social e ambiental son a medicina xenómica, a xenómica agropecuaria, a xenómica forense, a xenómica ambiental, a xenómica industrial etc. A xenómica é de grande importancia na investigación de doenzas xenéticas.
- Estudo de doenzas xenéticas:
- As doenzas xenéticas no ser humano poden ser de dous tipos: doenzas mendelianas ou doenzas polixénicas. As doenzas mendelianas xeralmente son causadas por un defecto nun só xene, o que dificulta o seu estudo debido á penetrancia incompleta, aínda que este factor tamén fai que existan distintos niveis de gravidade dependendo do individuo. A maioría das doenzas xenéticas que afectan a humanos son polixénicas (doenzas cardiovasculares, asma, cancro etc.) , polo que son producidas por varios xenes, e pola presión ambiental e as interaccións entre estes. Hai tres xeitos diferentes de levar a cabo o mapeo das variantes xenéticas implicadas nunha doenza: clonación funcional, estratexia do xene candidato e clonación posicional.
- Resposta a fármacos:
- O medicamento perfecto sería aquel que é efectivo contra unha doenza e non produce efectos secundarios. Xa que isto non se axusta á realidade, na que un mesmo fármaco pode causar efectos totalmente diferentes en dous individuos, o obxectivo da farmacoxenómica é o de entender a variabilidade entre uns pacientes e outros dos efectos producidos polo medicamento e intentar definir o tratamento que mellor se axuste a cada individuo.
- Estudos de domesticación: Actualmente co uso das ferramentas xenéticas iniciouse o estudo dos cambios fenotípicos poos que os animais deben pasar durante procesos de domesticación, para o cal por exemplo se poden usar elementos como SNPs en sitios conservados non codificantes e secuencias codificantes e a diversidade de nucleótidos dentro das poboacións de animais, como o caso do coello; estes datos poderían proporcionar información sobre polimorfismos ou reducións da diversidade xenética durante a colonización de novos lugares por parte dos animais.
A xenómica no futuro
[editar | editar a fonte]Os xenomas que foron secuenciados foron moi útiles para a humanidade, mais son unha mínima parte do total de xenomas existentes. A secuenciación destes xenomas fornecerá unha información moi valiosa para o tratamento de doenzas, a agricultura e a biotecnoloxía. As secuencias xenómicas completas de mamíferos axudarán ao entendemento da evolución e función do xenoma humano. No futuro, a información sobre a secuencia xenómica completa poderá aplicarse no tratamento individual de pacientes, mesmo de neonatos, dando lugar a unha medicina máis individualizada. O coñecemento de secuencias completas tamén ten un aspecto negativo, xa que pode levar á discriminación dalgunhas persoas identificadas como portadores de secuencias que determinen doenzas, trastornos e trazos físicos.
Notas
[editar | editar a fonte]- ↑ Marsden, R. L.; Lewis, T. A.; Orengo, C. A. (2007). "Towards a comprehensive structural coverage of completed genomes: A structural genomics viewpoint". BMC Bioinformatics 8: 86. doi:10.1186/1471-2105-8-86. PMC 1829165. PMID 17349043.
- ↑ Brenner, S. E.; Levitt, I. (2008). "Expectations from structural genomics". Protein Science 9 (1): 197–200. doi:10.1110/ps.9.1.197. PMC 2144435. PMID 10739263.
- ↑ Brenner, S. E. (2001). "A tour of structural genomics" (PDF). Nature Reviews Genetics 2 (10): 801–809. doi:10.1038/35093574. PMID 11584296. Retrieved 2012-12-07.
- ↑ 4,0 4,1 Francis, Richard C (2011). Epigenetics : the ultimate mystery of inheritance. New York: W.W. Norton. ISBN 9780393070057.
- ↑ Laird, P. W. (2010). "Principles and challenges of genome-wide DNA methylation analysis". Nature Reviews Genetics 11 (3): 191–203. doi:10.1038/nrg2732. PMID 20125086.
- ↑ Hugenholz, P; Goebel BM; Pace NR (1 September 1998). "Impact of Culture-Independent Studies on the Emerging Phylogenetic View of Bacterial Diversity". J. Bacteriol 180 (18): 4765–74. PMC 107498. PMID 9733676.
- ↑ Eisen, JA (2007). "Environmental Shotgun Sequencing: Its Potential and Challenges for Studying the Hidden World of Microbes". PLoS Biology 5 (3): e82. doi:10.1371/journal.pbio.0050082. PMC 1821061. PMID 17355177.
- ↑ Marco, D, ed. (2010). Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ↑ Marco, D, ed. (2011). Metagenomics: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-87-5.
- ↑ Canchaya, Carlos; Caroline Proux; Ghislain Fournous; Anne Bruttin; Harald Brüssow (June 2003). "Prophage Genomics". Microbiology and Molecular Biology Reviews 67 (2): 238–276. doi:10.1128/MMBR.67.2.238-276.2003. ISSN 1092-2172. PMC 156470. PMID 12794192.
- ↑ McGrath S and van Sinderen D, ed. (2007). Bacteriophage: Genetics and Molecular Biology (1st ed.). Caister Academic Press. ISBN 978-1-904455-14-1.
- ↑ Fouts, Derrick E. (November 2006). "Phage_Finder: Automated identification and classification of prophage regions in complete bacterial genome sequences". Nucleic Acids Research 34 (20): 5839–5851. doi:10.1093/nar/gkl732. ISSN 0305-1048. PMC 1635311. PMID 17062630.
- ↑ Herrero A and Flores E, ed. (2008). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). Caister Academic Press. ISBN 978-1-904455-15-8.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Bioinformática
- Farmacoxenómica
- Xenoma humano
- Xenómica comparada
- Xenómica estrutural
- Xenómica funcional
- Medicina xenómica
- Nutrixenómica
- Proteómica
- Metaxenómica
- Holoxenómica
Bibliografía
[editar | editar a fonte]- PRIMROSE S.B.; TWYMAN R.M. Principles of Genome Analysis and Genomics. 3ª ed. Blackwell Publishing, 2003.
- PIERCE. Genética, un enfoque conceptual. 3ªed. Editorial Médica Panamericana, 2009.
Ligazóns externas
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Xenómica |
- ActionBioscience.orgArquivado 17 de maio de 2008 en Wayback Machine. asuntos críticos da xenómica
- Número de Nature dedicado ao xenoma humano
- Páxina do NCBI
- Unidade de Xenómica UCM - PCM Arquivado 17 de decembro de 2007 en Wayback Machine.
- Centro de Ciencias Xenómicas, UNAM
- EE UU ordena á firma líder de test xenéticos que os deixe de vender
