Gripe
| Gripe | |
|---|---|
| Clasificación e recursos externos | |
 Partícula viral ou "virión" do virus da gripe. | |
| ICD-10 | J10, J11 |
| ICD-9 | 487 |
| DiseasesDB | 6791 |
| MedlinePlus | 000080 |
| eMedicine | ped/3006 |
| MeSH | D007251 |
Se cre que pode requirir tratamento, por favor, consúltello ao médico. | |
A gripe[1] ou influenza[2], é unha enfermidade infecciosa de aves e mamíferos causada por un tipo de virus de ARN da familia dos Orthomyxoviridae.
Nos seres humanos afecta ás vías respiratorias, inicialmente pode ser similar a un arrefriado e con frecuencia acompáñase de síntomas xerais como dor de garganta, debilidade, dores musculares (mialxias), dor estomacal, articulares (artralxias) e de cabeza (cefalea), con tose (que xeralmente é seca e sen mucosidade), malestar xeral e algúns signos como poida ser a febre.[3] Nalgúns casos máis graves pode complicarse con pulmonía (pneumonía), que pode resultar mortal, especialmente en nenos pequenos e sobre todo en anciáns. Aínda que se pode confundir co arrefriado común (catarro), a gripe é unha enfermidade máis grave e está causada por un tipo diferente de virus.[4] Tamén pode provocar, máis a miúdo en nenos, náuseas e vómitos,[3] que ao ser síntomas de gastroenterite fai que se denomine gripe estomacal ou abdominal.[5]
A gripe xeralmente transmítese polo ar desde individuos infectados a través de pingas en forma de aerosol cargadas de virus (procedentes de secreción nasal, bronquial ou saliva que conteña algúns deles[6]), que son emitidos coa tose ou cos esbirros ou só ao falar. Tamén é transmisible pola sangue[3] e polas superficies ou obxectos contaminados co virus, que se denominan fomites.
Os virus da gripe resisten máis en ambiente seco e frío. Poden conservar a súa capacidade infectiva durante unha semana á temperatura do corpo humano, durante 30 días a 0 °C e durante moito máis tempo a menores temperaturas.[7][8] Pode ser facilmente inactivado mediante deterxentes ou desinfectantes.[9][10][11]
A gripe distribúese en epidemias estacionais que provocan centos de miles de defuncións, que pasan a ser millóns nos anos de pandemia (epidemia global). Durante o século XX producíronse cinco pandemias de gripe debido á aparición por mutación de diferentes cepas do virus. A miúdo estas novas cepas xurdiron a partir do transvasamento de cepas típicas de animais ao ser humano, no que se denomina salto de especie ou heterocontaxio. Unha variante mortal do virus da gripe aviar denominada H5N1 pasou por ser a principal candidata para a seguinte pandemia de gripe en humanos desde que traspasou a barreira de especie nos anos 1990 e provocou decenas de defuncións en Asia, ata a aparición da neogripe A (H1N1) en 2009. Afortunadamente aquela variante aviar non mutou e non pode transmitirse de persoa a persoa, pois só afectou a humanos desde aves contaxiadas e ese contaxio non é fácil pois require unhas condicións moi especiais.[12]
Nos países desenvolvidos establecéronse campañas de vacinación anual fronte á gripe para as persoas con maior risco de contraer a enfermidade ou que son máis vulnerables ás súas complicacións,[13] así como controis estritos ás aves de curral.[14] A vacina humana habitual é a trivalente, que contén proteínas purificadas e inactivadas das tres cepas que se consideran van ser as máis comúns na seguinte epidemia: dous subtipos do virus A da gripe e un do virus B.[15] Unha vacina elaborada un ano pode non ser eficaz ao seguinte debido ás frecuentes e rápidas mutacións (cambios nos seus antíxenos) que sofre o virus, e á dominancia variable das diferentes cepas.
O tratamento é só sintomático e nos casos graves e hospitalarios é só de mantemento de constantes, pois os fármacos antivirais teñen unha eficacia moi limitada (os máis eficaces son os inhibidores da neuraminidase) e non carecen de toxicidade. Os antibióticos só son útiles se hai infección bacteriana asociada.
O prognóstico é bo con recuperación parcial á semana e total aos quince días, sendo, nas epidemias habituais, os exitus letalis consecuencia da patoloxía ou do deficiente estado inmunitario, previos á infección gripal.
En España a gripe é de declaración obrigatoria, non nominal e non urxente. Todos os venres ha de remitirse ás autoridades sanitarias o número de casos novos atendidos durante a semana. Antes de 2009 nunca se requiría enquisa epidemiolóxica, dada a súa alta morbilidade (cantidade porcentual de afectados) pero esta si debe realizarse hoxe en día nos casos de neogripe A, ata antes da confirmación polo laboratorio.
Etimoloxía
[editar | editar a fonte]Gripe (tamén ás veces gripa) procede do francés grippe, á súa vez do alemán de Suíza grupi (acurrucarse). A variedade influenza procede do italiano.
Historia
[editar | editar a fonte]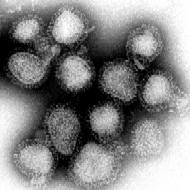
Os síntomas da gripe en humanos foron descritos por Hipócrates hai uns 2.400 anos.[16][17] Desde entón o virus causou, ademais da epidemia anual, numerosas pandemias. Os datos históricos sobre a gripe son difíciles de interpretar porque os síntomas poden ser similares aos doutras enfermidades, como a difteria, a pneumonía, o dengue ou o tifo. Desde 1510 describíronse unhas 31 pandemias. O primeiro rexistro detallado dunha pandemia gripal produciuse en 1850. Comezou en Asia e estendeuse a Europa e a África. As pandemias sucedéronse durante os séculos XVII e XVIII, sendo a de 1830-1833 especialmente virulenta e de gran morbilidade, xa que infectou aproximadamente a unha cuarta parte da poboación exposta.[18]
A pandemia máis letal e coñecida foi a denominada gripe española (virus A, subtipo H1N1), que durou desde 1918 a 1919. Denomínase así porque España era o país que publicaba máis datos sobre o desastre sanitario que estaba ocasionando pois moitos os censuraban con motivo da primeira guerra mundial na cal estaban inmersos. As estimacións máis antigas falaban duns 40 ó 50 millóns de mortos causados por ela,[19] aínda que as aproximacións máis actuais sitúan a cifra entre 50 e 100 millóns de persoas falecidas por aquela gripe en todo o mundo.[20] Esta pandemia foi descrita como o maior holocausto médico da historia, e causou polo menos tantos mortos como a peste negra.[18] Esta gran mortalidade foi debida á gran taxa de infectividade (ata o 50% da poboación exposta) e á gravidade dos síntomas causados pola produción masiva de citoquinas) (tormenta de citoquinas).[19] A isto hai que sumar que os primeiros síntomas, en 1918, foron atribuídos a outras enfermidades como dengue, cólera, ou a febre tifoide. Un observador escribía que "unha das peores complicacións é a hemorraxia das mucosas, especialmente a nasal, a do estómago ou a intestinal. Tamén son frecuentes o sangrado de oídos e as petequias".[20] A maior parte das mortes ocorreron por pneumonía bacteriana, unha infección secundaria provocada pola gripe, pero o virus tamén matou, directamente, a consecuencia das hemorraxias masivas e o edema pulmonar.[21]
A pandemia da gripe española tivo un orixe xeográfico aínda hoxe en día dubidoso e estendeuse por todo o planeta ata o Ártico e as remotas illas do océano Pacífico. A gravidade inesperada da enfermidade produciu a morte de entre o 2 e o 20% de todos os infectados, (fronte á taxa habitual de mortalidade da gripe común, que está en torno ao 0,1%).[20][21] Outra característica diferencial desta pandemia foi que a mortalidade afectou sobre todo a adultos novos, cun 99% das mortes en persoas por baixo dos 65 anos, e máis da metade en adultos entre os 20 e os 40 anos.[22] A gripe común ten as súas maiores taxas de mortalidade, pola contra, nos estratos de poboación máis nova (menores de dous anos) e sobre todo entre os maiores de 70. A mortalidade total real da pandemia de gripe de 1918-1919 non se coñece con certeza pero estímase que en torno ao 2.5% e o 5% da poboación mundial morreu pola súa causa (uns 25 millóns de persoas só nas primeiras 25 semanas). Foi a pandemia máis mortífera da historia da humanidade, superando á da peste negra. Vaia como comparación que o virus do sida causou esa mesma cantidade de mortes nos seus primeiros 25 anos de existencia.[20]
Coa recente dispoñibilidade de mostras de falecidos polo virus da gripe española, cultivos de virus da gripe e as novidosas técnicas de bioloxía molecular conseguiuse clonar o xenoma completo do axente causal da pandemia de 1918. Para iso, utilizouse metodoloxía baseada na xenética reversa para xerar un virus da influenza que contén os oito segmentos xenéticos deste virus. Este logro permite estudar as propiedades asociadas á súa extraordinaria virulencia. En marcado contraste coa influenza humana contemporánea (o virus H1N1), nos ensaios realizados in vitro o virus da pandemia de 1918 tivo a capacidade de replicarse en ausencia de tripsina, o que lle permitiu causar a morte en ratos e embrións de polo, mostrando un fenotipo de alta replicación nas células epiteliales bronquiais. Por outra banda, a expresión coordinada dos 1.918 xenes do virus sen dúbida outorga un fenotipo único de alta virulencia observada con este virus pandémico e que non se observou en ningún outro virus da influenza analizado ata este momento.[23]
As pandemias posteriores de gripe (a gripe asiática (tipo A, subtipo H2N2) e a de 1968 ou gripe de Hong Kong (tipo A, subtipo H3N2) non foron tan devastadoras pero tamén provocaron millóns de defuncións. Nas últimas pandemias, a dispoñibilidade de antibióticos serviu para controlar as infeccións oportunistas e isto axudou a reducir a taxa de mortalidade con respecto o da gripe española do 18. .[21]
| Nome da pandemia | Data | Mortes | Subtipo involucrado | Índice de gravidade da Pandemia |
|---|---|---|---|---|
| Gripe rusa | 1889–1890 | 1 millón | posiblemente H2N2 | ? |
| Gripe española | 1918–1920 | 40 a 100 millones | H1N1 | 5 |
| Gripe asiática | 1957–1958 | 1 a 1.5 millones | H2N2 | 2 |
| Gripe de Hong Kong | 1968–1969 | 0.75 a 1 millones | H3N2 | 2 |
| SARS | 2003-2004 | 774 | ||
| A (H1N1) | 2009-2010 | 730+ | H1N1 | 6 |
A familia de virus Orthomyxoviridae é a causante (etioloxía) da gripe, e foi descrita por primeira vez en porcos por Richard Schope en 1931.[25] Este descubrimento foi seguido en breve polo illamento do virus en humanos por un grupo de investigación dirixido por Patrick Laidlaw e o Medical Research Council do Reino Unido en 1933.[26] Con todo, houbo que esperar ata 1935 para que Wendell Meredith Stanley, Premio Nobel de Química 1946,[27] establecese a verdadeira natureza non celular dos virus.
O primeiro paso significativo cara á prevención da gripe foi o desenvolvemento dunha vacina de virus mortos por Thomas Francis, Jr en 1944. Posteriormente Frank Macfarlane Burnet demostrou que os virus perden virulencia ao ser cultivados en proteína de ovo, posibilitándose así as vacinas de virus inactivados, moito máis eficaces.
A aplicación desta observación permitiu a un grupo de investigadores da Universidade de Míchigan desenvolver a primeira vacina empregada en poboación,[28] coa colaboración do exército dos Estados Unidos.[29] A decisión do exército de participar no desenvolvemento desta vacina debeuse á súa experiencia coa gripe durante a primeira guerra mundial, cando miles de soldados morreron polo virus en cuestión de poucos meses.[20]
Aínda que se desataron algúns temores coa gripe do porco de New Xersei en 1976, en 1977 cunha repunta da gripe rusa e en Hong Kong e outros países asiáticos en 1997 (coa variante H5N1 da gripe aviaria), non houbo ningunha pandemia de importancia desde a gripe de Hong Kong de 1968. En maio de 2009 México tivo unha alerta de A(H1N1) (gripe A) que mantivo á poboación da Cidade de México en corentena. A inmunidade adquirida coas pandemias previas e as campañas de vacinación parecen limitar a extensión do virus e poden axudar a previr futuras pandemias.[24]
Etioloxía: viroloxía
[editar | editar a fonte]Tipos de virus da gripe
[editar | editar a fonte]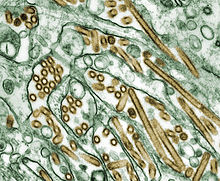
O virus da gripe é un virus ARN da familia dos Orthomyxoviridae, que comprende cinco xéneros:[30]
Só os tres primeiros (influenzavirus) son causantes de gripe. A nomenclatura xeral dos virus da gripe como tipos A, B ou C baséase en características antixénicas da nucleoproteína (NP) e os antíxenos proteínicos da matriz (M) para cada xénero. Cada xénero á súa vez, subtipificase e as cepas ou subtipos desígnanse seguindo este criterio:[31]
- Tipo do virus gripal
- Lugar de orixe
- Número de cepa
- Ano de illamento
- Subtipo segundo estrutura H/N (Por exemplo: «A/Hong Kong/5/68 (H3N2)»)
Influenzavirus A
[editar | editar a fonte]Este xénero posúe unha especie, o Influenza A virus.[32] As aves acuáticas salvaxes son os hóspedes naturais dos seus moitos subtipos. En ocasións os virus poden transmitirse a outras especies o que pode provocar graves epidemias na poboación de aves para consumo humano, ou saltar directamente ao ser humano coa conseguinte pandemia.[33] Os virus de tipo A son os patóxenos máis agresivos dos tres xéneros que poden provocar a enfermidade. En función do anticorpo dominante poden ser divididos en varios serotipos diferentes. Os serotipos que foron confirmados en humanos, ordenados polo número coñecido de mortes en pandemia son:
- H1N1, causante da gripe española en 1918
- H2N2, responsable da gripe asiática en 1957
- H3N2, que causou a gripe de Hong Kong en 1968
- H5N1, responsable da ameaza de pandemia en 2007?08.
- H7N7, que ten un excepcional potencial zoonótico[34]
- H1N2, endémico en humanos e porcos.
- H9N2
- H7N2
- H7N3
- H10N7
Influenzavirus B
[editar | editar a fonte]
Este xénero comprende a especie Influenza B virus.[32] Infecta case en exclusiva aos humanos[35] e é menos frecuente e menos agresivo que o tipo A. Ademais do home, o único animal susceptible de ser infectado por este tipo de virus é a foca.[36] Este virus ten unha taxa de mutación de 2 a 3 veces máis baixa que o tipo A[37] polo que é xeneticamente menos diverso, coñecéndose soamente un serotipo do grupo B.[35] A consecuencia desta carencia de variabilidade antixénica un certo grado de inmunidade fronte a este tipo adquírese normalmente desde a infancia. Con todo, presenta o suficiente grado de mutación como para impedir a inmunidade completa e definitiva.[38] Está reducida taxa de cambios antixénicos, en combinación co seu limitado rango de hóspedes posibles determina a inexistencia de pandemias de virus tipo B.[39]
Influenzavirus C
[editar | editar a fonte]Este xénero posúe unha especie: o Influenza C virus,[32] que infecta a humanos e a porcos, e que pode causar cadros graves e epidemias locais en animais.[40] O tipo C é menos frecuente que os outros dous tipos, e parece ser responsable con certa frecuencia de cadros banais en nenos.[41][42]
Estrutura e propiedades
[editar | editar a fonte]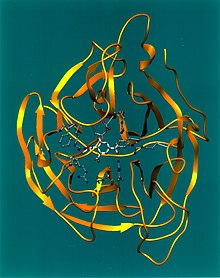
Os Influenzavirus A, B e C posúen unha estrutura moi parecida.[43] As partículas víricas alcanzan un diámetro de entre 80 e 120 nanómetros cunha forma máis ou menos esférica, aínda que en ocasións poden verse algúns exemplares de tipo filamentoso.[44] Aínda que infrecuente para un virus o seu xenoma non é un fragmento único de ácido nucleico senón que contén sete ou oito fragmentos de ARN inverso. O xenoma do tipo A codifica 11 proteínas: hemaglutinina (HA), neuraminidase (NA), nucleoproteína (NP), M1, M2, NS1, NS2(NEP), PA, PB1, PB1-F2 e PB2.[45]
HA e NA son grandes cadeas glicoproteicas que se proxectan do exterior da partícula vírica. HA é unha lectina mediadora da fixazón do virus á célula obxectivo e da entrada do material xenético nela, mentres que NA está involucrada na liberación da proxenie viral desde as células infectadas ao exterior, mediante a ruptura de azucres que ligan ás partículas virales maduras.[46] Estas proteínas son obxectivos para os fármacos antivirais.[47] A están clasificados en subtipos baseándose na resposta antixénica a HA e NA, dando lugar á nomenclatura H e N como se mencionou máis arriba.[24]
Patoxenia
[editar | editar a fonte]Infección
[editar | editar a fonte]
Os virus da gripe fíxanse mediante hemaglutininas aos azucres de ácido siálico da membrana celular das células epiteliais mucosas das fosas nasais, garganta e pulmóns (máis en nasofarinxe e traquea, pois a afectación bronquiolar e alveolar dáse só nos casos graves) nos mamíferos, e do intestino nas aves. (paso 1 da imaxe).[48]
Replicación
[editar | editar a fonte]A célula importa o virus mediante endocitose. Os ciclos de replicación duran entre 4 e 6 horas. No endosoma así formado, parte das proteínas de hemaglutinina fusionan a cuberta viral coa membrana vacúolar, liberando as moléculas de ARN vírico, proteínas accesorias e de ARN polimerase ao citoplasma (Paso 2).[49] Estas proteínas e o ARN forman un complexo que é transportado ao núcleo celular, onde a ARN polimerase comeza a transcribir copias complementarias positivas do ARN inverso (antisentido). (Pasos 3a e b).[50] O ARN vírico pode ser devolto ao citoplasma e traducido (Paso 4), ou permanecer no núcleo. As proteínas víricas recentemente creadas son tamén secretadas mediante o aparello de Golgi cara á superficie celular (no caso da neuraminidase e a hemaglutinina, Paso 5b) ou transportadas de volta ao núcleo para fixarse ao ARNv e formar novas partículas víricas (Paso 5a). Outras proteínas víricas teñen múltiples accións na célula hóspede, incluíndo a propia degradación do ARN celular co fin de empregar os nucleótidos resultantes para a síntese de máis ARNv e inhibindo a transcrición do ARN celular.[51] O xenoma vírico está composto por oito segmentos de ARN dunha soa cadea (monocatenario).[31]
O ARN inverso formado dará lugar ao xenoma de futuros virus, ARN polimerase e outras proteínas virales que se ensamblarán nun novo virión con capacidade infectante. As moléculas de hemaglutinina e neuraminidase agrúpanse formando protuberancias na membrana celular. O ARN vírico e as proteínas da nucleocápside saen do núcleo e entran nestas protuberancias da membrana (Paso 6). Os virus maduros ábrense ao exterior da célula nunha esfera de fosfolípidos de membrana, adquirindo hemaglutinina e neuraminidase xunto con esta cuberta membranosa. (Paso 7).[52] De novo, as partículas víricas así formadas adheriranse a novas células hóspede mediante as hemaglutininas transportadas; os virus maduros libéranse entón unha vez que as neuraminidases rompen os residuos de ácido siálico da célula hóspede.[48] Trala liberación da nova xeración de partículas víricas, a célula hóspede morre.
Mutacións antixénicas
[editar | editar a fonte]Aproximadamente unha vez cada dez mil nucleótidos (a lonxitude do ARN do virus), a ARN polimerase comete un erro na inserción dun nucleótido (debido a ausencia de enzimas de proba de lectura de ARN) o que ocasiona que case cada novo virus creado porta o menos unha mutación.[53] Esas mutacións provocan a variación antixénica dos virus e as dificultades do sistema inmunitario para identificarlos como tales e eliminalos.
A separación do xenoma en oito fragmentos diferentes permite recombinar os cambios se máis dunha estirpe viral infecta a mesma célula. O recambio rápido resultante no material xenético produce cambios antixénicos e permite o virus infectar novas especies hóspedes e superar rapidamente os mecanismos da defensa inmunitaria.[24] Isto ten transcendencia na fase de emerxencia das pandemias como se discutirá na sección de epidemioloxía.
Dano periférico
[editar | editar a fonte]A viremia é excepcional e o virus habitualmente só é localizable nas vías respiratorias, pero en casos graves na autopsia encontráronse virus en fígado, bazo, corazón, rils e ganglios linfáticos. Os síntomas, distais ao aparato respiratorio e habituais da gripe (como a febre, a cefalea ou a astenia) teñen a súa orixe nas enormes cantidades de citoquinas e quemoquinas (como o interferón ou o factor de necrose tumoral) producidas e liberadas polas células infectadas polo virus.[4][54] Pero en contraste co rinovirus, causante do catarro común, a gripe causa certo grao de dano tisular, polo que os síntomas non son exclusivamente debidos a resposta inflamatoria.[55]
Resposta inmune
[editar | editar a fonte]Na defensa inmune contra o virus implícanse 5 mecanismos:
- Inmunidade celular específica, moi temperán, con multiplicación das linfocitos T citotóxicos.
- Resposta inflamatoria inespecífica.
- Produción de interferón.
- Inmunidade humoral con aparición de anticorpos circulantes cun máximo cara á segunda semana que se detectan mediante IHA (inhibición da hemoaglutinación), neutralización, fixación do complemento, ELISA (inmunoabsorción por enzimas) etc.
- Inmunidade humoral con aparición de anticorpos locais (IgA).
A eliminación do virus (cara ao 8.º día) seguramente é debida aos 3 primeiros mecanismos pois os 2 últimos, con produción de anticorpos, son tardíos.
Anatomía patolóxica
[editar | editar a fonte]As células da mucosa que forma o epitelio respiratorio presentan cambios inflamatorios (tumefacción) do núcleo e no espazo intracelular (citoplasma) fórmanse vacúolos ("burbullas") froito de devanditos cambios. Finalmente a célula necrosase (morre) e despréndese deixando a capa basal do epitelio exposta: esta capa é moito máis sensible, é incapaz de reter o moco e a súa exposición é a causa da maior parte dos síntomas respiratorios do cadro.
Cinco días despois iníciase a rexeneración que inicialmente ten aspecto metaplásico (células atípicas) pero que ás dúas semanas adquire un aspecto totalmente normal.
Se se producise unha pneumonía vírica pódese producir a perda de epitelio ciliado na traquea, bronquios e bronquíolos. Os alvéolos pulmonares vense coas paredes engrosadas por edema (líquido no seu interior) e infiltración e cun revestimento membranoso hialino (de tecido conectivo en resposta á inflamación). Con iso o intercambio de osíxeno entre o pulmón e o sangue vese comprometido e o déficit de osíxeno en sangue pode ocasionar unha diminución global de osíxeno dispoñible para os tecidos (hipoxia tisular), coa conseguiente deterioración funcional.
Epidemioloxía
[editar | editar a fonte]A incidencia global calcúlase no 10-20% pero a selectiva, en determinados grupos de poboación, pode chegar ao 40-50 %.
Variacións estacionais
[editar | editar a fonte]A gripe alcanza os seus picos de maior prevalencia durante o inverno, e é debido a que os hemisferios norte e sur atravesan esta estación en diferentes momentos; existen, de feito, dúas tempadas de gripe cada ano: de outubro a abril no hemisferio norte e de maio a setembro no hemisferio sur. Este é o motivo polo que a OMS (asesorada polos Centros Nacionais para a Gripe) fai recomendacións para dúas formulacións vacinais cada ano: unha para cada hemisferio.[56] Ademais do clima e a humidade, o estilo de vida das poboacións e outros factores están asociados á aparición da gripe.[57]
Non está completamente claro por que as epidemias de gripe ocorren con carácter estacional e non de xeito máis uniforme ao longo de todo o ano. Unha posible explicación é que o contacto interpersonal é máis estreito no inverno por permanecer máis tempo no interior de domicilios e edificios, e isto facilitaría unha transmisión do virus de persoa a persoa. Outra explicación é que as temperaturas máis altas dos meses de verán e a maior sequidade do ar limitaría a expulsión do moco por deshidratación do mesmo, dificultando a transmisión a través do mecanismo de aerosol que se dá durante a tose ou o esbirro. O virus tamén pode sobrevivir moito máis tempo nos fomites (obxectos e superficies transmisores como pomos, mesados...) cando o ambiente é máis frío. Os desprazamentos de poboación durante as vacacións de Nadal no hemisferio norte tamén poderían xogar algún papel na súa transmisión.[58] Un factor que pode contribuír ao fenómeno estacional é que a transmisión a través do aerosol mucoso é maior en ambientes fríos (por baixo de 5 °C) e escasa humidade relativa.[59] Con todo, os cambios estacionais nas taxas de infección danse tamén en rexións tropicais e estes picos de infección poden verse principalmente durante a tempada de choivas.[60] Os cambios estacionais nas taxas de contacto durante os períodos escolares parecen xogar un rol máis importante que noutras enfermidades escolares como o xarampón e a tose ferina. Unha combinación destes pequenos factores estacionais pode verse amplificada por fenómenos de resonancia dinámica cos ciclos endóxenos de enfermidades rexionais.[61]
Non se coñece o mecanismo polo cal o virus subsiste entre os gromos epidémicos e suxeríronse dúas hipótese:
- O reservorio é humano e hai unha prevalencia interepidémica tan escasa que non é detectable e por iso non se pode actuar contra el.
- O reservorio é animal, probablemente atópase nos porcos en mandas.
Pandemias
[editar | editar a fonte]Nas pandemias, e así se definen, a epidemia progresa ata afectar a todo o planeta. As cinco últimas, do século XX, foron causadas por virus da cepa A, coa aparición dos subtipos:
- 1900-1901: A(H3N8)
- 1918-1919: A(H1N1) (gripe española) con 50 a 100 millóns de mortes
- 1957-1958: A(H2N2) (gripe asiática) con 70.000 falecementos
- 1968-1969: A(H3N2) (gripe de Hong Kong) 47.000 falecementos
- 1977: A(H1N1) (gripe rusa).
- 2009-: A(H1N1) (gripe A).
As tres últimas pandemias orixináronse en Asia, avanzaron cara a occidente e pasaron a América.
As pandemias teñen características comúns:
- aparición dun novo virus gripal de cepa A (no que corresponde aos antíxenos hemaglutinina, neuraminidase ou ambos)
- existencia de poboación mundial sen inmunidade previa por ser un virus novo.
- alta capacidade infectiva (trasmisión) da cepa.
A letalidade acumulada das epidemias supera, en moito, á das pandemias.
Diagnóstico
[editar | editar a fonte]Síntomas e signos
[editar | editar a fonte]
A infección con virus de influenza pode ser asintomática e subclínica sen interferir na capacidade laboral pero con plena infectividade. Son casos nos que o portador, e tamén transmisor, non é consciente da enfermidade. Isto é moi frecuente na gripe por virus C e moito máis raro nos tipos A e B.
Nos humanos os síntomas da gripe teñen unha aparición máis brusca, e son máis graves e máis duradeiros que os síntomas do arrefriado común. A recuperación completa lógrase nunha ou dúas semanas. En ocasións pode ser mortal, especialmente en pacientes debilitados (por ser anciáns ou doentes crónicos) ou con deficiencia inmunolóxica.[24] A gripe pode agravar patoloxías crónicas previas: pacientes con enfisema, bronquite crónica ou asma poden presentar episodios de dispnea durante a fase aguda da gripe e tamén pode agravarse unha patoloxía coronaria previa ou descompensarse un cadro de insuficiencia cardíaca.[62] O tabaco é outro factor de risco que se asocia con cadros máis graves e un incremento da mortalidade, pero non pola súa acción directa na patoxenia senón polas lesións enfisematosas e bronquíticas, previas e subxacentes por el motivadas.[63]
Os síntomas da gripe comezan de xeito brusco (por iso adóitase recordar incluso a hora exacta de aparición): entre 18 ou 72 horas (visto que posúen períodos de incubación extremadamente curtos, que é cando son proclives os contaxios) tralo contacto co virus e a infección. Os primeiros síntomas adoitan ser esbirros con sensación de arrefriado, febre alta de ata 39 °C, cansazo intenso (astenia), con dores musculares e articulares. O malestar xeral adoita provocar o encamamento do paciente durante dous ou tres días, con dores musculares xeneralizados (de maior intensidade en costas e pernas) e con persistente dor articular, máis intenso en ambos xeonllos.
Os síntomas (o que refire o paciente na anamnese) máis habituais son:
- Dor, especialmente nas articulacións (de máis a menos en xeonllos, cóbados e ombreiros), e na musculatura dorsolumbar e das extremidades (é o "trancazo").
- Odinofaxía (dor farínxeo só con deglutir saliva) con sensación de sequidade na garganta.
- Tose xeralmente seca ou non produtiva. A abundante mucosidade suxire complicación traqueal ou parenquimatosa.
- Conxestión nasal con espirros e rinorrea (produción de mucosidade) transparente.
- Febre con calafríos. É alta (38 °C chegando a 41 °C) e dura entre un e sete días, sendo só 3 o habitual (denomínase V gripal á gráfica térmica bifásica na que tras un brusco descenso volve subir nos días cuarto e quinto en ausencia de complicación.
- Cefalea fixa, non pulsátil, que é só consecuencia da febre.
- A epiforia (lagrimeo) é habitual.
- Dor retroocular que non adoita referir espontáneamente o paciente, pero que lle aparece ao pedirlle que lateralice a mirada (este síntoma é moi característico da gripe).
- Dispnea que só adoita producirse se hai patoloxía respiratoria previa.
- Exputoración pero xeralmente soamente ao final do período febril e parte da convalecencia.
- Dor retroesternal leve relacionado coa necrose do epitelio traqueal.
- Dor abdominal (máis habitual en nenos con infección por virus do tipo B).[64]
Os signos (que se evidencian cos 5 alicerces da exploración física: inspección, palpación, percusión, olfatación e auscultación) máis frecuentes son:
- Irritación ocular
- Conxestión da mucosa orofarínxea
- Enrojecimiento da pel, especialmente na cara.
- Os ganglios linfáticos cervicais están sensibles pero sen agrandamento.
- Cheiro a cetona do alento pola lipolíse, tras febre intensa e mantida.
- Auscultación torácica generalmente normal pero ocasionalmente (8-40%) hai roncus e sibilancias e poucas veces estertores crepitantes.
- Bradicardia relativa, menos frecuente que na febre tifoide.
Sensibilidade e especificidade nos síntomas
[editar | editar a fonte]Investigacións sobre os síntomas e signos da gripe demostraron que os mellores indicadores para o diagnóstico dá gripe son:[65]
| Síntomas: | Sensibilidade | Especificidade |
|---|---|---|
| Febre | 86% | 25% |
| Tose | 98% | 23% |
| Conxestión nasal | 70–90% | 20–40% |
Notas da táboa:
- A sensibilidade é a probabilidade de clasificar correctamente a un individuo doente. Por exemplo, o 86% dos pacientes con gripe presentaban febre.
- A especificidade é a probabilidade de definir de forma correcta a un individuo san. Noutras palabras, a maioría (o 75%) da xente con febre non tiña gripe.
- Todos estes achados, especialmente a febre, foron menos sensíbeis e específicos en persoas por encima dos 60 anos.
Dado que os fármacos antivirais son máis eficaces nas primeiras estadias da enfermidade (primeiras 48 horas) é importante o diagnóstico precoz da gripe. A avaliación combinada dos diferentes síntomas listados máis arriba pode mellorar a eficacia do primeiro diagnóstico.[66] No entanto ata evaluando a aparición combinada de síntomas prodúcense erros no diagnóstico, polo que en ocasións recórrese ao teorema de Bayes como ferramenta estatística para afinar o diagnóstico, aínda que hai que ter en conta que a súa aplicabilidade varía coa prevalencia da gripe no momento da súa aplicación: é dicir, durante unha epidemia de gripe ou en pleno inverno é máis probable que determinada combinación de síntomas apunten a unha gripe que, por exemplo, en pleno verán e sen casos de gripe na comunidade.[67] Usando os datos dos CDC (Centros para o Control de Enfermidades-Centers for Disease Control-), a seguinte táboa mostra como a probabilidade de gripe varía coa súa prevalencia:
| Combinacións de síntomas e signos | Sensibilidade | Especificidade | Como se reportou no estudo[68] e previstos durante as epidemias locais de gripe (prevalencia=66%) |
Previstos durante a tempada de gripe (prevalencia=25%) |
Previstos fora da tempada de gripe (prevalencia=2%) | |||
|---|---|---|---|---|---|---|---|---|
| VPP (Valor Preditivo Positivo) | VPN (Valor Preditivo Negativo) | VPP | VPN | VPP | VPN | |||
| Febre e tose | 64% | 67% | 79% | 49% | 39% | 15% | 4% | 1% |
| Febre, tose e dor de garganta | 56 | 71 | 79 | 45 | 39 | 17 | 4 | 2 |
| Febre, tose e conxestión nasal | 59 | 74 | 81 | 48 | 43 | 16 | 4 | 1 |
Dous estudos de análises de decisións[69][70] suxeriron que durante epidemias locais de gripe, a prevalencia estaría en torno ao 70%,[70] e polo tanto, os pacientes con algunha das combinacións de síntomas mencionadas máis arriba deberían, (se estivesen inmunodeprimidos, que é moi improbable), ser tratados con inhibidores da neuraminidase sen necesidade da aplicación do test. Ata en ausencia dunha epidemia local, o tratamento estaría xustificado (segundo algúns, poucos pois, o tratamento sintomático e de sostén adoita preferirse dada a escasa eficacia e a toxicidade dos antivirais actuais, salvo na neogripe A de 2009), na poboación anciá durante a tempada "alta" de gripe xa que a prevalencia estaría por encima do 15%.[70]
Diagnóstico diferencial
[editar | editar a fonte]- arrefriado común: pode ser difícil diferencialo nas súas primeiras fases, pero normalmente os síntomas da gripe son de presentación máis brusca (é característico que o paciente recorde incluso a hora exacta en que apareceron) e son máis intensos e duradeiros que os seus equivalentes no cadro catarral.
- Farinxite estreptocócica: a súa clínica inicial pode ser similar pero pronto aparecen os exsudados purulentos típicos.
- Adenovirus: os seus procesos teñen un inicio progresivo e o dor farínxeo é maior
A maior dificultade diagnóstica, se a epidemia aínda non está estabelecida, pode darse con:
- Enterovirus e arbovirus: teñen un cadro clínico apenas distinguible pero pola contra sen tose. Ambos tipos de virus son, con frecuencia, responsables da chamada gripe abdominal.
- Dengue: ten unha clínica (conxunto de síntomas e de signos) moi similar o da gripe.
Laboratorio
[editar | editar a fonte]Analítica xeral
[editar | editar a fonte]A VSG está pouco acelerada en contraste coa intensidade dos síntomas.
Os leucocitos poden aumentar ao comezo pero o característico é a leucopenia con linfocitose a partir do segundo día. Unha leucocitose superior a 15000 suxire complicación bacteriana.
Tests diagnósticos
[editar | editar a fonte]A dispoñibilidade de tests de laboratorio para o diagnóstico da gripe continúa mellorando. Os CDC dos Estados Unidos publican actualizacións dos test de laboratorio dispoñibles.[71] De acordo cos CDC, o diagnóstico rápido mediante os test de laboratorio dispoñibles teñen unha sensibilidade do 70-75% e unha especificidade do 90-95% en comparación cos cultivos do virus. Estes test poden ser especialmente útiles durante as tempadas de gripe (prevalencia=25%) pero non en ausencia de epidemias locais ou en tempada baixa (prevalencia=10%).
Os métodos serolóxicos (os antíxenos virais detéctanse con inmunofluorescencia ou con ELISA) son pouco útiles en clínica (pero si son moi útiles en epidemioloxía) pois requirese unha valoración e cuantificación evolutivas e obter soro da fase de convalecencia (cando xa cesou o perigo e se retirou o tratamento), de maneira que é positiva se hai cuadruplicación das taxas de anticorpos entre unha cuantificación e a seguinte. Prefírese a proba de anticorpos fixadores do complemento á da inhibición da hemaglutinación porque esta última depende das variacións de cepa ou subtipo.
O test da PCR en tempo real (RT-PCR) positivo na neogripe A determina o paso desde diagnóstico de sospeita a diagnóstico de probabilidade.
O diagnóstico de certeza só é posible coa identificación do virus mediante a inoculación das secrecións farínxeas en cultivos celulares de ril de mono, ou máis habitualmente na cavidade amnial de embrións de polo.
Tratamento
[editar | editar a fonte]Habitual
[editar | editar a fonte]Os consellos xerais para unha persoa afectada de gripe son repouso, inxesta abundante de líquidos, evitar o consumo de alcohol (licor) e tabaco (no caso improbable de que lle apeteza ao paciente, polo menos os primeiros días) e un fármaco que alivie os síntomas, como o paracetamol, que sendo antitérmico e tamén analxésico alivia simultaneamente a febre e a dor. Pódese asociar con codeína (salvo en pacientes respiratorios crónicos pois deprime o centro respiratorio) para así evitar a tose pois é improdutiva e polo tanto a súa supresión non é problemática xa que non provoca acumulación de secrecións. A asociación comercial de paracetamol con codeína non serve pois a dose desta só ten efecto analxésico e non antitoseno.
A aspirina non está indicada en nenos e adolescentes (e o tratamento previo parece aumentar a susceptibilidade de padecela) con síntomas de gripe (e tampouco en calquera outra situación febril) para evitar a aparición do síndrome de Reye, unha complicación infrecuente pero grave do fígado e do cerebro que pode afectarlles cando toman este antiinflamatorio no contexto dalgunhas enfermidades víricas (especialmente a infección por Influenzavirus B).[72]
A pneumonía vírica na súa fase grave adoita requirir ingreso en coidados intensivos e requirir medidas de mantemento como oxixenoterapia, fluidoterapia, fisioterapia e neumoterapia.
Antibióticos
[editar | editar a fonte]Dado que a gripe é unha infección vírica os antibióticos (fármacos antibacterianos, pero inactivos fronte a virus) non melloran o cadro, salvo que se prescriban pola aparición dunha infección bacteriana secundaria, situación na que adoita ser útil a tinguidura de Gram e un antibiograma para elixir o antibiótico adecuado.
Non se deben administrar con fins profilácticos (preventivos), pois ademais da súa inutilidade, así seleccionanse cepas microbianas multiresistentes.
Antivirais
[editar | editar a fonte]

Os fármacos antivirais teñen unha eficacia limitada, teñen toxicidade e os virus poden desenvolver resistencias ás drogas antivirais máis empregadas. Son especialmente útiles en pacientes de alto risco cando a epidemia xa está presente e non hai tempo para vacinar, así como en gromos nosocomiais.
Os dous tipos principais de antivirais son os inhibidores da neuraminidase e os inhibidores M2 (derivados do adamantano).
Inhibidores da neuraminidase
[editar | editar a fonte]Son de primeira elección na infección polo virus da gripe, aínda que o CDC estadounidense recomendou o uso de inhibidores M2 durante a tempada de gripe 2005/06.[73]
Lamentablemente un estudo demostrou que a administración do tratamento antiviral en pacientes con gripe provoca a aparición de resistencia durante a terapia, alterando o prognóstico da enfermidade. Iso ten importancia no impacto que leva o tratar masivamente a unha comunidade (~20% da poboación) durante unha pandemia, o cal pode provocar a desastrosa aparición de cepas resistentes durante o período da administración do tratamento.[74]
O oseltamivir (de nome comercial Tamiflu) e o zanamivir (Relenza) son inhibidores da neuraminidase que foron deseñados para deter a propagación do virus no organismo humano.[75] Teñen un rango alto de efectividade tanto fronte a Influenzavirus A como B. O grupo colaborativo Cochrane para a gripe realizou estudos sobre estes fármacos concluíndo que axudan a reducir os síntomas e as complicacións derivadas da infección.[76] As diferentes cepas de virus da gripe presentan resistencias variables á súa acción polo que é imposible predicir que grado de resistencia se atopara nunha futura pandemia.[77]
Sábese que o oseltamivir é moito máis vulnerable ao desenvolvemento de resistencias que o é o zanamivir, debido á diferenza no seu modo de acción.[74] Con todo, o zanamivir é un medicamento inhalado, de modo que pode non ser adecuado para o tratamento dunha infección sistémica posto que as concentracións do zanamivir, aínda que moi boas no tracto respiratorio, non alcanzan un efecto sistémico adecuado.[74]
O oseltamivir úsase en dose profiláctica nos casos sospeitosos de neogripe A para pasar a doses terapéutica cando o laboratorio confirma o diagnóstico.
Inhibidores M2 (adamantanos)
[editar | editar a fonte]Os antivirais amantadina e rimantadina foron deseñados para bloquear un canle iónico (proteína M2) e previr así a entrada do virus ás células hóspede. Estes fármacos son en ocasións eficaces fronte o Influenzavirus A se se administran precozmente, pero son sempre ineficaces fronte ao grupo B.[78] A resistencia medida a amantadina e rimantadina en cepas americanas illadas de H3N2 incrementouse ata un 91% no 2005.[79] A actividade dos admantanos parece ser pouco eficaz contra as cepas H5N1.[74]
Complicacións
[editar | editar a fonte]As complicacións da gripe ocorren máis a miúdo en pacientes maiores de 64 anos de idade, así como naqueles con certos trastornos crónicos, como enfermidades cardíacas e pulmonares, diabetes mellitus, hemoglobinopatías, disfunción renal e inmunodepresión.[31] A pulmonía é a complicación máis grave da gripe e pode presentarse como pneumonía gripal "primaria", pneumonía bacteriana secundaria ou pneumonía mixta, vírica e bacteriana.
Pneumonía vírica
[editar | editar a fonte]- Artigo principal: Pneumonía.
É a menos frecuente pero a máis grave de todas as complicacións pneumónicas. Actualmente só aparece en pacientes con bronquite crónica, enfisema, cardiopatía -xeralmente con estenose mitral-, en deficiencias inmunolóxicas- como na diabetes mellitus, SIDA etc.- e xa máis raramente no embarazo, frecuente na pandemia de 1918.
Aparece como cadro gripal que non se resolve e no que hai aumento da febre, expectoración escasa pero sanguiñolenta, taquipnea con dificultade respiratoria intensa e, finalmente, cianose central.
O paciente tende a sentar na cama pola aparición de ortopnea, pois respira mellor sentado que estando incorporado.
Como en todas as pneumonías atípicas virais non hai consolidación pulmonar completa, os alvéolos seguen ventilando e por iso a exploración auscultatoria pode ser anódina, con murmurio vesicular normal.
Contrastando co anterior as radiografías de tórax mostran infiltrados moi difusos que son xeralmente bilaterais e centrais (perihiliares). É conveniente pedir a radiografía anteroposterior e tamén a lateral esquerda para así evaliar mellor a extensión pneumónica. A gasometría arterial mostra intensa hipoxia.
O curso adoita ser moi grave e o exitus letalis, malia todas as terapias, adoita sobrevenir aos 7 días.
Pneumonía bacteriana
[editar | editar a fonte]- Artigo principal: Pneumonía bacteriana.
As bacterias patóxenas máis frecuentes son Streptococcus pneumoniae, Staphylococcus aureus e Haemophilus influenzae, que probablemente están previamente na farinxe e causan a infección por diminuír as defensas broncopulmonares durante o cadro gripal.
A pneumonía bacteriana adoita comezar cando xa hai franca melloría do cadro gripal, uns 2-3 días tralo inicio da enfermidade.
O esputo faise purulento, a auscultación é de evidente consolidación pulmonar e as radiografías de tórax mostran os signos habituais da pneumonía.
As bacterias poden identificar por hemocultivo e menos frecuentemente por cultivo de esputo, pero o virus gripal xa non se pode identificar por transcorrer máis dunha semana desde o inicio da enfermidade.
O prognóstico é moito mellor que o da pneumonía vírica dada a habitual eficacia dos antibióticos se se aplican rapidamente, salvo que o xerme responsable sexa resistente a eles.
Pneumonía mixta
[editar | editar a fonte]É un cadro clínico mestura dos dous anteriores pois hai empeoramento na fase aguda e posteriormente os síntomas son os típicos da pneumonía bacteriana e, quizais, a máis frecuente das complicacións pneumónicas.
A extensión adoita ser menor que a habitual na pneumonía vírica e responde ben aos antibióticos, o que induce a pensar que as bacterias son o axente patóxeno predominante.
Síndrome de Reye
[editar | editar a fonte]- Artigo principal: Síndrome de Reye.
Nesta síndrome hai encefalopatía e dexeneración graxa do fígado. Aparece ocasionalmente na infección polo virus B da gripe e menos na infección polo A.[31] Tamén aparece ás veces co virus varicela-zóster (VVZ).
Ao parecer está relacionado coa administración de aspirina en nenos e adolescentes prepuberales (ata 16-18 anos) para o tratamento da gripe ou da varíola.[80]
Hai náuseas e vómitos durante un ou dous días, seguidos de trastornos mentais, desde letarxia a coma,[81] con hepatomegalia (aumento do tamaño do fígado) e elevación dos niveis no soro sanguíneo das encimas aspartato aminotransferasa (GOT), alanina aminotransferasa (GPT) e LDH en sangue, pero permanecendo a bilirrubina normal e sen presentar ictericia.[82] A mortalidade descendeu ao 20% aínda que nestes casos o prognóstico é moi malo ou mortal.[81] Nas autopsias de pacientes falecidos da síndrome de Reye non se adoita atopar o virus nin en cerebro nin en fígado.[Cómpre referencia]
Outras
[editar | editar a fonte]Outras complicacións menos frecuentes descritas en asociación coa gripe inclúen:
- Traqueite.
- Exacerbación de bronquite crónica, que con frecuencia evoluciona a descompensación e insuficiencia respiratorias.
- Sinusite e otite media, que teñen a sintomatoloxía e requiren o tratamento habitual.
- Musculares, como a miosite, rabdomiolise e como consecuencia mioglobinuria.
Xa máis raramente, pero que si foron frecuentes na pandemia de 1918, poden presentarse:
Outras complicacións neurolóxicas, de presentación moi ocasional, son parálise de pares craniais, mielite, xordeira, afasia, hemiplexía, síndrome de Guillain-Barré e psicose, pero a relación co proceso gripal non está totalmente demostrada.[31]
Prognóstico
[editar | editar a fonte]A maioría das persoas que contraen a gripe recupéranse nunha ou dúas semanas (unha de enfermidade e outra de convalecencia), pero algunhas desenvolven complicacións graves como pneumonía.[57] Segundo a OMS: "Cada inverno, dez millóns de persoas contraen a gripe. A maioría só enferman e auséntanse do traballo durante unha semana, pero a poboación anciá presenta un maior risco de complicacións mortais. Sabemos que a cantidade de falecementos anuais é duns centos de miles de individuos, pero mesmo nos países desenvolvidos as cifras son incertas porque as autoridades médicas non adoitan verificar quen morre realmente a consecuencia da gripe e non doutros cadros parecidos".[83] Incluso a poboación sa pode verse afectada e a calquera idade poden producirse complicacións graves. O grupo de poboación de persoas por encima dos 50 anos, os nenos pequenos e a poboación de calquera idade con patoloxía crónica teñen maior risco de padecer esas complicacións, como pneumonía, bronquite, sinusite ou otite.[84]
Prevención
[editar | editar a fonte]Os suplementos vitamínicos demostráronse inútiles, tanto os de vitamina C (inocua pois a sobrante adóitase eliminar por ouriños) como os da vitamina D, coa que hai que levar máis coidado pois ao ser liposoluble e non hidrosoluble pode acumularse e provocar intoxicación se se dan doses altas.
Vacinación
[editar | editar a fonte]Existen vacinas e antivirais para a profilaxe e o tratamento das infeccións polo virus da gripe. As vacinas están formuladas a partir de virus inactivados ou virións atenuados da gripe humana H1N1 e H3N2, así como os dos virus da influenza B. Debido a que a antixenicidade dos virus salvaxes evolucionan, as vacinas se reformulan anualmente. Con todo, cando a antixenicidade das cepas que forman parte das vacinas e a dos virus salvaxes que circulan entre a poboación non coinciden, as vacinas deixan de ser efectivas. Noutras ocasións, mesmo cando ambas as antixenicidades coinciden, pódese dar o caso de que aparezan mutantes que escapan á vacina. Os fármacos máis frecuentes inclúen a amantadina, que inhibe a perda da envoltura dos virións ao interferir con M2, e oseltamivir, que inhibe a liberación dos virións das células infectadas ao interferir con NA. Con todo, os mutantes que son capaces de escapar á vacina xeráronse, principalmente, en ex-usuarios de drogas e con menor frecuencia para o último fármaco.[85]
Realizáronse varios estudos co obxectivo de demostrar a inmunoxenicidade da vacina inactivada contra a gripe. En 1976 atopouse que dita inmunidade persistía ao cabo de tres anos posterior á vacinación do tipo monovalente A.[86] Un ano despois reportouse que os individuos vacinados durante unha epidemia de influenza tipo A presentaban inmunidade a partir do oitavo ou noveno día despois da vacinación e persistía ao cabo dun ano. En 1982 comprobouse a eficacia da vacina trivalente en 75 recrutas do exército italiano e centos doutros voluntarios doutros países.[86]

A vacinación antigripal está amplamente recomendada para grupos de alto risco,[57] que son aqueles nos que as complicacións da gripe poden ser graves:
- Maiores de 60 anos
- Menores de 5 anos
- Inmunodeprimidos (diabetes, sida, trasplantados etc.).
- Con enfermidade grave previa especialmente respiratoria (enfisema, bronquite etc) ou cardíaca (infarto de miocardio, valvulopatías, insuficiencia etc.).
Ademais dos grupos de risco é habitual a vacinación anual do persoal de servizos sociais básicos como médicos, docentes, bombeiros ou militares.
En xeral a vacina adminístrase a todo aquel con maior indefensión ante as complicacións por déficit inmunitario e tamén a todo aquel que o solicite dadas as súas escasas contraindicacións (hipersensibilidade ou alerxia ás proteínas de ovo ou aos antibióticos usados no cultivo dos virus), a fin de dificultar a transmisión todo o posible.
A vacinas fronte ao virus da gripe poden fabricarse seguindo diferentes procesos: o máis habitual é o cultivo de virus en proteínas de ovo de galiña. Tras a súa purificación o virus é inactivado (mediante o uso de axentes químicos (deterxentes) ou físicos para producir unha vacina que poden ser de virus íntegros ou fraccionados, estas últimas son de elección en nenos por ocasionar menor número de reaccións febrís. Tamén poden realizarse cultivos de virus en proteínas de ovo ata que perden o seu virulencia xerando así vacinas.
As de virus vivos atenuados para administración nasal[24] son menos aconsellables en inmunodeprimidos.
A eficacia destas vacinas é variable e non se atopan grandes diferenzas entre as vacinas de virus fraccionado (subviróns) e as vacinas de subunidades, en termos de inocuidade, reactoxenicidade e inmunidade en adultos e anciáns.[87]
Debido á alta taxa de mutación do virus unha formulación vacunal concreta confire inmunidade durante non máis duns poucos anos. Cada ano a OMS realiza unha predición sobre que cepa do virus é máis probable que sexa a causante da seguinte onda, permitindo así á industria farmacéutica o desenvolvemento das vacinas máis apropiadas contra esas cepas.[56] As vacinas tamén se poden desenvolver para protexer ás aves de curral de consumo humano da gripe aviaria. Estas vacinas poden ser eficaces contra múltiples cepas e son usadas xunto co sacrificio selectivo dos animais con maior risco de transmisión de cepas mutadas, como parte dunha estratexia de prevención con obxecto de evitar ou reducir as posibles epidemias e pandemias en humanos.
É posible estar vacinado e aínda así contraer a gripe (un de cada 5 casos) pois a vacina ten unha eficacia de ao redor do 80%. A vacina elabórase antes de cada tempada de gripe para unhas cepas específicas pero pode suceder que se produza a propagación dalgunha cepa non prevista ou mutada. Tárdase ao redor de seis meses en formular e fabricar masivamente unha nova vacina; en ocasións unha nova ou imprevista cepa propágase durante ese período e consegue infectar a moita xente antes de dispoñer dos millóns de doses vacunais necesarias (como sucedeu na epidemia de gripe Fujian (H3N2) na tempada de gripe 2003/04).[88] Tamén é posible infectarse xusto antes da vacinación e enfermar coa cepa supostamente cuberta pola vacina, xa que a vacina tarda unhas dúas semanas en lograr a súa máxima efectividade.[84]
A tempada 2006/07 foi a primeira na que o CDC recomendou a vacinación anual dos nenos menores de 5 anos.[89]
As vacinas contra a gripe son seguras e de cando en cando repórtanse efectos adversos. Os efectos secundarios máis frecuentes son dor, enroxecemento e leve edema no sitio da inxección (20%), dor de cabeza, malestar e debilidade xeneralizada. Con menos frecuencia observáronse mareos e hipotensión. En 1-2% dos casos hai febre e síntomas constitucionais. Pode causar tamén reaccións inmunitarias que se asemellan a unha infección real polo virus, ou a síntomas xerais de infección (moitos síntomas catarrais ou gripais son, en realidade, síntomas xerais inespecíficos de infección), aínda que dunha maneira leve e transitoria.
Os casos máis graves inclúen reaccións alérxicas e broncoespasmo.[87] por reacción fronte a algún dos compoñentes da vacina (residuos das proteínas do ovo ou dos antibióticos empregados para a súa elaboración); non obstante este tipo de reaccións son extremadamente infrecuentes.[90]
Hixiene e asepsia no control da infección
[editar | editar a fonte]Uns adecuados hábitos persoais de hixiene son eficaces tamén para a prevención da infección. As persoas que contraeron a gripe son máis infectivas durante o segundo e terceiro día tras contraela e a súa capacidade infectiva prolóngase durante uns dez días.[91] Os nenos son especialmente infectivos (máis que os adultos) e poden propagar partículas víricas desde antes mesmo da aparición dos seus síntomas, e ata dúas semanas despois.[91][92]
Dado que a gripe contáxiase a través das pingas emitidas en aerosol coa tose, o esbirro e mesmo co fala, e a través do contacto con superficies contaminadas, é de especial importancia recomendar á poboación que se cubra a cara cando tosan ou esbirren, así como o lavado frecuente de mans.[89]
A desinfección de superficies está recomendada nas zonas nas que poida depositarse o virus.[93] O alcohol é un eficaz desinfectante do virus da gripe e se se usa xunto con sales de amonio cuaternario increméntase notablemente a súa eficacia.[94] Nos hospitais os sales de amonio cuaternario e diversos compostos haloxenados, como o hipoclorito de sodio son habitualmente empregados para a desinfección de zonas sanitarias e equipamento médico que foron ocupados ou usados por pacientes con síntomas de gripe.[94]
En anteriores pandemias o peche de colexios, igrexas e teatros retardou a propagación do virus pero non parece ter unha influencia significativa na diminución da taxa de mortalidade.[95][96]
Notas
[editar | editar a fonte]- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para gripe.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para influenza.
- ↑ 3,0 3,1 3,2 Merck Sharp & Dohme de España, S.A. (2005). "CAPÍTULO 186. Infecciones víricas". Manual Merck de información médica para el hogar (en castelán). Arquivado dende o orixinal o 23/07/2013. Consultado o 15/11/2013.
- ↑ 4,0 4,1 Eccles, R (2005). "Understanding the symptoms of the common cold and influenza". Lancet Infect Dis 5 (11): 718–25. PMID 16253889. doi:10.1016/S1473-3099(05)70270-X.
- ↑ Kristina Duda, R.N (22 de decembro de 2006). "Seasonal Flu vs. Stomach Flu". About.com, forma parte de The New York Times Company (en inglés). Arquivado dende o orixinal o 07 de xullo de 2011. Consultado o 1, 10 2008.
- ↑ Lucy Atkins (15 de febreiro de 2005). "It's OK, you can kiss me". The Guardian (en inglés). Consultado o 26, 04 2012.
- ↑ Reid AH, Fanning TG, Hultin JV, Taubenberger JK (1999). "Origin and evolution of the 1918 "Spanish" influenza virus hemagglutinin gene". Proc. Natl. Acad. Sci. U.S.A. 96 (4): 1651–6. PMID 9990079. doi:10.1073/pnas.96.4.1651.
- ↑ J Gen Virol 87 (2006), 3655-3659; DOI 10.1099/vir.0.81843-0 Arquivado 27 de novembro de 2010 en Wayback Machine. article Recent H5N1 avian Influenza A virus increases rapidly in virulence to mice after a single passage in mice says "To prepare the original virus stock for this study, virus was propagated once in the allantoic cavity of embryonated eggs at 37 °C for 1–2 days and then stored at –80 °C until use."
- ↑ Suarez, D; Spackman E, Senne D, Bulaga L, Welsch A, Froberg K (2003). "The effect of various disinfectants on detection of avian influenza virus by real time RT-PCR". Avian Dis 47 (3 Suppl): 1091–5. PMID 14575118.
- ↑ Center for Infectious Disease Research & Policy (CIDRAP) (28 de agosto de 2008). "Avian Influenza (Bird Flu): Implications for Human Disease". Academic Health Center - Universidad de Minnesota (en inglés). Arquivado dende o orixinal o 17 de xuño de 2013. Consultado o 1, 10 2008.
- ↑ Reuters (28 de agosto de 2008). "Flu viruses 'can live for decades' on ice". The New Zealand Herald (en inglés). Consultado o 1, 10 2008.
- ↑ World Health Organization (WHO) (febreiro de 2006). "Avian influenza (" bird flu") - Fact sheet" (en inglés). Consultado o 1, 10 2008.
- ↑ World Health Organization (WHO) (19 de agosto de 2005). "WHO position paper: influenza vaccines" (PDF). Weekly epidemiological record, Vol. 80, 33, pp. 277–288 (en inglés). Consultado o 1, 10 2008.
- ↑ Villegas, P (1998). "Viral diseases of the respiratory system". Poult Sci 77 (8): 1143–5. PMID 9706079.
- ↑ Horwood, F; Macfarlane J (2002). "Pneumococcal and influenza vaccination: current situation and future prospects" (PDF). Thorax. 57 Suppl 2: II24–II30. PMID 12364707.
- ↑ Martin, P; Martin-Granel E (2006). "2,500-year evolution of the term epidemic". Emerg Infect Dis (en inglés) 12 (6). PMID 16707055. Arquivado dende o orixinal o 30/04/2011. Consultado o 16/11/2013.
- ↑ Hippocrates; Adams, Francis (transl.) (400 BCE). "Of the Epidemics". Consultado o 18-10-2006.
- ↑ 18,0 18,1 18,2 Potter, CW (2006). "A History of Influenza". J Appl Microbiol. 91 (4): 572–579. PMID 11576290. doi:10.1046/j.1365-2672.2001.01492.x. Arquivado dende o orixinal o 10 de maio de 2021. Consultado o 09 de maio de 2021.
- ↑ 19,0 19,1 Patterson, KD; Pyle GF (1991). "The geography and mortality of the 1918 influenza pandemic". Bull Hist Med. 65 (1): 4–21. PMID 2021692.
- ↑ 20,0 20,1 20,2 20,3 20,4 Knobler S, Mack A, Mahmoud A, Lemon S (ed.). "1: The Story of Influenza". The Threat of Pandemic Influenza: Are We Ready? Workshop Summary (2005). Washington, D.C.: The National Academies Press. pp. 60–61.
- ↑ 21,0 21,1 21,2 Taubenberger, J; Reid A, Janczewski T, Fanning T (2001). "Integrating historical, clinical and molecular genetic data in order to explain the origin and virulence of the 1918 Spanish influenza virus". Philos Trans R Soc Lond B Biol Sci 356 (1416): 1829–39. PMID 11779381. doi:10.1098/rstb.2001.1020.
- ↑ Simonsen, L; Clarke M, Schonberger L, Arden N, Cox N, Fukuda K (1998). "Pandemic versus epidemic influenza mortality: a pattern of changing age distribution". J Infect Dis 178 (1): 53–60. PMID 9652423.
- ↑ Tumpey, Terrence M; et al. (2005). "Characterization of the Reconstructed 1918 Spanish Influenza Pandemic Virus". Science 310 (77). doi:10.1126/science.1119392.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Hilleman, M (2002). "Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control". Vaccine 20 (25–26): 3068–87. PMID 12163258. doi:10.1016/S0264-410X(02)00254-2.
- ↑ Shimizu, K (1997). "History of influenza epidemics and discovery of influenza virus". Nippon Rinsho 55 (10): 2505–201. PMID 9360364.
- ↑ Smith, W; Andrewes CH, Laidlaw PP (1933). "A virus obtained from influenza patients". Lancet 2: 66–68. doi:10.1016/S0140-6736(00)78541-2.
- ↑ The Nobel Prize in Chemistry 1946
- ↑ Sir Frank Macfarlane Burnet: Biography The Nobel Foundation. Consultado o 22 de outubro de 2006
- ↑ Hoyt, Kendall (2006-04-01). "Vaccine Innovation: Lessons from World War II". Journal of Public Health Policy (en inglés) 27 (1): 38–57. ISSN 1745-655X. doi:10.1057/palgrave.jphp.3200064. Consultado o 12 de abril de 2022.
- ↑ Kawaoka Y (editor). (2006). Caister Academic Press, ed. Influenza Virology: Current Topics (en inglés). ISBN 978-1-904455-06-6. Consultado o 17/11/2013.
- ↑ 31,0 31,1 31,2 31,3 31,4 Harrison Principios de Medicina Interna 16a edición (2006). McGraw-Hill, ed. "Influenza o gripe". Harrison online en español (en castelán). Arquivado dende o orixinal o 08/11/2014. Consultado o 17/11/2013.
- ↑ 32,0 32,1 32,2 Base de datos do ICTV (ed.). "Virus Taxonomy". Consultado o 17/11/2013.
Lista de especies do Xénero Influenzavirus A
- ↑ Klenk; et al. (2008). "Avian Influenza: Molecular Mechanisms of Pathogenesis and Host Range". En Caister Academic Press. Animal Viruses: Molecular Biology (en inglés). ISBN 978-1-904455-22-6. Consultado o 17/11/2013.
- ↑ Fouchier, R; Schneeberger P, Rozendaal F, Broekman J, Kemink S, Munster V, Kuiken T, Rimmelzwaan G, Schutten M, Van Doornum G, Koch G, Bosman A, Koopmans M, Osterhaus A (2004). "Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome". Proc Natl Acad Sci U S a 101 (5): 1356–61. PMID 14745020. doi:10.1073/pnas.0308352100. Arquivado dende o orixinal o 12/01/2008. Consultado o 17/11/2013.
- ↑ 35,0 35,1 Hay, A; Gregory V, Douglas A, Lin Y (2001). "The evolution of human influenza viruses". Philos Trans R Soc Lond B Biol Sci 356 (1416): 1861–70. PMID 11779385. doi:10.1098/rstb.2001.0999.
- ↑ Osterhaus, A; Rimmelzwaan G, Martina B, Bestebroer T, Fouchier R (2000). "Influenza B virus in seals". Science 288 (5468): 1051–3. PMID 10807575. doi:10.1126/science.288.5468.1051.
- ↑ Nobusawa, E; Sato K (2006). "Comparison of the mutation rates of human influenza A and B viruses". J Virol 80 (7): 3675–8. PMID 16537638. doi:10.1128/JVI.80.7.3675-3678.2006.
- ↑ R, Webster; Bean W, Gorman O, Chambers T, Kawaoka Y (1992). "Evolution and ecology of influenza A viruses". Microbiol Rev 56 (1): 152–79. PMID 1579108.
- ↑ Zambon, M (1999). "Epidemiology and pathogenesis of influenza". Journal of Antimicrobial Chemotherapy. 44 Suppl B: 3–9. PMID 10877456. doi:10.1093/jac/44.suppl_2.3.
- ↑ Matsuzaki, Y; Sugawara K, Mizuta K, Tsuchiya E, Muraki Y, Hongo S, Suzuki H, Nakamura K (2002). "Antigenic and genetic characterization of influenza C viruses which caused two outbreaks in Yamagata City, Japan, in 1996 and 1998". J Clin Microbiol 40 (2): 422–9. PMID 11825952. doi:10.1128/JCM.40.2.422-429.2002.
- ↑ Matsuzaki, Y; Katsushima N, Nagai Y, Shoji M, Itagaki T, Sakamoto M, Kitaoka S, Mizuta K, Nishimura H (2006). "Clinical features of influenza C virus infection in children". J Infect Dis 193 (9): 1229–35. PMID 16586359. doi:10.1086/502973.
- ↑ Katagiri, S; Ohizumi A, Homma M (1983). "An outbreak of type C influenza in a children's home". J Infect Dis 148 (1): 51–6. PMID 6309999.
- ↑ International Committee on Taxonomy of Viruses descriptions of: Orthomyxoviridae, Influenzavirus B and Influenzavirus C
- ↑ International Committee on Taxonomy of Viruses. "The Universal Virus Database, version 4: Influenza A".
- ↑ Ghedin, E; Sengamalay N, Shumway M, Zaborsky J, Feldblyum T, Subbu V, Spiro D, Sitz J, Koo H, Bolotov P, Dernovoy D, Tatusova T, Bao Y, St George K, Taylor J, Lipman D, Fraser C, Taubenberger J, Salzberg S (2005). "Large-scale sequencing of human influenza reveals the dynamic nature of viral genome evolution". Nature 437 (7062): 1162–6. PMID 16208317. doi:10.1038/nature04239.
- ↑ Suzuki, Y (2005). "Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses". Biol Pharm Bull 28 (3): 399–408. PMID 15744059. doi:10.1248/bpb.28.399. Arquivado dende o orixinal o 12 de xaneiro de 2009. Consultado o 17 de novembro de 2013.
- ↑ Wilson, J; von Itzstein M (2003). "Recent strategies in the search for new anti-influenza therapies". Curr Drug Targets 4 (5): 389–408. PMID 12816348. doi:10.2174/1389450033491019.
- ↑ 48,0 48,1 Wagner, R; Matrosovich M, Klenk H (2002). "Functional balance between haemagglutinin and neuraminidase in influenza virus infections". Rev Med Virol 12 (3): 159–66. PMID 11987141. doi:10.1002/rmv.352.
- ↑ Lakadamyali, M; Rust M, Babcock H, Zhuang X (2003). "Visualizing infection of individual influenza viruses". Proc Natl Acad Sci U S a 100 (16): 9280–5. PMID 12883000. doi:10.1073/pnas.0832269100.
- ↑ Cros, J; Palese P (2003). "Trafficking of viral genomic RNA into and out of the nucleus: influenza, Thogoto and Borna disease viruses". Virus Res 95 (1–2): 3–12. PMID 12921991. doi:10.1016/S0168-1702(03)00159-X.
- ↑ Kash, J; Goodman A, Korth M, Katze M (2006). "Hijacking of the host-cell response and translational control during influenza virus infection". Virus Res 119 (1): 111–20. PMID 16630668. doi:10.1016/j.virusres.2005.10.013.
- ↑ Nayak, D; Hui E, Barman S (2004). "Assembly and budding of influenza virus". Virus Res 106 (2): 147–65. PMID 15567494. doi:10.1016/j.virusres.2004.08.012.
- ↑ Drake, J (1993). "Rates of spontaneous mutation among RNA viruses". Proc Natl Acad Sci USA 90 (9): 4171–5. PMID 8387212. doi:10.1073/pnas.90.9.4171.
- ↑ Schmitz N, Kurrer M, Bachmann M, Kopf M (2005). "Interleukin-1 is responsible for acute lung immunopathology but increases survival of respiratory influenza virus infection". J Virol 79 (10): 6441–8. PMID 15858027. doi:10.1128/JVI.79.10.6441-6448.2005.
- ↑ Winther B, Gwaltney J, Mygind N, Hendley J (1998). "Viral-induced rhinitis". Am J Rhinol 12 (1): 17–20. PMID 9513654. doi:10.2500/105065898782102954.
- ↑ 56,0 56,1 Recommended composition of influenza virus vaccines for use in the 2006–2007 influenza season WHO report 14 de febreiro de 2006. Visto 31/01/2015 (en inglés)
- ↑ 57,0 57,1 57,2 GUTIERREZ, Eliana Battaggia, LI, Ho Yeh, SANTOS, Ana Catarina De Seixas et al. Effectiveness of influenza vaccination in elderly outpatients in São Paulo city, Brazil. Rev. Inst. Med. trop. S. Paulo [online]. 2001, vol. 43, no. 6 [citado o 10 de setembro de 2008], pp. 317-320. Dispoñíbel na World Wide Web: [1]. ISSN 0036-4665. doi: 10.1590/S0036-46652001000600003. (en inglés)
- ↑ Weather and the Flu Season NPR Day to Day, 17 de decembro de 2003. Visto 31/01/2015 (en inglés)
- ↑ Lowen AC, Mubareka S, Steel J, Palese P (2007). "Influenza virus transmission is dependent on relative humidity and temperature". PLoS Pathog. (en inglés) 3 (10): 1470–6. PMID 17953482. doi:10.1371/journal.ppat.0030151.
- ↑ Shek LP, Lee BW. "Epidemiology and seasonality of respiratory tract virus infections in the tropics." Paediatr Respir Rev. 2003 Jun;4(2):105–11. PMID 12758047
- ↑ Dushoff J, Plotkin JB, Levin SA, Earn DJ. "Dynamical resonance can account for seasonality of influenza epidemics." Proc Natl Acad Sci U S A. 30 de novembro de 2004;101(48):16915–6. PMID 15557003
- ↑ Angelo SJ, Marshall PS, Chrissoheris MP, Chaves AM. "Clinical characteristics associated with poor outcome in patients acutely infected with Influenza A." Conn Med. 2004 Apr;68(4):199–205. PMID 15095826
- ↑ Murin S, Bilello K (2005). "Respiratory tract infections: another reason not to smoke". Cleve Clin J Med 72 (10): 916–20. PMID 16231688.
- ↑ Kerr AA, McQuillin J, Downham MA, Gardner PS (1975). "Gastric 'flu influenza B causing abdominal symptons in children". Lancet 1 (7902): 291–5. PMID 46444. doi:10.1016/S0140-6736(75)91205-2.
- ↑ 65,0 65,1 65,2 Call S, Vollenweider M, Hornung C, Simel D, McKinney W (2005). "Does this patient have influenza?". JAMA 293 (8): 987–97. PMID 15728170. doi:10.1001/jama.293.8.987.
- ↑ Monto A, Gravenstein S, Elliott M, Colopy M, Schweinle J (2000). "Clinical signs and symptoms predicting influenza infection". Arch Intern Med (en inglés) 160 (21): 3243–7. PMID 11088084. doi:10.1001/archinte.160.21.3243. Consultado o 24/02/2015.
- ↑ Centers for Disease Control and Prevention. Weekly Report: Influenza Summary Update. Consultado o 1 de xaneiro de 2007.
- ↑ .
- ↑ Smith K, Roberts M (2002). "Cost-effectiveness of newer treatment strategies for influenza". Am J Med 113 (4): 300–7. PMID 12361816. doi:10.1016/S0002-9343(02)01222-6.
- ↑ 70,0 70,1 70,2 Rothberg M, Bellantonio S, Rose D (2003). "Management of influenza in adults older than 65 years of age: cost-effectiveness of rapid testing and antiviral therapy". Ann Intern Med (en inglés) 139 (5 Pt 1): 321–9. PMID 12965940. Consultado o 24/02/2015.
- ↑ Centers for Disease Control and Prevention. Lab Diagnosis of Influenza. Aceso o 5 de Abril de 2015
- ↑ Glasgow, J; Middleton B (2001). "Reye syndrome — insights on causation and prognosis". Arch Dis Child (en inglés) 85 (5): 351–3. PMID 11668090. doi:10.1136/adc.85.5.351.
- ↑ Centers for Disease Control and Prevention, ed. (21 de xullo do 2006). "2005-06 U.S. INFLUENZA SEASON SUMMARY" (en inglés). Consultado o 15 de agosto do 2015.
- ↑ 74,0 74,1 74,2 74,3 CALVO A., Mario. Otra nueva mala noticia en gripe aviar Oseltamivar resistance during treatment of Influenza A (H5N1) infection Jong MD, Thanh TT, Khanh TH, Hien VM et al. NEJM 353; 25: 2667-72. Rev. chil. infectol. [online]. Mar. 2006, vol.23, no.1 [citado 10 setembro de 2008], p.84-85. Dispoñíbel na World Wide Web: [2]. ISSN 0716-1018.
- ↑ Moscona, A (2005). "Neuraminidase inhibitors for influenza". N Engl J Med (en inglés) 353 (13): 1363–73. PMID 16192481. doi:10.1056/NEJMra050740. Arquivado dende o orixinal o 02 de xaneiro de 2008. Consultado o 15 de agosto do 2015.
- ↑ Jefferson, T; Demicheli V, Di Pietrantonj C, Jones M, Rivetti D (2006). "Neuraminidase inhibitors for preventing and treating influenza in healthy adults". Cochrane Database Syst Rev 3: CD001265. PMID 16855962. doi:10.1002/14651858.CD001265.pub2.
- ↑ Webster, Robert G. (2006). "H5N1 Influenza — Continuing Evolution and Spread". N Engl J Med (en inglés) 355 (21): 2174–77. PMID 16192481. doi:10.1056/NEJMp068205. Arquivado dende o orixinal o 05 de decembro de 2006. Consultado o 15 de agosto do 2015.
- ↑ Stephenson, I; Nicholson K (1999). "Chemotherapeutic control of influenza". J Antimicrob Chemother 44 (1): 6–10. PMID 10459804. doi:10.1093/jac/44.1.6.
- ↑ "High levels of adamantane resistance among influenza A (H3N2) viruses and interim guidelines for use of antiviral agents — United States, 2005–06 influenza season". MMWR Morb Mortal Wkly Rep 55 (2): 44–6. 2006. PMID 16424859.
- ↑ Síndrome de Reye en Medlineplus (en castelán)
- ↑ 81,0 81,1 Síndrome de Reye (en castelán)
- ↑ El síndrome de Reye y su relación con el ácido acetilsalicílico Arquivado 04 de febreiro de 2017 en Wayback Machine. en Butlletí groc Universidade Autónoma de Barcelona (en castelán)
- ↑ Peter M. Sandman and Jody Lanard "Bird Flu: Communicating the Risk" Arquivado 23 de abril de 2011 en Wayback Machine. 2005 Perspectives in Health Magazine Vol. 10 issue 2.
- ↑ 84,0 84,1 Key Facts about Influenza (Flu) Vaccine Arquivado 28 de febreiro de 2018 en Wayback Machine. CDC publication. Publicado o 17 de outubro de 2006. Consultado o 18 de outubro de 2006.
- ↑ Suzuki, Yoshiyuki (2006). "Natural Selection on the Influenza Virus Genome". Mol. Biol. Evol 23 (10): 1902–1911. PMID 16818477. doi:10.1093/molbev/msl050.
- ↑ 86,0 86,1 MANCINI, Dalva A. Portari, NASCIMENTO, Elvira M. Mendes do, TAVARES, Valéria Rosa et al. Vacina inativada contra gripe trivalente: estudo comparativo da resposta imunitária pelos métodos de inibição de hemaglutinação e da hemólise radial simples. Rev. Saúde Pública [online]. 1985, vol. 19, no. 5 [citado 2008-09-10], pp. 438-443. Disponível em: [3]. ISSN 0034-8910. doi: 10.1590/S0034-89101985000500007.
- ↑ 87,0 87,1 MORALES, A., ARIAS SALAZAR, J., SALAZAR, Y. et al. A randomized controlled trial comparing split and subunit influenza vaccines in adults in Colombia. Medicina (B. Aires). [online]. mayo/jun. 2003, vol.63, no.3 [citado 10 setembro de 2008], p.197-204. Disponible en la World Wide Web: [4]. ISSN 0025-7680.
- ↑ Holmes E, Ghedin E, Miller N, Taylor J, Bao Y, St George K, Grenfell B, Salzberg S, Fraser C, Lipman D, Taubenberger J (2005). "Whole-genome analysis of human influenza A virus reveals multiple persistent lineages and reassortment among recent H3N2 viruses". PLoS Biol 3 (9): e300. PMID 16026181. doi:10.1371/journal.pbio.0030300.
- ↑ 89,0 89,1 Prevention and Control of Influenza: Recommendations of the Advisory Committee on Immunization Practices (ACIP) CDC report (MMWR 2006 Jul 28;55(RR10):1–42) visto 19 de oct 2006.
- ↑ Questions & Answers: Flu Shot Arquivado 17 de xullo de 2018 en Wayback Machine. CDC publication updated 24 de xullo de 2006. Visto 19 de outubro 06.
- ↑ 91,0 91,1 Carrat F, Luong J, Lao H, Sallé A, Lajaunie C, Wackernagel H (2006). "A 'small-world-like' model for comparing interventions aimed at preventing and controlling influenza pandemics". BMC Med 4: 26. PMID 17059593. doi:10.1186/1741-7015-4-26.
- ↑ Mitamura K, Sugaya N (2006). "Diagnosis and Treatment of influenza—clinical investigation on viral shedding in children with influenza]". Uirusu 56 (1): 109–16. PMID 17038819. doi:10.2222/jsv.56.109.
- ↑ Hota B (2004). "Contamination, disinfection, and cross-colonization: are hospital surfaces reservoirs for nosocomial infection?". Clin Infect Dis 39 (8): 1182–9. PMID 15486843. doi:10.1086/424667.
- ↑ 94,0 94,1 McDonnell G, Russell A (1999). "Antiseptics and disinfectants: activity, action, and resistance". Clin Microbiol Rev 12 (1): 147–79. PMID 9880479. Arquivado dende o orixinal o 22 de outubro de 2008. Consultado o 08 de xullo de 2018.
- ↑ Hatchett RJ, Mecher CE, Lipsitch M (2007). "Public health interventions and epidemic intensity during the 1918 influenza pandemic". Proc Natl Acad Sci U S A. 104 (18): 7582–7587. PMID 17416679. doi:10.1073/pnas.0610941104. Arquivado dende o orixinal o 09 de marzo de 2008. Consultado o 08 de xullo de 2018.
- ↑ Bootsma MC, Ferguson NM (2007). "The effect of public health measures on the 1918 influenza pandemic in U.S. cities". Proc Natl Acad Sci U S A. 104 (18): 7588–7593. PMID 17416677. doi:10.1073/pnas.0611071104. Arquivado dende o orixinal o 22 de marzo de 2020. Consultado o 08 de xullo de 2018.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Gripe |
Bibliografía
[editar | editar a fonte]Xeral
- Artigo (en castelán) sobre a gripe aviar no New England Journal of Medicine
- Bernd Sebastian Kamps, Christian Hoffmann e Wolfgang Preiser (Eds.) Influenza Report 2006 Editorial Flying 2006.
- Gripe (en castellano). The Journal of the American Medical Association.
- Samuel Baron, et al. Medical Microbiology Cuarta Edición, The University of Texas Medical Branch at Galveston, 1996, ISBN 0-9631172-1-1.
- Cox NJ, Subbarao K. "Influenza". Lancet. 1999 Oct 9;354(9186):1277–82. PMID 10520648
Historia
- Edwin D. Kilbourne, "Influenza Pandemics of the 20th Century", Emerging Infectious Diseases Número Especial: Influenza, Vol. 12, No. 1, xaneiro de 2006
- Richard Collier, The Plague of the Spanish Lady, Editorial Macmillan (Londres), 1974, ISBN 0-7490-0246-8
- John M. Barry, The Great Influenza: the Epic Story of the Deadliest Plague in History, Penguin, 2004, ISBN 0-670-89473-7
Microbioloxía
- Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y. "Evolution and ecology of influenza A viruses" Microbiol Rev. 1992 Mar;56(1):152–79. PMID 1579108
- Scholtissek C. "Molecular epidemiology of influenza". Arch Virol Suppl. 1997;13:99–103. PMID 9413530
Patoxénese
- Adolfo García-Sastre "Antiviral Response in Pandemic Influenza Viruses" Emerging Infectious Diseases Special Issue: Influenza Vol. 12, No. 1, xaneiro 2006
- Zambon MC. "The pathogenesis of influenza in humans". Rev Med Virol. 2001 Jul–Ag;11(4):227–41. PMID 11479929
Epidemioloxía
- Walter R. Dowdle "Influenza Pandemic Periodicity, Virus Recycling, and the Art of Risk Assessment" Emerging Infectious Diseases Special Issue: Influenza Vol. 12, No. 1, xaneiro de 2006
- Horimoto T, Kawaoka Y. "Pandemic threat posed by avian influenza A viruses". Clin Microbiol Rev. 2001 Jan;14(1):129–49. PMID 11148006
- Epidemiology of WHO-confirmed human cases of avian influenza A(H5N1) infection
Prevención e tratamento
- CDC 2005. Centers for Disease Control. Prevention and Control of Influenza Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2005; 54 (RR08): 1–40.
- Arnold S. Monto, "Vaccines and Antiviral Drugs in Pandemic Preparedness", Emerging Infectious Diseases Special Issue: Influenza Vol. 12, No. 1, xaneiro de 2006
- MOUNIER-JACK, Sandra, JAS, Ria e COKER, Richard. Progresos y deficiencias de los planes estratégicos nacionales europeos para afrontar una gripe pandémica. Bull World Health Organ [en liña]. 2007, vol. 85, no. 12 [citado 9 de setembro de 2008], pp. 923-929. ISSN 0042-9686. doi: 10.1590/S0042-96862007001200012.
Investigación
- Peter Palese, "Making Better Influenza Virus Vaccines?", Emerging Infectious Diseases Special Issue: Influenza Vol. 12, No. 1, xaneiro 2006
- WHO (PDF) contains latest Evolutionary "Tree of Life" for H5N1 article Antigenic and genetic characteristics of H5N1 viruses and candidate H5N1 vaccine viruses developed for potential use as pre-pandemic vaccines publicado o 18 de agosto de 2006
- WHO's assessment of Flu Research novembro de 2006.
Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- "O que tes que saber sobre a gripe está na túa man", información sobre a doenza na web do Sergas.

