Anticorpo
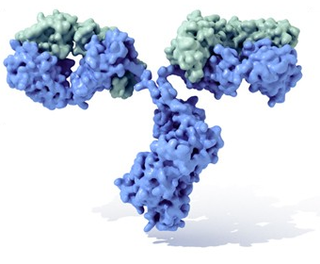
Os anticorpos (tamén coñecidos como inmunoglobulinas, abreviado Ig) son glicoproteínas de tipo gammaglobulina, a fracción de globulinas máis abundante no plasma sanguíneo. Poden encontrarse en forma soluble no sangue ou noutros fluídos corporais dos vertebrados, ou poden estar inseridos na membrana plasmática, onde actúan como receptores nos linfocitos B. Son empregados polo sistema inmunitario para neutralizar patóxenos tales como bacterias, virus e parasitos.[1] En xeral, considérase que anticorpo e inmunoglobulina son termos equivalentes, facendo referencia o primeiro termo á función, mentres que o segundo alude á estrutura. O termo gammaglobulina refírese ás propiedades electroforéticas das inmunoglobulinas solubles no soro sanguíneo, se ben algunhas inmunoglobulinas migran coas fraccións alfa, beta e incluso coa albumina.
Un anticorpo típico está constituído por unidades estruturais básicas, cada unha delas con dous grandes cadeas pesadas e dúas cadeas lixeiras de menor peso molecular. A molécula de anticorpo ten forma de Y; os extremos dos brazos do Y son o fragmento Fab por onde se une ao antíxeno; o pé do Y é o fragmento Fc. As moléculas dos anticorpos poden aparecer por separado, como monómeros, ou asociarse entre si formando dímeros con dúas unidades ou pentámeros con cinco unidades. Os anticorpos son sintetizados por un tipo de leucocito denominado linfocito B ou célula B. Existen distintos tipos de anticorpo, chamados isotipos, diferenciados pola forma da cadea pesada que presenten. Coñécense cinco clases de isotipos en mamíferos que desempeñan funcións diferentes, contribuíndo a dirixir a resposta inmune axeitada para cada distinto tipo de corpo estraño que encontran, que son: IgA, IgD, IgE, IgG e IgM.[2]
Aínda que a estrutura xeral de todos os anticorpos é moi semellante, unha pequena rexión do ápice da proteína é extremadamente variable, o cal permite a existencia de millóns de anticorpos, cada un cun extremo lixeiramente distinto. Esta parte da proteína coñécese como rexión hipervariable e dá lugar a millóns de anticorpos distintos. Cada unha destas variantes pode unirse a unha "diana" distinta, que é o antíxeno.[3] Esta enorme diversidade de anticorpos permite ao sistema inmunitario recoñecer unha diversidade igualmente elevada de antíxenos. O anticorpo non recoñece o antíxeno na súa globalidade, senón que só recoñece certas partes del. Esa parte do antíxeno recoñecida polo anticorpo denomínase epítopo. Un antíxeno pode ter múltiples epítopos na súa superficie. Estes epítopos únense co seu anticorpo nunha interacción altamente específica que se denomina adaptación inducida, que permite aos anticorpos identificar e unirse soamente ao seu único antíxeno en medio dos millóns de moléculas diferentes que compoñen un organismo.
O recoñecemento dun antíxeno por un anticorpo deixa o antíxeno marcado para ser atacado por outros compoñentes do sistema inmunitario. Os anticorpos tamén poden neutralizar os seus obxectivos directamente, mediante, por exemplo, a unión a unha porción dun patóxeno necesaria para que este provoque unha infección.
A extensa poboación de anticorpos e a súa diversidade xérase por combinacións ao azar dun xogo de segmentos xenéticos que codifican diferentes lugares de unión ao antíxeno (ou parátopos), que posteriormente, durante o desenvolvemento do linfocito, sofren mutacións aleatorias nesta zona do xene do anticorpo, o cal orixina unha diversidade aínda maior.[2][4] Os xenes dos anticorpos tamén se reorganizan nun proceso coñecido como cambio de clase das inmunoglobulinas que cambia a cadea pesada por outra, creando un isotipo de anticorpo diferente pero mantendo a rexión variable específica para o antíxeno diana. Isto posibilita que un só anticorpo poida ser usado polas diferentes partes do sistema inmunitario. A produción de anticorpos é a función principal do sistema inmunitario humoral.[5]

Historia
[editar | editar a fonte]En 1890 comezou o estudo dos anticorpos cando Emil Adolf von Behring e Shibasaburo Kitasato describiron a actividade dos anticorpos contra as toxinas da difteria e o tétano.[9] Behring e Kitasato propuxeron a teoría da inmunidade humoral, que establecía a existencia dun mediador no soro sanguíneo que podería reaccionar cun antíxeno estraño, dándolle o nome de anticorpo.[10][11] A súa idea levou en 1897 a Paul Ehrlich a propoñer a teoría da cadea lateral sobre a interacción entre antíxeno e anticorpo e elaborar a hipótese de que existían receptores (descritos como "cadeas laterais") na superficie das células que se poderían unir especificamente a toxinas —nunha interacción de tipo chave e pechadura— e que esta reacción de acoplamento era a causante da produción de anticorpos.[12]
En 1904, seguindo a idea doutros investigadores de que os anticorpos se encontraban libres no sangue, Almroth Wright suxeriu que os anticorpos solubles recubrían as bacterias para sinalalas para a súa fagocitose e destrución nun proceso denominado opsonización.[13]
Na década de 1920, Michael Heidelberger e Oswald Avery descubriron a natureza dos postulados anticorpos ao observar que os antíxenos podían ser precipitados por eles e demostrando que estes eran un tipo de proteínas.[14]

A finais da década de 1930 John Marrack examinou as propiedades bioquímicas das unións antíxeno-anticorpo.[15] Logo, na década de 1940 tivo lugar o seguinte avance de importancia, cando Linus Pauling confirmou a teoría da chave e a pechadura proposta por Ehrlich mostrando que as interaccións entre anticorpos e antíxenos dependían máis da súa forma que da súa composición química.[16] En 1948, Astrid Fagreaus descubriu que os linfocitos B transformados en células plasmáticas eran responsables da produción de anticorpos.[17]
Os seguintes traballos de investigación concentráronse na caracterización da estrutura molecular dos anticorpos:
- A principios da década de 1960 prodúcese o principal avance neste sentido, co descubrimento por Gerald M. Edelman e Joseph Gally da cadea lixeira,[18] e a comprensión de que esta era idéntica á proteína de Bence Jones descrita en 1845 por Henry Bence Jones.[19] Edelman continuou co descubrimento de que os anticorpos estaban compostos por cadeas lixeiras e pesadas unidas por enlaces disulfuro.
- Polas mesmas datas, Rodney Porter caracterizou as rexións de unión do antíxeno no anticorpo (Fab ou F antigen-binding) e a cola do anticorpo (Fc) no tipo IgG.[20] Conxuntamente, estes científicos deduciron a estrutura e a secuencia completa de aminoácidos da IgG, polo cal recibiron ex aequo o Premio Nobel de Fisioloxía ou Medicina en 1972.[20]
- Aínda que a maioría destes primeiros estudos se centraron nas IgM e IgG, identificáronse tamén outros isotipos de inmunoglobulinas na década de 1960: Thomas Tomasi descubriu os anticorpos secretados (IgA)[21] e David Rowe e John Fahey identificaron a IgD,[22] e a IgE foi identificada por Kikishige Ishizaka e Teruki Ishizaka como unha clase de anticorpos implicados en reaccións alérxicas.[23]
- En 1975 César Milstein e Georges J.F. Köhler idean o método para a produción de anticorpos monoclonais.[24] En 1976, os estudos xenéticos revelaron a base da vasta diversidade dos anticorpos ao identificar Susumu Tonegawa a recombinación somática dos xenes de inmunoglobulina.[25]
Formas de anticorpos
[editar | editar a fonte]
Os linfocitos B activados diferéncianse en células plasmáticas, cuxa función é a produción de anticorpos solubles ou ben en linfocitos B de memoria, que sobreviven no organismo durante os anos seguintes para posibilitar que o sistema inmune lembre o antíxeno e responda máis rápido a futuras exposicións ao axente inmunóxeno.[26] Os anticorpos son, por tanto, un produto esencial do sistema inmunitario adaptativo que aprenden e lembran as respostas a patóxenos invasores. Os anticorpos encóntranse en dúas formas: en forma soluble segregada no sangue e outros fluídos do corpo e en forma unida á membrana celular que está ancorada á superficie dun linfocito B.
Forma soluble
[editar | editar a fonte]Os anticorpos solubles son segregados por un linfocito B activado (na súa forma de célula plasmática) para unirse a substancias estrañas e sinalizalas para a súa destrución polo resto do sistema inmunitario. Tamén se lles podería chamar anticorpos libres ata que se unen a un antíxeno e acaban como parte dun complexo antíxeno-anticorpo ou denominalos anticorpos segregados. Nesta forma soluble as inmunoglobulinas únense a moléculas adicionais. Nas IgM, por exemplo, encontramos unha glicoproteína unida á fracción constante mediante pontes disulfuro duns 15 KDa, chamada cadea J. Ao isotipo IgA, ademais, úneselle a chamada "peza de secreción". Trátase dunha glicoproteína que se forma nas células epiteliais e glándulas exócrinas, e que posteriormente se une á inmunoglobulina para facilitar a súa secreción.[27]
Forma ancorada á membrana
[editar | editar a fonte]A forma ancorada á membrana dun anticorpo poderíase chamar inmunoglobulina de superficie (sIg) ou inmunoglobulina de membrana (mIg), xa que non é segregado: sempre está asociado á membrana plasmática. Forma parte do receptor do linfocito B (BCR), que permite a este detectar cando un antíxeno específico está presente no organismo, desencadenando a activación do linfocito B.[28] O BCR componse de anticorpos IgD ou IgM unidos á superficie de membrana e os seus heterodímeros asociados Ig-α e Ig-β que teñen capacidade de realizar a transdución de sinais do recoñecemento do anticorpo ao interior da célula.[29] Un linfocito B humano típico ten entre 50 000 e 100 000 anticorpos unidos á súa superficie.[29] Tralo acoplamento do antíxeno, estes agrúpanse formando grandes parches cuxo diámetro pode superar 1μm en balsas lipídicas que illan os BCR (receptores da célula B) da maior parte dos restantes receptores de sinalización celular.[29] Estes parches poderían mellorar a eficiencia da resposta inmune celular.[30] Nos seres humanos, a superficie celular está libre doutras proteínas arredor dos receptores dos linfocitos B en distancias dalgúns miles de ángstroms,[29] o cal reduce de tal maneira as influencias que compiten coa súa función, que se pode dicir que illa os BCR.
- Véxase tamén: Receptor da célula T.
Isotipos, alotipos e idiotipos
[editar | editar a fonte]| Nome | Tipos | Descrición | Complexos de anticorpos |
| IgA | 2 | Encóntrase nas mucosas, como o tubo dixestivo, o tracto respiratorio e o tracto uroxenital. Impide a súa colonización por patóxenos.[31] Tamén se encontran na saliva, as bágoas e o leite materno. Presenta a cadea pesada α. | 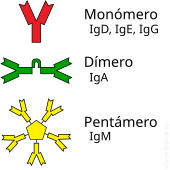
|
| IgD | 1 | A súa función consiste principalmente en servir de receptor de antíxenos nos linfocitos B que non foron expostos aos antíxenos.[32] A súa función está menos definida que noutros isotipos. Presenta a cadea pesada δ. | |
| IgE | 1 | Únese a alérxenos e desencadea a liberación de histamina polas células cebadas e basófilos e está implicada na alerxia. Tamén protexen contra vermes parasitos. Presenta a cadea pesada ε.[5] | |
| IgG | 4 | Proporcionan, nas súas catro formas, a maior parte da protección inmunitaria baseada en anticorpos contra os patóxenos invasores.[5] É o único anticorpo que pode cruzar a placenta para proporcionar ao feto inmunidade pasiva. Presenta a cadea pesada γ. | |
| IgM | 1 | Exprésase na superficie dos linfocitos B e en forma de secreción con gran avidez pola súa diana. Elimina os patóxenos nos estadios temperáns da resposta inmune mediada por linfocitos B (humoral) ata que existen suficientes IgG. Presenta a cadea pesada μ.[5][32] |
Os anticorpos poden presentarse en distintas variedades coñecidas como isotipos ou clases. En mamíferos placentarios existen cinco isotipos de anticorpos chamados IgA, IgD, IgE, IgG e IgM, con distintas cadeas pesadas. Noméanse mediante o prefixo "Ig" que significa inmunoglobulina e difiren nas súas propiedades biolóxicas, localizacións funcionais e capacidade para recoñecer diferentes tipos de antíxenos como se mostra na táboa.[33]
O isotipo cambia durante o desenvolvemento e a activación dos linfocitos B. Antes da maduración destes últimos, cando aínda non se expuxeron ao seu antíxeno, coñécense como linfocitos B virxes e só expresan o isotipo IgM na súa forma ancorada á superficie celular. Os linfocitos comezan a expresar tanto IgM coma IgD unidas a membrana cando alcanzan a madurez e nese momento están listos para responder ao seu antíxeno.[34] A activación dos linfocitos B segue ao encontro e unión deste co seu antíxeno, o que estimula a célula para que se divida e se diferencie nunha célula produtora de anticorpos denominada plasmática. Nesta forma activada, os linfocitos B comezan a segregar anticorpos en lugar de ancoralos á membrana. Algunhas células fillas dos linfocitos B activados sofren un cambio isotípico, un mecanismo que provoca que a produción de anticorpos nas formas IgM ou IgD se trasmute aos outros tipos, IgE, IgA ou IgG, que desempeñan distintos papeis no sistema inmunitario.
| Nome | Tipos | Descrición |
|---|---|---|
| IgY | Atópase en aves e réptiles; está relacionada coa IgG de mamíferos.[35] | |
| IgW | Propia de peixes elasmobranquios (tiburóns, raias); relacionada coa IgD de mamíferos.[36] |
Alotipos
[editar | editar a fonte]Enténdese por alotipos os distintos anticorpos que teñen pequenas diferenzas na secuencia de aminoácidos na rexión constante das cadeas lixeiras e pesadas producidos polos distintos individuos dunha especie, que se herdan de forma mendeliana[27]. En seres humanos describíronse 3 tipos de determinantes alotípicos:
- En 1956 Grubb e Laurell descobren o sistema Gm na clase de inmunoglobulinas IgG. Este sistema puxo de manifesto os diversos alotipos das cadeas pesadas. Tamén permite diferenciar catro subclases nestas moléculas: IgG1, IgG2, IgG3 e IgG4 que están determinadas xeneticamente.[37]
- C. Ropartz e colaboradores descubriron en 1961 o sistema Km (chamado Inv inicialmente), localizado na cadea lixeira Kappa. Este alotipo está presente en todas as clases de inmunoglobulina.
- Tamén existe o sistema ISf, situado na cadea pesada γ1 da IgG1. A expresión desta especificidade aumenta coa idade, e dáse nun 25 % dos suxeitos antes dos 20 anos e ata nun 60 % despois dos 70 anos nos caucasoides.
- Os alotipos definidos polo sistema Am sitúanse nas IgA, e máis precisamente nas cadeas α2. Existen dous isotipos, α1 e α2, que caracterizan as subclases Am1 e Am2 das IgA.[38]
Idiotipo
[editar | editar a fonte]O idiotipo son as diferenzas atopadas nas Ig na parte hipervariable das cadeas pesada e lixeira, que son propias das moléculas de anticorpos pertencentes a un clon en particular. Este elemento forma parte ou está moi próximo ao lugar de recoñecemento do antíxeno, e está situado na porción variable Fab. O parátopo é a parte da rexión variable do anticorpo que se une ao antíxeno. Fronte aos idiotipos formaríanse anticorpos (anticorpos de anticorpos). Segundo a teoría de Jerne, a formación de anticorpos antiidiotipo formaría unha rede (rede de Jerne) cuxa función sería a regulación da síntese de novas inmunoglobulinas.[27].
Estrutura
[editar | editar a fonte]Os anticorpos son proteínas plasmáticas globulares pesadas (~150 kDa), tamén chamadas inmunoglobulinas. Teñen cadeas de azucres unidas a algún dos seus residuos de aminoácidos, polo que son glicoproteínas.[39] A unidade básica funcional dos anticorpos é o monómero de inmunoglobulina, que contén unha soa unidade de Ig. Os anticorpos segregados tamén poden ser dímeros con dúas unidades de Ig, como no caso das IgA, tetraméricos con catro unidades Ig como nas IgM de teleósteos, ou pentaméricos con cinco unidades de IgM, como no caso das IgM de mamíferos.[40]
Primeiros traballos
[editar | editar a fonte]As primeiras investigacións sobre a estrutura dos anticorpos foron realizadas por medio de sinxelas dixestións con pepsina e papaína por Rodney Robert Porter e Gerald M. Edelman, seguidas de electroforese. Ambos recibiron por isto o Premio Nobel de medicina en 1972. Tamén foi importante a figura de Alfred Nisonoff:
- Na década de 1950, Porter fixo unha dixestión suave con papaína, obtendo tres fragmentos, dous dos cales retiñan a especificidade de antíxeno (fragmento Fab, do inglés ab=antigen-binding), mentres que o terceiro non mostraba actividade de unión e podía cristalizar (fragmento Fc, c=cristalizable).
- En 1959, Edelman, utilizando 2-mercaptoetanol e urea, seguido de electroforese, consegue illar as cadeas lixeiras e pesadas, ao disociar os seus enlaces disulfuro e non covalentes.
- Ese mesmo ano, Porter identificou os compoñentes das cadeas lixeiras e pesadas que se encontraban nos seus fragmentos dixeridos con papaína e pepsina, e conseguiu medir os seus pesos moleculares.
- En 1960, Nisonoff demostrou que a dixestión con pepsina de IgG producía un fragmento bivalente, que en realidade está formado por outros dous, que el denominou F (ab')2.[42]
Dominios de inmunoglobulina
[editar | editar a fonte]O monómero de Ig é unha molécula en forma de "Y" que consta de dúas cadeas de polipéptido; dúas cadeas pesadas idénticas e dúas cadeas lixeiras idénticas conectadas por enlaces disulfuro.[33] Cada cadea componse de dominios estruturais chamados dominios Ig. Estes dominios conteñen entre 70 e 110 aminoácidos e clasifícanse en diferentes categorías, por exemplo en variables (IgV) e constantes (IgC) de acordo co seu tamaño e función.[43] Teñen un "pregamento de inmunoglobulina" característico no cal dúas láminas beta xeran unha forma de "sándwich", permanecendo xuntas por interaccións entre cisteínas ben conservadas ao longo da evolución, así como outros aminoácidos cargados.
Cadea pesada
[editar | editar a fonte]Hai cinco tipos de Ig en mamíferos que se nomean por letras gregas: α, δ, ε, γ e μ.[3] O tipo de cadea pesada presente define a clase (isotipo) do anticorpo. Estas cadeas encóntranse nos anticorpos IgA, IgD, IgE, IgG, e IgM, respectivamente. As distintas cadeas pesadas difiren en tamaño e composición: α e γ conteñen aproximadamente 450 aminoácidos, mentres que μ e ε posúen aproximadamente 550 aminoácidos.[3]
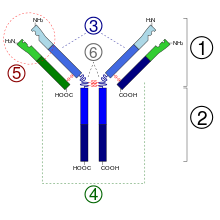
2. Rexión Fc
3. Cadea pesada cun dominio variable (VH) seguido por un dominio constante (CH1), unha rexión bisagra, e dous máis constantes, os dominios (CH2 e CH3).
4. Cadea lixeira cun dominio variable (VL) e un constante (CL)
5. Lugar de unión co antíxeno (parátopo)
6. Rexións bisagra.
As cadeas pesadas γ, α e δ teñen unha rexión constante composta de tres dominios estruturais Ig en tándem e unha rexión bisagra para proporcionarlle flexibilidade.[33] As cadeas pesadas μ e ε teñen unha rexión constante composta por catro dominios de inmunoglobulina.[3] A rexión variable da cadea pesada é distinta nos anticorpos producidos nos diferentes linfocitos B, mais é idéntica para todos os anticorpos producidos polo mesmo linfocito B ou pola súa liña clonal. A rexión variable de cada cadea pesada é de aproximadamente 110 aminoácidos e está composta por un único dominio Ig.
Recentemente puido determinarse a topoloxía in vivo do xene da cadea pesada, Igh, no que foi un dos primeiros estudos nese campo. O resultado é que a cromatina se dispón formando xiros sucesivos unidos por linkers, dando lugar a formas similares a unha flor. A posición relativa dos distintos segmentos varía drasticamente ao longo do desenvolvemento do linfocito B, permitindo así un maior rango de interaccións xenómicas.[44]
Cadea lixeira
[editar | editar a fonte]Nos mamíferos hai dous tipos de cadea lixeira, chamados lambda (λ) e kappa (κ).[3] Unha cadea lixeira contén dous dominios sucesivos: un dominio constante e outro variable. A lonxitude aproximada da cadea lixeira é de 211 a 217 aminoácidos.[3] Cada anticorpo contén dúas cadeas lixeiras que son sempre idénticas. Só un tipo de cadea lixeira, κ ou λ, está presente dentro do mesmo anticorpo en mamíferos. Outros tipos de cadeas lixeiras como a cadea iota (ι), encóntranse en vertebrados inferiores, como os peixes condrictios e teleósteos.
Rexións Fab e Fc
[editar | editar a fonte]Algunhas partes do anticorpo teñen funcións únicas. Os extremos dos brazos do "Y", por exemplo, conteñen o lugar que se une ao antíxeno e, por tanto, recoñecen elementos estraños específicos e neles acaban os extremos N-terminais das cadeas polipeptídicas lixeira e pesada. Esta rexión do anticorpo chámase fragmento de unión ao antíxeno ou rexión Fab. Está composta por un dominio constante e outro variable de cada unha das cadeas lixeira e pesada do anticorpo.[45] O parátopo está conformado polos dominios variables das cadeas pesada e lixeira no seu extremo amino terminal. O papel que desempeña a base ou pé do "Y" consiste en modular a actividade da célula inmunitaria. Esta rexión chámase fragmento cristalizable ou Fc e está composta por dous ou tres dominios constantes de ambas as cadeas pesadas, o tipo de cadea pesada depende da clase do anticorpo. O pé termina nos extremos C-terminal das cadeas pesadas.[3] Mediante a unión a proteínas específicas a rexión Fc asegura que cada anticorpo xera unha resposta inmune axeitada para un antíxeno dado.[46] A rexión Fc tamén se une a varios receptores celulares como o receptor do Fc e outras moléculas do sistema inmunitario como as proteínas do complemento. Ao efectuar isto, intervén na mediación de diferentes efectos fisiolóxicos como o recoñecemento de partículas opsonizadas (uníndose a FcγR), lise celular (uníndose ao complemento) e desgranulación das células cebadas, basófilos e eosinófilos (uníndose a FcεR).[33][47]
Función
[editar | editar a fonte]- Véxase tamén: Sistema inmunitario.

Como os anticorpos se encontran en forma libre no torrente sanguíneo, dise que forman parte do sistema inmunitario humoral. Os anticorpos circulantes son producidos por liñas clonais de linfocitos B que responden especificamente a un antíxeno, que pode ser un fragmento de proteína da cápside viral, por exemplo. Os anticorpos contribúen á inmunidade de tres formas: poden impedir que os patóxenos entren nas células ou as danen ao unirse a elas (neutralización). Poden estimular a eliminación dun patóxeno polos macrófagos e outras células recubrindo o patóxeno (opsonización) e poden desencadear a destrución directa do patóxeno estimulando outras respostas inmunes como a vía do complemento (lise).[48]
Os principais tipos de acción dos anticorpos no sistema inmunitario poden resumirse nos seguintes:
- Neutralización, na cal anticorpos neutralizantes bloquean partes da superficie dunha célula bacteriana ou virión para facer que o seu ataque non sexa efectivo ou neutralizan toxinas.
- Aglutinación, na cal os anticorpos fan que as células alleas "se peguen unhas a outras" formando grupos compactos que son dianas atractivas para a fagocitose.
- Precipitación, na cal os anticorpos fan que se "peguen entre si" os antíxenos solubles no soro, o que causa a súa precipitación fóra da solución en grupos que despois serán fagocitados.
- Activación do complemento (fixación), na cal os anticorpos que están unidos á superficie das células alleas favorecen o ataque do complemento e a formación do complexo de ataque á membrana, o que conduce á lise das células alleas e impulsa a inflamación por atracción quimiotáctica de células inflamatorias.
Activación do complemento
[editar | editar a fonte]Os anticorpos que se unen á superficie dos antíxenos, por exemplo nunha bacteria, atraen os primeiros compoñentes da fervenza do complemento por medio da súa rexión Fc e inician a activación do sistema "clásico" do complemento.[48] Isto acaba coa morte da bacteria de dúas formas:[5] Primeiro, a unión das moléculas do complemento co anticorpo marca o microbio para a inxestión polos fagocitos nun proceso chamado opsonización. Estes fagocitos son atraídos por certas moléculas do complemento. En segundo lugar, algúns compoñentes do sistema do complemento forman un complexo de ataque á membrana para axudar aos anticorpos a matar a bacteria por medio de lise. Os anticorpos máis efectivos na activación do sistema do complemento son os de tipo IgM e os IgG subclase 1 e 3 (IgG1 e IgG3).[49]
Activación de células efectoras
[editar | editar a fonte]Para combater os patóxenos que se replican no exterior das células, os anticorpos únense aos patóxenos para ensamblalos todos xuntos provocando a súa aglutinación. Como un anticorpo ten polo menos dous parátopos (os que son poliméricos teñen máis) pode unirse a máis dun antíxeno acoplándose a epítopos idénticos presentes nas superficies deses antíxenos. Ao cubriren o patóxeno, os anticorpos estimulan as funcións efectoras contra este nas células que recoñecen a rexión Fc.[5]
Aquelas células que recoñecen os patóxenos recubertos de anticorpos teñen receptores do Fc que, como o seu nome indica, interaccionan coa rexión Fc dos anticorpos IgA, IgG, e IgE. O acoplamento dun anticorpo particular co receptor Fc dunha determinada célula desencadea nela unha función efectora: os fagocitos realizarán a fagocitose, as células cebadas e os neutrófilos sufrirán a desgranulación, as células asasinas naturais liberarán citocinas e moléculas citotóxicas que finalmente acabarán destruíndo o microbio invasor. Os receptores Fc son específicos do isotipo, o que dá unha maior flexibilidade ao sistema inmune, afectando só ao mecanismo inmune adecuado para os distintos patóxenos.[3]

Anticorpos naturais
[editar | editar a fonte]Os humanos e primates superiores producen tamén os chamados "anticorpos naturais" que están presentes no soro sanguíneo xa antes de que se producise a infección viral. Os anticorpos naturais foron definidos como anticorpos que se producen sen que exista unha infección previa, vacinación, exposición a outros antíxenos alleos ou inmunización pasiva. Estes anticorpos poden activar a vía do complemento clásica, o que orixina a lise de partículas víricas con envoltura moito antes de que se active a resposta inmunitaria adaptativa. Moitos anticorpos naturais son dirixidos contra o disacárido galactosa α(1,3)-galactosa (α-Gal), que se encontra como azucre terminal de proteínas da superficie celular glicosiladas, e xéranse en resposta á produción deste azucre polas bacterias que se encontran no tracto dixestivo humano.[50] O rexeitamento de órganos xenotransplantados crese que se produce, en parte, como resultado de anticorpos naturais circulantes no soro do receptor que se unen a antíxenos α-Gal expresados no tecido do doante.[51]
Interaccións antíxeno-anticorpo
[editar | editar a fonte]O parátopo do anticorpo (situado nos extremos dos brazos do Y) interacciona co epítopo do antíxeno. Un antíxeno xeralmente contén diferentes epítopos ao longo da súa superficie, dispostos de forma descontinua, e os epítopos dominantes dun antíxeno denomínanse determinantes antixénicos.
O antíxeno e o anticorpo interaccionan por complementariedade espacial (como unha chave na súa pechadura). As forzas moleculares implicadas nas interaccións do extremo Fab do anticorpo co epítopo do antíxeno son débiles e non específicas, como forzas electrostáticas, enlaces de hidróxeno, interaccións hidrofóbicas, e forzas de van der Waals. Isto significa que a unión entre o anticorpo e o antíxeno é reversible, e a afinidade do anticorpo cara ao antíxeno é relativa en vez de absoluta. Unha unión relativamente feble tamén significa que é posible que un anticorpo estableza reaccións cruzadas con diferentes antíxenos que teñen distintas afinidades relativas.
Con frecuencia, unha vez que un anticorpo se une co seu antíxeno, estes forman un inmunocomplexo, que funciona como un obxecto unitario e mesmo pode actuar como un antíxeno de seu, que será contrarrestado por outros anticorpos. De xeito similar, os haptenos son pequenas moléculas que non provocan unha resposta inmune por si sós, pero que unha vez que se unen a proteínas, o complexo resultante aduto hapteno-portador é antixénico.
Diversidade das inmunoglobulinas
[editar | editar a fonte]Practicamente todos os microorganismos poden desencadear a resposta dos anticorpos. O recoñecemento e a erradicación con éxito de tipos moi distintos de microbios require que os anticorpos posúan unha enorme diversidade. A súa composición de aminoácidos varía para permitirlles interaccionar con antíxenos moi diferentes.[52] Estimouse que os seres humanos xeran uns 10 mil millóns de anticorpos diferentes, cada un deles con capacidade de unirse a un epítopo distinto.[53] Aínda que se xera un enorme repertorio de diferentes anticorpos nun mesmo individuo, o número de xenes dispoñible para fabricar estas proteínas é limitado. Nos vertebrados evolucionaron diferentes mecanismos xenéticos complexos para permitir que os linfocitos B xeren esta diversidade a partir dun número relativamente pequeno de xenes de anticorpos.[54]
Variabilidade de dominios
[editar | editar a fonte]
A rexión (locus) do cromosoma que codifica un anticorpo é grande e contén varios xenes diferentes para cada dominio do anticorpo, que se combinan entre si. O locus que contén os xenes para as cadeas pesadas (IGH@) encóntrase en humanos no cromosoma 14 e os loci que conteñen os xenes lambda e kappa da cadea lixeira (IGL@ e IGK@) encóntranse no 22 e no 2. Un destes dominios é coñecido como "dominio variable" está presente en todas as cadeas lixeiras e pesadas dos anticorpos, pero pode ser diferente entre os distintos anticorpos xerados polas diversas liñas de linfocitos B. As diferenzas entre os dominios variables localízanse en tres bucles coñecidos como rexións hipervariables (HV-1, HV-2 e HV-3) ou rexións determinantes da complementariedade (CDR1, CDR2 e CDR3). As CDR son mantidas dentro dos dominios variables por rexións armazón conservadas. O locus da cadea pesada contén uns 65 xenes de dominio variable distintos, que difiren nos seus CDR. Combinando estes xenes con varios xenes doutros dominios xérase un gran continxente de anticorpos cun alto grado de variabilidade. Esta combinación denomínase recombinación V(D)J.[55]
Recombinación V(D)J
[editar | editar a fonte]- Artigo principal: Recombinación V(D)J.

A recombinación somática das inmunoglobulinas, chamada recombinación V(D)J, consiste na xeración dunha rexión variable de inmunoglobulina exclusiva formada pola combinación de varios segmentos xénicos. A rexión variable de cada inmunoglobulina pesada está codificada por varias partes, denominadas segmentos, chamados segmento variable (V), de diversidade (D) e de acoplamento —joining, en inglés— (J).[54] Os segmentos V, D e J encóntranse nas cadeas pesadas. Nas lixeiras só encontramos os segmentos V e J. Hai múltiples copias de todos estes segmentos organizadas en tándem no xenoma dos mamíferos. Na medula ósea cada linfocito B en desenvolvemento ensambla a rexión variable da súa inmunoglobulina seleccionando e combinando ao chou un segmento V cun D e outro J na cadea pesada e un V e outro J na cadea lixeira. Como existen múltiples copias lixeiramente distintas para cada secuencia xenética dos segmentos, vanse dar diferentes combinacións que por medio deste proceso xeran un elevado número de parátopos e tamén diferentes especificidades de antíxeno.[2]
As proteínas RAG xogan un importante papel na recombinación V(D)J ao cortaren o ADN en determinadas rexións.[56] Sen a presenza destas proteínas a recombinación V(D)J non pode ocorrer.[56]
Trala produción dunha inmunoglobulina funcional por un linfocito B durante a recombinación V(D)J este non poderá expresar ningunha rexión variable diferente (este proceso chámase exclusión alélica). Por tanto, cada linfocito B só pode producir anticorpos que conteñen un só tipo de cadea variable.[3][57]
Hipermutación somática e maduración da afinidade
[editar | editar a fonte]- Artigos principais: Hipermutación somática e Maduración da afinidade.
Outro mecanismo que xera diversidade nos anticorpos ten lugar nos linfocitos B maduros. Trala activación por antíxeno, os linfocitos B comenzan a proliferar rapidamente. Nestas células en rápida división, os xenes que codifican os dominios variables das cadeas pesadas e lixeiras sofren unha gran taxa de mutación puntual mediante un proceso chamado hipermutación somática. Esta produce aproximadamente o cambio dun nucleótido por xene variable e célula en cada división celular.[4] Como consecuencia, calquera célula filla dunha liña de linfocitos B adquire unha lixeira diferenza na secuencia de aminoácidos dos dominios variables das súas cadeas de anticorpos.
A hipermutación somática serve para incrementar a diversidade do reservorio de anticorpos e inflúe na afinidade da unión entre o antíxeno e o anticorpo.[58] Algunhas mutacións puntuais terminarán por producir anticorpos que teñen interaccións máis febles (baixa afinidade) co seu antíxeno que o anticorpo orixinal, mentres que outras xerarán anticorpos cunha interacción máis forte (alta afinidade).[59] Os linfocitos B que expresan anticorpos de elevada afinidade na súa superficie recibirán un forte sinal para que sobrevivan durante as interaccións con outras células, mentres que as que expresan anticorpos de baixa afinidade morrerán por apoptose.[59] Así, os linfocitos B que expresan anticorpos cunha afinidade máis elevada polo seu antíxeno competirán con vantaxe contra aqueles de menor afinidade na súa función e supervivencia permitindo o incremento do nivel medio de afinidade dos anticorpos co paso do tempo. O proceso de xeración de anticorpos con afinidade aumentada progresivamente chámase maduración da afinidade. A maduración da afinidade ten lugar nos linfocitos B maduros trala recombinación V(D)J e é dependente do soporte que reciban dos linfocitos T colaboradores.[60]

Cambio de clase
[editar | editar a fonte]O cambio de clase das inmunoglobulinas é un proceso biolóxico que ten lugar trala activación dos linfocitos B, o cal lle permite a produción de diferentes clases de anticorpos (IgA, IgE, ou IgG).[2] Estas clases están definidas polas rexións constantes (C) da cadea pesada da inmunoglobulina. Inicialmente os linfocitos B virxes expresan só IgM e IgD na superficie celular (inseridas na membrana) con rexións de unión ao antíxeno idénticas. Cada isotipo está adaptado para unha función distinta e, por tanto, despois da activación, cómpre un anticorpo cun efector IgG, IgA ou IgE para a eliminación eficaz do antíxeno. O cambio de clase permite á descendencia dun só linfocito B producir anticorpos de diferentes isotipos. Soamente a rexión constante da cadea pesada do anticorpo cambia durante o cambio de clase. As rexións variables, e, por tanto, a especificidade de antíxeno, permanece invariable. Deste modo, prodúcense efectores coa función axeitada para cada ameaza do antíxeno. O cambio de clase iníciase por influencia de citocinas. O isotipo xerado depende das citocinas presentes no contorno do linfocito B.[61]
O proceso ten lugar no xene da cadea pesada por un mecanismo chamado recombinación de cambio de clase (ou CSR, do inglés class switch recombination). Este mecanismo está baseado en secuencias de nucleótidos conservadas, chamadas rexións de cambio ou conmutación (rexións S ou switch), que se encontran nun punto da secuencia de ADN anterior aos xenes da rexión constante (agás na cadea δ). A febra de ADN escíndese pola actividade de certos encimas en dúas rexións S concretas.[62][63] O exón do dominio variable volve empalmarse mediante un proceso chamado unión de extremos non homólogos (ou NHEJ, non-homologous end joining) á rexión constante elixida (γ, α ou ε). Este proceso conclúe formando un xene de inmunoglobulina que codifica un anticorpo dun isotipo diferente.[64]
Conversión xénica
[editar | editar a fonte]A conversión xénica é un intercambio non recíproco, no que a secuencia de ADN doante non se modifica, mentres que o xene aceptor adquiere un segmento do doante por recombinación homóloga. Aínda que este mecanismo para xerar diversidade nos anticorpos se coñecía desde hai tempo, non se lle dera relevancia dabondo ata agora. Sábese que é moi importante en aves, as cales usan nas súas cadeas lixeiras e pesadas un gran número de pseudoxenes semellantes ás secuencias D, situadas ao principio da secuencia do xene das cadeas de inmunoglobulina. Posteriormente, estes segmentos cambian somaticamente a única rexión V, e poden tamén estar sometidas a hipermutación.[65] Este mecanismo, curiosamente, tamén está presente nalgúns outros mamíferos, como os coellos.[66]
Fases finais da síntese de inmunoglobulinas
[editar | editar a fonte]Unha vez reagrupados todos os segmentos, prodúcese un só ARN mensaxeiro, que se poliadenila. Este ARN abandona o núcleo, dirixíndose aos ribosomas do retículo endoplasmático rugoso, onde comeza a súa tradución. Posteriormente prodúcese a glicosilación dos anticorpos na parte luminal do retículo endoplasmático rugoso e a ensamblaxe, cuxo proceso é o seguinte: H+H → H2+L → H2L2. Constitúe unha excepción a IgM, na que se une primeiro unha cadea pesada cunha lixeira. O seu destino final, é servir como receptor ou ben ser segregado, e depende de se posúe ou non un fragmento engadido de 19 aminoácidos no extremo C-terminal. Este péptido incorpórase á síntese mediante un proceso de empalme ou splicing. A súa presenza determina a posesión dunha rexión hidrófoba que pode ancorarse á membrana plasmática.[27]
Designacións de especificidade
[editar | editar a fonte]Un anticorpo pode denominarse monoespecífico se ten especificidade polo mesmo antíxeno ou epitopo,[67] ou biespecífico se ten afinidade por dous antíxenos diferentes ou dous epitopos distintos do mesmo antíxeno.[68] Un grupo de anticorpos pode denominarse polivalente (ou inespecífico) se ten afinidade por varios antíxenos[69] ou microorganismos.[69] A chamada inmunoglobulina intravenosa, se non se indica o contrario, consiste nunha variedade de distintas IgG (IgG policlonal). En contraste, os anticorpos monoclonais son anticorpos idénticos producidos por unha soa célula B.
Anticorpos asimétricos
[editar | editar a fonte]Os anticorpos heterodímeros, que son tamén asimétricos, posibilitan unha maior flexibilidade e novos formatos que permitan unir diversos fármacos aos brazos do anticorpo. Un dos formatos xerais para o anticorpo heterodímero é o formato "protuberancias-en-buratos" ("knobs-into-holes"). Este formato é específico da parte da cadea pesada da rexión constante dun anticorpo. A parte das "protuberancias" (“knobs”) é construída por enxeñaria substituíndo un aminoácido pequeno por outro máis grande. Este encaixa dentro do "burato" (“hole”), o cal se constrúe por enxeñaría substituíndo un aminoácido grande por poutro máis pequeno. O que conecta as “protuberancias” cos “buratos” son pontes disulfuro entre as cadeas. A forma “protuberancias-en-buratos” facilita a citotoxicidade mediada por células dependente de anticorpo. Os fragmentos variables de cadea sinxela (scFv) están conectados ao dominio variable das cadeas pesada e lixeira por medio dun curto péptido de unión ou linker. Este é rico en glicina, o cal lle dá máis flexibilidade, e en serina/treonina, o cal lle dá a súa especificidade. Poden conectarse dous fragmentos scFv distintos por medio da rexión bisagra ao dominio constante da cadea pesada ou o dominio constante da cadea lixeira.[70] Isto orixina a biespecificidade do anticorpo, permitíndolle interaccionar coas especificidades de unión de dous antíxenos diferentes.[71] O formato “protuberancias-en-buratos” potencia a formación de heterodímeros pero non suprime a formación de homodímeros.
Para melloraren máis o funcionamento dos anticorpos heterodímeros, moitos científicos están pensando en producir construtos artificiais. Os anticorpos artificiais son motivos proteicos moi diversos que usan a estratexia funcional da molécula de anticorpo, pero non están limitados polas restricións estruturais do armazón e bucles dos anticorpos naturais.[72] Poder controlar o deseño combinacional da secuencia e espazo tridimensional podería transcender o deseño natural e permitir a unión de diferentes combinacións de fármacos aos brazos da molécula.
Os anticorpos heterodímeros teñen unha maior variedade de formas que poden adoptar e os fármacos que están unidos aos brazos non teñen por que ser o mesmo en todos os brazos, o que permite facer distintas combinacións de fármacos para usalos no tratamento do cancro. Os farmacéuticos poden producir anticorpos altamente funcionais biespecíficos e incluso multiespecíficos. O grao no cal poden funcionar é impresionante dado que tal cambio de forma con respecto da forma natural debería, en principio, levar a unha diminución da funcionalidade.
Evolución das inmunoglobulinas
[editar | editar a fonte]O desenvolvemento de organismos complexos, con tecidos e varias liñas celulares necesitou a aparición de novas moléculas para asegurar, por un lado, que as células se adherían a outras da mesma colonia e por outro, a defensa ante posibles intrusos parasitos ou patóxenos. Ao longo da evolución utilizáronse varios tipos de moléculas, como as lectinas e as inmunoglobulinas, foron utilizadas no desenvolvemento dos sistemas inmunitarios. Os seus padróns operativos mestúranse ás veces para combinar as súas propiedades, aínda que existen poucos casos que conteñan todas, como é o caso do xene da enfermidade poliquística renal (PKD1).[73]
Moitos estudos achegan probas importantes de que a superfamilia das inmunoglobulinas ten representantes entre as bacterias e arqueas ou que polo menos as presentes neste grupo e as de eucariotas poderían ter un antepasado común, a partir do cal evolucionaron de forma diverxente. Así, atribuíronse a este grupo de proteínas bacterianas "semellantes a inmunoglobulinas" (BIg's) o receptor do Fc de Ig en Streptococcus agalactiae, e a endoglucanase C de Cellulomonas fimi.[74] Tamén existen outros exemplos como a invasina de Yersinia pseudotuberculosis ou as Lig (Leptospiral Ig-like, similares a Ig de Leptospira) de diversas especies de Leptospira.[75][76] Despois do seu achado en Streptococcus descubriuse unha proteína deste tipo no fago T4. Nesta ocasión destacouse que o seu papel estaba relacionado coa adhesividade celular.[77]
As proteínas con dominios Ig son comúns en eucariotas unicelulares, e ata certo punto a súa estrutura é un carácter conservado.[78] Un exemplo disto serían as alfa aglutininas de Saccharomyces cerevisiae. Trátase de moléculas que median na adhesión celular e que gardan grandes homoloxías co grupo CD2-CD4 de humanos, cuxo papel é en parte similar, intervindo neste último caso na adhesión dos linfocitos T coas células presentadoras de antíxenos e as células diana.[79]

Animais pluricelulares
[editar | editar a fonte]Porén, é nos grupos de animais pluricelulares máis primitivos, os Parazoa, onde os científicos intentan atopar respostas á orixe do sistema inmunitario adaptativo.[81] Neste sentido, téñense feito varios traballos de investigación con este taxon, e en especial cunha esponxa considerada como fósil vivente, Geodia cydonium e tamén con Suberites domuncula. Na primeira pódense encontrar moitos dos tipos de proteínas que tamén están implicadas na inmunidade dos mamíferos. En especial, hai dous tipos da superfamilia das inmunoglobulinas, as unidas á receptor tirosina quinase, e as moléculas non encimáticas de adhesión das esponxas. Curiosamente, os dominios correspondentes xa demostran polimorfismo, e aínda que cumpren papeis que son simultaneamente de receptores e de moléculas de adhesión celular, sobrerregúlanse en experimentos de enxerto.[82]
En resumo, a superfamilia das inmunoglobulinas interveu no xurdimento da multicelularidade ao manter a integridade estrutural dos organismos distinguindo o propio do alleo. Isto é debido a que grazas ás súas capacidades de xerar módulos, de unirse especificamente a outras proteínas e de formar bastóns, así como de oligomerizarse e xerar diversidade por empalme alternativo a partir de material xenético limitado, convértense en ideais para mediar a adherencia celular e como receptores de superficie de membrana.[83][84]
Na busca de precedentes do sistema inmunitario adaptativo, encontramos varios exemplos de proteínas da superfamilia das Ig en protóstomos que cumpren un papel na defensa inmunitaria, como a hemolina en vermes da seda, ou a proteína Dscam en Drosophila melanogaster, así como proteínas relacionadas co fibrinóxeno con dominios Ig (FREP) en gasterópodos. Algunhas destas proteínas, que representan unha barreira de tipo innato, poden ter isoformas solubles e ancoradas a membrana, e xerar diversidade por empalme alternativo, e en zonas da molécula diferentes ás cadeas variables de vertebrados.[85]
Deuteróstomos
[editar | editar a fonte]Moitos dos elementos do sistema inmunitario adaptativo, incluídas as células especializadas, están xa preconfigurados nos organismos máis basais dos deuteróstomos. Realizáronse investigacións no ourizo de mar Strongylocentrotus purpuratus, encontrándose un rico sistema inmunitario con homólogos de importantes reguladores inmunitarios e hematopoéticos de vertebrados, algúns deles críticos. Especúlase por iso que a presión evolutiva clave para o desenvolvemento do complexo sistema inmunitario en deuteróstomos non foi tanto a ameaza de patóxenos coma a existencia dunha rica variedade de organismos simbiontes, dos cales é un bo exemplo a flora intestinal humana.[86] Como ilustración deste punto, viuse que o 60 % das especies de equinodermos se asocian con simbiontes bacterianos.[87] En tunicados continúa o aumento da complexidade do sistema inmune. Na ascidia Botryllus schlosseri, en experimentos con enxertos non compatibles, detectáronse moitas proteínas que revelan un complexo sistema inmunitario innato e algunhas proteínas con dominio de inmunoglobulina.[88][89] e o que é máis sorprendente, tamén se pode encontrar un homólogo convincente de RAG1, contiguo a unha estrutura similar a RAG2.[90] Porén, é en cefalocordados onde encontramos as primeiras pegadas das nosas actuais inmunoglobulinas. Realizáronse moitos estudos no anfioxo Branchiostoma floridae, no que se atoparon unhas curiosas proteínas, chamadas VCBP (por Proteínas tipo V que conteñen dominios que se unen á quitina) con grandes homoloxías coas rexións V (variables) das inmunoglobulinas, certamente implicadas na resposta inmunitaria, pero carentes da súa variabilidade. Estudos cristalográficos demostraron que probablemente se trata dunha molécula semellante ao antepasado molecular das actuais rexións variables de vertebrados.[91][92][93]
Nos actuais ágnatos danse algún dos trazos que identifican un moderno sistema inmunitario adaptativo, mentres que outros están ausentes. Por unha parte, existen células que xa conteñen gran parte da maquinaria molecular dos linfocitos. Isto suxire unha evolución deste tipo celular nos vertebrados máis basais, e posiblemente nun protocordado. Existen varias proteínas Ig con dominios semellantes a V, que incluso conteñen rexións V e J, aínda que están codificados nun único exón e non é reorganizable. Porén, non posúen un sistema inmunitario como o dos vertebrados, baseado nos clásicos anticorpos solubles, receptores de membrana, reorganización e empalme por RAG. En lugar disto, esta función é asumida por unha serie de proteínas ricas en repeticións de leucina, que incluso poden sufrir unha complexa recombinación, como resultado da cal se obtén unha variabilidade equiparable á dos anticorpos (1014). Isto constitúe un extraordinario exemplo de evolución paralela.[94]
Gnatóstomos
[editar | editar a fonte]A aparición do moderno sistema inmunitario considérase que tivo que acontecer hai 500 millóns de anos, durante a explosión cámbrica.[95] Probablemente ocorreu nun contexto no que existirían moitas formas e combinacións de módulos de proteínas das que moitas desaparecerían polas presións selectivas. Neste sentido, unha das cuestións que suscita o apartado anterior é que se a evidencia paleontolóxica indica que os peixes mandibulados actuais proceden dos ágnatos, e estes carecen do mesmo sistema de recombinación dos modernos sistemas inmunitarios, seguramente debeu existir un antepasado común, un ostracodermo ancestral que posuíse ambos os sistemas. De acordo con este punto de vista, o sistema de recombinación V(D)J probablemente representa un desenvolvemento evolutivo converxente nunha rama dos ostracodermos que precedeu á liña dos gnatóstomos.[96][97]
En canto ás clases das inmunoglobulinas, en peixes encontramos análogos da clase IgM, así como da IgD, identificada en moitas especies de teleósteos;[98] Tamén existen moitas clases exclusivas, como as que conteñen as cadeas pesadas ζ e τ. Posiblemente son isotipos anteriores á IgM na evolución.[99][100] No caso dos condrictios tamén encontramos isotipos exclusivos, ademais de IgM. Trátase das IgW (IgX ou IgNARC) e as IgNAR.[101]
O tipo IgG xorde en anfibios e continúa en réptiles, mentres que o tipo IgA aparentemente xorde nun antepasado común entre aves e mamíferos. O tipo IgE parece ser exclusivo de mamíferos[27].
Aplicacións médicas
[editar | editar a fonte]Diagnóstico de enfermidades
[editar | editar a fonte]Para facer moitos diagnósticos é común a detección de anticorpos como proba de confirmación da patoloxía. Para iso realízase unha proba serolóxica.[102] Como exemplos, en ensaios bioquímicos para o diagnóstico de enfermidades, estímase o título de anticorpos contra o virus de Epstein-Barr ou contra a enfermidade de Lyme.[103] Se non se encontran eses anticorpos significa que a persoa non está infectada ou que o estivo hai moito tempo e os linfocitos B que xeraban estes anticorpos se reduciron de forma natural.
Na inmunoloxía clínica valórase por nefelometría (ou turbidimetría) os niveis das distintas clases de inmunoglobulinas para caracterizar o perfil de anticorpos do paciente.[104] Por exemplo, unha observación dunha elevación do título das distintas clases de inmunoglobulina pode ser útil ás veces para determinar a causa do dano hepático mediante diagnóstico diferencial. Neste sentido, un título elevado de IgA indicaría cirrose alcohólica; se o que está elevado son as IgM sospeitaríase que hai unha hepatite viral e cirrose biliar primaria, mentres que as IgG aparecerían elevadas na hepatite vírica, autoinmune e cirrose.
As doenzas autoinmunes pódense diagnosticar por anticorpos que se unen a epítopos do propio organismo; moitos deles pódense detectar mediante análise de sangue. Un exemplo sería o caso dos anticorpos dirixidos contra os antíxenos de superficie de eritrocitos na anemia hemolítica mediada polo sistema inmunitario, que se detectan mediante a proba de Coombs.[105] Esta proba tamén se usa para rastrear anticorpos na preparación de transfusións de sangue e tamén nas mulleres no período prenatal.[105]
Na práctica existen moitos métodos inmunodiagnósticos baseados na detección de complexos antíxeno-anticorpo que se utilizan no diagnóstico de doenzas infecciosas, por exemplo ELISA, inmunofluorescencia, western blot, inmunodifusión e inmunoelectroforese.
A nova química de dioxaborolano permite a marcaxe con fluoruro radioactivo (18F) dos anticorpos, que posibilita o uso de imaxes de tomografía de emisión de positróns (TEP ou PET) do cancro.[106]
Tratamentos terapéuticos
[editar | editar a fonte]A terapia de anticorpos monoclonais emprégase no tratamento de doenzas como a artrite reumatoide,[107] esclerose múltiple,[108] psoríase,[109] e moitas formas de cancro, incluíndo o linfoma non de Hodgkin,[110] cancro colorrectal, cancro de cabeza e pescozo e cancro de mama.[111] Algunhas inmunodeficiencias, como a agammaglobulinemia ligada ao cromosoma X e a hipogammaglobulinemia consisten nunha carencia parcial ou completa de anticorpos.[112] Estas enfermidades trátanse ás veces inducindo unha inmunidade a curto prazo chamada inmunidade pasiva. Esta adquírese por medio da infusión de anticorpos "prefabricados" en forma de soro sanguíneo humano ou animal, inmunoglobulinas intravenosas ou anticorpos monoclonais no individuo afectado.[113]
Terapia prenatal
[editar | editar a fonte]As chamadas Inmunoglobulinas Rho (D) ou inmunoglobulinas anti-RhD son específicas do antíxeno humano Rhesus D tamén coñecido como factor Rhesus.[114] Destes anticorpos anti-RhD coñécense varias marcas comerciais, como RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, e WinRho SDF. O factor Rhesus é un antíxeno que se encontra nos eritrocitos. Os individuos Rhesus-positivos (Rh+) exhiben este anticorpo no glicocálix dos seus eritrocitos, mentres que os individuos (Rh–) carecen del. Durante o nacemento normal, o sangue fetal pode pasar á nai por traumas no parto ou complicacións do embarazo. No caso de incompatibilidade Rh entre a nai e o fillo, a conseguinte mestura de sangre pode sensibilizar a unha nai Rh- contra o antíxeno Rh do fillo, facendo que nos seguintes embarazos os fetos corran risco de sufrir eritroblastose fetal.[115] Os Anti-RhD adminístranse como parte do tratamento prenatal para previr a sensibilización que puidese ter lugar para así evitalo. Ao tratar á nai con anticorpos anti-RhD antes e inmediatamente despois do trauma e o parto destrúe o antíxeno Rh do feto no corpo da nai. Un aspecto importante é que isto acontece antes de que o antíxeno poida estimular os linfocitos B maternos que máis tarde poderían "lembrar" o antíxeno Rh xerando linfocitos B de memoria. Por tanto, o seu sistema humoral inmune non fabricará anticorpos anti-Rh e non atacará os antíxenos Rhesus do seu bebé actual ou futuro.[114]
Aplicacións en investigación científica
[editar | editar a fonte]
En investigación, os anticorpos purificados úsanse en moitas aplicacións. Son moi habituais para identificar e localizar proteínas intra e extracelulares. Os anticorpos úsanse na citometría de fluxo, inmunoprecipitación, en análises de western blot para identificar proteínas separadas por electroforese, e en inmunohistoquímica ou inmunofluorescencia. As proteínas tamén se poden detectar e cuantificar con anticorpos utilizando as técnicas ELISA e ELISPOT.
Obtención
[editar | editar a fonte]Os anticorpos específicos son producidos en investigación inxectando un antíxeno nun mamífero, como un rato, rata, coello, cabra, ovella ou cabalo para obter grandes cantidades de anticorpos. O sangue que se illa destes animais contén anticorpos policlonais (moitos anticorpos que se unen ao mesmo antíxeno) no soro, o que se denomina antisoro. Os antíxenos tamén se poden inxectar en polos para a xeración de anticorpos policlonais na xema do ovo.[116] Para obter anticorpos que sexan específicos para un só epítopo dun antíxeno, íllanse os linfocitos que segregan anticorpos do animal e son inmortalizados fusionándoos cunha liña de células cancerosas. As células fusionadas son chamadas hibridomas, e crecen continuamente e segregan anticorpos en cultivo. As céllas de hibridoma simples son illados por clonación por dilución para xerar clons celulares que todos producen o mesmo anticorpo; estes anticorpos son chamados anticorpos monoclonais.[117] Os anticorpos policlonais e monoclonais adoitan purificarse usando a proteína A/G ou cromatografía de afinidade a antíxenos.[118]
Aplicacións
[editar | editar a fonte]En investigación, os anticorpos modificados son utilizados en moitas aplicacións. Os anticorpos para aplicacións de investigación poden encontrarse directamente en fornecedores de anticorpos ou utilizando un motor de investigación especialista. Os anticorpos para investigación son principalmente usados para identificar e localizar proteínas intracelulares e extracelulares. Os anticorpos son utilizados en citometría de fluxo para diferenciar tipos celulares polas proteínas que expresan; os diferentes tipos de células expresan diferentes combinacións de moléculas de clusters de diferenciación (CD) na súa superficie, e producen diferentes proteínas intracelulares e segregables.[119] Tamén se utilizaron en inmunoprecipitación para separar proteínas e calquera cousa unida a elas (coinmunoprecipitación) doutras moléculas nun lisado celular,[120] en análises pola técnica western blot para identificar proteínas separadas por electroforese,[121] e en inmunohistoquímica ou inmunofluorescencia para examinar a expresión de proteínas en seccións de tecidos ou para localizar proteínas dentro das células coa axuda dun microscopio.[119][122] As proteínas poden tamén ser detectadas e cuantificadas con anticorpos, usando as técnicas ELISA e ELISPOT.[123][124]
Rexistro e información
[editar | editar a fonte]Os anticorpos usados en investigación son algúns dos reactivos máis poderosos e tamén problemáticos cun enorme número de factores que deben ser controlados en calquera experimento como a reactividade cruzada, ou o recoñecemento polo anticorpo de múltiples epitopos e afinidades, o que pode variar amplamente dependendo das condicións experimentais como o pH, solvente, estado do tecido etc. Fixéronse múltiples intentos de mellorar tanto o modo en que os investigadores validan os anticorpos[125][126] e os modos nos que informan dos anticorpos. Os investigadores que usan os anticorpos no seu traballo necesitan rexistralos correctamente para que a súa investigación poida ser reproducible (e, por tanto, comprobada, e cualificada por outros investigadores). Menos da metade dos anticorpos de investigación referenciados en artigos académicos poden ser identificados doadamente.[127] Os artigos publicados en F1000 en 2014 e 2015 proporcionan aos investigadores unha guía para informar do uso de anticrorpos en investigación.[128][129] O documento RRID, é copublicado en 4 revistas que aplican os estándares RRIDs para a cita de recursos de investigación, os cales utilizan datos de antibodyregistry.org como fonte de identificadores de anticorpos.[130] (ver tamén o grupo en Force11[131]).
Variantes de anticorpos en medicina e investigación
[editar | editar a fonte]En ocasións necesítase producir anticorpos específicos. Inxectando un antíxeno nun mamífero, como rato, rata ou coello se se require pouca cantidade; ou en cabra, ovella ou cabalo se se requieren grandes cantidades. O sangue illado destes animais contén anticorpos policlonais (múltiples anticorpos que se unen ao mesmo antíxeno) no soro sanguíneo, ao cal se denomina antisoro. Tamén se poden inxectar antíxenos en galiñas e recoller na xema de ovo os anticorpos policlonais IgY xerados.[132] Porén, para aplicacións analíticas cómpre unha maior especificidade, sobre todo se se trata de detectar moléculas moi pequenas, así como cando se usan en aplicacións terapéuticas nas que se desexa bloquear ou detectar marcadores moi específicos. Por iso a tecnoloxía dos anticorpos xerou algunhas variantes de anticorpos, entre as que salientan as segintes:
- Anticorpos monoclonais
- Se se desexa obter anticorpos específicos para un único epítopo dun antíxeno, íllanse linfocitos secretores de anticorpos dun animal e inmortalízanse fusionándoos cunha liña celular cancerosa. As células fusionadas denomínanse hibridomas e continuarán crecendo e segregando anticorpos no cultivo. Íllanse as células de hibridoma individuais mediante clonación por dilución para xerar clons que produzan todos o mesmo anticorpo. A estes anticorpos denomínaselles anticorpos monoclonais.[133]
- Os anticorpos mono e policlonais xerados pódense purificar utilizando a proteína A/G ou cromatografía de afinidade a antíxenos.[134]
- Anticorpos de cadea sinxela
- É posible xerar artificialmente un anticorpo que conte só coas rexións variables da cadea lixeira e pesada, unidas por un pequeno péptido ou un só aminoácido. Neste caso teremos anticorpos de cadea sinxela ou scFv. Actualmente aplícanse en técnicas como a citometría de fluxo ou a inmunohistoquímica.[135]
- Abzimas
- A maioría dos anticorpos diferéncianse doutras proteínas por non presentar catálise encimática na súa función, polo que tradicionalmente se consideran proteínas de recoñecemento de superficies moleculares. Porén, na década de 1990 e principios do século XXI diversos estudos de inmunoloxía encontraron anticorpos con propiedades catalíticas. Ditos anticorpos recibiron o nome de abzimas (abcimas). É posible encontralos en cantidades baixas no soro de persoas sas. Un exemplo da existencia dos abzimas no corpo humano foi a detección de abzimas contra o ADN no leite materno.[136] Entre outras, estas actividades catalíticas detectadas son a de peptidases inespecíficas e amilolíticas (degradación de amidón). Por outro lado, observouse un incremento no nivel de abzimas en enfermidades de tipo autoinmune. Porén, normalmente fabrícanse de forma artificial xerando anticorpos contra o composto intermediario dunha reacción para a que se desexa crear un encima. Nalgunhas ocasións poderían ter aplicacións terapéuticas e industriais.[137][138]
- Nanocorpos
Existen propostas para a utilización terapéutica de anticorpos monoclonais que se desenvolveron imitando os anticorpos de cadea pesada de camélidos, que foron chamados nanocorpos. Estes son excepcionais no reino animal, dado o seu reducido tamaño, debido a que están compostos unicamente por dúas cadeas pesadas.[139] Tales peculiaridades permitiríanlles acceder a localizacións celulares e antíxenos inaccesibles para os anticorpos normais, ademais de ser posible a súa administración oral.[140]
- Faboterápicos
Para obter antídotos contra velenos de picaduras de animais como serpentes ou artrópodos, fabrícanse antisoros mediante soro cru ou ben altamente enriquecido en inmunoglobulinas. Estes procedementos producían inicialmente un gran número de reaccións alérxicas, como anafilaxes ou a enfermidade do soro. Para evitalo, nos anos 40 e 50 realizáronse estudos de proteólise para reducir ao mínimo a parte da molécula implicada na neutralización do veleno. Finalmente, encontrouse que o fragmento F(ab’)2, resultante da dixestión con pepsina dos anticorpos, que carece das zonas efectoras da molécula, pode neutralizar igualmente os velenos. O profesor Alejandro Alagón Cano propuxo para este enfoque terapéutico o nome de faboterapia, observándose unha incidencia moito menor de reaccións adversas ao soro, así como un mellor alcance do compartimento extravascular.[141]
Predición da estrutura
[editar | editar a fonte]A importancia dos anticorpos en sanidade e industria biotecnolóxica demanda o coñecemento das súas estruturas a alta resolución. Esta información utilízase na enxeñaría de proteínas, modificando a afinidade de unión aos antíxenos, e identificando un epítopo dun determinado anticorpo. Un método comunmente usado para determinar as estruturas dos anticorpos é a cristalografía de raios X. Porén, cristalizar un anticorpo é a miúdo laborioso e leva moito tempo. Os métodos computacionais proporcionan unha alternativa máis barata e rápida á cristalografía, pero os seus resultados son máis equívocos, xa que non producen estruturas empíricas. Os servidores web en liña como Web Antibody Modeling (WAM)[142] e Prediction of Immunoglobulin Structure (PIGS)[143] permiten facer os modelos computacional de rexións variables dos anticorpos. Rosetta Antibody é un novo servidor para a predición de estruturas da rexión FV de anticorpos, que incorpora técnicas sofisticadas para minimizar os bucles CDR e optimizar a orientación relativa das cadeas lixeira e pesada, así como modelos de homoloxía que predí a unión exitosa dos anticorpos cos seus antíxenos específicos.[144]
A capacidade de describir o anticorpo pola afinidade de unión ao antíxeno é suplementada pola información sobre a estrutura de anticorpos e secuencias de aminoácidos co propósito de rexistrar patentes.[145]
Notas
[editar | editar a fonte]- ↑ Litman GW, Rast JP, Shamblott MJ; et al. (1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire". Mol. Biol. Evol. 10 (1): 60–72. PMID 8450761.
- ↑ 2,0 2,1 2,2 2,3 Eleonora Market, F. Nina Papavasiliou (2003) V(D)J Recombination and the Evolution of the Adaptive Immune System Arquivado 16 de febreiro de 2008 en Wayback Machine. PLoS Biology1(1): e16.doi 10.1371/journal.pbio.0000016
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 Janeway CA, Jr; et al. (2001). Immunobiology. (5th ed. ed.). Garland Publishing. ISBN 0-8153-3642-X.
- ↑ 4,0 4,1 Diaz M, Casali P (2002). "Somatic immunoglobulin hypermutation". Curr Opin Immunol 14 (2): 235–40. PMID 11869898. doi:10.1016/S0952-7915(02)00327-8.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 1-55581-246-5.
- ↑ Padlan, Eduardo (1994). "Anatomy of the antibody molecule". Mol. Immunol. 31 (3): 169–217. PMID 8114766. doi:10.1016/0161-5890(94)90001-9.
- ↑ "New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus". Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 12 de decembro de 2008.
- ↑ "Protein sculpture inspired by Vitruvian Man". Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 12 de decembro de 2008.
- ↑ Grundbacher FJ (13 de maio de 1992). "Behring's discovery of diphtheria and tetanus antitoxins.". Immunol Today. (5): 188–90. PMID 1642758. doi:10.1016/0167-5699(92)90125-Q.
- ↑ "Emil von Behring - Biography". Consultado o 5 de xuño de 2007.
- ↑ AGN (1931). "The Late Baron Shibasaburo Kitasato". Canadian Medical Association Journal: 206.
- ↑ Winau F, Westphal O, Winau R (2004). "Paul Ehrlich--in search of the magic bullet". Microbes Infect. 6 (8): 786–9. PMID 15207826. doi:10.1016/j.micinf.2004.04.003.
- ↑ Silverstein AM (2003). "Cellular versus humoral immunology: a century-long dispute". Nat. Immunol. 4 (5): 425–8. PMID 12719732. doi:10.1038/ni0503-425.
- ↑ Van Epps HL (2006). "Michael Heidelberger and the demystification of antibodies" (PDF). J. Exp. Med. 203 (1): 5. PMID 16523537. doi:10.1084/jem.2031fta.
- ↑ Marrack, JR (1938). Chemistry of antigens and antibodies (2nd ed. ed.). London: His Majesty's Stationery Office. OCLC 3220539.
- ↑ "The Linus Pauling Papers: How Antibodies and Enzymes Work". Consultado o 5 de xuño de 2007.
- ↑ Silverstein AM (2004). "Labeled antigens and antibodies: the evolution of magic markers and magic bullets" (PDF). Nat. Immunol. 5 (12): 1211–1217. PMID 15549122. doi:10.1038/ni1140. Arquivado dende o orixinal (PDF) o 16 de xuño de 2007. Consultado o 27 de decembro de 2017.
- ↑ Edelman GM, Gally JA (1962). "The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins". J. Exp. Med. 116: 207–27. PMID 13889153.
- ↑ Stevens FJ, Solomon A, Schiffer M (1991). "Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology". Biochemistry 30 (28): 6803–5. PMID 2069946. doi:10.1021/bi00242a001.
- ↑ 20,0 20,1 Raju TN (1999). "The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85)". Lancet 354 (9183): 1040. PMID 10501404.
- ↑ Tomasi TB (1992). "The discovery of secretory IgA and the mucosal immune system". Immunol. Today 13 (10): 416–8. PMID 1343085.
- ↑ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E (2000). "Structural and functional properties of membrane and secreted IgD". Mol. Immunol. 37 (15): 871–87. PMID 11282392. doi:10.1016/S0161-5890(01)00006-2.
- ↑ Johansson SG (2006). "The discovery of immunoglobulin E". Allergy and asthma proceedings : the official journal of regional and state allergy societies 27 (2 Suppl 1): S3–6. PMID 16722325.
- ↑ Raju, T N (2000). "The Nobel chronicles. 1984: Niels Kai Jerne, (1911-94); César Milstein (b 1926); and Georges Jean Franz Köhler (1946-95)". The Lancet 355 (9197): 75. PMID 10615922. doi:10.1016/S0140-6736(05)72025-0.
- ↑ Hozumi N, Tonegawa S (1976). "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions". Proc. Natl. Acad. Sci. U.S.A. 73 (10): 3628–32. PMID 824647.
- ↑ Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion". Immunol Res 36 (1-3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27.
- ↑ 27,0 27,1 27,2 27,3 27,4 Peña Martínez, J (Coordinador) (1998). Inmunología. Pirámide. ISBN 84-368-1213-1. Dispoñible unha versión online en http://www.uco.es
- ↑ Parker D (1993). "T cell-dependent B cell activation". Annu Rev Immunol 11: 331–60. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555.
- ↑ 29,0 29,1 29,2 29,3 Wintrobe, Maxwell Myer (2004). Wintrobe's clinical hematology. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas (11 ed.). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 453–456. ISBN 0-7817-3650-1.
- ↑ Tolar P, Sohn HW, Pierce SK (2008). "Viewing the antigen-induced initiation of B-cell activation in living cells". Immunol. Rev. 221: 64–76. PMID 18275475. doi:10.1111/j.1600-065X.2008.00583.x.
- ↑ Underdown B, Schiff J (1986). "Immunoglobulin A: strategic defense initiative at the mucosal surface". Annu Rev Immunol 4: 389–417. PMID 3518747. doi:10.1146/annurev.iy.04.040186.002133.
- ↑ 32,0 32,1 Geisberger R, Lamers M, Achatz G (2006). "The riddle of the dual expression of IgM and IgD". Immunology 118 (4): 429–37. PMID 16895553.
- ↑ 33,0 33,1 33,2 33,3 Woof J, Burton D (2004). "Human antibody-Fc receptor interactions illuminated by crystal structures". Nat Rev Immunol 4 (2): 89–99. PMID 15040582. doi:10.1038/nri1266.
- ↑ Goding J. "Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation". Contemp Top Immunobiol 8: 203–43. PMID 357078.
- ↑ Lundqvist, ML; Middleton, DL; Radford, C; Magor, KE (2006). "Immunoglobulins of the non-galliform birds: antibody expression and repertoire in the duck". Dev Comp Immunol. 30 (1): 93–100. PMC 1317265. PMID 16150486. doi:10.1016/j.dci.2005.06.019.
- ↑ Berstein, RM; Schluter, SF; Shen, S; Marchalonis, JJ (1996-04-16). "A new high molecular weight immunoglobulin class from the carcharhine shark: implications for the properties of the primordial immunoglobulin.". Proc Natl Acad Sci U S A 93 (8): 3289–3293. PMC 39599. PMID 8622930. doi:10.1073/pnas.93.8.3289.
- ↑ Grubb, R., and Laurell, A. B., Acta Path. Microb. Scand., 39, 390 (1956). PMID 13381487
- ↑ Janeway, CA; Staff, VV. Tradución de Eva Sanz (2003). Inmunobiología: el sistema inmunitario en condiciones de salud y enfermedad. Elsevier España. ISBN 978-84-458-1176-4.
- ↑ Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R (1998). "The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions". J Biol Chem 273 (4): 2260–72. PMID 9442070. doi:10.1074/jbc.273.4.2260.
- ↑ Roux K (1999). "Immunoglobulin structure and function as revealed by electron microscopy". Int Arch Allergy Immunol 120 (2): 85–99. PMID 10545762. doi:10.1159/000024226.
- ↑ "Antigen binding sites" (en inglés). Arquivado dende o orixinal o 19 de abril de 2007. Consultado o 27 de decembro de 2017.
- ↑ Stevenson, JR (18 de agosto). "Immunoglobulin Structure and Function". CAS, Universidade de Miami. Arquivado dende o orixinal o 25 de septembro de 2008. Consultado o 25 de agosto de 2008.
- ↑ Barclay A (2003). "Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules". Semin Immunol 15 (4): 215–23. PMID 14690046. doi:10.1016/S1044-5323(03)00047-2.
- ↑ Murre C, e outros: (2008). "The 3D structure of the immunoglobulin heavy-chain locus: implications for long-range genomic interactions". Cell 133 (2). PMID 18423198.
- ↑ Putnam FW, Liu YS, Low TL (1979). "Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain". J Biol Chem 254 (8): 2865–74. PMID 107164.
- ↑ Huber R (1980). "Spatial structure of immunoglobulin molecules". Klin Wochenschr 58 (22): 1217–31. PMID 6780722. doi:10.1007/BF01478928.
- ↑ Heyman B (1996). "Complement and Fc-receptors in regulation of the antibody response". Immunol Lett 54 (2-3): 195–9. PMID 9052877. doi:10.1016/S0165-2478(96)02672-7.
- ↑ 48,0 48,1 Ravetch J, Bolland S (2001). "IgG Fc receptors". Annu Rev Immunol 19: 275–90. PMID 11244038. doi:10.1146/annurev.immunol.19.1.275.
- ↑ Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunol Res 33 (2): 103–12. PMID 16234578. doi:10.1385/IR:33:2:103.
- ↑ Racaniello, Vincent (6 de outubro de 2009). "Natural antibody protects against viral infection". Virology Blog. Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 22 de xaneiro de 2010.
- ↑ Milland J, Sandrin MS (decembro de 2006). "ABO blood group and related antigens, natural antibodies and transplantation". Tissue Antigens 68 (6): 459–466. PMID 17176435. doi:10.1111/j.1399-0039.2006.00721.x.
- ↑ Mian I, Bradwell A, Olson A (1991). "Structure, function and properties of antibody binding sites". J Mol Biol 217 (1): 133–51. PMID 1988675. doi:10.1016/0022-2836(91)90617-F.
- ↑ Fanning LJ, Connor AM, Wu GE (1996). "Development of the immunoglobulin repertoire". Clin. Immunol. Immunopathol. 79 (1): 1–14. PMID 8612345.
- ↑ 54,0 54,1 Nemazee D (2006). "Receptor editing in lymphocyte development and central tolerance". Nat Rev Immunol 6 (10): 728–40. PMID 16998507. doi:10.1038/nri1939.
- ↑ Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62
- ↑ 56,0 56,1 Market, Eleonora; Papavasiliou, F. Nina (outubro de 2003). "V(D)J Recombination and the Evolution of the Adaptive Immune System". PLoS Biology 1 (1): E16. PMC 212695. PMID 14551913. doi:10.1371/journal.pbio.0000016.
- ↑ Bergman Y, Cedar H (2004). "A stepwise epigenetic process controls immunoglobulin allelic exclusion". Nat Rev Immunol 4 (10): 753–61. PMID 15459667. doi:10.1038/nri1458.
- ↑ Honjo T, Habu S (1985). "Origin of immune diversity: genetic variation and selection". Annu Rev Biochem 54: 803–30. PMID 3927822. doi:10.1146/annurev.bi.54.070185.004103.
- ↑ 59,0 59,1 Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J (2007). "Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation". Immunol. Rev. 216: 130–41. PMID 17367339. doi:10.1111/j.1600-065X.2007.00507.x.
- ↑ Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C (2000). "Memory in the B-cell compartment: antibody affinity maturation". Philos Trans R Soc Lond B Biol Sci 355 (1395): 357–60. PMID 10794054. doi:10.1098/rstb.2000.0573.
- ↑ Stavnezer J, Amemiya CT (2004). "Evolution of isotype switching". Semin. Immunol. 16 (4): 257–75. PMID 15522624. doi:10.1016/j.smim.2004.08.005.
- ↑ Durandy A (2003). "Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation". Eur. J. Immunol. 33 (8): 2069–73. PMID 12884279. doi:10.1002/eji.200324133.
- ↑ Casali P, Zan H (2004). "Class switching and Myc translocation: how does DNA break?". Nat. Immunol. 5 (11): 1101–3. PMID 15496946. doi:10.1038/ni1104-1101.
- ↑ Lieber MR, Yu K, Raghavan SC (2006). "Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations". DNA Repair (Amst.) 5 (9-10): 1234–45. PMID 16793349. doi:10.1016/j.dnarep.2006.05.013.
- ↑ Weill, JC e outros: (1989). "Somatic hyperconversion diversifies the single VH gene of the chicken with a high incidence in the D region". Cell 59.
- ↑ Knight, KL: (1992). "Restricted VH gene usage and generation of antibody diversity in rabbit.". annu. Rev. immunol. 10.
- ↑ page 22 in: Shoenfeld, Yehuda.; Meroni, Pier-Luigi.; Gershwin, M. Eric (2007). Autoantibodie. Amsterdam; Boston: Elsevier. ISBN 978-0-444-52763-9.
- ↑ Spiess, Christoph; Zhai, Qianting; Carter, Paul J. (outubro de 2015). "Alternative molecular formats and therapeutic applications for bispecific antibodies". Molecular Immunology 67 (2): 95–106. doi:10.1016/j.molimm.2015.01.003.
- ↑ 69,0 69,1 Farlex dictionary > polyvalent Citing: The American Heritage Medical Dictionary. 2004
- ↑ Gunasekaran K (2010). "Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG". The Journal of Biological Chemistry 285 (25): 19637–19646. PMC 2885242. PMID 20400508. doi:10.1074/jbc.M110.117382.
- ↑ Muller K.M (1998). "The first constant domain (CH1 and CL) of an antibody used as heterodimerization domain for bispecific miniantibodies". FEBS Letters 422 (2): 259–264. doi:10.1016/s0014-5793(98)00021-0.
- ↑ Gao C (1999). "Making artificial antibodies: A format for phage display of combinatorial heterodimeric arrays". PNAS 96 (11): 6025–6030. PMC 26829. PMID 10339535. doi:10.1073/pnas.96.11.6025.
- ↑ Litman, G; Cannon, JP y Dishaw, LJ: (novembro de 2005). "Reconstructing immune phylogeny:new perspectives". Nature 5. doi:10.1038/nri1712.
- ↑ Bateman, A; Eddy, SR y Chothia, C (1996). "Members of the immunoglobulin superfamily in bacteria". Protein Science 5 (5). PMID 8880921.
- ↑ Dersch P, Isberg RR. (2000). "An immunoglobulin superfamily-like domain unique to the Yersinia pseudotuberculosis invasin protein is required for stimulation of bacterial uptake via integrin receptors.". Infect Immun 68 (5). PMID 10768991.
- ↑ Matsunaga, J; Ko, AI e colaboradores: (2005). "Pathogenic Leptospira species express surface-exposed proteins belonging to the bacterial immunoglobulin superfamily". Mol Microbiol 49 (4). PMCID PMC1237129.
- ↑ ateman A, Eddy SR, Mesyanzhinov VV: (1997). "A member of the immunoglobulin superfamily in bacteriophage T4". Virus Genes 14 (2). PMID 9237357.
- ↑ Wojciechowicz D, Lu CF, Kurjan J, Lipke PN (1993). "Cell surface anchorage and ligand-binding domains of the Saccharomyces cerevisiae cell adhesion protein alpha-agglutinin, a member of the immunoglobulin superfamily". Mol Cell Biol 13 (4). PMID 8455628.
- ↑ Grigorescu A, Chen MH, Zhao H, Kahn PC, Lipke PN (2000). "A CD2-based model of yeast alpha-agglutinin elucidates solution properties and binding characteristics". IUBMB Life 50 (2). PMID 11185954.
- ↑ Nick Matzke (28 de abril). "Postulated intermediates in the molecular evolution of the Ig and TCR loci". Annotated Bibliography on the Evolutionary Origin of the Vertebrate Immune System. Journal of Experimental Medicine. Consultado o 22 de agosto de 2008.
- ↑ Müller CI, Blumbach B, Krasko A, Schröder HC (2001). "Receptor protein-tyrosine phosphatases: origin of domains (catalytic domain, Ig-related domain, fibronectin type III module) based on the sequence of the sponge Geodia cydonium". Gene 262 (1-2). PMID 11179687.
- ↑ Kubrycht J, Borecký J, Soucek P, Jezek P (2004). "Sequence similarities of protein kinase substrates and inhibitors with immunoglobulins and model immunoglobulin homologue: cell adhesion molecule from the living fossil sponge Geodia cydonium. Mapping of coherent database similarities and implications for evolution of CDR1 and hypermutation". Folia Microbiol (49). 3 PMID 15259763.
- ↑ Brümmendorf, T y Lemmon, V: (2001). "Immunoglobulin superfamily receptors: cis-interactions, intracellular adapters and alternative splicing regulate adhesion". Current opinion in cell biology 13 (5). doi 10.1016/S0955-0674(00)00259-3.
- ↑ Strecker, G y otros: (2004). "Molecular recognition between glyconectins as an adhesion self-assembly pathway to multicellularity". J Biol Chem. 279 (15). PMID 14701844.
- ↑ "The Evolution of Adaptative Immune Systems". Cell (124). 2006. DOI 10.1016/j.cell.2006.02.001.
- ↑ Litman, GW e outros: (2006). "Genomic Insights into the Immune System of the Sea Urchin". Science 314 (5801). DOI 10.1126/science.1134301.
- ↑ Noverr, MC e Huffnagle, GB. "Does the microbiota regulate immune responses outside the gut?". Trends Microbiol 12. PMID.
- ↑ Oren M, Douek J, Fishelson Z, Rinkevich B: (2007). "Identification of immune-relevant genes in histoincompatible rejecting colonies of the tunicate Botryllus schlosseri". Dev Comp Immunol 31 (9). PMID 17287019.
- ↑ Pancer Z, Diehl-Seifert B, Rinkevich B, Müller WE: (1997). "A novel tunicate (Botryllus schlosseri) putative C-type lectin features an immunoglobulin domain". DNA Cell Biol. 16 (6). PMID 9212174.
- ↑ Kapitonov, VV;Jurka, J: (2005). "RAG1 core and V(D)J recombination signal sequences were derived from Transib transposons". PLoS Biol. 3.
- ↑ Cannon JP, Haire RN, Litman GW: (2002). "Identification of diversified genes that contain immunoglobulin-like variable regions in a protochordate". Nat Immunol 3 (12). PMID 12415263.
- ↑ Hernández Prada JA, Haire RN, Allaire M, Jakoncic J, Stojanoff V, Cannon JP, Litman GW, Ostrov DA: (2006). "Ancient evolutionary origin of diversified variable regions demonstrated by crystal structures of an immune-type receptor in amphioxus". Nature immunology 7 (8). PMID.
- ↑ Litman GW, Cannon JP, Dishaw LJ, Haire RN, Eason DD, Yoder JA, Prada JH, Ostrov DA: (2007). "Immunoglobulin variable regions in molecules exhibiting characteristics of innate and adaptive immune receptors". Immunol Res. 38 (1-3). PMID 17917037.
- ↑ Cooper, MD y Alder, MN (2006). "The Evolution of Adaptive Immune Systems". Cell 124. DOI 10.1016/j.cell.2006.02.001.
- ↑ Kurt Buchmann (2014). "Evolution of Innate Immunity: Clues from Invertebrates via Fish to Mammals". Frontiers in Immunology. (5): 459. PMC 4172062. PMID 25295041. doi:10.3389/fimmu.2014.00459.
- ↑ Janvier, P (1999). "Catching the first fish". Nature 402.
- ↑ ThomasBoehm (11 de setembro de 2012). "Evolution of Vertebrate Immunity". Current Biology 22 (17): R722–R732.
- ↑ Stein Tore Solem e Jørgen Stenvik. Antibody repertoire development in teleosts--a review with emphasis on salmonids and Gadus morhua L. Developmental & Comparative Immunology. Volume 30. Número 1-2, Antibody repertoire development, 2006. Páxinas 57-76.
- ↑ J.D. Hansen, E.D. Landis and R.B. Phillips. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish. Proceedings of the National Academy of Sciences U S A. Volume 102, Número 19, 2005. Páxinas 6919-24.
- ↑ N. Danilova, J. Bussmann, K. Jekosch, L.A Steiner. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z. Nature Immunology, Volume 6. Número 3, 2005. Páxinas 295-302.
- ↑ H. Dooley and M.F. Flajnik. Antibody repertoire development in cartilaginous fish. Developmental & Comparative Immunology. Volume 30. Número 1-2. Antibody repertoire development, 2006. Páxinas 43-56.
- ↑ "Animated depictions of how antibodies are used in ELISA assays". Cellular Technology Ltd.—Europe. Arquivado dende o orixinal o 09 de maio de 2007. Consultado o 8 de maio de 2007.
- ↑ "Animated depictions of how antibodies are used in ELISPOT assays". Cellular Technology Ltd.—Europe. Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 8 de maio de 2007.
- ↑ Stern P (2006). "Current possibilities of turbidimetry and nephelometry" (PDF). Klin Biochem Metab 14 (3): 146–151. Arquivado dende o orixinal (PDF) o 26 de setembro de 2007. Consultado o 27 de decembro de 2017.
- ↑ 105,0 105,1 Dean, Laura (2005). "Chapter 4: Hemolytic disease of the newborn". Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US),.
- ↑ Rodriguez, Erik A.; Wang, Ye; Crisp, Jessica L.; Vera, David R.; Tsien, Roger Y.; Ting, Richard (2016-04-27). "New Dioxaborolane Chemistry Enables [18F]-Positron-Emitting, Fluorescent [18F]-Multimodality Biomolecule Generation from the Solid Phase". Bioconjugate Chemistry (en inglés) 27 (5): 1390–1399. PMC 4916912. PMID 27064381. doi:10.1021/acs.bioconjchem.6b00164.
- ↑ Feldmann M, Maini R (2001). "Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?". Annu Rev Immunol 19: 163–96. PMID 11244034. doi:10.1146/annurev.immunol.19.1.163.
- ↑ Doggrell S (2003). "Is natalizumab a breakthrough in the treatment of múltiple sclerosis?". Expert Opin Pharmacother 4 (6): 999–1001. PMID 12783595. doi:10.1517/14656566.4.6.999.
- ↑ Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M (2007). "A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis". N Engl J Med 356 (6): 580–92. PMID 17287478. doi:10.1056/NEJMoa062382.
- ↑ Plosker G, Figgitt D (2003). "Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia". Drugs 63 (8): 803–43. PMID 12662126. doi:10.2165/00003495-200363080-00005.
- ↑ Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S (2001). "First-line Herceptin monotherapy in metastatic breast cancer". Oncology. 61 Suppl 2: 37–42. PMID 11694786. doi:10.1159/000055400.
- ↑ LeBien TW (2000). "Fates of human B-cell precursors". Blood 96 (1): 9–23. PMID 10891425. Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 27 de decembro de 2017.
- ↑ Ghaffer A (26 de marzo de 2006). "Immunization". Immunology - Chapter 14. University of South Carolina School of Medicine. Consultado o 6 de xuño de 2007.
- ↑ 114,0 114,1 Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D (2003). "Prevention of Rh alloimmunization". J Obstet Gynaecol Can 25 (9): 765–73. PMID 12970812.
- ↑ Urbaniak S, Greiss M (2000). "RhD haemolytic disease of the fetus and the newborn". Blood Rev 14 (1): 44–61. PMID 10805260. doi:10.1054/blre.1999.0123.
- ↑ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (2002). "Generation and application of chicken egg-yolk antibodies". Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. 131 (3): 569–574. PMID 11867282. doi:10.1016/S1095-6433(01)00508-6.
- ↑ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (1984). "Human monoclonal antibodies". Mol. Cell. Biochem. 62 (2): 109–20. PMID 6087121. doi:10.1007/BF00223301.
- ↑ Kabir S (2002). "Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis". Immunol Invest 31 (3–4): 263–278. PMID 12472184. doi:10.1081/IMM-120016245.
- ↑ 119,0 119,1 Brehm-Stecher B, Johnson E (2004). "Single-cell microbiology: tools, technologies, and applications". Microbiol Mol Biol Rev 68 (3): 538–559. PMC 515252. PMID 15353569. doi:10.1128/MMBR.68.3.538-559.2004. Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 27 de decembro de 2017.
- ↑ Williams N (2000). "Immunoprecipitation procedures". Methods Cell Biol. Methods in Cell Biology 62: 449–453. ISBN 978-0-12-544164-3. PMID 10503210. doi:10.1016/S0091-679X(08)61549-6.
- ↑ Kurien B, Scofield R (2006). "Western blotting". Methods 38 (4): 283–293. PMID 16483794. doi:10.1016/j.ymeth.2005.11.007.
- ↑ Scanziani E (1998). "Immunohistochemical staining of fixed tissues". Methods Mol Biol 104: 133–140. ISBN 978-0-89603-525-6. PMID 9711649. doi:10.1385/0-89603-525-5:133.
- ↑ Reen DJ. (1994). "Enzyme-linked immunosorbent assay (ELISA)". Methods Mol Biol. 32: 461–466. ISBN 0-89603-268-X. PMID 7951745. doi:10.1385/0-89603-268-X:461.
- ↑ Kalyuzhny AE (2005). "Chemistry and biology of the ELISPOT assay". Methods Mol Biol. 302: 015–032. ISBN 1-59259-903-6. PMID 15937343. doi:10.1385/1-59259-903-6:015.
- ↑ Saper (2005). "An open letter to our readers on the use of antibodies". Journal of Comparative Neurology 493: 477–8. PMID 16304632. doi:10.1002/cne.20839.
- ↑ "Implementing Rigor and Transparency in NIH & AHRQ Research Grant Applications".
- ↑ "On the reproducibility of science: unique identification of research resources in the biomedical literature". PeerJ. 2 de setembro de 2013. Consultado o 1 de setembro de 2014.
- ↑ Bandrowski A, Brush M, Grethe JS, Haendel MA, Kennedy DN, Hill S, Hof PR, Martone ME, Pols M, Tan S, Washington N, Zudilova-Seinstra E, Vasilevsky N (2015). "The Resource Identification Initiative: a cultural shift in publishing". F1000Res 4: 134. PMC 4648211. PMID 26594330. doi:10.12688/f1000research.6555.2.
- ↑ "Reporting research antibody use: how to increase experimental reproducibility". F1000. 23 de agosto de 2013. Consultado o 1 de setembro de 2014.
- ↑ "The Antibody Registry".
- ↑ "Resource Identification Initiative". FORCE11. Consultado o 18 de abril de 2016.
- ↑ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (2002). "Generation and application of chicken egg-yolk antibodies". Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. 131 (3): 569–74. PMID 11867282.
- ↑ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (1984). "Human monoclonal antibodies". Mol. Cell. Biochem. 62 (2): 109–20. PMID 6087121.
- ↑ Kabir S (2002). "Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis". Immunol Invest 31 (3-4): 263–78. PMID 12472184. doi:10.1081/IMM-120016245.
- ↑ Lennard, S (2001). "Standard Protocols for the Construction of scFv Libraries". Springer protocols. DOI 10.1385/1-59259-240-6:059.
- ↑ Altria, KD (1996). Capillary Electrophoresis Guidebook Principles, Operation, and Applications, páxina 226. Humana Press. ISBN 1-59259-538-3.
- ↑ Blackburn, GM y colaboradores: (1996). "Toward antibody-directed "abzyme" prodrug therapy, ADAPT: carbamate prodrug activation by a catalytic antibody and its in vitro application to human tumor cell killing". PNAS 93 (2). Arquivado dende o orixinal (PDF) o 16 de outubro de 2019. Consultado o 27 de decembro de 2017.
- ↑ Shiro Kobayashi, Helmut Ritter, David Kaplan (2006). Enzyme-Catalyzed Synthesis of Polymers,. Birkhäuser. pp. 206. ISBN 3-540-29212-8.
- ↑ Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa EB, Bendahman N, Hamers R., Naturally occurring antibodies devoid of light chains, Nature. 1993 xuño 3;363(6428):446-8
- ↑ "Nanobodies herald a new era in cancer therapy". Medical News. 2004.
- ↑ Cano, AA. "ANTICUERPOS TERAPEUTICOS: EL CASO DE LOS ANTIVENENOS" (PDF). Sociedad Mexicana de Bioquímica. Arquivado dende o orixinal (PDF) o 03 de decembro de 2008. Consultado o 25 de agosto de 2008.
- ↑ Arquivado 18 de novembro de 2010 en WebCite
WAM - ↑ Marcatili P, Rosi A, Tramontano A (2008). "PIGS: automatic prediction of antibody structures". Bioinformatics 24 (17): 1953–1954. PMID 18641403. doi:10.1093/bioinformatics/btn341. Arquivado dende o orixinal o 18 de novembro de 2010. Consultado o 10 de marzo de 2018.
Prediction of Immunoglobulin Structure (PIGS) Arquivado 10 de setembro de 2011 en Wayback Machine. - ↑ Arquivado 18 de novembro de 2010 en WebCite
RosettaAntibody - ↑ Park, Hyeongsu. "Written Description Problems of the Monoclonal Antibody Patents after Centocor v. Abbott". jolt.law.harvard.edu. Arquivado dende o orixinal o 13 de decembro de 2014. Consultado o 12 Dec 2014.
Véxase tamén
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Anticorpo |
Bibliografía
[editar | editar a fonte]- Janeway, CA; Staff, VV. Tradución de Eva Sanz (2003). Inmunobiología: el sistema inmunitario en condiciones de salud y enfermedad. Elsevier España. ISBN 978-84-458-1176-4.
- Peña Martínez, J (Coordinador) (1998). Inmunología. Pirámide. ISBN 84-368-1213-1. Dispoñible unha versión online en http://www.uco.es
Outros artigos
[editar | editar a fonte]- Anticorpo monoclonal
- Autoanticorpo
- Inmunoensaio
- ELISA
- ELISPOT
- Inmunoensaio de polarización fluorescente
- Tecnoloxía IgY
- Inmunoglobulina A IgA
- Inmunoglobulina D IgD
- Inmunoglobulina E IgE
- Inmunoglobulina G IgG
- Inmunoglobulina M IgM
Ligazóns externas
[editar | editar a fonte]- Animacións que representan como se utilizan os anticorpos nas técnicas de ELISPOT e ELISA (en inglés)
- Bibliografía anotada sobre evolución do sistema inmunitario en vertebrados (en inglés)
- Nanobodies (material gráfico) (en castelán)
- Anticorpo, base de datos (en inglés)
- BBC Mundo: Achan un "superanticorpo" contra todos os virus da gripe (en castelán)
