Citometría de fluxo
En biotecnoloxía, a citometría de fluxo é unha tecnoloxía biofísica baseada na impedancia eléctrica e no láser empregada para a contaxe de células, selección de células, detección de biomarcadores e enxeñaría de proteínas, na que se suspenden as células nunha corrente dun fluído e fanse pasar por un aparello electrónico de detección. Un citómetro de fluxo permite a análise multiparamétrica simultánea das características físicas ou químicas de ata miles de partículas (células, proteínas...) por segundo.
A citometría de fluxo utilízase rutineiramente no diagnóstico de trastornos da saúde, especialmente cancros hematolóxicos, pero ten moitas outras aplicacións en investigación básica, práctica clínica e probas clínicas. Unha variante común desta técnica implica ligar a capacidade analítica do citómetro de fluxo a un aparello para escoller as partículas, para así separalas fisicamente e, por tanto, purificar as partículas de interese baseándose nas súas propiedades ópticas. Tales procesos denomínanse selección ou clasificación de células, e o instrumento adoita denominarse "selector de células".
Historia[editar | editar a fonte]
O primeiro aparello de citometría de fluxo baseado na impedancia, que usaba o principio de Coulter, foi patentado nos Estados Unidos en 1953 por Wallace H. Coulter. Mack Fulwyler foi o inventor do predecesor dos citómetros de fluxo de hoxe en día, especialmente o selector de células.[1] Fulwyler desenvolveu isto en 1965 coa súa publicación na revista Science.[2] O primeiro citómetro de fluxo baseado en fluorescencia (ICP 11) foi desenvolvido en 1968 por Wolfgang Göhde na Universidade de Münster, patentado ese mefsmo ano[3] e comezado a comercializar en 1968/69 polo desenvolvedor alemán e fabricante Partec a través de Phywe AG en Göttingen. Nesa época, os métodos de absorción eran aínda os preferidos por outros científicos en vez dos métodos de fluorescencia.[4] Pouco despois, desenvolvéronse instrumentos para a citometría de fluxo, incluíndo o citofluorógrafo (1971) de Bio/Physics Systems Inc. (posteriormente chamada Ortho Diagnostics), o PAS 8000 (1973) de Partec, o primeiro FACS (fluorescence-activated cell sorting ou selector de células activado por fluorescencia) de Becton Dickinson (1974), o ICP 22 (1975) de Partec/Phywe e o Epics de Coulter (1977/78). O primeiro citómetro de fluxo de impedancia de alta frecuencia sen necesidade de etiquetaxe baseado nun "lab-on-chip" microfluídico patentado, Ampha Z30, foi introducido por Amphasys (2012).
Nome[editar | editar a fonte]
O nome orixinal da tecnoloxía de fluxo baseada na fluorescencia foi "citofotometría de pulsos" (en alemán: Impulszytophotometrie), segundo a primeira patente dunha aplicación da citometría de fluxo baseada na fluorescencia. Na 5ª Conferencia da Fundación de Enxeñaría Americana sobre Citoloxía Automatizada celebrada en Pensacola (Florida) en 1976 , oito anos despois da introdución do primeiro citometro de fluxo baseado en fluorescencia (1968), acordouse usar comunmente o nome "citometría de fluxo", un termo que rapidamente se fixo popular entre os científicos.[5]
Principios[editar | editar a fonte]

Un raio de luz monocromático, usualmente de luz láser, é dirixido cara a un finísimo chorro de líquido enfocado hidrodinamicamente. Colócanse unha serie de detectores no punto no que o chorro de líquido atravesa o raio de luz. Un colócase en liña co raio de luz (a este detector chámaselle FSC, por Forward Scatter ou detector de dispersión frontal), e varios angularmente á traxectoria do raio (a estes chámaselles SSC, por Side Scatter, ou detectores de dispersión lateral); ademais dun ou máis detectores de fluorescencia. Cada unha das partículas suspendidas cun tamaño de entre 0,2 a 0,150 micrómetros que atravesan o raio de luz e dispérsano, e as substancias químicas fluorescentes que se encontran dentro ou adheridas ás partículas son excitadas ata emitir luz dunha lonxitude de onda maior que a da fonte de luz. Esta combinación de luz dispersada e fluorescencia é recollida polos detectores, e por medio dunha análise da flutuación da intensidade luminosa recollida por cada detector, é posible derivar varios tipos de información sobre a estrutura física e química de cada partícula individual.
O detector frontal ou FSC dá información sobre o volume da partícula, mentres que os detectores laterais ou SSC dan información sobre a complexidade interna da mesma (por exemplo a forma do núcleo celular, a cantidade e tipo de gránulos citoplasmáticos ou a rugosidade da membrana plasmática). Isto débese a que os compoñentes internos das células dispersan a luz. Algúns dos citómetros de fluxo presentes no mercado eliminaron a necesidade dun detector de fluorescencia e utilizan só a información de luz dispersada para as medicións. Outros citómetros de fluxo poden xerar gráficos dos datos obtidos da fluorescencia das células, luz dispersada e luz transmitida.
Citómetros de fluxo[editar | editar a fonte]

Os modernos citómetros de fluxo poden analizar moitos miles de partículas por segundo, en "tempo real," e, se é configurado como selector de células, pode separar activamente e illar partículas a taxas similares coas propiedades ópticas especificadas. Un citómetro de fluxo é similar a un microscopio, excepto en que en vez de producir unha imaxe da célula, o citómetro de fluxo ofrece unha cuantificación automatizada a grande escala e de alto rendemento dos parámetros ópticos especificados e célula por célula. Para analizar tecidos sólidos, debe prepararse primeiro unha suspensión de células sinxelas.
Un citómetro de fluxo ten cinco compoñentes principais: unha cela de fluxo, un sistema de medición, un detector, un sistema de amplificación e un computador para a análise de sinais. A célula de fluxo ten unha corrente de líquido (fluído envolvente), que transporta e aliña as células para que pasen en fila unha por unha a través do raios de luz para seren detectadas. O sistema de medición xeralmente usa medidas de impedancia (ou condutividade) e sistemas ópticos, como lámpadas (de mercurio ou xenon); láseres arrefriados con auga de alta potencia (de argon, cripton, láser de tinguidura); láseres arrefriados con aire de baixa potencia (argon (488 nm), vermello-HeNe (633 nm), verde-HeNe, HeCd (UV)); láseres de díodo (azul, verde, vermello, violeta) que orixinan sinais de luz. O detector e o sistema de conversión analóxica a dixital (ADC) converten as medicións analóxicas de luz dispersada fontalmente (FSC, do inglés forward-scattered ligth) e a luz dispersada lateralmente (SSC, do inglés side-scattered light) así como os sinais de fluorescencia específicos de tinguidura en sinais dixitais, que poden ser procesados por un computador. O sistema de amplificación pode ser linear ou logarítmico.
O proceso de recollida de datos a partir de mostras usando o citómetro de fluxo denomínase 'adquisición'. A adquisición realízase por medio dun computador conectado fisicamente ao citómetro de fluxo, e o software que manexa a interface dixital co citómetro. O software pode axustar parámetros (por exemplo, voltaxe, compensación) para que se poida examinar a mostra, e tamén axuda a mostrar información da mostra inicial mentres adquire os datos da mostra para asegurar que os parámetros se establecen correctamente. Os primeiros citómetros de fluxo eran, en xeral, aparellos experimentais, pero os avancces tecnolóxicos permiten amplas aplicacións para o seu uso en diversas tarefas de investigación ou clínicas. Debido a estes desenvolvementos, desenvolveuse un considerable mercado de instrumentos, software de análise,e de reactivos usados para a adquisición, como os anticorpos etiquetados fluorescentemente.
Os instrumentos modernos xeralmente teñen múltiples láseres e detectores de fluorescencia. O instrumento comercial con máis láseres e detectores ten dez láseres[6] e 30 detectores de fluorescencia.[7] Incrementar o número de láseres e detectores permite a etiquetaxe de moitos anticorpos, e pode identificar máis precisamente unha poboación diana polos seus marcadores fenotípicos. Certos instrumentos poden incluso tomar imaxes dixitais de células individuais, o que posibilita a análise da localización do sinal fluorescente dentro ou na superficie das células.
Análise de datos[editar | editar a fonte]
Compensación[editar | editar a fonte]
Os fluorocromos teñen un amplo espectro de fluorescencia. Cando se usa máis dun fluorocromo, poden producirse solapamentos entre os espectros dos fluorocromos. Esta situación denomínase solapamento de espectro e debe ser evitada. Por exemplo, no espectro de emisión de FITC (fluoresceína isotiocianato) e PE (R-ficoeritrina) a luz emitida pola fluoresceína solápase na mesma lonxitude de onda a medida que pasa a través do filtro usado para PE. Este solapamento espectral é corrixido eliminando unha parte do sinal da FITC do sinal da PE ou viceversa. Este proceso denomínase compensación de cor, que calcula un fluorocromo como unha porcentaxe para medilo.[8]
"A compensación é o proceso matemático polo cal corriximos os datos de fluxo citométrico multiparámetros para o solapamento espectral. Este solapamento, ou “spillover" ("excedente, rebordamento”), é resultado do uso de tinguiduras fluorescentes que son medibles en máis dun detector; este spillover está correlacionado por unha constante coñecida como coeficiente de spillover. O proceso de compensación é unha aplicación simple da álxebra linear, co obxectivo de corrixir os spillovers de todas as tinguiduras nos detectores, tal que no resultado os datos están efectivamente normalizados para que cada parámetro conteña información dunha soa tinguidura. En xeral, a nosa capacidade de procesar datos é máis efectiva cando a visualización de datos se presenta sen correlacións innecesarias".[8]
En xeral, cando se mostran os gráficos dun ou máis parámetros é para mostrar que os outros parámetros non contribúen á distribución presentada. Ata agora non se descubriu ningunha ferramenta para mostrar eficientemente parámetros multidimensionais. A compensación é moi importante para ver a distinción entre células.
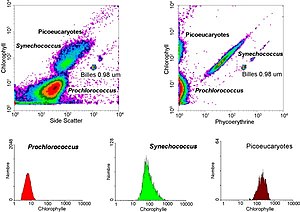
Gating[editar | editar a fonte]
Os datos xerados polos citómetros de fluxo poden ser representados graficamente nunha soa dimensión, producindo un histograma, ou en gráficos de puntos (dot plots) en dúas dimensións ou mesmo en tres dimensións. As rexións destes gráficos poden ser separadas secuencialmente baseándose na intensidade da fluorescencia, ao crear unha serie de extraccións, denominadas "gates" (portais). Hai protocolos de gating específicos para o diagnóstico e propósitos clínicos, especialmente en hematoloxía. As células separadas individuais son a miúdo distingidas dos dobretes de células ou agregados maiores polo seu "tempo de voo" (chamado tamén "ancho de pulso") por medio dun raio láser estreitamente enfocado.[9]
Os gráficos ou plots están a miúdo feitos a escalas logarítmicas. Como o espectro de emisión de diferentes tinguiduras fluorescentes se solapa,[10][11] os sinais nos detectores teñen que ser compensados electronicamente e computacionalmente. Os datos acumulados usando o citómetro de fluxo poden ser analizados usando software, por exemplo: JMP, WinMDI,[12] Flowing Software,[13] e o baseado nunha web Cytobank[14] (todos programas gratuítos ou freeware), Cellcion, FCS Express, FlowJo, FACSDiva, CytoPaint (tamén chamado Paint-A-Gate),[15] VenturiOne, CellQuest Pro, Infinicyt ou Cytospec.[16] Unha vez que se recollen os datos, non hai necesidade de permanecer conectados ao citómetro de fluxo e a análise é realizada a maior parte das veces nun computador separado. Isto é especialmente necesario en instalacións centrais onde o uso destas máquinas ten unha alta demanda.
Análise computacional[editar | editar a fonte]
Recentes progresos sobre a identificación de poboacións automatizadas usando métodos computacionais ofrecéronse como alternativa ás estratexias de gating tradicionais. Os sistemas de identificación automatizados poderían potencialmente axudar a descubrir poboacións raras ou ocultas. Entre os métodos automatizados representativos están FLOCK [17] en Immunology Database e Analysis Portal (ImmPort),[18] SamSPECTRAL[19] e flowClust[20][21][22] en Bioconductor e FLAME [23] en GenePattern. T-Distributed Stochastic Neighbor Embedding (tSNE) é un algoritmo deseñado para realizar a redución de dimensionalidade, para permitir a visualización de datos multidimensionais complexos nun "mapa" bidimensional.[24] Diversos esforzos colaborativos deron como resultado un proxecto aberto chamado FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods,[25]) para proporcionar un modo obxectivo de comparar os métodos de agrupamento para avaliar os datos de citometría de fluxo, e tamén para establecer unha guía sobre o uso apropiado e a aplicación deses métodos.
Selección de células activada por fluorescencia[editar | editar a fonte]

A selección de células activada por fluorescencia (Fluorescence-activated cell sorting, FACS) é un tipo especializado de citometría de fluxo. Proporciona un método para a selección dunha mestura heteroxénea de células biolóxicas en dous ou máis contedores, unha célula de cada vez, baseada nas características da dispersión da luz específica e fluorescencia de cada célula.[26] É un instrumento científico útil que proporciona rexistros cuantitativos, obxectivos e rápidos de sinais fluorescentes de células individuais así como a separación física de células de particular interese. A técnica foi ampliada por Len Herzenberg, que foi quen acuñou o termo FACS.[27] Herzenberg recibiu o Premio Quioto en 2006 polo seus traballos pioneiros en citometría de fluxo.
No citómetro a suspensión de células desprázase no centro dunha estreita corrente de líquido que flúe rapidamente. O fluxo disponse de maneira que haxa unha gran separación entre as células en relación co seu diámetro. Un mecanismo de vibración causa que a corrente que leva as células rompa en gotas individuais. O sistema axústase para que haxa unha baixa probabilidade de haber máis dunha célula por gota. Xusto antes de que a corrente se separe en gotiñas, o fluxo pasa a través dunha estación de medida da fluorescencia, onde se mide o carácter fluorescente de cada célula de interese. Un anel que carga electricamente sitúase xusto no punto onde a corrente rompe en gotiñas. Unha carga eléctrica é situada no anel inmediatamente antes de que se mida a intensidade da fluorescencia, e a carga oposta é atrapadada pola gota a medida que se separa da corrente. As gotas cargadas caen pasando por un sistema de deflexión electrostática que desvía as gotas a contedores baseándose na súa carga. Nalgúns sistemas, a carga aplícase directamente á corrente, e a gota que se separa retén unha carga do mesmo signo que a corente. A corrente volve despois ao estado neutro despois de que a gota se desprende.
O acrónimo FACS é unha marca e propiedade de Becton, Dickinson and Company.[28]
Etiquetas[editar | editar a fonte]
Etiquetas fluorescentes[editar | editar a fonte]
Pode utilizarse unha ampla variedade de fluoróforos como etiquetas fluorescentes para a citometría de fluxo.[10] Os fluoróforos, ou simplemente "flúores", únense normalmente a un anticorpo que recoñece unha característica da diana na célula; poden estar tamén ligados a unha entidade química con afinidade pola membrana plasmática ou outra estrutura celular. Cada fluoróforo ten un pico de excitación e lonxitude de onda de emisión característicos, e os espectros de emisión a miúdo solápanse. En consecuencia, a combinación de etiquetas que se poden usar depende da lonxitude de onda da(s) lámpada(s) ou láser(es) usados para excitar os fluorocromos e dos detectores dispoñibles.[29] O número máximo de etiquetas fluorescentes distinguibles crese que é 17 ou 18, e este nivel de complexidade necesita unha optimización laboriosa para limitar os artefactos que se poden producir, así como uns complexos algoritmos de deconvolución para separar o solapamento dos espectros.[30] A citometría de fluxo usa a fluorescencia como unha ferramenta cuantitativa; a máxima sensibilidade da citometría de fluxo non é igualada por outras plataformas de detección de fluorescencia como a microscopía confocal. A sensibilidade á fluorescencia absoluta é xeralmente menor na microscopía confocal porque os sinais fóra de foco son rexeitados polo sistema óptico confocal e porque a imaxe é acumulada en serie a partir das medicións individuais en cada localización a través da célula, o que reduce a cantidade de tempo necesario para recoller o sinal.[31]
Puntos cuánticos[editar | editar a fonte]
Ás veces utilízanse os puntos cuánticos en lugar dos tradicionais fluoróforos debido aos seus picos de emisión máis estreitos.
Marcaxe isotópica[editar | editar a fonte]
A citometría de masas supera o límite de etiquetaxe fluorescente ao utilizar isótopos de lantánidos unidos aos anticorpos. Este método podería teoricamente permitir o uso de 40 a 60 etiquetas distinguibles e a súa eficacia foi demostrada para 30 etiquetas.[30] A citometría de masas é fundamentalmente diferente da citometría de fluxo: as células son introducidas nun plasma, ionizadas e os isótopos asociados son cuantificados por medio da chamada espectrometría de masas de tempo de voo. Aínda que este método permite o uso dun gran número de etiquetas, actualmente ten unha menor capacidade de rendemento que a citometría de fluxo. Tamén destrúe as células analizadas, polo que non é posible a súa recuperación por selección.[30]
Matriz de boliñas citométrica[editar | editar a fonte]
Ademais da capacidade de etiquetar e identificar células individuais por medio de anticorpos fluorescentes, poden medirse tamén os produtos celulares como citocinas, proteínas e outros factores. Similar aos ensaios en sándwich de ELISA, os ensaios de matrices de boliñas citométricas (CBA) usan múltiples poboacións de boliñas ou doas normalmente diferenciadas en tamaño e diferentes niveis de intensidade de fluorescencia para distinguir múltiples analitos nun só ensaio. A cantidade do analito capturada detéctase por medio de anticorpos biotinilados contra un epítopo secundario da proteína, seguido dun tratamento con estreptavidina-R-ficoeritrina. A intensidade de fluorescencia da R-ficoeritrina nas boliñas cuantifícase nun citómetro de fluxo equipado cunha fonte de excitación de 488 nm. As concentracións dunha proteína de interese nas mostras poden obterse comparando os sinais fluorescentes con aqueles dunha curva estándar xerada a partir dunha dilución en serie dunha concentración coñecida do analito. Tamén se adoita denominar matriz de boliñas de citocinas (CBA).
Citometría de fluxo de impedancia[editar | editar a fonte]
Os sistemas de análise de células separadas baseadas na impedancia son xeralmente coñecidos como contadores Coulter. Representan un método ben establecido para contar e distinguir por tamaño virtualmente calquera tipo de célula ou partícula. Recentemente a tecnoloxía sen etiquetas foi mellorada co uso dunha estratexia baseada nun "lab-on-a-chip" e pola aplicación de corrente alterna de alta frecuencia no rango da frecuencia de radio (de 100 kHz a 30 MHz) en vez da corrente continua estática ou os campos de corrente alterna de baixa frecuencia.[32] Esta tecnoloxía patentada permite unha análise de células altamente precisa e proporciona información adicional como a capacitancia de membrana e a súa viabilidade. O tamaño relativamente pequeno e a robustez dos aparellos permiten o uso no lugar en estudos de campo con baterías.
Parámetros medibles[editar | editar a fonte]
Son moitos os parámetros que se poden medir ou estudar utilizando a citometría de fluxo. Velaquí unha lista:
- Apoptose (cuantificación, medición da degradación do ADN, potencial de membrana mitocondrial, cambios de permeabilidade, actividade da caspase)
- Adhesión celular (por exemplo, adhesión patóxeno-célula hóspede)
- Pigmentos celulares como a clorofila ou a ficoeritrina
- Antíxenos da superficie celular (marcadores de cluster de diferenciación ou CD)
- Viabilidade celular
- Caracterización da resistencia a multifármacos (MDR) en células cancerosas
- Análise cromosómica e selección (construción de bibliotecas, pintura de cromosomas)
- Variación no número de copias do ADN (por Flow-FISH ou tecnoloxía BACs-on-Beads)
- Actividade encimática
- Glutatión
- Antíxenos intracelulares (varias citocinas, mediadores secundarios etc.)
- Fluidez da membrana
- Monitorización da electropermeabilización de células
- Antíxenos nucleares
- Explosión oxidativa
- pH, calcio ionizado intracelular, magnesio, potencial de membrana
- Expresión e localización de proteínas
- Modificación de proteínas, fosfoproteínas
- A dispersión da luz pode utilizarse para medir o volume (por dispersión frontal, FSC) e a complexidade morfolóxica (por dispersión lateral, SSC) de células ou outras partículas, mesmo daquelas que non son fluorescentes.
- Contido total de ADN (análise do ciclo celular, cinética celular, proliferación celular, ploidía, aneuploidía, endorreplicación etc.)
- Contido total de ARN
- Produtos transxénicos in vivo, especialmente a proteína fluorescente verde ou proteínas fluorescentes relacionadas
- Varias combinacións (antíxenos de superficie/ADN etc.).
Aplicacións[editar | editar a fonte]
Esta tecnoloxía ten aplicacións en numerosos campos, como a bioloxía molecular, patoloxía, inmunoloxía, bioloxía das plantas e bioloxía mariña.[33] Ten unha ampla aplicación en medicina, especialmente en transplantes, hematoloxía, inmunoloxía de tumores e quimioterapia, diagnóstico prenatal, xenética e selección de esperma para a preselección do sexo. Ademais, é amplamente utilizada en investigación para a detección de danos no ADN,[34][35] clivaxe por caspases e apoptose.[36] En neurociencia, pode tamén analizarse a coexpresión de antíxenos da superficie celular ou intracelulares.[37] En bioloxía mariña, as propiedades autofluorescentes do plancto fotosintético poden ser aproveitadas pola citometría de fluxo para caracterizar a abundancia e a estrutura da comunidade. En enxeñaría de proteínas, a citometría de fluxo utilízase en conxunción coa yeast display e a bacterial display para identificar variantes de proteínas presentes na superficie das células coas propiedades desexadas.
Notas[editar | editar a fonte]
- ↑ US 3380584, Mack Fulwyler, "Particle Separator", issued 1965-06-01
- ↑ Fulwyler MJ (1965). "Electronic separation of biological cells by volume". Science 150 (3698): 910–911. PMID 5891056. doi:10.1126/science.150.3698.910.
- ↑ DE 1815352, Wolfgang Dittrich & Wolfgang Göhde, "Flow-through Chamber for Photometers to Measure and Count Particles in a Dispersion Medium"
- ↑ Kamentsky in Proceedings of the 1968 Conference „Cytology Automation" (1970), edited by D. M. D. Evans.
- ↑ Sack, Ulrich; et al. Zelluläre Diagnostik. Karger Publishers (2006).
- ↑ "Centenary Institute - Resources & Equipment". Arquivado dende o orixinal o 18 de febreiro de 2017. Consultado o 28 de marzo de 2018.
- ↑ "BD Biosciences - Special Order Products".
- ↑ 8,0 8,1 Roederer, M. (2001-11-01). "Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats". Cytometry 45 (3): 194–205. ISSN 0196-4763. PMID 11746088. doi:10.1002/1097-0320(20011101)45:3<194::aid-cyto1163>3.0.co;2-c.
- ↑ Sharpless T, Traganos F, Darzynkiewicz Z, Melamed MR. (1975) Flow cytofluorometry: Discrimination between single cells and cell aggregates by direct size measurements. Acta Cytol 19:577-581. PMID 1108568
- ↑ 10,0 10,1 "Fluorochrome Table (Tools)". www.thefcn.org.
- ↑ "Fluorochrome Table". Arquivado dende o orixinal o 20 de outubro de 2014. Consultado o 28 de marzo de 2018.
- ↑ "TSRI Cytometry Software Page". Arquivado dende o orixinal o 25 de agosto de 2016. Consultado o 2009-09-03.
- ↑ "Flowing Software Web Page". Consultado o 2013-02-22.
- ↑ "Cytobank Main Page". Consultado o 2013-05-28.
- ↑ "Advanced Software for Flow Cytometry". leukobyte.com. Arquivado dende o orixinal o 29 de decembro de 2017. Consultado o 28 de marzo de 2018.
- ↑ "PUCL Cytometry Software Page". Consultado o 2011-07-07.
- ↑ Qian Y, Wei C, Eun-Hyung Lee F, Campbell J, Halliley J, Lee JA, Cai J, Kong YM, Sadat E, Thomson E, Dunn P, Seegmiller AC, Karandikar NJ, Tipton CM, Mosmann T, Sanz I, Scheuermann RH (2010). "Elucidation of seventeen human peripheral blood B-cell subsets and quantification of the tetanus response using a density-based method for the automated identification of cell populations in multidimensional flow cytometry data". Cytometry Part B. 78 Suppl 1: S69. PMC 3084630. PMID 20839340. doi:10.1002/cyto.b.20554.
- ↑ "Immunology Database and Analysis Portal". Arquivado dende o orixinal o 26 de xullo de 2011. Consultado o 2009-09-03.
- ↑ Zare H, Shooshtari P, Gupta A, Brinkman RR (2010). "Data reduction for spectral clustering to analyze high throughput flow cytometry data". BMC Bioinformatics 11: 403. PMC 2923634. PMID 20667133. doi:10.1186/1471-2105-11-403.
- ↑ "flowClust". Consultado o 2009-09-03.
- ↑ Lo K, Brinkman RR, Gottardo R (2008). "Automated gating of flow cytometry data via robust model-based clustering". Cytometry Part A 73 (4): 321–332. PMID 18307272. doi:10.1002/cyto.a.20531.
- ↑ Lo, Kenneth; Hahne, Florian; Brinkman, Ryan R.; Gottardo, Raphael (14 May 2009). "flowClust: a Bioconductor package for automated gating of flow cytometry data". BMC Bioinformatics 10: 145. doi:10.1186/1471-2105-10-145 – vía BioMed Central.
- ↑ "FLow analysis with Automated Multivariate Estimation (FLAME)". Arquivado dende o orixinal o 21 de agosto de 2009. Consultado o 2009-09-03.
- ↑ Martin, Wattenberg,; Fernanda, Viégas,; Ian, Johnson, (2016-10-13). "How to Use t-SNE Effectively". Distill.
- ↑ "FlowCAP - Flow Cytometry: Critical Assessment of Population Identification Methods". Consultado o 2009-09-03.
- ↑ FlowMetric. "Sorting Out Fluorescence Activated Cell Sorting" (en inglés). Consultado o 2017-11-09.
- ↑ Julius MH, Masuda T, Herzenberg LA (1972). "Demonstration that antigen-binding cells are precursors of antibody-producing cells after purification with a fluorescence-activated cell sorter". Proc. Natl. Acad. Sci. U.S.A. 69 (7): 1934–8. PMC 426835. PMID 4114858. doi:10.1073/pnas.69.7.1934.
- ↑ "FACS MultiSET System" (PDF). Becton Dickinson. Arquivado dende o orixinal (PDF) o 18 de outubro de 2006. Consultado o 2007-02-09.
- ↑ Loken MR (1990). "Immunofluorescence Techniques in Flow Cytometry and Sorting" (2nd ed.). Wiley: 341–53.
- ↑ 30,0 30,1 30,2 Ornatsky O, Bandura D, Baranov V, Nitz M, Winnik MA, Tanner S (2010). "Highly multiparametric analysis by mass cytometry". J. Immunol. Methods 361 (1–2): 1–20. PMID 20655312. doi:10.1016/j.jim.2010.07.002.
- ↑ Basiji DA, Ortyn WE, Liang L, Venkatachalam V, Morrissey P (2007). "Cellular image analysis and imaging by flow cytometry". Clin. Lab. Med. 27 (3): 653–70, viii. PMC 2034394. PMID 17658411. doi:10.1016/j.cll.2007.05.008.
- ↑ Cheung, Karen C.; Berardino, Marco Di; Schade-Kampmann, Grit; Hebeisen, Monika; Pierzchalski, Arkadiusz; Bocsi, Jozsef; Mittag, Anja; Tárnok, Attila. "Microfluidic impedance-based flow cytometry". Cytometry Part A 77A (7): 648–666. doi:10.1002/cyto.a.20910.
- ↑ Murphy RW, Lowcock LA, Smith C, Darevsky IS, Orlov N, MacCulloch RD, Upton DE (1997). "Flow cytometry in biodiversity surveys: methods, utility and constraints". Amphibia-Reptilia 18: 1–13. doi:10.1163/156853897x00260.
- ↑ Tanaka T, Halicka HD, Huang X, Traganos F, Darzynkiewicz Z. (2006) Constitutive histone H2AX phosphorylation and ATM activation, the reporters of DNA damage by endogenous oxidants. Cell Cycle 5:1940-1945, PMID 16940754
- ↑ MacPhail SH, Banáth JP, Yu Y, Chu E, Olive PL.Cell cycle-dependent expression of phosphorylated histone H2AX: reduced expression in unirradiated but not X-irradiated G1-phase cells.Radiat Res. 2003 Jun;159(6):759-67. PMID 12751958
- ↑ Darzynkiewicz Z, Juan G, Li X, Gorczyca W, Murakami, M. Traganos F. (1997) Cytometry in cell necrobiology. Analysis of apoptosis and accidental cell death (necrosis). Cytometry 27:1-20, PMID 9000580.
- ↑ Menon, Vishal; Thomas, Ria; Ghale, Arun R.; Reinhard, Christina; Pruszak, Jan (2014-12-18). "Flow Cytometry Protocols for Surface and Intracellular Antigen Analyses of Neural Cell Types". Journal of Visualized Experiments (en inglés) (94). ISSN 1940-087X. PMC 4396953. PMID 25549236. doi:10.3791/52241.
Véxase tamén[editar | editar a fonte]
| Commons ten máis contidos multimedia sobre: Citometría de fluxo |
Outros artigos[editar | editar a fonte]
- Contador Coulter
- Citometría
- Dielectroforese
- Estándar da citometría de fluxo
- Citometría de masas
- Microfluorimetría
Bibliografía[editar | editar a fonte]
- Flow Cytometry in Microbiology" by David Lloyd ISBN 3-540-19796-6
- Practical Flow Cytometry by Howard M. Shapiro. ISBN 0-471-41125-6
- Flow Cytometry for Biotechnology by Larry A. Sklar. ISBN 0-19-515234-4
- Handbook of Flow Cytometry Methods by J. Paul Robinson, et al. ISBN 0-471-59634-5
- Current Protocols in Cytometry, Wiley-Liss Pub. ISSN 1934-9297
- Flow Cytometry in Clinical Diagnosis, v4, (Carey, McCoy, e Keren, eds), ASCP Press, 2007. ISBN 0-89189-548-5
- ′′Essential Cytometry Methods′′ by Z. Darzynkiewicz, J.P. Robinson e M. Roederer, Elsevier/Academic Press, 2010. ISBN 978-0-12-375045-7
- ′′Ormerod, M.G. (ed.) (2000) Flow Cytometry — A practical approach. 3rd edition. Oxford University Press, Oxford, UK. ISBN 0-19-963824-1
- ′′Ormerod, M.G. (1999) Flow Cytometry. 2nd edition. BIOS Scientific Publishers, Oxford. ISBN 1-85996-107-X
- Flow Cytometry — A basic introduction. Michael G. Ormerod, 2008. ISBN 978-0-9559812-0-3
- ′′ Methods in Cell Biology, Cytometry, 4th edition, Vol. 75. by Z. Darzynkiewicz, M. Roederer e H.J. Tanke. Elsevier /Academic Press, 2004, ISBN 0-12-480283-4.
- ′′Recent Advances in Cytometry. PART A′′ by Z. Darzynkiewicz et al., Methods in Cell Biology, Vol. 102, Elsevier/Academic Press, 2011. ISBN 978-0-12-374912-3.
- ′′Recent Advances in Cytometry. PART B′′ by Z. Darzynkiewicz et al., Methods in Cell Biology, Vol. 103, Elsevier/Academic Press, 2011. ISBN 978-0-12-385493-3
Ligazóns externas[editar | editar a fonte]
- Flow cytometry Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Flow cytometry - How does it work? (Universidade do Estado de Oregón)
- Flow Cytometry Resource Tool (Novus Biologicals)
- Powerpoint lectures on flow cytometry Arquivado 02 de abril de 2018 en Wayback Machine. (Universidade Purdue)
- Searchable database of fluorescent dyesArquivado 18 de decembro de 2014 en Wayback Machine. (Universidade de Tecnoloxía de Graz)
- Table of fluorochromes (Instituto Salk)
- Java Fluorescence Spectrum Viewer Arquivado 26 de xaneiro de 2009 en Wayback Machine. (Becton, Dickinson and Company)
- The History of the Cell Sorter Interviews from the Arquivos da Institución Smithsonian
