Yersinia pseudotuberculosis
| Yersinia pseudotuberculosis | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||
| Clasificación científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| 'Yersinia pseudotuberculosis' (Pfeiffer 1889) Smith & Thal 1965 | |||||||||||||||
Yersinia pseudotuberculosis é unha especie de bacteria gramnegativa e urease positiva, que causa a febre escarlatinoide en humanos, os cales poden ocasionalmente ser infectados por vía zoonótica, xeralmente a través de alimentos.[1] Os animais tamén poden ser infectados por esta bacteria.
Foi descrita en 1889 e tivo os nomes Pasteurella pseudotuberculosis e Shigella pseudotuberculosis e en 1965 estableceuse o nome Yersinia pseudotuberculosis.[2]
Patoxénese[editar | editar a fonte]
En animais, Y. pseudotuberculosis pode causar síntomas parecidos aos da tuberculose, como necrose localizada de tecidos e granulomas no bazo, fígado, e ganglios linfáticos.
Nos humanos, os síntomas da febre escarlatinoide son similares aos das infeccións producidas por Yersinia enterocolitica (febre e dor abdominal no lado dereito), coa excepción do compoñente diarreico, que está xeralmente ausente, o que ás veces fai que a condición resultante sexa difícil de diagnosticar. As infeccións por Y. pseudotuberculosis poden semellar unha apendicite, especialmente en nenos e adultos novos, e, en raros casos, a doenza pode causar doenzas da pel (eritema nodoso), rixidez articular e dor (artrite reactiva), ou unha dispersión da bacteria polo sangue (bacteremia).
A febre escarlatinoide xeralmente se fai aparente 10 días despois da exposición e tipicamente dura dunha a tres semanas sen tratamento. En casos complexos ou nos que afectan a pacientes inmunocomprometidos, poden ser necesarios antibióticos para conseguir a resolución; poden ser efectivos a ampicilina, aminoglicósidos, tetraciclina, cloranfenicol, ou unha cefalosporina.
Os síntomas de febre e dor abdominal parecidos aos da apendicite (en realidade dunha linfadenite mesentérica) [3][4][5] asociados coa infección por Y. pseudotuberculosis non son típicos dos síntomas de diarrea e vómitos debidos a intoxicacións alimentarias clásicas. Aínda que Y. pseudotuberculosis xeralmente só pode colonizar os hóspedes por rutas periféricas e causar enfermidades graves en individuos inmunocomprometidos, no caso de que esta bacteria consiga acceder á corrente sanguínea ten unha LD50 comparable á de Y. pestis a só 10 CFU.[6]
Relación con Y. pestis[editar | editar a fonte]
Xeneticamente, o patóxeno que causa a peste bibónica, Y. pestis, é moi similar a Y. pseudotuberculosis. O axente da peste parece que evolucionou a partir de Y. pseudotuberculosis hai entre 1.500 e 20.000 anos.[7]
Factores de virulencia[editar | editar a fonte]
Para facilitar a adhesión, invasión, e colonización dos seus hóspedes, esta bacteria posúe moitos factores de virulencia. Os superantíxenos, adhesións bacterianas, e as accións das Yops (que son proteínas bacterianas que antes se pensaba que eran "proteínas da membrana externa de Yersinia") que están codificadas no "plásmido para a virulencia de Yersinia", normalmente chamado pYV, causan a patoxénese no hóspede e permiten ás bacterias vivir parasiticamente.
pYV[editar | editar a fonte]
O plásmido pYT de 70 kb é fundamental para a patoxenicidade de Yersinia, xa que contén moitos xenes que codifican factores de virulencia e a súa perda orixina a ausencia de virulencia en todas as especies de Yersinia.[6] Unha "rexión central" (core) de 26 kb do pYV contén os xenes ysc, que regulan a expresión e secreción das proteínas Yops.[5] Moitas proteínas Ysc tamén se ensamblan para formar un aparato secretor de tipo III, que segrega moitas Yops no citoplasma da célula hóspede coa axuda do "aparato de translocación", construído con YopB e YopD.[8][9] Esta rexión central tamén inclúe aos xenes yopN, yopB, yopD, tyeA, lcrG, e lcrV, que tamén regulan a expresión xénica das Yops e axudan a translocar as Yops secretoras na célula diana.[5] Por exemplo, as proteínas YopN e TyeA están situadas como un tapón no aparato polo que só o seu cambio conformacional, inducido pola súa interacción con certas proteínas da membrana do hóspede, causa o desbloqueo da vía secretora.[5][10] A secreción regúlase deste xeito para que as proteínas non sexan expulsadas á matriz extracelular e orixinen unha resposta inmunitaria. Como esta vía proporciona selectividade de secreción, é un factor de virulencia.
Yops efectoras[editar | editar a fonte]
A diferenza dos produtos dos xenes ysc e yop mencionados antes, as Yops que actúan directamente sobre as células hóspede para causar efectos citopatolóxicos ("Yops efectoras") están codificadas por xenes pYV que están fóra da rexión central ou core.[5] A única excepción é LcrV, que tamén se chama "Yop versátil" polos dous papeis que ten como Yop efectora e reguladora.[5] A función combinada destas Yops efectoras permite á bacteria resistir a súa internalización en células intestinais inmunitarias e evadirse das accións bactericidas dos neutrófilos e macrófagos. Dentro da bacteria, estas Yops únense a proteínas Sycs codificadas no pYV (que son chaperonas de Yop específicas), que impiden a interacción prematura con outras proteínas e guían as Yops a un aparato secretorio de tipo III.[9] Ademais do complexo Syc-Yop, as Yops están tamén etiquetadas para a secreción de tipo III polos primeiros 60 nucleótidos do seu transcrito de ARNm correspondente ou polos correspondentes 20 primeiros aminoácido N-terminais.[4] As proteínas LcrV, YopQ, YopE, YopT, YopH, YpkA, YopJ, YopM, e YadA son segregadas todas pola vía secretora de tipo III.[4][5][10] A LcrV inhibe a quimiotaxe de neutrófilos e a produción de citocinas, facilitando que Y. pseudotuberculosis forme grandes colonias sen inducir fallos sistémicos[10] e, con YopQ, contribúe ao proceso de translocación ao traer a YopB e YopD á membrana plasmática eucariótica para que formen poros.[4][11] Ao causaren a despolarización dos filamentos de actina, YopE, YopT, e YpkA resisten a endocitose das células intestinais e a fagocitose mentres producen cambios citotóxicos na célula hóspede. YopT únese á Rho GTPase, normalmente chamada "RhoA", e desacóplaa da membrana, deixándoa nun estado inactivo como RhoA-GDI (undida ao inhibidor da disociación do nucleótido guanina),[12] mentres que YopE e YpkA converten as proteínas Rho ao seu estado inactivo unido a GDP ao expresaren actividade de GTPase.[10] YpkA tamén cataliza a autofosforilación de serinas, polo que pode ter funcións reguladoras en Yersinia[13] ou minar as fervenzas de sinalización da resposta inmunitaria da célula hóspede, xa que YpkA está destinada ao lado citoplasmático da membrana plasmática do hóspede.[14] YopH actúa sobre os sitios de adhesión focal ao desfosforilar varios residuos de fosfotirosina na quinase de adhesión focal (FAK) e nas proteínas de adhesión focal paxilina e p130.[15] Como a fosforilación de FAK está implicada na captación de yersinias[16] e tamén das respostas de células T e B á unión ao antíxeno,[10] YopH orixina efectos antifagocíticos e outros efectos antiinmunes. YopJ, que comparte un operón con YpkA, "...interfire coas actividades de quinase MAP (proteína activada por mitóxeno) da JNK (c-Jun N-terminal quinase), p38, e da quinase regulada por sinal extracelular",[17] o que leva á apoptose do macrófago.[4] Ademais, YopJ inhibe a liberación de TNF-α en moitos tipos celulares, posiblemente por medio dunha acción inhibidora sobre NF-κB, suprimindo a inflamación e a resposta inmune.[18] YopM, por medio da secreción a través dunha vía de tipo III e a súa localización no núcleo por un método dependente de microtúbulo e asociado a vesícula, pode alterar o crecemento da célula hóspede ao unirse á RSK (quinase ribosómica S6), que regula os xenes de regulación do ciclo celular.[10] Un feito interesante é que YadA perdeu as súas funcións de adhesión,[19] resistencia á opsonización, resistencia á fagocitose, e resistencia ao explosión respiratoria[20][21] en Y. pseudotuberculosis debido a unha mutación de corremento da pauta de lectura causada pola deleción dun só par de bases no xene yadA en comparación co yadA de Y. enterocolitica; non obstante, aínda é segregada por medio dunha secreción de tipo III.[22] Os xenes yop, yadA, ylpA, e o operón virC son considerados o "regulón Yop", xa que están corregulados pola proteína VirF, codificada en pYV. Á súa vez o xene virF está termorregulado. A 37 °C a Ymo codificada no cromosoma, que regula o superenrolamento do ADN arredor do xene virF, cambia de conformación, o que permite a expresión da proteína VirF, a cal despois regula á alza o regulón Yop.[23]
Adhesion[editar | editar a fonte]
Y. pseudotuberculosis adhírese fortemente ás células intestinais por medio de proteínas codificadas no cromosoma[4] para que poida producirse a secreción de Yop, para evitar que as bacterias sexan retiradas por efecto do peristaltismo, e poidan invadir as células diana hóspedes. Unha proteína transmembrana chamada invasina, facilita estas funcións ao unirse ás integrinas αβ1 da célula hóspede.[24] Por medio desta unión, as integrinas agrúpanse, e así activan a FAK, e causan unha reorganización correspondente do citoesqueleto.[4][24] A subseguinte entrada das bacterias unidas ocorre cando as Yops que despolimerizan a actina non se expresan.[10] A proteína codificada no "locus de adhesión de invasión" denominado Ail tamén confire adhesión e capacidades invasivas ás yersinias[25] á vez que interfire coa unión do complemento sobre a superficie bacteriana.[26] Para incrementar a especificidade de unión, o antíxeno fibrilar pH6 serve para unir a bacteria ás células diana intestinais só cando é termoinducido.[27]
Superantíxenos[editar | editar a fonte]
Certas cepas de Y. pseudotuberculosis expresan unha exotoxina superantixénica chamada YPM, ou o mitóxeno derivado de Y. pseudotuberculosis, no xene cromosómico ypm.[28] YPM únese especificamente e causa a proliferación de linfocitos T que expresan as rexións variables Vβ3, Vβ7, Vβ8, Vβ9, Vβ13.1, e Vβ13.2 [29] con preferencia por células T CD4+, aínda que se produce tamén a activación dalgunhas células T CD8+.[3] Esta expansión de células T pode causar esplenomegalia acoplada con sobreprodución de IL-2 e IL-4.[30] Como a administración de anticorpos monoclonais anti-TNF-α e anti-IFN-γ neutraliza a toxicidade de YPM in vivo,[28] estas citocinas son en gran medida responsables dos danos causados indirectamente pola exotoxina. As cepas que levan o xene da exotoxina son raras nos países occidentais, onde a doenza, cando chega a ser aparente, maniféstase maiormente con síntomas leves, mentres que máis do 95% das cepas nos países do Oriente asiático conteñen ypm[31] e están correlacionadas coa febre de Izumi e a enfermidade de Kawasaki.[32] Aínda que o superantíxeno supón a maior ameaza para a saúde do hóspede, todos os factores de virulencia contribúen á viabilidade de Y. pseudotuberculosis in vivo e definen as características patoxénicas da bacteria. Y. pseudotuberculosis pode vivir extracelularmente debido aos seus formidables mecanismos de resistencia á fagocitose e opsonización por medio da expresión de Yops e da vía de tipo III;[9] porén, pola limitada acción de pYV, pode poboar as células hóspede, especialmente os macrófagos, intracelularmente para evadir as respostas inmunes e ser diseminada polo corpo.[33]
| YpM | |||||||||
|---|---|---|---|---|---|---|---|---|---|
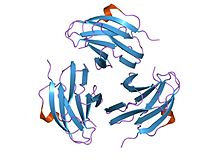 estrutura cristalina do mitóxeno derivado de Yersinia pseudotuberculosis (ypm) | |||||||||
| Identificadores | |||||||||
| Símbolo | YpM | ||||||||
| Pfam | PF09144 | ||||||||
| InterPro | IPR015227 | ||||||||
| SCOPe | 1pm4 / SUPFAM | ||||||||
| |||||||||
Función[editar | editar a fonte]
Os mitóxenos derivados de Yersinia pseudotuberculosis (YpM) son superantíxenos, que poden activar excesivamente as células T ao unirse ao receptor de células T. Como YpM pode activar grandes cantidades de poboacións de células T, isto dá lugar á liberación de citocinas inflamatorias.
Estrutura[editar | editar a fonte]
Algúns membros da familia dos mitóxenos de Yersinia pseudotuberculosis presentan unha estrutura secundaria en sándwich que consiste en 9 febras en dúas follas beta, nunha topoloxía de tipo biscoito enrolado (jelly-roll). O peso molecular de YpM é de aproximadamente 14 kDa. Estruturalmente, é diferente a calquera outro superantíxeno, mais é moi similar ao factor de necrose tumoral e a proteínas de cápsides virais. Isto suxire unha posible relación evolutiva.[34]
Subfamilias[editar | editar a fonte]
Caracterizáronse algunhas variantes altamente homólogas de YPM, como YPMa, YPMb, e YPMc.
Notas[editar | editar a fonte]
- ↑ Ryan KJ; Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed. ed.). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ Jani, Asim (2003). "Pseudotuberculosis (Yersina)". Consultado o 2006-03-04.
- ↑ 3,0 3,1 Carnoy, C.; Lemaitre, N.; Simonet, M. (2005). "The superantigenic toxin of Yersinia pseudotuberculosis". En Ladant, Daniel; Alouf, Joseph E.; Popoff, Michel R. The Comprehensive Sourcebook of Bacterial Protein Toxins. Academic Press. pp. 862–871. ISBN 978-0-08-045698-0.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Robins-Browne, R.; Hartland, E. (2003). "Yersinia species". En Miliotis, Marianne D.; Bier, Jeffrey W. International Handbook of Foodborne Pathogens. CRC Press. pp. 323–355. ISBN 978-0-203-91206-5.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Lindler, L. (2004). "Virulence plasmids of Yersinia: characteristics and comparison". En Funnell, B.E.; Phillips, G.J. Plasmid biology. ASM Press. pp. 423–437. ISBN 1555812651.
- ↑ 6,0 6,1 Brubaker RR (1983). "The Vwa+ virulence factor of yersiniae: the molecular basis of the attendant nutritional requirement for Ca++". Rev. Infect. Dis. 5 (Suppl 4): S748–58. PMID 6195719.
- ↑ Achtman, M.; Zurth, K.; Morelli, G.; Torrea, G.; Guiyoule, A.; Carniel, E. (23 November 1999). "Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis". Proc. Natl. Acad. Sci. U.S.A. 96 (24): 14043–8. PMC 24187. PMID 10570195. doi:10.1073/pnas.96.24.14043.
- ↑ Iriarte M, Cornelis GR (1999). "Identification of SycN, YscX, and YscY, three new elements of the Yersinia yop virulon". J. Bacteriol. 181 (2): 675–80. PMC 93427. PMID 9882687.
- ↑ 9,0 9,1 9,2 Cornelis GR, Boland A, Boyd AP, Geuijen C, Iriarte M, Neyt C, Sory MP, Stainier I (1998). "The virulence plasmid of Yersinia, an antihost genome". Microbiol. Mol. Biol. Rev. 62 (4): 1315–52. PMC 98948. PMID 9841674.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 Lee VT, Tam C, Schneewind O (2000). "LcrV, a substrate for Yersinia enterocolitica type III secretion, is required for toxin targeting into the cytosol of HeLa cells". J. Biol. Chem. 275 (47): 36869–75. PMID 10930402. doi:10.1074/jbc.M002467200. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 01 de agosto de 2015.
- ↑ Zumbihl R, Aepfelbacher M, Andor A, Jacobi CA, Ruckdeschel K, Rouot B, Heesemann J (1999). "The cytotoxin YopT of Yersinia enterocolitica induces modification and cellular redistribution of the small GTP-binding protein RhoA". J. Biol. Chem. 274 (41): 29289–93. PMID 10506187. doi:10.1074/jbc.274.41.29289. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 01 de agosto de 2015.
- ↑ Persson C, Carballeira N, Wolf-Watz H, Fällman M (1997). "The PTPase YopH inhibits uptake of Yersinia, tyrosine phosphorylation of p130Cas and FAK, and the associated accumulation of these proteins in peripheral focal adhesions". EMBO J. 16 (9): 2307–18. PMC 1169832. PMID 9171345. doi:10.1093/emboj/16.9.2307.
- ↑ Håkansson S, Galyov EE, Rosqvist R, Wolf-Watz H (1996). "The Yersinia YpkA Ser/Thr kinase is translocated and subsequently targeted to the inner surface of the HeLa cell plasma membrane". Mol. Microbiol. 20 (3): 593–603. PMID 8736538. doi:10.1046/j.1365-2958.1996.5251051.x.
- ↑ Ruckdeschel K, Machold J, Roggenkamp A, Schubert S, Pierre J, Zumbihl R, Liautard JP, Heesemann J, Rouot B (1997). "Yersinia enterocolitica promotes deactivation of macrophage mitogen-activated protein kinases extracellular signal-regulated kinase-1/2, p38, and c-Jun NH2-terminal kinase. Correlation with its inhibitory effect on tumor necrosis factor-alpha production". J. Biol. Chem. 272 (25): 15920–7. PMID 9188492. doi:10.1074/jbc.272.25.15920. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 01 de agosto de 2015.
- ↑ Alrutz MA, Isberg RR (1998). "Involvement of focal adhesion kinase in invasin-mediated uptake". Proc. Natl. Acad. Sci. U.S.A. 95 (23): 13658–63. PMC 24875. PMID 9811856. doi:10.1073/pnas.95.23.13658.
- ↑ Galyov EE, Håkansson S, Forsberg A, Wolf-Watz H (1993). "A secreted protein kinase of Yersinia pseudotuberculosis is an indispensable virulence determinant". Nature 361 (6414): 730–2. PMID 8441468. doi:10.1038/361730a0.
- ↑ Boland A, Cornelis GR (1998). "Role of YopP in suppression of tumor necrosis factor alpha release by macrophages during Yersinia infection". Infect. Immun. 66 (5): 1878–84. PMC 108138. PMID 9573064.
- ↑ Skurnik M, el Tahir Y, Saarinen M, Jalkanen S, Toivanen P (1994). "YadA mediates specific binding of enteropathogenic Yersinia enterocolitica to human intestinal submucosa". Infect. Immun. 62 (4): 1252–61. PMC 186266. PMID 8132332.
- ↑ China B, Sory MP, N'Guyen BT, De Bruyere M, Cornelis GR (1993). "Role of the YadA protein in prevention of opsonization of Yersinia enterocolitica by C3b molecules". Infect. Immun. 61 (8): 3129–36. PMC 280979. PMID 8335343.
- ↑ China B, N'Guyen BT, de Bruyere M, Cornelis GR (1994). "Role of YadA in resistance of Yersinia enterocolitica to phagocytosis by human polymorphonuclear leukocytes". Infect. Immun. 62 (4): 1275–81. PMC 186269. PMID 8132334.
- ↑ Han YW, Miller VL (1997). "Reevaluation of the virulence phenotype of the inv yadA double mutants of Yersinia pseudotuberculosis". Infect. Immun. 65 (1): 327–30. PMC 174597. PMID 8975933.
- ↑ Cornelis GR, Sluiters C, Delor I, Geib D, Kaniga K, Lambert de Rouvroit C, Sory MP, Vanooteghem JC, Michiels T (1991). "ymoA, a Yersinia enterocolitica chromosomal gene modulating the expression of virulence functions". Mol. Microbiol. 5 (5): 1023–34. PMID 1956283.
- ↑ Isberg RR, Van Nhieu GT (1994). "Two mammalian cell internalization strategies used by pathogenic bacteria". Annu. Rev. Genet. 28: 395–422. PMID 7893133. doi:10.1146/annurev.ge.28.120194.002143. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 01 de agosto de 2015.
- ↑ 24,0 24,1 Miller, V. (1992). "Yersinia invasion genes and their products". ASM News 58: 26–33.
- ↑ Bliska JB, Falkow S (1992). "Bacterial resistance to complement killing mediated by the Ail protein of Yersinia enterocolitica". Proc. Natl. Acad. Sci. U.S.A. 89 (8): 3561–5. PMC 48908. PMID 1565652. doi:10.1073/pnas.89.8.3561.
- ↑ Lindler LE, Tall BD (1993). "Yersinia pestis pH 6 antigen forms fimbriae and is induced by intracellular association with macrophages". Mol. Microbiol. 8 (2): 311–24. PMID 8100346. doi:10.1111/j.1365-2958.1993.tb01575.x.
- ↑ Miyoshi-Akiyama T, Fujimaki W, Yan XJ, Yagi J, Imanishi K, Kato H, Tomonari K, Uchiyama T (1997). "Identification of murine T cells reactive with the bacterial superantigen Yersinia pseudotuberculosis-derived mitogen (YPM) and factors involved in YPM-induced toxicity in mice". Microbiol. Immunol. 41 (4): 345–52. PMID 9159409. doi:10.1111/j.1348-0421.1997.tb01211.x.
- ↑ 28,0 28,1 Uchiyama T, Miyoshi-Akiyama T, Kato H, Fujimaki W, Imanishi K, Yan XJ (1993). "Superantigenic properties of a novel mitogenic substance produced by Yersinia pseudotuberculosis isolated from patients manifesting acute and systemic symptoms". J. Immunol. 151 (8): 4407–13. PMID 8409410.
- ↑ Carnoy C, Loiez C, Faveeuw C, Grangette C, Desreumaux P, Simonet M (2003). "Impact of the Yersinia pseudotuberculosis-derived mitogen (YPM) on the murine immune system". Adv. Exp. Med. Biol. 529: 133–5. PMID 12756744. doi:10.1007/0-306-48416-1_26.
- ↑ Yoshino K, Ramamurthy T, Nair GB, Fukushima H, Ohtomo Y, Takeda N, Kaneko S, Takeda T (1995). "Geographical heterogeneity between Far East and Europe in prevalence of ypm gene encoding the novel superantigen among Yersinia pseudotuberculosis strains". J. Clin. Microbiol. 33 (12): 3356–8. PMC 228710. PMID 8586739.
- ↑ Fukushima H, Matsuda Y, Seki R, Tsubokura M, Takeda N, Shubin FN, Paik IK, Zheng XB (2001). "Geographical heterogeneity between Far Eastern and Western countries in prevalence of the virulence plasmid, the superantigen Yersinia pseudotuberculosis-derived mitogen, and the high-pathogenicity island among Yersinia pseudotuberculosis strains". J. Clin. Microbiol. 39 (10): 3541–7. PMC 88386. PMID 11574570. doi:10.1128/JCM.39.10.3541-3547.2001.
- ↑ Nikolova S, Najdenski H, Wesselinova D, Vesselinova A, Kazatchca D, Neikov P (1997). "Immunological and electronmicroscopic studies in pigs infected with Yersinia enterocolitica 0:3". Zentralbl. Bakteriol. 286 (4): 503–10. PMID 9440199. doi:10.1016/s0934-8840(97)80053-9.
- ↑ Smith MG (1992). "Destruction of bacteria on fresh meat by hot water". Epidemiol. Infect. 109 (3): 491–6. PMC 2271933. PMID 1468533. doi:10.1017/s0950268800050482.
- ↑ Donadini R, Liew CW, Kwan AH, Mackay JP, Fields BA (January 2004). "Crystal and solution structures of a superantigen from Yersinia pseudotuberculosis reveal a jelly-roll fold". Structure 12 (1): 145–56. PMID 14725774. doi:10.1016/j.str.2003.12.002.
Este artigo contén textos en dominio público de Pfam e InterPro - IPR015227.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
| Wikispecies posúe unha páxina sobre: Yersinia pseudotuberculosis |
- Xenoma de Yersinia pseudotuberculosis[Ligazón morta]
- "Yersinia pseudotuberculosis". NCBI Taxonomy Browser. 632.
