Hibridoma

Un hibridoma é unha liña celular híbrida resultante da fusión de células B illadas normais e células B cancerosas inmortais de mieloma, de modo que as células do hibridoma combinan a capacidade de producir anticorpos da célula B e a extremada lonxevidade e reproductividade do mieloma. A tecnoloxía do hibridoma é un método no que se producen hibridomas, utilizado para producir grandes cantidades de anticorpos idénticos (chamados anticorpos monoclonais). Este proceso empeza inxectando a un rato (ou outro mamífero) un antíxeno que provoca nel unha resposta inmune. Extráese do rato un tipo de glóbulo branco, unha determinada liña de célula B, que é a que produce os anticorpos que se unen a ese antíxeno. Despois fusiónase esa célula B cunha célula cancerosa de mieloma, creando o hidridoma. Os hibridomas poden crecer en cultivo, cada cultivo empeza cunha soa célula de hibridoma viable, orixinando cultivos cada un dos cales consta de células de hibridoma xeneticamente idénticas, que producen un só tipo de anticorpo por cultivo (monoclonal) en vez de mesturas de diferentes anticorpos (policlonais). A liña celular de mieloma que se usa para ser fusionada neste proceso é seleccionada pola súa capacidade de crecer en cultivo de tecidos e pola ausencia de síntese de anticorpos. En contraste cos anticorpos policlonais, que son mesturas de moitos anticorpos diferentes, os anticorpos monoclonais producidos por cada liña de hibridoma son quimicamente idénticos, todos coa mesma especificidade antixénica.
A produción de anticorpos monoclonais foi inventada por César Milstein e Georges J. F. Köhler en 1975, os cales compartiron o Premio Nobel de Medicina ou Fisioloxía de 1984 con Niels Kaj Jerne, que fixo outras importantes contribucións á inmunoloxía. O termo hibridoma foi acuñado por Leonard Herzenberg durante o seu ano sabático no laboratorio de César Milstein en 1976–1977.[1]
Método
[editar | editar a fonte]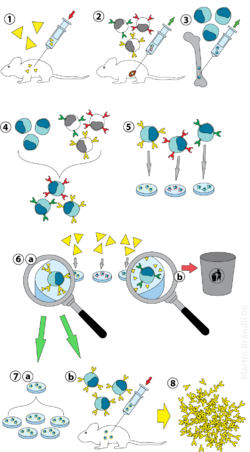
(2) Illamento de células B do bazo
(3) Cultivo de células de mieloma
(4) Fusión das células B e de mieloma
(5) Separación das liñas celulares
(6) Exame e escolla das liñas celulares adecuadas
(7) Multiplicación in vitro (a) ou in vivo (b)
(8) Recollida


Os animais de laboratorio (por exemplo, o rato) son expostos primeiramente ao antíxeno contra o que se pretende que se xere o anticorpo que interesa. Usualmente isto faise por medio dunha serie de inxeccións do antíxeno en cuestión durante varias semanas. Estas inxeccións son normalmente seguidas do uso de electroporación in vivo, que potencia significativamente a resposta inmune. Unha vez que se illan esplenocitos (mestura de diversos linfocitos) do bazo do mamífero, as células B obtidas deles son fusionadas con células de mieloma inmortalizadas. A fusión das células B con células de mieloma pode facerse por electrofusión. A electrofusión causa que as células B e as de mieloma se aliñen e fusionen ao aplicarlles un campo eléctrico. Alternativamente, as células B e de mieloma poden fusionarse utilizando protocolos químicos, xeralmente usando polietilenglicol. As células de mieloma son seleccionadas con antelación para asegurarse que non segregan elas anticorpos e que carecen do xene da hipoxantina-guanina fosforribosiltransferase (HGPRT), o que as fai sensibles ao medio HAT (véxase máis abaixo).
As células fusionadas son incubadas en medio HAT (medio hipoxantina-aminopterina-timidina) durante de 10 a 14 días. A aminopterina bloquea a ruta que permite a síntese de nucleótidos. Por tanto, as células de mieloma non fusionadas morren, xa que non poden producir nucleótidos nin pola síntese "de novo" nin polas vías de salvamento porque carecen de HGPRT. A eliminación das células de mieloma que non se fusionaron é necesaria porque teñen o potencial de crecer máis que as outras células, especialmente en hibridomas establecidos debilmente. As células B non fusionadas morren axiña, xa que teñen unha curta vida. Deste modo, só sobreviven as híbridas célula B-mieloma, xa que nelas o xene HGPRT das células B é funcional. Estas células producen anticorpos (unha propiedade das células B) e son inmortais (unha propiedade das células de mieloma). O medio incubado é despois diluído en placas de múltiples pozos en tan gran medida que cada pozo contén unha soa célula. Como os anticorpos nun destes pociños son producidos pola mesma célula B, son iguais e van dirixidos contra o mesmo epítopo, polo que son anticorpos monoclonais.
O seguinte paso é un rápido proceso de exame primario, no que se identifican e seleccionan só aqueles hibridomas que producen anticorpos dunha especificidade apropiada. A primeira técnica de exme utilizada é a ELISA. Incúbanse o sobrenadante do cultivo de hibridoma, un conxugado etiquetado cun encima secundario e un substrato cromoxénico, e a formación dun produto coloreado indicará un hibridoma positivo. Alternativamente, pode utilizarse un cribado inmunocitoquímico.[2]
A célula B que produce os anticorpos desexados pode ser clonada para producir moitos clons fillos idénticos. Os medios suplementarios que conteñen interleucina 6 (como briclone) son esenciais nesta etapa. Unha vez que a colonia do hibridoma está establecida, crecerá continuamente nun medio de cultivo como RPMI-1640 (con antibióticos e soro bovino fetal) e producirá anticorpos.[2]
As placas multipozo utilízanse inicialmente para que crezan os hibridomas, e despois da selección estes son traspasados a frascos de cultivo de tecidos. Isto mantén en boas condicións os hibridomas e proporciona células dabondo para a criopreservación e sobrenadante para subseguintes investigacións. O sobrenadante do cultivo pode render de 1 a 60 µg/mL de anticorpos monoclonais, e consérvase a -20 °C ou menos ata que sexa necesario utilizalo.[2]
Usando o sobrenadante do cultivo ou unha preparación de inmunoglobulina purificada, poden realizarse ulteriores análises dun hibridoma que produce un potencial anticorpo monoclonal en canto á súa reactividade, especificidade e reactividade cruzada.[2]
Aplicacións
[editar | editar a fonte]Os anticorpos monoclonais obtidos de hibridomas teñen múltiples usos en prevención, diagnóstico e tratamento de enfermidades,[2][3][4][5] ademais do seu uso en diversas técnicas biotecnolóxicas e investigación, marcadores para os grupos de diferenciación da superficie celular ou en selección de células activada por fluorescencia. Un estudo informou do illamento dunha liña celular de hibridoma (clon 1E10), que produce un anticorpo monoclonal (IgM, isotipo k), que tingue inmunocitoquimicamente especificamente o nucléolo.[6]
Notas
[editar | editar a fonte]- ↑ Milstein, C (1999). "The hybridoma revolution: an offshoot of basic research". BioEssays 21 (11): 966–73. PMID 10517870. doi:10.1002/(SICI)1521-1878(199911)21:11<966::AID-BIES9>3.0.CO;2-Z.
- ↑ 2,0 2,1 2,2 2,3 2,4 Nelson, PN; Reynolds, GM; Waldron, EE; Ward, E; Giannopoulos, K; Murray, PG (2000). "Demystified …: Monoclonal antibodies". Molecular pathology : MP 53 (3): 111–7. PMC 1186915. PMID 10897328. doi:10.1136/mp.53.3.111.
- ↑ Bretton, PR; Melamed, MR; Fair, WR; Cote, RJ (1994). "Detection of occult micrometastases in the bone marrow of patients with prostate carcinoma". Prostate 25 (2): 108–14. PMID 7518596. doi:10.1002/pros.2990250208.
- ↑ Kvalheim, G (1998). "Diagnosis of minimal residual disease in bone marrow and blood in cancer patients--methods and clinical implications". Acta oncologica (Stockholm, Sweden) 37 (5): 455–62. PMID 9831374. doi:10.1080/028418698430403.
- ↑ Franklin, WA; Shpall, EJ; Archer, P; Johnston, CS; Garza-Williams, S; Hami, L; Bitter, MA; Bast, RC; Jones, RB (1996). "Immunocytochemical detection of breast cancer cells in marrow and peripheral blood of patients undergoing high dose chemotherapy with autologous stem cell support". Breast Cancer Res Treat 41 (1): 1–13. PMID 8932871. doi:10.1007/BF01807031.
- ↑ Vissers, CJ; Flohil, CC; De Jong, AA; Dinjens, WN; Bosman, FT (1996). "A new monoclonal antibody for specific immunocytochemical staining of nucleoli". Acta histochemica 98 (2): 113–21. PMID 8739296. doi:10.1016/S0065-1281(96)80028-6.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Hybridomas Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- "Hybridoma Technology". Understanding Cancer Series: The Immune System. National Cancer Institute. Arquivado dende o orixinal o 05 de outubro de 2014. Consultado o 30 de marzo de 2018.
- "Hybridoma Cell Culture". Arquivado dende o orixinal o 20 de febreiro de 2018. Consultado o 30 de marzo de 2018.
