Testosterona
Número CAS:58-22-0.
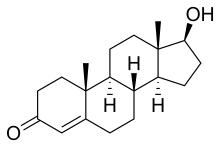
Nome IUPAC:(8R,9S,10R,13S,14S,17S)- 17-hidroxi-10,13-dimetil- 1,2,6,7,8,9,11,12,14,15,16,17- dodecahidrociclopenta[a]fenantren-3-ona.

A testosterona é unha hormona esteroide do grupo dos andróxenos propia dos mamíferos, réptiles,[1] aves,[2] e outros vertebrados. Nos mamíferos, a testosterona prodúcese principalmente nos testículos dos machos e nos ovarios das femias, aínda que se segregan pequenas cantidades polas glándulas suprarrenais. É a hormona sexual principal masculina e un esteroide anabólico.
Nos homes, a testosterona desempeña un papel chave no desenvolvemento dos tecidos reprodutivos masculinos como os testículos e próstata, e na promoción dos caracteres sexuais secundarios tales como o incremento da masa muscular e ósea e o crecemento do pelo corporal.[3] Ademais, a testosterona é esencial para a saúde e o benestar[4] e tamén para a prevención da osteoporose.[5]
De media, o corpo dun adulto humano masculino produce arredor de dez veces máis testosterona ca o corpo dunha muller adulta, pero as mulleres son máis sensibles á hormona.[6]
A testosterona é unha hormona conservada a través da maioría dos vertebrados, aínda que os peixes producen unha lixeiramente distinta chamada 11-cetotestosterona.[7] O homólogo da testosterona nos insectos é a ecdisona.[8] Estes esteroides ubicuos suxiren que as hormonas sexuais teñen unha historia evolutiva antiga.[9]
Bioquímica[editar | editar a fonte]
Estrutura química[editar | editar a fonte]
A testosterona é un andróxeno esteroide derivado do ciclopentanoperhidrofenantreno, que ten 19 átomos de carbono, un dobre enlace entre C4 e C5, un átomo de osíxeno (=O) en C3 e un grupo hidroxilo (OH) en C12. A súa fórmula é C19H28O2. Esta estrutura é necesaria para o mantemento da actividade androxénica. A testosterona pode ser aromatizada en varios tecidos para formar estradiol, de tal maneira que no home é normal unha produción diaria de 50 microgramos. O papel do estradiol no home aínda non está aclarado, pero o seu exceso absoluto ou relativo pode provocar feminización. A testosterona do testículo prodúcena as células de Leydig, pero tamén se sintetiza noutros tecidos a partir dos andróxenos circulantes (DHEA,DHEA-S), que proveñen do córtex suprarrenal (zona reticular).
Biosíntese[editar | editar a fonte]

Como outras hormonas esteroides, a testosterona deriva do colesterol (ver figura da dereita).[10] O primeiro paso da súa biosíntese implica a rotura oxidativa da cadea lateral do colesterol polo encima CYP11A, unha oxidase de citocromo P450 mitocondrial coa perda de seis átomos de carbono, orixinando pregnenolona. No seguinte paso, elimínanse dous átomos de carbono polo encima CYP17A no retículo endoplasmático para producir unha variedade de esteroides C19.[11] Ademais, o grupo 3-hidroxilo é oxidado pola 3-β-HSD, producindo androstenediona. Na reacción final, que é limitante para a velocidade de produción, o grupo C-17 ceto da androstenediona é reducido pola 17-beta hidroxiesteroide deshidroxenase para producir a testosterona.
A maior parte da produción de testosterona (>95%) nos machos ten lugar nos testículos.[3] Tamén a sintetizan en cantidades menores as mulleres nas células da teca dos folículos dos ovarios, e pola placenta, e na zona reticular do córtex suprarrenal en ambos os sexos. Nos testículos, a testosterona é producida polas células de Leydig.[12] Os testículos tamén conteñen células de Sertoli que requiren testosterona para favoreceren a espermatoxénese. Como a maioría das hormonas, a testosterona chega aos tecidos obxectivo por vía sanguínea, e no sangue a maior parte da testosterona transpórtase ligada a dúas proteínas do plasma, a SHGB (sex hormone-binding globulin, globulina de unión á hormona sexual) e a albumina. A SHBG liga unha soa molécula de testosterona con alta afinidade, entanto que a albumina liga varias moléculas pero con baixa afinidade. En función destes equilibrios defínese a testosterona libre como a totalidade da non unida, e a testosterona biodispoñible como a total menos a unida á SHBG.
Regulación[editar | editar a fonte]

Nos homes, a testosterona sintetízase principalmente nas células de Leydig. O número de células de Leydig está regulado pola hormona luteinizante (LH) e a hormona estimulante dos folículos (FSH). A cantidade de testosterona producida polas células de Leydig existentes está baixo o control da LH que regula a expresión da 17-beta hidroxiesteroide deshidroxenase.[13]
A cantidade de testosterona sintetizada é regulada polo eixe hipotálamo-hipofisario-testicular (ver figura da dereita).[14] Cando os niveis de testosterona están baixos, o hipotálamo libera a hormona liberadora da gonadotropina (GnRH), a cal á súa vez estimula a glándula pituitaria para liberar FSH e LH. Estas dúas últimas hormonas estimulan os testículos para sintetizar a testosterona. Finalmente, os altos niveis de testosterona actúan no hipotálamo e a hipófise por retroalimentación negativa para inhibir a liberación da GnRH e FSH/LH respectivamente.
Factores ambientais que afectan aos niveis de testosterona son:
- A perda de status ou dominancia nos homes pode orixinar a diminución dos niveis de testosterona.[15]
- A motivación de poder implícito predí un incremento na liberación de testosterona nos homes.[16]
- O envellecemento reduce a liberación de testosterona.[17]
- No hipogonadismo prodúcese menos testosterona.
- A fase do sono de movementos oculares rápidos incrementa os niveis de testosterona nocturnos.[18]
- O adestramento deportivo de resistencia incrementa os niveis de testosterona;[19] porén, en homes de idade avanzada, ese incremento pode ser impedido ao inxerir proteínas.[20]
- A deficiencia de cinc diminúe os niveis de testosterona,[21] pero a sobresuplementación deste non ten efectos nos niveis de testosterona.[22]
- A regalicia. Os ingredientes activos da raíz de regalicia, a glicirricina, foron vinculados a unha pequena e clinicamente insignificante diminución nos niveis de testosterona.[23] Polo contrario, un estudo máis recente feito exclusivamente sobre unha mostra feminina pequena encontrou que a administración de regalicia produce unha diminución substancial nos niveis de testosterona.[24]
- Antiandróxenos naturais ou artificiais, como o te de Mentha spicata reducen os niveis de testosterona.[25][26][27]
Metabolismo[editar | editar a fonte]
O lugar de síntese principal de testosterona son as células de Leydig do testículo, onde se forma a partir do colesterol. Tamén se pode sintetizar na zona rugosa do córtex suprarrenal, nas células tecais do ovario e na placenta. Aproximadamente o 7% da testosterona é reducida a 5α-dihidrotestosterona (DHT) polo encima do citocromo P450 5α-redutase,[28] un encima altamente expresado nos órganos accesorios sexuais masculinos e folículos pilosos.[3] Aproximadamente o 0,3% da testosterona é convertida en estradiol pola aromatase (CYP19A1)[29] un encima expresado no cerebro, fígado e tecido adiposo.[3]
A DHT é unha forma máis potente da testosterona, entanto que o estradiol ten actividades completamente distintas (feminización) comparadas coas da testosterona (masculinización). Finalmente, a testosterona e a DHT poden ser desactivadas ou eliminadas por encimas que hidroxilan nas posicións 6, 7, 15, ou 16.[30]
Modo de acción[editar | editar a fonte]
Os efectos da testosterona nos humanos e outros vertebrados teñen lugar a través de dous mecanismos principais: a activación do receptor androxénico (directamente como testosterona ou como DHT), e a conversión a estradiol e a activación de certos receptores de estróxeno.[32][33]
A testosterona e os andróxenos atravesan doadamente a membrana celular e únense a receptores intracelulares específicos (androxénicos). Estes receptores que foron purificados, son proteínas cun peso molecular de aproximadamente 120 kilodaltons. A súa síntese está determinada xeneticamente no cromosoma X. A testosterona libre (T) transpórtase ao interior do citoplasma das células do tecido obxectivo, onde se une a dito receptor androxénico, ou pode ser convertida en 5α-dihidrotestosterona (DHT) polo encima citoplasmático 5-alfa redutase. A DHT únese ao mesmo receptor androxénico ca a testosterona pero con moita máis afinidade, facendo a súa potencia androxénica arredor de 5 veces maior ca a da testosterona.[34] O complexo de receptores-T/-DHT sométese a un cambio estrutural que lle permite á hormona entrar no núcleo celular e unirse directamente a secuencias específicas de nucleótidos do ADN. As áreas onde se produce esta unión denomínanse elementos de resposta a hormonas (HREs), e influencian a actividade transcricional de certos xenes, producindo o efecto androxénico.
Nos vertebrados, os receptores androxénicos aparecen en diversos tecidos, e tanto os machos coma as femias responden de xeito similar a niveis semellantes de testosterona. A gran diferenza que hai entre os niveis de testosterona antes de nacer, durante a puberdade e ao longo da vida explican as diferenzas biolóxicas entre os machos e as femias.
Os ósos e o cerebro son dous tecidos importantes nos humanos onde o principal efecto da testosterona é a través da aromatización a estradiol. No tecido óseo, o estradiol acelera a maduración da cartilaxe para formar óso, orixinando o peche da epífise e, en consecuencia, a finalización do crecemento do óso. No sistema nervioso central, a testosterona é aromatizada a estradiol. É o estradiol e non a testosterona, o que serve como sinal máis importante da retroalimentación negativa no hipotálamo (afectando especificamente a secreción de LH). En moitos mamíferos, a "masculinización" prenatal das áreas de dimorfismo sexual do cerebro son feitas polo estradiol derivado da testosterona.
O músculo esquelético non posúe receptores de testosterona ou da DHT polo que os efectos anabólicos non están aínda o suficientemente explicados. Suxeriuse que os andróxenos poderían bloquear no músculo os receptores citosólicos dos glicocorticoides inhibindo as accións catabólicas destes axentes.
Tanto os homes coma as mulleres producen testosterona e estróxeno, pero os homes producen grandes cantidades de testosterona e pequenas de estróxenos, e as mulleres ao revés. A testosterona causa a aparición de características masculinas (engrosamento da voz, pilosidade facial e pubiana, incremento da masa muscular etc.) Igual que os homes, as mulleres dependen da testosterona para manteren a libido, densidade ósea e masa muscular ao longo das súas vidas. Nos homes, os niveis inadecuadamente altos de estróxeno diminúen os niveis de testosterona, diminúen a masa muscular, inhiben o crecemento nos adolescentes, inducen a xinecomastia, incrementan as características femininas, reducen a susceptibilidade a contraer cáncer prostático, reducen a libido, causan disfunción eréctil e orixinan suoración excesiva e abafos. Porén, requírese un nivel apropiado de estróxeno polos homes para garantir o benestar, manter a densidade ósea, libido, función eréctil etc.
Efectos fisiolóxicos[editar | editar a fonte]
En xeral, os andróxenos promoven a síntese de proteínas e o crecemento dos tecidos con receptores androxénicos. Os efectos da testosterona poden clasificarse como virilizantes e anabólicos, aínda que a distinción é un pouco artificial, xa que moitos dos efectos poderían considerarse de ambos os tipos. A testosterona é anabólica, porque promove o crecemento da masa ósea e muscular.
- Efectos anabólicos. Inclúen o crecemento da masa muscular e forza, o incremento da densidade ósea e resistencia do óso, e a estimulación do crecemento lonxitudinal e a maduración dos ósos.
- Efectos androxénicos. Inclúen a maduración dos órganos sexuais, particularmente o pene e a formación do escroto no feto, e despois do nacemento (xeralmente na puberdade) a voz vólvese máis grave, medra a barba e o pelo axilar. Moitos destes efectos caen na categoría de caracteres sexuais secundarios.
Máis pormenorizadamente, os principais efectos fisiolóxicos da testosterona son:
- Accións sexuais: a testosterona é necesaria para o normal desenvolvemento dos xenitais externos e internos masculinos durante o primeiro trimestre da vida fetal. Despois, a testosterona produce os seguintes efectos sobre os órganos sexuais primarios: promove o crecemento do escroto, pene e glándulas secretorias sexuais, aumenta o peso e crecemento testicular, estimula a espermatoxénese nos túbulos seminíferos, estimula a maduración das espermátidas a espermatozoides, completa as características do seme e estimula a súa constitución definitiva no seu paso polo epidídimo e os condutos deferentes, aumenta a libido ou desexo sexual. Ademais, a testosterona produce os seguintes efectos sobre as características sexuais secundarias: incremento da masa muscular (acción anabólica), proliferación das glándulas sebáceas (a aparición de acne pode relacionarse con este efecto), engrosamento da pel, hipertrofia da larinxe e produción dunha voz grave permanente, distribución do pelo masculino en: pube, tronco, extremidades e barba, ten unha relación determinada xeneticamente coa aparición de calvicie no home, aumento do ritmo de crecemento dos ósos longos na puberdade, e aumento de estatura, peche das placas epifisarias e cartilaxe de conxunción (faino indirectamente, mediante a súa conversión en estróxenos pola aromatase), comportamento máis agresivo e maior vigor físico e muscular no home que na muller, accións anabólicas noutros órganos e sistemas: fígado, ril, corazón, medula ósea etc.
- Accións sobre a hipófise: por retroalimentación negativa a testosterona inhibe a secreción das gonadotropinas hipofisarias; concretamente de LH. A testosterona ou a DHT inhiben tamén no hipotálamo a produción dos factores de liberación de gonadotropinas cara ao sistema portal hipotálamo-hipofisario. Os factores de liberación (GnRH) son os que estimulan finalmente a secreción de LH e FSH na hipófise anterior. O envellecemento asóciase cunha diminución da función testicular, cunha baixada da concentración de testosterona plasmática e unha diminución do número de células de Leydig intersticiais despois dos 60 anos. Paralelamente, obsérvase un incremento na concentración plasmática de LH e FSH indicando a presenza de factores testiculares que afectan a produción de testosterona.
- Accións metabólicas: Os andróxenos e a testosterona producen en xeral efectos anabólicos e de tipo mineralcorticoide: aumento da síntese de proteínas, incremento da retención de nitróxeno e balance de N positivo, acción miotrófica (aumento da masa muscular), aumento da estatura corporal (efecto sobre os ósos longos), aumento do peso corporal, retención de sodio, cloro e auga (acción mineralcorticoide), retención de fósforo e potasio. As accións anabólicas dos andróxenos poden ser útiles ocasionalmente en terapéutica. As drogas máis usadas pola súa actividade anabólica son derivados da 19-nor-testosterona, a nandrolona, oximetolona, metenolona e estanozolol. A súa utilización, porén, debe ser sumamente prudente polos seus posibles efectos secundarios.
- Estímulo da eritropoese: a concentración de hemoglobina é habitualmente de 1 a 2g/dl superior no home adulto ca na muller ou nos nenos. Ademais é frecuente observar unha anemia moderada en homes hipogonadotrópicos. Os andróxenos estimulan a eritropoese a través dun incremento na produción renal de eritropoetina. Actualmente, observáronse efectos directos estimulantes da eritropoese en cultivos celulares de medula ósea pola testosterona. Demostrouse un aumento do desenvolvemento do número de colonias eritroides BFU-E e CFU-E en placas de cultivo que contiñan testosterona.
Efectos segundo a idade[editar | editar a fonte]
Os efectos da testosterona tamén poden clasificarse pola idade de aparición. Para os efectos posnatais tanto en homes coma en mulleres, estes son maioritariamente dependentes dos niveis e duración da testosterona libre circulante.
Prenatais[editar | editar a fonte]
O desenvolvemento normal mostra por primeira vez un pico de testosterona entre as semanas 11 e 16 de xestación (concentración algo maior de 230 ng/dl) e ao final da xestación, isto último debido á retroalimentación negativa na hipófise producido polo elevado nivel de estróxenos maternos. A testosterona do feto descende tras o nacemento a unha concentración aproximada de 75-100 ng/dl. O segundo pico de testosterona, que chega aos niveis máximos, prodúcese arredor dos 60 días de vida, tras ser estimulada a síntese de gonadotropinas hipofisiarias por un descenso na circulación de estróxenos maternos.[35]
Os efectos androxénicos prenatais aparecen entre 4 e 6 semanas de xestación.
- Virilización xenital (fusión da liña media, uretra fálica, adelgazamento escrotal, crecemento fálico); aínda que o papel da testosterona é nisto moito menos importante ca o da dihidrotestosterona.
- Desenvolvemento da próstata e as vesículas seminais.
- Identidade de xénero.[36]
Infancia temperá[editar | editar a fonte]
Os efectos androxénicos na infancia temperá son os menos entendidos. Nas primeiras semanas de vida do bebé masculino, aumentan os niveis de testosterona. Os niveis mantéñense no rango puberal durante algúns meses, pero normalmente acadan os niveis case indetectables da nenez aos 4-6 meses de vida.[37][38] A función deste aumento nos humanos descoñécese. Suxeriuse que está tendo lugar a "masculinización do cerebro", xa que non se identificaron cambios significativos noutras partes do corpo.[39] Sorprendentemente, o cerebro masculino masculinízase cando a testosterona é aromatizada a estróxeno, o cal cruza a barreira hematoencefálica e entra no cerebro masculino, entanto que os fetos femininos teñen alfa-fetoproteínas que se unen aos estróxenos de modo que o cerebro feminino non é afectado.[40]
Preperipuberais[editar | editar a fonte]
Os efectos androxénicos preperipuberais son os primeiros efectos observables do incremento nos niveis de andróxenos ao final da infancia, e ocorren tanto en nenos coma en nenas. Son:
- Olor corporal como o dos adultos.
- A pel e o pelo fanse máis aceitosos, acne.
- Pubarquia (aparición de pelos pubianos).
- Pilosidade axilar.
- Crecemento, maduración ósea acelerada.
- Pelo no beizo superior e patillas.
Puberais[editar | editar a fonte]
Os efectos androxénicos puberais empezan a ocorrer unha vez que os niveis androxénicos estiveron máis altos durante meses ou anos cós dun adulto feminino. Nos homes (machos), estes normalmente son efectos puberais que ocorren máis ao final da puberdade, e nas mulleres ocorren despois de períodos prolongados de niveis elevados de testosterona libre no sangue.
- Agrandamento das glándulas sebáceas. Isto podería causar acne.
- Agrandamento fálico ou clitoromegalia.
- Incremento da libido e frecuencia de ereccións ou crecemento clitoral.
- O pelo pubiano esténdese cara ás coxas e cara ao embigo.
- Pilosidade facial (patillas, barba, bigote).
- Perda do pelo (alopecia androxénica).
- Pelo pectoral, pelo periareolar, pelo perianal.
- Pelo nas pernas.
- Pelo axilar.
- A graxa subcutánea diminúe.
- Incremento da forza e masa muscular.[41]
- Voz máis grave.
- Crecemento da noz de Adán.
- Crecemento do tecido espermatoxénico nos testículos, fertilidade masculina.
- Crecemento da mandíbula, das cellas, do queixo e do nariz, e remodelación dos contornos dos ósos faciais.
- Os ombros vólvense máis amplos e a caixa torácica expándese.
- Terminación da maduración ósea e crecemento óseo. Isto ocorre indirectamente por medio dos metabolitos do estradiol, polo que ten lugar de xeito máis gradual nos homes ca nas mulleres.
Adultos[editar | editar a fonte]
Os efectos da testosterona en adultos son claramente máis demostrables no home ca na muller, pero son igualmente importantes para ambos os sexos. Algúns destes efectos poden diminuír cando os niveis de testosterona decrecen nas últimas décadas da vida adulta.

- A testosterona é necesaria para o desenvolvemento normal do espermatozoide. A testosterona activa xenes nas células de Sertoli, os cales promoven a diferenciación das espermatogonias.
- Regula a resposta aguda do eixe hipotalámico-hipofisario-adrenal)[42]
- Enerxía física e mental.
- Mantemento do trofismo muscular.
- A testosterona regula a poboación dos receptores tromboxano A2 en megacariocitos e plaquetas e, por tanto, a agrupación de plaquetas en humanos.[43][44]
- A testosterona non aumenta os riscos de cáncer de próstata. Nas persoas sometidas a terapia de privación de testosterona, os incrementos de testosterona superiores aos niveis de castrado incrementan a rapidez de propagación dun cáncer prostático xa existente.[45][46][47]
- Estudos recentes mostraron resultados contraditorios sobre a importancia da testosterona no mantemento da saúde cardiovascular.[48][49] Porén, manter niveis normais de testosterona en homes anciáns mellora varios parámetros que se pensa que reducen o risco de enfermidades cardiovasculares, tales como o incremento da masa magra, diminución da graxa visceral, diminución do colesterol total e o control sobre os niveis glicémicos.[50]
- En certas condicións a testosterona pode que teña un papel na regulación da resposta de "loita ou fuxida".[15]
- Namorarse diminúe os niveis de testosterona nos homes, pero increméntaos nas mulleres.[51] Comprobouse que cando a testosterona e as endorfinas no seme exaculado chegan á parede do cérvix uterino despois dunha relación sexual, as mulleres reciben un golpe de testosterona, endorfina e oxitocina, e os homes despois do orgasmo experimentan un incremento de endorfinas e un incremento marcado nos niveis de oxitocina.[52]
- Estudos recentes suxiren que os niveis de testosterona teñen un papel importante na toma de riscos durante decisións financeiras.[53][54]
- A administración de testosterona fai aos homes máis egoístas.[55]
- A paternidade tamén diminúe os niveis de testosterona nos homes, suxerindo que os cambios no comportamento e emocionais promoven o coidado paternal.[56]
- Nalgúns animais (as aves tetraoninas e os lagartos áxiles), os niveis altos de testosterona foron relacionados cunha redución na actividade do sistema inmunitario.[57][58]
Cerebro[editar | editar a fonte]
O cerebro vese afectado pola diferenciación sexual creada pola testosterona;[36] o encima aromatase converte a testosterona en estradiol que é o responsable da masculinización do cerebro dos roedores machos. Nos humanos, a masculinización do cerebro fetal parece estar asociada con receptores androxénicos funcionais, tal como se observou en pacientes con enfermidades xenéticas que afectan á formación de andróxenos ou ao funcinamento dos receptores androxénicos.[59]
Hai algunhas diferenzas entre o cerebro masculino e feminino, posiblemente resultado de niveis distintos de testosterona, unha delas é o tamaño: o cerebro humano masculino é como media máis grande.[60] Nun estudo danés de 2003, encontrouse que os homes tiñan 176.000 km de fibras mielinizadas á idade de 20, entanto que as mulleres tiñan un total de 149.000 km.[61] Porén, as mulleres teñen máis conexións dendríticas entre as células do cerebro.[62]
Un estudo realizado en 1996 non encontrou ningún efecto a curto prazo no estado de ánimo ou comportamento pola administración de doses suprafisiolóxicas de testosterona durante 10 semanas en 43 homes saudables.[41] Outro estudo encontrou unha correlación entre a testosterona e a tolerancia de risco na elección de carreira entre as mulleres.[63]
A literatura científica suxire que a atención, memoria e habilidade espacial son funcións cognitivas afectadas pola testosterona en humanos. Algunhas evidencias preliminares suxiren que os niveis baixos de testosterona poden ser un factor de risco para a deterioración de habilidades cognitivas e posiblemente para a demencia do tipo alzhéimer,[64][65] o cal é un argumento chave na medicina para a prolongación da vida e o uso da testosterona en terapias antienvellecemento. Porén, gran parte da literatura suxire unha relación curvilineal ou mesmo cuadrática entre o rendemento espacial e a testosterona circulante,[66] onde tanto a hiposecreción coma a hipersecreción de andróxenos teñen un efecto negativo na cognición, como se indicou arriba.
A diminución na produción de testosterona é unha consecuencia normal do envellecemento nos homes. Unha posible consecuencia disto é o incremento do risco do desenvolvemento do alzhéimer.[67][68]
Agresión[editar | editar a fonte]
A correlación positiva entre niveis de testosterona e a agresión en humanos foi demostrada en moitos estudos.[69]
Niveis alterados de testosterona en sangue[editar | editar a fonte]
Os niveis máis altos de testosterona encóntranse despois da adolescencia, entre 800 e 1200 nanogramos por decilitro (ng/dl) de sangue. Estes niveis mantéñense durante aproximadamente dez ou vinte anos, despois dos cales comenzan a diminuír arredor do 1 % por ano.
- Os niveis aumentados de testosterona en sangue poden aparecer nos seguintes casos:
- Puberdade precoz.
- Resistencia aos andróxenos.
- Cáncer de ovario.
- Hiperplasia suprarrenal conxénita.
- Enfermidade ovárica poliquística.
- Cáncer testicular.
- Os niveis diminuídos de testosterona poden darse en:
- Hipopituitarismo.
- Insuficiencia testicular.
- Atraso na puberdade.
- Enfermidade crónica.
- Prolactinoma.
Tendencia nos países occidentais[editar | editar a fonte]
Análises recentes mostran que os niveis medios de testosterona están diminuíndo nos homes de todas as idades nos países occidentais.[70][71] Para explicar esta redución propuxéronse varias teorías desde o incremento da obesidade á exposición a perturbadores endócrinos.[72]
Insuficiencia[editar | editar a fonte]
A insuficiencia de testosterona (tamén chamada hipotestosteronismo ou hipotestosteronemia) é unha produción de testosterona anormalmente baixa. Pode ocorrer por disfunción testicular (hipogonadismo primario) ou disfunción hipotalámico-hipofisaria (hipogonadismo secundario) e pode ser conxénita ou adquirida.[73] Unha forma adquirida de hipotestosteronismo é o declive dos niveis de testosterona que ocorre co envellecemento, ás veces chamada andropausa.
Usos médicos[editar | editar a fonte]

O uso orixinal e principal da testosterona é para o tratamento de homes con hipogonadismo con niveis de produción de testosterona endóxena moi baixa ou nula. O tratamento axeitado para este trastorno é a terapia de substitución hormonal (terapia de substitución de testosterona [TRT]), que mantén os niveis de testosterona dentro do rango normal.
Porén, a través dos anos, como todas as hormonas, a testosterona e outros esteroides anabólicos tamén foron utilizados para tratar outras condicións e propósitos ademais da substitución, con éxitos variables pero cunha maior taxa de efectos secundarios. Exemplos son a redución da infertilidade, corrixir a falta de libido ou disfunción eréctil, corrixir a osteoporose, promover a ampliación do pene, fomentar o crecemento da altura, estimular a medula ósea, reverter os efectos da anemia e ata para a estimulación do apetito. A finais da década de 1940, a testosterona estaba sendo promocionada como unha droga milagrosa antienvellecemento.[74] A diminución nos niveis de testosterona coa idade espertou o interese pola terapia de substitución de andróxenos.
Para aproveitar a vantaxe dos seus efectos virilizantes, a testosterona (ou os antiandróxenos, segundo os casos) son a miúdo administrados a transexuais para promover o cambio de sexo.
Os parches de testosterona son efectivos para tratar a libido baixa nas mulleres posmenopáusicas.[75] As mulleres tamén poden usar terapias de testosterona para o tratamento ou prevención da perda de densidade ósea e masa muscular e para trataren certos tipos de depresión e estados de baixa enerxía. As mulleres baixo terapia de testosterona poden experimentar unha subida de peso sen un incremento na graxa corporal debido a cambios na densidade ósea e muscular. A maioría dos efectos indesexados da terapia de testosterona poden ser controlados con estratexias de redución de pilosidade, prevención de acne etc. Existe un risco teórico de que a terapia de testosterona poida incrementar o risco de cancro de mama ou xinecolóxico, e requírese máis investigación sobre este aspecto para definir mellor os riscos.[75]
Terapia de substitución de andróxenos[editar | editar a fonte]
Os niveis de testosterona nos humanos diminúen gradualmente coa idade. A significancia desta diminución é discutible (ver andropausa). Hai un desacordo sobre cando tratar os homes de idade coa terapia de substitución de testosterona. A posición da Sociedade Americana de Androloxía respecto ao tema é que "a terapia de substitución de testosterona en homes de idade está indicada cando están presentes síntomas clínicos e signos que suxiren unha deficiencia androxénica e niveis baixos de testosterona." [76] A Asociación Americana de Endocrinólogos Clínicos di que "o hipogonadismo defínese cando os niveis de testosterona libre están debaixo do límite inferior do rango normal para adultos xoves. Antes, a diminución relacionada coa idade da testosterona libre foi algunha vez aceptada como normal, pero na actualidade non é considerada normal." [77]
Non existe unha concordancia total sobre o límite inferior de nivel de testosterona a partir do que se pode considerar que se trata dun caso de hipogonadismo; actualmente non existen estándares sobre cando tratar as mulleres. A testosterona pode medirse como "libre" (é dicir, biodispoñible e non unida) ou máis comunmente, como "total" (incluíndo a porcentaxe que está quimicamente unida e non dispoñible). Por exemplo, nos Estados Unidos, os niveis de testosterona total dun home por debaixo de 300 ng/dL (nunha mostra tomada pola mañá) son xeralmente considerados baixos.[78] A identificación unicamente polos síntomas de niveis inadecuados de testosterona nun home que envellece pode ser difícil.
A terapia de substitución pode facerse con frascos inxectables, parches transdérmicos e xeles, pellets subcutáneos e terapia oral. Efectos adversos da suplementación de testosterona inclúen efectos secundarios menores tales como acne e pel aceitosa, e complicacións máis significativas tales como o incremento do hematocrito que require unha venopunción para o seu tratamento, a exacerbación da síndrome de apnea do sono e unha aceleración no crecemento dun cáncer prostático preexistente en individuos que se someteron a privación androxénica. Outro efecto adverso pode ser a perda significativa do cabelo e/ou o adelgazamento do pelo. Isto podería previrse usando Propecia (Finasteride), que inhibe o encima 5-alfa redutase (responsable da conversión da testosterona a DHT), durante o tratamento. A testosterona exóxena tamén causa a supresión da espermatoxénese e pode levar á esterilidade.[79] Recoméndase que os médicos busquen un cáncer de próstata cun exame rectal dixital e unha comprobación dos niveis de PSA (antíxeno prostático específico) antes de empezar a terapia, e monitorear de preto os niveis de PSA e hematocrito durante a terapia.
Beneficios[editar | editar a fonte]
Unha terapia de testosterona apropiada pode mellorar o tratamento da diabetes mellitus tipo 2.[80] Os baixos niveis de testosterona tamén favorecen o risco de desenvolver o alzhéimer.[67][68]
Aínda cómpren estudos de grande escala para avaliar a eficacia e seguridade a longo prazo da testosterona.[81]
Efectos adversos[editar | editar a fonte]
A suplementación de testosterona exóxena pode supoñer unha serie de riscos para a saúde. A fluoximesterona e metiltestosterona son derivados sintéticos da testosterona. A fluoximesterona e metiltestosterona xa non se prescriben dado os seus pobres historiais de seguridade, e a substitución de testosterona en homes posúe un rexistro de seguridade moi bo como o demostran máis de 60 anos de uso médico en homes con hipogonadismo.
Os principais efectos adversos do uso de andróxenos que se teñen observado, sobre todo en tratamentos de longa duración e altas doses, son os seguintes:
- Efectos androxénicos adversos (masculinización): estes efectos son dependentes da dose en xeral e ocorren cando os tecidos diana son estimulados excesivamente. Adquiren unha maior transcendencia na muller e nos nenos en idade prepuberal. Na muller pode aparecer crecemento da barba, voz grave, irregularidades do ciclo menstrual, amenorrea, aumento da masa muscular viril, hipertrofia do clítoris e outros. Estes efectos ocorren en realidade despois de tratamentos prolongados, como no tratamento paliativo do cancro mamario metastásico. En nenos na fase prepuberal, a testosterona acelera o peche das epífises, produce unha maduración sexual precoz e detención do crecemento. Nos homes a testosterona pode producir priapismo, acne, policitemia moderada e aumento do tamaño prostático. Por este motivo os andróxenos están contraindicados ante a sospeita dun cáncer de próstata. Os andróxenos tamén producen unha diminución das HDL (lipoproteínas de alta densidade) polo que son ateroxénicos (favorecen a arteriosclerose).
- Hepatotoxicidade: ictericia colestásica. Os andróxenos 17-alquil-substituídos como a metiltestosterona e a fluoximesterona poden producir ictericia colestásica, caracterizada por ictericia, acumulación e espesamento da bile nos canalículos biliares dos lobuliños hepáticos. Este efecto pode ser unha resposta idiosincrática. En principio non hai danos nos hepatocitos, nin obstrución dos canalículos biliares maiores. A ictericia acompáñase de hiperbilirrubinemia, aumento de aspartato aminotransferase e fosfatase alcalina. A ictericia colestásica non se observa coa administración parenteral da testosterona. Os andróxenos de uso oral polo tanto, deben ser soamente utilizados en tratamentos de curta duración e están contraindicados en pacientes con enfermidade hepática.
- Carcinoma hepático: a incidencia de adenocarcinoma hepático aumenta significativamente en pacientes que recibiron tratamentos con andróxenos 17-alquil-substituídos, durante longo período de tempo (1 a 7 anos).
- Cáncer de próstata: describiuse que homes fisioculturistas que consumiron anabolizantes androxénicos coa intención de aumentar a súa masa muscular e rendemento físico, desenvolveron carcinoma prostático precozmente (antes dos 50 anos). Pero polos estudos dos últimos anos parece que a testosterona afecta a cánceres xa existentes, máis que aos non desenvolvidos aínda.
- Retención hidrosalina: polos seus efectos mineralcorticoides os andróxenos poden producir retención hidrosalina. O edema secundario ao tratamento androxénico só se observa cando se administran grandes doses para o tratamento de enfermidades neoplásicas (cáncer). O edema pode ser máis importante en pacientes con insuficiencia cardíaca conxestiva ou con insuficiencia renal. Este efecto pode ademais complicar unha hipertensión arterial. A retención hidrosalina pode tratarse con diuréticos tiazídicos.
- Diminución da espermatoxénese e efectos secundarios feminizantes: en tratamentos prolongados con andróxenos suprímese a secreción de gonadotropinas, o que provoca hipotrofia testicular, diminución do peso dos testículos e supresión da espermatoxénese. A inhibición da secreción de gonadotropinas pode tamén ocasionar azoospermia e incremento da conversión de andróxenos en estróxenos. Por iso a concentración plasmática de estróxenos aumenta no home que recibe andróxenos. A actividade do encima aromatase que provoca a aromatización da testosterona e a súa conversión a estradiol é maior, sobre todo en nenos e en pacientes con enfermidade hepática subxacente. Os efectos secundarios feminizantes son ás veces importantes (xinecomastia, diminución da libido e da espermatoxénese), e os anabolizantes androxénicos esteroides poden producir os mesmos efectos.
Uso atlético[editar | editar a fonte]
A testosterona é ás veces utilizada polos atletas coa fin de mellorar o seu rendemento, e considérase na maioría dos deportes unha forma de dopaxe. Existen varios métodos de aplicación da testosterona, como inxeccións intramusculares, parches e xeles transdérmicos, e pellets implantables.
O esteroides anabolizantes (como a testosterona) tamén se teñen utilizado para mellorar o desenvolvemento muscular, forza, ou resistencia. Fano directamente ao incrementaren a síntese proteica nos músculos. Como resultado, as fibras musculares fanse máis grandes e repáranse máis rápido ca as dunha persoa media. Despois dunha serie de escándalos e mala publicidade na década de 1980 (tales como o aumento do rendemento de Ben Johnson nos Xogos Olímpicos de Seúl 1988), a prohibición do uso dos esteroides anabólicos foi ratificada ou fortalecida por varias organizacións deportivas e países. Por exemplo, en 1990, a testosterona e outros esteroides anabólicos designáronse como "substancias controladas" polo Congreso dos Estados Unidos, coa Lei de Control de Esteroides Anabólicos (Anabolic Steroid Control Act).[82] O uso destas substancias vese como un problema serio no deporte moderno, especialmente tendo en conta os extremos aos que os atletas e laboratorios profesionais chegan para intentar ocultar ditos abusos.
Detección do abuso[editar | editar a fonte]
Empréganse unha serie de métodos para a detección do uso de testosterona en atletas, a maioría baseados en análises de urina. Estes inclúen a cuantificación da proporción testosterona/epitestosterona (normalmente menor de 6), a proporción testosterona/hormona luteinizante e a proporción carbono-13/carbono-12 (a testosterona farmacéutica contén menos carbono-13 ca a testosterona endóxena). Nalgunos programas de avaliación, os mesmos resultados históricos do atleta poden servir como un intervalo de referencia para a interpretación dalgún achado sospeitoso. Outro método que se está a investigar é a detección da forma de testosterona administrada, usualmente un éster, no pelo.[83][84][85][86]
Vías de administración[editar | editar a fonte]
Existen moitas vías de administración da testosterona. As formas de testosterona para a administración humana que están dispoñibles actualmente son inxectables (como cipionato ou enantato de testosterona en aceite),[87] orais, bucais,[88] parches transdérmicos cutáneos, cremas transdérmicas, xeles,[89][90] e pellets (gránulos) implantables.[91] Estanse desenvolvendo tamén métodos roll-on e aerosois nasais.
Análogos sintéticos[editar | editar a fonte]
Os derivados da testosterona orixínanse a partir de modificacións da súa estrutura química.
A) Testosterona oral: O agregado de grupos metilos en C-1, C-7 e C-17 aumenta a actividade biolóxica. A 17-alfa-metiltestosterona é un derivado especial porque conserva a súa acción androxénica e é activa por vía oral. A fluoximesterona é un derivado fluorado en C9 da metiltestosterona. Estes derivados alquilados da testosterona son metabolizados lentamente no fígado, despois da súa absorción oral. Porén, a hepatotoxicidade, ictericia colestásica principalmente, e a incidencia de adenocarcinoma hepático aumenta en pacientes tratados durante períodos prolongados de tempo con estes andróxenos 17-alquil-substituídos. A testosterona natural, polo contrario, sofre unha rápida degradación no seu primeiro paso polo fígado e non produce practicamente estes efectos adversos.
B) Testosterona parenteral: A esterificación da testosterona no OH no C-17 aumenta a liposolubilidade da testosterona e prolonga a súa acción. O propionato de testosterona é particularmente activo por vía parenteral e de acción relativamente curta (1-2 días). O ciclopentilpropionato ou cipionato e o enantato son andróxenos de acción prolongada. Administrados por vía intramuscular profunda producen efectos androxénicos durante 2 ou 3 semanas. Os ésteres son convertidos en testosterona libre na circulación. A testosterona administrouse tamén por vía subcutánea e ultimamente está a administrarse tamén por vía transdérmica a través dun parche autoadhesivo que se aplica na pel do escroto aproveitando que nesta superficie a absorción é considerablemente maior ca no resto da pel (Testoderm). Aínda que tamén hai parches que se deben aplicar noutras partes do corpo como o abdome ou as coxas (Androderm). Existen tamén xeles de recente aparición de aplicación transdérmica (Testim e Testogel).
Fármacos relacionados[editar | editar a fonte]
Algúns fármacos teñen como obxectivo indirecto a testosterona e utilízanse como tratamento de certas doenzas. Por exemplo, os inhibidores da 5-alfa-redutase, como o finasteride inhibe a conversión da testosterona en dihidrotestosterona (DHT), un metabolito que é máis potente ca a testosterona.[92] Estes inhibidores da 5-alfa-redutase usáronse para tratar varias condicións asociadas cos andróxenos, como a alopecia androxenética, hirsutismo, hiperplasia prostática benigna e cáncer de próstata.[92] Alternativamente, os antagonistas da GnRH únense aos receptores da GnRH da glándula pituitaria, bloqueando a liberación de hormona luteinizante (LH) e de hormona estimulante dos folículos (FSH) na pituitaria.[93] Nos homes, a redución da LH leva a unha rápida supresión da liberación de testosterona nos testículos. Os antagonistas da GnRH utilizáronse para o tratamento do cáncer prostático.
Historia[editar | editar a fonte]
No século XIX certas accións testiculares foron asociadas cunha fracción do sangue circulante (que hoxe sabemos que contiña unha familia de hormonas androxénicas) nos traballos iniciais sobre a castración de aves e transplante testicular feitas por Arnold Adolph Berthold (1803-1861).[94] A investigación sobre a acción da testosterona recibiu un breve pulo en 1889, cando o profesor de Harvard Charles-Édouard Brown-Séquard (1817-1894), entón en París, se autoinxectou subcutaneamente un “elixir de rexuvenecemento”, que consistía nun extracto de testículo de testículo de can e de cobaia. Informou na revista The Lancet que o seu vigor e sensación de benestar se recobraran claramente pero, como era previsible, os efectos eran transitorios [95] (e principalmente baseados no efecto placebo), e as esperanzas de Brown-Séquard sobre este composto cesaron. Ao sufrir a ridiculización por parte dos seus colegas, os seus traballos sobre os mecanismos e efectos dos andróxenos nos seres humanos foron abandonados tanto por Brown-Séquard coma polas seguintes xeracións de bioquímicos durante os seguintes 40 anos.
Non se retomaron os traballos ata que en 1927 o profesor de Fisioloxía da Universidade de Chicago Fred C. Koch e o seu discípulo, Lemuel McGee, extraeron 20 mg unha substancia a partir de 40 libras de testículos bovinos, a cal, cando se administraba a galos, porcos e ratas castrados, facía que se remasculinizasen.[96] O grupo de Ernst Laqueur na Universidade de Ámsterdam purificou a testosterona a partir de testículos bovinos dun modo semellante en 1934. Mais a obtención de suficientes cantidades da hormona de tecidos animais que permitisen facer estudos serios en humanos conseguírona tres compañías farmacéuticas europeas: Schering (de Alemaña), Organon (de Holanda) e Ciba (de Suíza), que desenvolveron na década de 1930 estudos a grande escala con esteroides.

O grupo holandés foi o primeiro en illar a hormona e identificala en 1935, e publicou o achado nun artigo titulado "Sobre a hormona cristalina masculina dos testículos (testosterona)".[97] Denominaron a hormona testosterona, termo formado coas raíces das palabras testículo e esterol, e o sufixo ona propio das cetonas. A estrutura foi dilucidada por Adolf Butenandt da compañía alemá Schering.[98][99]
A síntese química de testosterona a partir do colesterol conseguírona Butenandt e Hanisch en 1935,[100] só unha semana antes de que o grupo da compañía suíza Ciba formado por Leopold Ruzicka (1887-1976) e A. Wettstein, publicasen tamén a súa propia síntese de testosterona.[101] Estas sínteses parciais independentes da testosterona a partir de colesterol supuxéronlles a Butenandt e Ruzicka compartir o Premio Nobel de Química de 1939.[99][102] A testosterona foi identificada como 17β-hidroxiandrost-4-en-3-ona (C19H28O2), un alcohol policíclico cun grupo hidroxilo no carbono 17. Ao coñecerse a estrutura quedou claro que se podían facer modificacións adicionais á testosterona sintetizada como esterificacións ou alquilacións.
A síntese parcial na década de 1930 de ésteres da testosterona potentes e abondosos permitiu a caracterización dos efectos da hormona, e Kochakian e Murlin (1936) atoparon que a testosterona elevaba no can a retención de nitróxeno (o mecanismo fundamental no anabolismo), e despois o grupo de Allan Kenyon[103] demostrou os efectos anabólicos e androxénicos do propionato de testosterona en homes eunucos (castrados), rapaces e mulleres. O período que vai de 1930 a 1950 denominouse "idade de ouro da química dos esteroides",[104] e os traballos durante este período avanzaron rapidamente. Demostrouse que a testosterona ou a súa familia de compostos derivados, potenciaba os músculos, a forza e o benestar.[74]
Notas[editar | editar a fonte]
- ↑ Cox RM, John-Alder HB (2005). "Testosterone has opposite effects on male growth in lizards (Sceloporus spp.) with opposite patterns of sexual size dimorphism". J. Exp. Biol. 208 (Pt 24): 4679–87. PMID 16326949. doi:10.1242/jeb.01948.
- ↑ Reed WL, Clark ME, Parker PG, Raouf SA, Arguedas N, Monk DS, Snajdr E, Nolan V, Ketterson ED (2006). "Physiological effects on demography: a long-term experimental study of testosterone's effects on fitness". Am. Nat. 167 (5): 667–83. PMID 16671011. doi:10.1086/503054.
- ↑ 3,0 3,1 3,2 3,3 Mooradian AD, Morley JE, Korenman SG (1987). "Biological actions of androgens". Endocr. Rev. 8 (1): 1–28. PMID 3549275. doi:10.1210/edrv-8-1-1.
- ↑ Bassil N, Alkaade S, Morley JE (2009). "The benefits and risks of testosterone replacement therapy: a review". Ther Clin Risk Manag 5 (3): 427–48. PMC 2701485. PMID 19707253.
- ↑ Tuck SP, Francis RM (2009). "Testosterone, bone and osteoporosis". Front Horm Res 37: 123–32. PMID 19011293. doi:10.1159/000176049.
- ↑ Dabbs M, Dabbs JM (2000). McGraw-Hill - New York, ed. Heroes, rogues, and lovers: testosterone and behavior. ISBN 0-07-135739-4.
- ↑ Nelson, Randy F. (2005). Sinauer Associates - Sunderland, Mass, ed. An introduction to behavioral endocrinology. pp. 143. ISBN 0-87893-617-3.
- ↑ De Loof, Arnold (2006). "Ecdysteroids: the overlooked sex steroids of insects? Males: the black box". Insect Science 13 (5): 325–338. doi:10.1111/j.1744-7917.2006.00101.x.
- ↑ Mechoulam R, Brueggemeier RW, Denlinger DL (1984). "Estrogens in insects". Journal Cellular and Molecular Life Sciences 40 (9): 942–944. doi:10.1007/BF01946450.
- ↑ Waterman MR, Keeney DS (1992). "Genes involved in androgen biosynthesis and the male phenotype". Horm. Res. 38 (5-6): 217–21. PMID 1307739. doi:10.1159/000182546.
- ↑ Zuber MX, Simpson ER, Waterman MR (1986). "Expression of bovine 17 alpha-hydroxylase cytochrome P-450 cDNA in nonsteroidogenic (COS 1) cells". Science 234 (4781): 1258–61. Bibcode:1986Sci...234.1258Z. PMID 3535074. doi:10.1126/science.3535074.
- ↑ Brooks RV (1975). "Androgens". Clin Endocrinol Metab 4 (3): 503–20. PMID 58744.
- ↑ Payne AH, O'Shaughnessy P (1996). "Structure, function, and regulation of steroidogenic enzymes in the Leydig cell". En Payne AH, Hardy MP, Russell LD. Leydig Cell. Cache River Press - Vienna [Il]. pp. 260–285. ISBN 0-9627422-7-9.
- ↑ Swerdloff RS, Wang C, Bhasin S (1992). "Developments in the control of testicular function". Baillieres Clin. Endocrinol. Metab. 6 (2): 451–83. PMID 1377467. doi:10.1016/S0950-351X(05)80158-2.
- ↑ 15,0 15,1 Mehta PH, Josephs RA (2006). "Testosterone change after losing predicts the decision to compete again". Horm Behav 50 (5): 684–92. PMID 16928375. doi:10.1016/j.yhbeh.2006.07.001.
- ↑ Schultheiss OC, Campbell KL, McClelland DC (1999). "Implicit power motivation moderates men's testosterone responses to imagined and real dominance success". Horm Behav 36 (3): 234–41. PMID 10603287. doi:10.1006/hbeh.1999.1542.
- ↑ Liu PY, Pincus SM, Takahashi PY, Roebuck PD, Iranmanesh A, Keenan DM, Veldhuis JD (2006). "Aging attenuates both the regularity and joint synchrony of LH and testosterone secretion in normal men: analyses via a model of graded GnRH receptor blockade". Am. J. Physiol. Endocrinol. Metab. 290 (1): E34–E41. PMID 16339924. doi:10.1152/ajpendo.00227.2005.
- ↑ Andersen ML, Tufik S (2008). "The effects of testosterone on sleep and sleep-disordered breathing in men: its bidirectional interaction with erectile function" (PDF). Sleep Med Rev 12 (5): 365–79. PMID 18519168. doi:10.1016/j.smrv.2007.12.003. Arquivado dende o orixinal (PDF) o 27 de marzo de 2009. Consultado o 25 de xaneiro de 2012.
- ↑ Marin DP, Figueira AJ Junior, Pinto LG. "One session of resistance training may increase serum testosterone and triiodetironine in young men". Medicine & Science in Sports & Exercise 38 (5): S285.
- ↑ Hulmi JJ, Ahtiainen JP, Selänne H, Volek JS, Häkkinen K, Kovanen V, Mero AA (2008). "Androgen receptors and testosterone in men--effects of protein ingestion, resistance exercise and fiber type". J. Steroid Biochem. Mol. Biol. 110 (1-2): 130–7. PMID 18455389. doi:10.1016/j.jsbmb.2008.03.030.
- ↑ Prasad AS, Mantzoros CS, Beck FW, Hess JW, Brewer GJ (1996). "Zinc status and serum testosterone levels of healthy adults". Nutrition 12 (5): 344–8. PMID 8875519. doi:10.1016/S0899-9007(96)80058-X.
- ↑ Koehler K, Parr MK, Geyer H, Mester J, Schänzer W (2009). "Serum testosterone and urinary excretion of steroid hormone metabolites after administration of a high-dose zinc supplement". Eur J Clin Nutr 63 (1): 65–70. PMID 17882141. doi:10.1038/sj.ejcn.1602899.
- ↑ Josephs RA, Guinn JS, Harper ML, Askari F (2001). "Liquorice consumption and salivary testosterone concentrations". Lancet 358 (9293): 1613–4. PMID 11716893. doi:10.1016/S0140-6736(01)06664-8.
- ↑ Armanini D, Mattarello MJ, Fiore C, Bonanni G, Scaroni C, Sartorato P, Palermo M (2004). "Licorice reduces serum testosterone in healthy women". Steroids 69 (11-12): 763–6. PMID 15579328. doi:10.1016/j.steroids.2004.09.005.
- ↑ Akdoğan M, Tamer MN, Cüre E, Cüre MC, Köroğlu BK, Delibaş N (2007). "Effect of spearmint (Mentha spicata Labiatae) teas on androgen levels in women with hirsutism". Phytother Res 21 (5): 444–7. PMID 17310494. doi:10.1002/ptr.2074.
- ↑ Kumar V, Kural MR, Pereira BM, Roy P (2008). "Spearmint induced hypothalamic oxidative stress and testicular anti-androgenicity in male rats - altered levels of gene expression, enzymes and hormones". Food Chem. Toxicol. 46 (12): 3563–70. PMID 18804513. doi:10.1016/j.fct.2008.08.027.
- ↑ Grant P (2010). "Spearmint herbal tea has significant anti-androgen effects in polycystic ovarian syndrome. A randomized controlled trial". Phytother Res 24 (2): 186–8. PMID 19585478. doi:10.1002/ptr.2900.
- ↑ Randall VA (1994). "Role of 5 alpha-reductase in health and disease". Baillieres Clin. Endocrinol. Metab. 8 (2): 405–31. PMID 8092979. doi:10.1016/S0950-351X(05)80259-9.
- ↑ Meinhardt U, Mullis PE (2002). "The essential role of the aromatase/p450arom". Semin. Reprod. Med. 20 (3): 277–84. PMID 12428207. doi:10.1055/s-2002-35374.
- ↑ Trager L (1977). Steroidhormone: Biosynthese, Stoffwechsel, Wirkung (en alemán). Springer-Verlag. p. 349. ISBN 0-3870-8012-0.
- ↑ Pereira de Jésus-Tran K, Côté PL, Cantin L, Blanchet J, Labrie F, Breton R (2006). "Comparison of crystal structures of human androgen receptor ligand-binding domain complexed with various agonists reveals molecular determinants responsible for binding affinity". Protein Sci. 15 (5): 987–99. PMC 2242507. PMID 16641486. doi:10.1110/ps.051905906.
- ↑ Hiipakka RA, Liao S (1998). "Molecular mechanism of androgen action". Trends Endocrinol. Metab. 9 (8): 317–24. PMID 18406296. doi:10.1016/S1043-2760(98)00081-2.
- ↑ McPhaul MJ, Young M (2001). "Complexities of androgen action". J. Am. Acad. Dermatol. 45 (3 Suppl): S87–94. PMID 11511858. doi:10.1067/mjd.2001.117429.
- ↑ Breiner M, Romalo G, Schweikert HU (1986). "Inhibition of androgen receptor binding by natural and synthetic steroids in cultured human genital skin fibroblasts". Klin. Wochenschr. 64 (16): 732–7. PMID 3762019. doi:10.1007/BF01734339.
- ↑ Gill B., Kogan S. Crypstorchidism. Current concepts. Pdiatr Clin North Am 44(5): 1211-1227 (1997)
- ↑ 36,0 36,1 Swaab DF, Garcia-Falgueras A (2009). "Sexual differentiation of the human brain in relation to gender identity and sexual orientation". Funct. Neurol. 24 (1): 17–28. PMID 19403051.
- ↑ Forest MG, Cathiard AM, Bertrand JA (1973). "Evidence of testicular activity in early infancy". J. Clin. Endocrinol. Metab. 37 (1): 148–51. PMID 4715291. doi:10.1210/jcem-37-1-148.
- ↑ Corbier P, Edwards DA, Roffi J (1992). "The neonatal testosterone surge: a comparative study". Arch Int Physiol Biochim Biophys 100 (2): 127–31. PMID 1379488. doi:10.3109/13813459209035274.
- ↑ Dakin CL, Wilson CA, Kalló I, Coen CW, Davies DC (2008). "Neonatal stimulation of 5-HT(2) receptors reduces androgen receptor expression in the rat anteroventral periventricular nucleus and sexually dimorphic preoptic area". Eur. J. Neurosci. 27 (9): 2473–80. PMID 18445234. doi:10.1111/j.1460-9568.2008.06216.x.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 22 de febreiro de 2012. Consultado o 25 de xaneiro de 2012.
- ↑ 41,0 41,1 Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B, Phillips J, Bunnell TJ, Tricker R, Shirazi A, Casaburi R (1996). "The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men". N. Engl. J. Med. 335 (1): 1–7. PMID 8637535. doi:10.1056/NEJM199607043350101.
- ↑ Mehta PH, Jones AC, Josephs RA (2008). "The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat" (PDF). J Pers Soc Psychol 94 (6): 1078–93. PMID 18505319. doi:10.1037/0022-3514.94.6.1078. Arquivado dende o orixinal (PDF) o 19 de abril de 2009. Consultado o 25 de xaneiro de 2012.
- ↑ Ajayi AA, Halushka PV (2005). "Castration reduces platelet thromboxane A2 receptor density and aggregability". QJM 98 (5): 349–56. PMID 15820970. doi:10.1093/qjmed/hci054.
- ↑ Ajayi AA, Mathur R, Halushka PV (1995). "Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses". Circulation 91 (11): 2742–7. PMID 7758179.
- ↑ Morgentaler A, Schulman C (2009). "Testosterone and prostate safety". Front Horm Res 37: 197–203. PMID 19011298. doi:10.1159/000176054.
- ↑ Rhoden, E.L., M.A. Averbeck, and P.E. Teloken (2008). "Androgen replacement in men undergoing treatment for prostate cancer". J Sex Med 5 (9): 2202–8. PMID 18638000. doi:10.1111/j.1743-6109.2008.00925.x.
- ↑ Morgentaler, A. and A.M. Traish (2009). "Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth". Eur Urol 55 (2): 310–20. PMID 18838208. doi:10.1016/j.eururo.2008.09.024.
- ↑ Haddad RM, Kennedy CC, Caples SM, Tracz MJ, Boloña ER, Sideras K, Uraga MV, Erwin PJ, Montori VM (2007). "Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials". Mayo Clin. Proc. 82 (1): 29–39. PMID 17285783. doi:10.4065/82.1.29.
- ↑ Jones TH, Saad F (2009). "The effects of testosterone on risk factors for, and the mediators of, the atherosclerotic process". Atherosclerosis 207 (2): 318–27. PMID 19464009. doi:10.1016/j.atherosclerosis.2009.04.016.
- ↑ Stanworth RD, Jones TH (2008). "Testosterone for the aging male; current evidence and recommended practice". Clin Interv Aging 3 (1): 25–44. PMC 2544367. PMID 18488876.
- ↑ Marazziti D, Canale D (2004). "Hormonal changes when falling in love". Psychoneuroendocrinology 29 (7): 931–6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Marazziti D, Canale D (2004). "Hormonal changes when falling in love" 29 (7): 931–6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Sapienza P, Zingales L, Maestripieri D (2009). "Gender differences in financial risk aversion and career choices are affected by testosterone". Proc. Natl. Acad. Sci. U.S.A. 106 (36): 15268–73. Bibcode:2009PNAS..10615268S. PMC 2741240. PMID 19706398. doi:10.1073/pnas.0907352106.
- ↑ Apicella CL, Dreber A, Campbell B, Gray PB, Hoffman M, Little AC (2008). "Testosterone and financial risk preferences". Evolution and Human Behavior 29 (6): 384–390. doi:10.1016/j.evolhumbehav.2008.07.001.
- ↑ Zak PJ; et al. (2009). "Testosterone administration decreases generosity in the ultimatum game". PLoS ONE 4: e8330. Bibcode:2009PLoSO...4.8330Z. doi:10.1371/journal.pone.0008330.
- ↑ Berg SJ, Wynne-Edwards KE (2001). "Changes in testosterone, cortisol, and estradiol levels in men becoming fathers". Mayo Clinic Proceedings 76 (1): 582–592.
- ↑ Braude S, Tang-Martinezb Z, Taylor GT (1999). "Stress, testosterone, and the immunoredistribution hypothesis". Behavioral Ecology 10 (3): 345–350. doi:10.1093/beheco/10.3.345.
- ↑ Olsson M, Wapstra E, Madsen T, Silverin B (2000). "Testosterone, ticks and travels: a test of the immunocompetence-handicap hypothesis in free-ranging male sand lizards". Proc. Biol. Sci. 267 (1459): 2339–43. PMC 1690810. PMID 11413653. doi:10.1098/rspb.2000.1289.
- ↑ Wilson JD (2001). "Androgens, androgen receptors, and male gender role behavior". Horm Behav 40 (2): 358–66. PMID 11534997. doi:10.1006/hbeh.2001.1684.
- ↑ Cosgrove, KP , Mazure CM, Staley JK (2007). "Evolving knowledge of sex differences in brain structure, function, and chemistry.". Biol Psychiat 62 (8): 847–55. PMC 2711771. PMID 17544382. doi:10.1016/j.biopsych.2007.03.001.
- ↑ Marner L, Nyengaard JR, Tang Y, Pakkenberg B. (2003). Marked loss of myelinated nerve fibers in the human brain with age. J Comp Neurol. 462(2):144-52. [1] PMID 12794739
- ↑ Rabinowicz T, Dean DE, Petetot JM, de Courten-Myers GM (1999). Journal of Child Neurology - Lausanne, Switzerland, ed. Gender differences in the human cerebral cortex: more neurons in males; more processes in females.
- ↑ "Testosterone Affects Some Women's Career Choices". Arquivado dende o orixinal o 28 de xaneiro de 2012. Consultado o 25 de xaneiro de 2012.
- ↑ Hogervorst E, Bandelow S, Combrinck M, Smith AD (2004). "Low free testosterone is an independent risk factor for Alzheimer's disease". Exp. Gerontol. 39 (11-12): 1633–9. PMID 15582279. doi:10.1016/j.exger.2004.06.019.
- ↑ Moffat SD, Zonderman AB, Metter EJ, Kawas C, Blackman MR, Harman SM, Resnick SM (2004). "Free testosterone and risk for Alzheimer disease in older men". Neurology 62 (2): 188–93. PMID 14745052.
- ↑ Moffat SD, Hampson E (1996). "A curvilinear relationship between testosterone and spatial cognition in humans: possible influence of hand preference". Psychoneuroendocrinology 21 (3): 323–37. PMID 8817730. doi:10.1016/0306-4530(95)00051-8.
- ↑ 67,0 67,1 Pike CJ, Rosario ER, Nguyen TV (2006). "Androgens, aging, and Alzheimer's disease". Endocrine 29 (2): 233–41. PMID 16785599. doi:10.1385/ENDO:29:2:233.
- ↑ 68,0 68,1 Rosario ER, Chang L, Stanczyk FZ, Pike CJ (2004). "Age-related testosterone depletion and the development of Alzheimer disease". JAMA 292 (12): 1431–2. PMID 15383512. doi:10.1001/jama.292.12.1431-b.
- ↑ Wright J, Ellis L, Beaver K (2009). Academic Press, ed. Handbook of crime correlates. San Diego. ISBN 0-12-373612-9.
- ↑ Travison TG, Araujo AB, O'Donnell AB, Kupelian V, McKinlay JB (2007). "A population-level decline in serum testosterone levels in American men". J. Clin. Endocrinol. Metab. 92 (1): 196–202. PMID 17062768. doi:10.1210/jc.2006-1375.
- ↑ Dindyal S (2007). "The sperm count has been decreasing steadily for many years in Western industrialised countries: Is there an endocrine basis for this decrease?". The Internet Journal of Urology 2 (1): 1–21. Arquivado dende o orixinal o 22 de xaneiro de 2014. Consultado o 28 de agosto de 2018.
- ↑ Bhasin S (2007). "Secular decline in male reproductive function: Is manliness threatened?". J. Clin. Endocrinol. Metab. 92 (1): 44–5. PMID 17209224. doi:10.1210/jc.2006-2438.
- ↑ Gould DC, Petty R (2000). "The male menopause: does it exist?: For: Some men need investigation and testosterone treatment". West. J. Med. 173 (2): 76–8. PMC 1070997. PMID 10924412. doi:10.1136/ewjm.173.2.76.
- ↑ 74,0 74,1 de Kruif P (1945). The Male Hormone. New York: Harcourt, Brace.
- ↑ 75,0 75,1 Davis SR, Moreau M, Kroll R, Bouchard C, Panay N, Gass M, Braunstein GD, Hirschberg AL, Rodenberg C, Pack S, Koch H, Moufarege A, Studd J (2008). "Testosterone for low libido in postmenopausal women not taking estrogen". N. Engl. J. Med. 359 (19): 2005–17. PMID 18987368. doi:10.1056/NEJMoa0707302.
- ↑ "Testosterone replacement therapy for male aging: ASA position statement". J. Androl. 27 (2): 133–4. 2006. PMID 16474019.
- ↑ Guay AT, Spark RF, Bansal S, Cunningham GR, Goodman NF, Nankin HR, Petak SM, Perez JB (2003). "American Association of Clinical Endocrinologists medical guidelines for clinical practice for the evaluation and treatment of male sexual dysfunction: a couple's problem--2003 update" (PDF). Endocr Pract 9 (1): 77–95. PMID 12917096. Arquivado dende o orixinal (PDF) o 27 de decembro de 2010. Consultado o 25 de xaneiro de 2012.
- ↑ Holt EH, Zieve D (18-03-2008). U.S. National Library of Medicine, ed. "Testosterone". MedlinePlus Medical Encyclopedia. Consultado o 17-07-2009.
- ↑ "Contraceptive efficacy of testosterone-induced azoospermia in normal men. World Health Organization Task Force on methods for the regulation of male fertility". Lancet 336 (8721): 955–9. 1990. PMID 1977002. doi:10.1016/0140-6736(90)92416-F.
- ↑ Traish AM, Saad F, Guay A (2009). "The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance". J. Androl. 30 (1): 23–32. PMID 18772488. doi:10.2164/jandrol.108.005751.
- ↑ Cunningham GR (25-06-2008). EndocrineToday.com, ed. "Testosterone treatment in aging men". Consultado o 17-07-2009.
- ↑ "Anabolic Steroid Control Act" (PDF). United States Sentencing Commission. 1990. Arquivado dende o orixinal (PDF) o 07 de maio de 2006. Consultado o 25 de xaneiro de 2012.
- ↑ Strahm E, Emery C, Saugy M, Dvorak J, Saudan C (2009). "Detection of testosterone administration based on the carbon isotope ratio profiling of endogenous steroids: international reference populations of professional soccer players". Br J Sports Med 43 (13): 1041–4. PMC 2784500. PMID 19549614. doi:10.1136/bjsm.2009.058669.
- ↑ Kicman AT, Cowan DA (2009). "Subject-based profiling for the detection of testosterone administration in sport". Drug Test Anal 1 (1): 22–4. PMID 20355155. doi:10.1002/dta.14.
- ↑ Pozo OJ, Deventer K, Van Eenoo P, et al. Quantification of testosterone undecanoate in human hair by liquid chromatography-tandem mass spectrometry. Biomed. Chromatogr. 23: 873-880, 2009.
- ↑ Baselt RC (2008). Disposition of Toxic Drugs & Chemicals in Man (8th ed.). Foster City, Calif: Biomedical Publications. pp. 1501–1504. ISBN 978-0-9626523-7-0.
- ↑ "Testosterone Information". Drugs.com.
- ↑ "Striant Official FDA information, side effects and uses.". Drugs.com. Arquivado dende o orixinal o 25 de xaneiro de 2012. Consultado o 25 de xaneiro de 2012.
- ↑ "AndroGel Official FDA information, side effects and uses.". Drugs.com.
- ↑ "Testim (patches and gel) medical facts". Drugs.com. Arquivado dende o orixinal o 14 de outubro de 2012. Consultado o 25 de xaneiro de 2012.
- ↑ "Testopel Pellets" (PDF). www.slatepharma.com. Arquivado dende o orixinal (PDF) o 15 de febreiro de 2010. Consultado o 25 de xaneiro de 2012.
- ↑ 92,0 92,1 Bratoeff E, Cabeza M, Ramirez E, Heuze Y, Flores E (2005). "Recent advances in the chemistry and pharmacological activity of new steroidal antiandrogens and 5 alpha-reductase inhibitors". Curr. Med. Chem. 12 (8): 927–43. PMID 15853706. doi:10.2174/0929867053507306.
- ↑ Engel JB, Schally AV (2007). "Drug Insight: clinical use of agonists and antagonists of luteinizing-hormone-releasing hormone". Nat Clin Pract Endocrinol Metab 3 (2): 157–67. PMID 17237842. doi:10.1038/ncpendmet0399.
- ↑ Berthold AA (1849). "Transplantation der Hoden" [Transplantation of testis]. Arch. Anat. Physiol. Wissensch. (en German) 16: 42–6.
- ↑ Brown-Sequard CE (1889). "The effects produced on man by subcutaneous injections of liquid obtained from the testicles of animals". Lancet 2 (3438): 105. doi:10.1016/S0140-6736(00)64118-1.
- ↑ Gallagher TF, Koch FC (1929). "The testicular horomone". J. Biol. Chem. 84 (2): 495–500.
- ↑ David KG., Dingemanse E, Freud J. Laqueur E (1935). "Über krystallinisches mannliches Hormon aus Hoden (Testosteron) wirksamer als aus harn oder aus Cholesterin bereitetes Androsteron" [On crystalline male hormone from testicles (testosterone) effective as from urine or from cholesterol]. Hoppe Seylers Z Physiol Chem (en German) 233 (5–6): 281. doi:10.1515/bchm2.1935.233.5-6.281.
- ↑ Butenandt A, Hanisch G (1935). "Umwandlung des Dehydroandrosterons in Androstendiol und Testosterone; ein Weg zur Darstellung des Testosterons aus Cholestrin" [About Testosterone. Conversion of Dehydro-androsterons into androstendiol and testosterone; a way for the structure assignment of testosterone from cholestrol]. Hoppe Seylers Z Physiol Chem (en German) 237 (2): 89. doi:10.1515/bchm2.1935.237.1-3.89.
- ↑ 99,0 99,1 Freeman ER, Bloom DA, McGuire EJ (2001). "A brief history of testosterone". J. Urol. 165 (2): 371–3. PMID 11176375. doi:10.1097/00005392-200102000-00004.
- ↑ Butenandt A, Hanisch G (1935). "Uber die Umwandlung des Dehydroandrosterons in Androstenol-(17)-one-(3) (Testosterone); um Weg zur Darstellung des Testosterons auf Cholesterin (Vorlauf Mitteilung). [The conversion of dehydroandrosterone into androstenol-(17)-one-3 (testosterone); a method for the production of testosterone from cholesterol (preliminary communication)]". Chemische Berichte (en German) 68: 1859–1862.
- ↑ Ruzicka L, Wettstein A (1935). "Uber die kristallinische Herstellung des Testikelhormons, Testosteron (Androsten-3-ol-17-ol) [The crystalline production of the testicle hormone, testosterone (Androsten-3-ol-17-ol]". Helvetica Chimica Acta (en German) 18: 1264–1275. doi:10.1002/hlca.193501801176.
- ↑ Hoberman JM, Yesalis CE (1995). "The history of synthetic testosterone". Sci. Am. 272 (2): 76–81. PMID 7817189. doi:10.1038/scientificamerican0295-76.
- ↑ Kenyon AT, Knowlton K, Sandiford I, Koch FC, Lotwin,G (1940). "A comparative study of the metabolic effects of testosterone propionate in normal men and women and in eunuchoidism". Endocrinology 26 (1): 26–45. doi:10.1210/Endo-26-1-26.
- ↑ Schwarz S, Onken D, Schubert A (1999). "The steroid story of Jenapharm: from the late 1940s to the early 1970s". Steroids 64 (7): 439–45. PMID 10443899. doi:10.1016/S0039-128X(99)00003-3.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Ficha técnica da testosterona no sitio web do NIST
- Testosterona: artigo divulgativo
- Algo sobre testosterona
- Testosterona / andropausa (hipogonadismo) Arquivado 10 de setembro de 2009 en Wayback Machine. Información sobre testosterona / andropausa (hipogonadismo)
- Artigo da AESS sobre a testosterona como tratamento da disfunción eréctil
