Alzhéimer
| Alzhéimer | |
|---|---|
| Clasificación e recursos externos | |
 Comparación entre un cerebro normal e un cerebro afectado de alzhéimer. | |
| ICD-10 | G30, F00G30, F00 |
| ICD-9 | 331.0, 290.1 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | neuro/13 alzheimer's+disease |
| MeSH | D000544 |
| GeneReviews | NBK1161 |
Se cre que pode requirir tratamento, por favor, consúltello ao médico. | |
A doenza de Alzheimer, enfermidade de Alzheimer ou simplemente alzhéimer[1] é unha enfermidade neurodexenerativa e desmielinizante do cerebro, caracterizada por unha perda das facultades cognitivas superiores, manifestándose inicialmente como alteracións da memoria episódica. Estes déficits amnésicos agrávanse coa progresión da doenza, e están posteriormente acompañados por déficits visio-espaciais e de linguaxe. O inicio da doenza pode darse moitas veces como simples alteracións da personalidade, con ideación paranoide. Caracterízase na súa forma típica por unha perda da memoria inmediata e doutras capacidades mentais, a medida que as células nerviosas (neuronas) morren e diferentes zonas do cerebro se atrofian. A enfermidade adoita ter unha duración media aproximada despois do diagnóstico de entre 7 a 10 anos,[2] variando en proporción directa coa severidade da enfermidade no momento do diagnóstico.
A enfermidade de Alzheimer é a forma máis común de demencia, é incurable e terminal, que aparece con maior frecuencia en persoas maiores de 65 anos de idade.[3] Os síntomas da enfermidade como unha entidade nosolóxica definida foi identificada por Emil Kraepelin,[4] mentres que a neuropatoloxía característica foi observada por primeira vez por Alois Alzheimer en 1906.[5][6][7] Así pois, o descubrimento da enfermidade foi obra de ambos os dous psiquiatras, que traballaban no mesmo laboratorio. Con todo, dada a grande importancia que Kraepelin daba a atopar a base neuropatolóxica das desordes psiquiátricas, decidiu designar a doenza como enfermidade de Alzheimer en honor ao seu compañeiro.
Polo xeral, o síntoma inicial é a inhabilidade de adquirir novas memorias, pero adoita confundirse con actitudes relacionadas coa vellez ou o estrés.[8] Ante a sospeita de alzhéimer, o diagnóstico realízase con avaliacións de conduta e cognitivas, así como neuroimaxes, de estar dispoñibles.[9] A medida que progresa a enfermidade, aparecen confusión mental, irritabilidade e agresión, cambios do humor, trastornos da linguaxe, perda da memoria de longo prazo e unha predisposición a illarse a medida que os sentidos do paciente diminúen.[8][10] Gradualmente pérdense as funcións biolóxicas que finalmente levan á morte.[11] O prognóstico para cada individuo é difícil de determinar. A media xeral é de 7 anos,[12] menos do 3% dos pacientes viven máis de 14 anos despois do diagnóstico.[13]
A causa do alzhéimer permanece descoñecida, aínda que as últimas investigacións parecen indicar que están implicados procesos de tipo priónico.[14] As investigacións adoitan asociar a enfermidade á aparición de placas senís e nobelos neurofibrilares.[15] Os tratamentos actuais ofrecen moderados beneficios sintomáticos, pero non hai tratamento que atrase ou deteña o progreso da enfermidade.[16] Para a prevención do alzhéimer, suxeríronse un número variado de hábitos condutuais, pero non hai evidencias publicadas que destaquen os beneficios desas recomendacións, incluíndo estimulación mental e dieta equilibrada.[17] O papel que xoga o coidador do suxeito con alzhéimer é fundamental,[18] aínda cando as presións e demanda física deses coidados poden chegar a ser unha grande carga persoal.[19][20][21]
O Día Internacional do Alzhéimer celébrase o 21 de setembro, data elixida pola OMS e a Federación Internacional do Alzhéimer, data na cal se celebran en diversos países actividades para concienciar e axudar a previr a enfermidade.[22]
Prevese que en 2050 os pacientes de alzhéimer se vaian multiplicar por cinco.[23]
Historia[editar | editar a fonte]

Médicos gregos e romanos asociaron a vellez coa demencia,[7] pero non foi ata 1901 cando o psiquiatra alemán Alois Alzheimer identificou o primeiro caso do que se coñece hoxe como enfermidade de Alzheimer,[25] nunha muller de cincuenta anos de idade, a quen chamou «Auguste D». O investigador fixo o seguimento do seu paciente ata a súa morte en 1906, momento en que por primeira vez informou publicamente do caso.[24]
Un dos primeiros síntomas dunha muller de 51 anos foi un forte sentimento de celos cara ao seu marido. Pronto mostrou progresivos fallos de memoria, non podía atopar o seu camiño a casa, arrastraba obxectos sen sentido, escondíase ou ás veces pensaba que outras persoas querían matala, de forma que empezaba a gritar.Durante o seu internamento os seus xestos mostraban unha completa impotencia. Estaba desorientada en tempo e espazo. De cando en cando dicía que non entendía nada, que se sentía confusa e totalmente perdida. Ás veces consideraba a chegada do médico como a visita dun oficial e pedía perdón por non acabar o seu traballo, mentres que outras veces comezaba a gritar por temor a que o médico quixese operala. En ocasións despedíao completamente indignada, berrando frases que indicaban o seu temor a que o médico quixese ferir o seu honor. De cando en vez estaba completamente delirante, arrastrando as mantas dun lado a outro, chamando ao seu marido e á súa filla, e con aspecto de ter alucinacións auditivas. Con frecuencia gritaba durante horas e cunha voz horrible.
A regresión mental avanzou gradualmente. Tras catro anos e medio de enfermidade, a paciente faleceu. Ao final estaba completamente apática e confinada na cama onde adoptaba unha posición fetal.
Trala morte da muller, Alzheimer examinoulle o cerebro ao microscopio. Anotou as alteracións das "neurofibrilas", elementos do citoesqueleto tinguidos cunha solución de prata.
A preparación de prata de Bielchowsky mostrou cambios moi característicos das neurofibrilas. Con todo, no interior da célula de aspecto normal podíase observar unha ou varias fibras únicas que eran prominentes polo seu grosor e a súa impregnabilidade. Nunha etapa máis avanzada moitas fibriñas dispostas en paralelo mostraban os mesmos cambios. Logo acumulábanse formando feixes densos e gradualmente avanzaban cara á superficie da célula. Algunhas veces, o núcleo e o citoplasma desaparecían, e só un conxunto de feixes de fibriñas indicaba o lugar onde existiu unha neurona. Como estas fibras podían ser tinguidas con tincións diferentes das neurofibrilas normais, tiña que haberse producido unha transformación química da substancia fibrilar. Esta podería ser a razón pola que as fibriñas sobrevivían á destrución da célula. Parece que a transformación das fibriñas coincide co almacenamento dun produto patolóxico aínda non ben coñecido do metabolismo da neurona. Ao redor dun cuarto ou un terzo de todas as neuronas da cortiza cerebral mostraban esas alteracións. Numerosas neuronas, especialmente nas capas celulares altas, desapareceran totalmente.
Durante os seguintes cinco anos, a literatura médica reportou polo menos once casos similares, algúns deles utilizando xa o termo «enfermidade de Alzheimer».[7] A enfermidade foi categorizada por primeira vez por Emil Kraepelin logo da supresión dalgúns elementos clínicos concomitantes como delirios e alucinacións, así como características histolóxicas irrelevantes para a enfermidade como os cambios arterioscleróticos, os cales figuraban no informe orixinal sobre Auguste D.[27] Na oitava edición do seu libro de texto de Psiquiatría, publicado en 1910, incluíu á enfermidade do Alzheimer, denominada tamén por Kraepelin «demencia presenil», como un subtipo de demencia senil.[28]
Durante a maior parte do século xx, o diagnóstico do alzhéimer estaba reservado para as persoas entre as idades de 45 e 65 anos con síntomas de demencia. A terminoloxía cambiou desde 1977 cando, nunha conferencia sobre alzhéimer, chegouse á conclusión de que as manifestacións clínicas e patolóxicas da demencia presenil e senil eran case idénticas, aínda que os autores tamén agregaron que iso non descartaba a posibilidade de que tivesen causas diferentes.[26] Isto, a longo prazo, levou a facer o diagnóstico do alzhéimer independentemente da idade.[29] O termo demencia senil do tipo alzhéimer foi empregado durante un tempo para describir o trastorno naquelas persoas maiores de 65 anos, mentres que a enfermidade clásica de Alzheimer reservábase para as de menor idade. Finalmente, o termo enfermidade de Alzheimer foi aprobado oficialmente na nomenclatura médica para describir a individuos de todas as idades cun patrón de síntomas: características, curso da enfermidade e neuropatoloxía comúns.[30]
A Organización Mundial da Saúde (OMS) proclamou o 21 de setembro como o Día Internacional do Alzhéimer (ou da Loita contra o Alzhéimer). Segundo esta organización, a enfermidade de Alzhéimer representa entre un 60% e un 70% dos casos de demencia [31].
Epidemioloxía[editar | editar a fonte]
| Idade | Incidencia (novos casos) por cada mil persoas-idade |
|---|---|
| 65-69 | 3 |
| 70-74 | 6 |
| 75-79 | 9 |
| 80-84 | 23 |
| 85-89 | 40 |
| 90- | 69 |
A incidencia en estudos de cohortes, mostra taxas de entre 10 e 15 novos casos cada mil persoas ao ano para a aparición de calquera forma de demencia e entre 5 e 8 para a aparición do alzhéimer.[32][33] É dicir, a metade de todos os casos novos de demencia cada ano son pacientes con alzhéimer. Tamén hai diferenzas de incidencia dependendo do sexo, xa que se aprecia un risco maior de padecer a enfermidade nas mulleres, en particular entre a poboación maior de 85 anos.[33][34]
A prevalencia é a porcentaxe dunha poboación dada cunha enfermidade. A idade avanzada é o principal factor de risco para sufrir alzhéimer: maior frecuencia a maior idade. Nos Estados Unidos, a prevalencia do alzhéimer foi dun 1,6% no ano 2000, tanto na poboación xeral como na comprendida entre os 65 e 74 anos. Apreciouse un aumento do 19% no grupo dos 75 aos 84 anos e do 42% nos maiores de 84 anos de idade;[35] con todo, as taxas de prevalencia nas rexións menos desenvolvidas do mundo son inferiores.[36] A Organización Mundial da Saúde estimou que en 2005 o 0,379% das persoas a nivel mundial tiñan demencia e que a prevalencia aumentaría a un 0,441% en 2015 e a un 0,556% en 2030.[37] doutra banda, para o ano 2010 a Alzheimer's Disease International estimou unha prevalencia de demencia do 4,7% a nivel mundial para persoas con 60 anos ou máis,[38] representada por certas cifras ao alza respecto de varios estudos publicados con anterioridade (10% superiores ás estimadas para The Lancet en 2005).[36]
Outro estudo estimou que no ano 2006, un 0,4% da poboación mundial (entre 0,17 e o 0,89%; valor absoluto aproximadamente 26,6 millóns ou entre 11,4 e o 59,4 millóns) veríase afectado polo alzhéimer e que a prevalencia se triplicaría para o ano 2050.[39]
Etioloxía[editar | editar a fonte]
As causas do alzhéimer non foron completamente descubertas. Existen tres principais hipóteses para explicar o fenómeno: o déficit da acetilcolina, a acumulación de amiloide ou tau e os trastornos metabólicos.
A máis antiga delas e na que se basean a maioría dos tratamentos dispoñibles é a hipótese colinérxica, a cal suxire que o alzhéimer débese a unha redución na síntese do neurotransmisor acetilcolina. Esta hipótese non mantivo apoio global por razón de que os medicamentos que tratan unha deficiencia colinérxica teñen reducida efectividade na prevención ou cura do alzhéimer, aínda que se propuxo que os efectos da acetilcolina dan inicio a unha acumulación a tan grandes escalas que leva á neuroinflamación xeneralizada que deixa de ser tratable simplemente promovendo a síntese do neurotransmisor.[40][41]
Outra hipótese proposta en 1991,[42] relacionouse coa acumulación anómala de proteínas beta-amiloide (tamén chamada amiloide Aβ) e tau no cerebro dos pacientes con alzhéimer.[43] Nunha minoría de pacientes, a enfermidade prodúcese pola aparición de mutacións nos xenes PSEN1, PSEN2 e no xene da APP, localizado no cromosoma 21. Neste último caso a enfermidade aparece clasicamente en persoas co síndrome de Down (trisomía no cromosoma 21), case universalmente aos 40 anos de vida e transmítese de pais a fillos (polo que existen, habitualmente, antecedentes familiares de alzhéimer nos pacientes que desenvolven a enfermidade en idades precoces). Esa relación co cromosoma 21, e a tan elevada frecuencia de aparición da enfermidade nas trisomías dese cromosoma, fan que a teoría sexa moi evidente.[44][45]
O alzhéimer está caracterizado por depósitos amiloideos no cerebro.[46] O seu compoñente principal é o péptido beta amiloide de 42 aminoácidos (βA42), en cuxo proceso de produción, é fundamental a participación da γ-secretase, que depende á súa vez das presenilinas (PSEN).[47]
Deste xeito institúese un novo grupo de moléculas de relativo recente descubrimento, implicadas na xénese da enfermidade do Alzheimer e fundamental para a súa comprensión e que ofrecen posibilidades como dianas terapéuticas.[48] Para comprender que son estas moléculas, debemos sinalar que se tratan dun grupo de substancias peptídicas producidas principalmente no cerebro.[48][49] Hai dous tipos, PSEN 1 e PSEN 2, cunha estrutura similar. A función principal que desempeñan ambas PSEN consiste no procesamento proteolítico de numerosas proteínas de membrana de tipo 1, entre elas a APP, formando parte da γ secretase; de aí a importancia das PSEN na enfermidade de Alzheimer, xa que a través da regulación da γ secretase determinan a forma de Aβ que se xera e xa que logo a súa acumulación no tecido cerebral.[47][50][51] O alzhéimer de inicio cedo relacionouse con mutacións no cromosoma 21, que contén o xene da APP, e os cromosomas 14 e 1, que codifican para PSEN1 e PSEN2 respectivamente; estas mutacións teñen como resultado, entre outros efectos, o aumento da concentración de βA. Mentres que o alzhéimer de inicio tardío relaciónase con mutacións no xene da apolipoproteina E.[46][52] O xene que codifica a PSEN1, do que se coñecen 177 mutacións distintas, é o responsable da aparición do alzhéimer de inicio tan cedo como aos 23 anos. A mutación da PSEN2 é o causante de menos do 1% dos casos de alzhéimer autosómicos dominantes, influíndo máis nestes portadores os factores ambientais.[52][53][54][55]
Outro grande factor de risco xenético é a presenza do xene da APOE4, o cal tende a producir unha acumulación amiloide no cerebro antes da aparición dos primeiros síntomas do alzhéimer. Polo tanto, a deposición do amiloide Aβ tende a preceder a clínica do alzhéimer.[56] Outras evidencias parten dos achados en ratos xeneticamente modificados, os cales só expresan un xene humano mutado, o da APP, o cal invariablemente cáusalles o desenvolvemento de placas amiloides fibrilares.[57] Descubriuse unha vacina experimental que causaba a eliminación destas placas pero non tiña efecto sobre a demencia.[58]
Os depósitos das placas non teñen correlación coa perda neuronal.[59] Esta observación apoia a hipótese tau, a cal defende que é esta proteína a que dá inicio á cascada de trastornos da enfermidade de Alzheimer. De acordo a este modelo, as tau hiperfosforiladas adoptan formas anómalas distribuíndose en longas fileiras. Eventualmente forman ovillos de neurofibrilas dentro dos corpos das células nerviosas.[60] Cando isto ocorre, os microtúbulos desintégranse colapsando o sistema de transporte da neurona. Iso pode dar inicio ás primeiras disfuncións na comunicación bioquímica entre unha neurona e a outra e implicar á morte destas células.[61]
Un número de investigacións recentes relacionou a demencia,[62] incluíndo a enfermidade de Alzheimer,[63] con desordes metabólicas,[64] particularmente coa hiperglicemia e a resistencia á insulina. A expresión de receptores da insulina foi demostrada nas neuronas do sistema nervioso central, preferentemente nas do hipocampo. Nestas neuronas, cando a insulina se une ao seu receptor celular, promovese a activación de cascadas de señalización intracelular que conducen ao cambio da expresión dos xenes relacionados cos procesos de plasticidade sináptica e das enzimas relacionadas co despexe da mesma insulina e do beta-amiloide. Estas enzimas degradantes de insulina promoven a diminución da toxicidade debida ao amiloide en modelos animais.
Algúns estudos suxeriron unha hipótese sobre a relación desta enfermidade co aluminio. Dita hipótese suxire que os utensilios de aluminio contaminan con trazas de ións alúmina nos alimentos. Estes ións focalizanse nos receptores producindo degradación e formación de plaquetas amiloide, este feito está sendo proposto nos centros de investigación da enfermidade.[65] Malia a polémica existente en torno ao papel que ten o aluminio como factor de risco do alzhéimer, nos últimos anos os estudos científicos mostraron que este metal podería estar relacionado co desenvolvemento da enfermidade. Os resultados mostran que o aluminio asóciase a varios procesos neurofisiolóxicos que provocan a característica dexeneración do alzhéimer.[66]
Patoxenia[editar | editar a fonte]

A enfermidade de Alzheimer caracterízase pola perda de neuronas e sinapses no córtex cerebral e en certas rexións subcorticais. Esta perda resulta nunha atrofia das rexións afectadas, incluíndo unha dexeneración no lobo temporal e parietal e partes da córtex frontal e a circunvolución cingulada.[41]
Neuropatoloxía[editar | editar a fonte]
As placas son depósitos densos, insolubles, da proteína beta-amiloide e de material celular, que se localizan fóra e ao redor das neuronas. Estas continúan crecendo ata formar fibras entretecidas dentro da célula nerviosa, os chamados nobelos. É probable que moitos individuos, na súa vellez, desenvolvan estas placas e nobelos como parte do proceso normal do envellecemento, con todo, os pacientes con alzhéimer teñen un maior número en lugares específicos do cerebro como o lobo temporal.[67]
Bioquímica[editar | editar a fonte]
A enfermidade de Alzheimer definiuse como unha enfermidade que altera o pregamento de proteínas ou proteopatía, debido á acumulación de proteínas Aβ e tau, anormalmente dobradas, no cerebro.[68] As placas neuríticas están constituídas por pequenos péptidos de 39 a 43 aminoácidos de lonxitude, chamados beta-amiloides (abreviados A-beta ou Aβ). O beta-amiloide é un fragmento que provén dunha proteína de maior tamaño coñecida como proteína precursora amiloide (APP, polas súas siglas en inglés). Esta proteína é indispensable para o crecemento das neuronas, para a súa supervivencia e a súa reparación postdano.[69][70] Na enfermidade de Alzheimer, un proceso aínda descoñecido é o responsable de que a APP sexa dividida en varios fragmentos de menor tamaño por enzimas que catalizan un proceso de proteólise.[71] Un destes fragmentos é a fibra do beta-amiloide, o cal agrúpase e depositase fóra das neuronas en formacións microscopicamente densas coñecidas como placas senís.[15][72]
A enfermidade do Alzheimer considérase tamén unha tauopatía, debido á agregación anormal da proteína tau. As neuronas sas conteñen un citoesqueleto, unha estrutura intracelular de soporte, parcialmente feito de microtúbulos. Estes microtúbulos actúan como vías que guían os nutrientes e outras moléculas desde o corpo celular ata os extremos dos axóns e viceversa. Cada proteína tau estabiliza os microtúbulos cando é fosforilado, e por esa asociación denomínaselle proteína asociada ao microtúbulo. No alzhéimer, a tau procede por cambios químicos resultado da súa hiperfosforilación, únese con outras febras tau creando madeixas de neurofibrilas e, deste xeito, desintegra o sistema de transporte da neurona.[73]

Patoloxía[editar | editar a fonte]
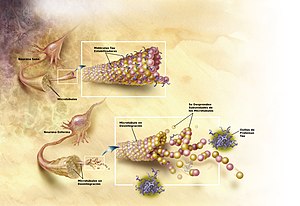
Non se explicou por completo como a produción e agregación dos péptidos Aβ xogan un rol no alzhéimer.[74] A fórmula tradicional da hipótese amiloide apunta á acumulación dos péptidos Aβ como o evento principal que comporta a dexeneración neuronal. A acumulación das fibras amiloides, que parece ser a forma anómala da proteína responsable da perturbación da homeostase do ion calcio intracelular, induce a morte celular programada, chamada apoptose.[75] Sábese tamén, que a Aβ acumúlase selectivamente nas mitocondrias das células cerebrais afectadas no alzhéimer e que é capaz de inhibir certas funcións enzimáticas, así como alterar a utilización da glicosa polas neuronas.[76]
Varios mecanismos inflamatorios e a intervención das citoquinas poden tamén xogar un papel na patoloxía da enfermidade de Alzheimer. A inflamación é o marcador xeral de dano nos tecidos en calquera enfermidade e pode ser secundario ao dano producido polo alzhéimer, ou ben, a expresión dunha resposta inmunolóxica.[77]
Xenética[editar | editar a fonte]
A gran maioría dos pacientes desta enfermidade teñen ou han ter algún familiar con devandita enfermidade. Tamén hai que dicir que unha pequena representación dos pacientes de alzhéimer é debido a unha xeración autosomal dominante, facendo que a enfermidade apareza de forma temperá. En menos dun 10% dos casos, o alzhéimer aparece antes dos 60 anos de idade como consecuencia de mutacións autosómicas dominantes, representando, apenas, un 0,01% de todos os casos.[78][79][80] Estas mutacións descubríronse en tres xenes distintos: o xene da proteína precursora de amiloide (APP) e os xenes das presenilinas 1 e 2.[78] Aínda que a forma de aparición temperá da enfermidade de Alzheimer ocorre por mutacións en tres xenes básicos, a forma máis común non se puido explicar cun modelo puramente xenético. A presenza do xene da apolipoproteína E é o factor de risco xenético máis importante para padecer alzhéimer, pero non permite explicar todos os casos da enfermidade.[78]
En 1987, descubriuse a relación da enfermidade de Alzheimer co cromosoma 21. Isto foi importante porque a maioría dos afectados pola "síndrome de Down" ou trisomía do cromosoma 21, padecen lesións neuropatolóxicas similares ás do alzhéimer.[44] Dentro do cromosoma 21 atopamos o xene APP. John Hardy e os seus colaboradores en 1991 afirmaron que este xene estaba implicado na enfermidade de Alzheimer nun reducido número de familias. Con todo, considérase que entre o 5-10% dos familiares coa enfermidade precoz padécena debido a unha mutación deste xene. As investigacións dentro deste xene centráronse no péptido Aβ (todas as mutacións atópanse ao redor deste péptido). As mutacións producían un aumento das concentracións do péptido Aβ. Isto levou á formación da hipótese de "fervenza amiloide" nos anos 90. A "fervenza amiloide" consiste en que a grande produción de Aβ levaría á formación de depósitos en formas de placas senís. Estas placas senís serían nocivas para as células que producirían madeixas neurofibrilares, a morte celular e a demencia. Máis tarde viuse nun grupo amplo de familias o ligamento da enfermidade de Alzheimer co cromosoma 14. Pero isto levou a unha cadea de erros e con iso unhas conclusións erróneas. Rudy Tanzi e Peter St George-Hyslop en 1995, mediante as técnicas de clonaxe descubriron outro xene, o S182 ou Presenilina-1 (PS1). Este xene atópase entre os dominios 9 e 8 de transmembrana (con dúas rexións hidrofílicas) e atoparonse máis de 30 mutacións. Este xene intervén en procesos de apoptose e é fundamental durante o desenvolvemento. A maioría das mutacións do xene Presenilina-1 (PS1) provocan un cambio na estrutura primaria. A PS1 e a enfermidade do Alzheimer non teñen unha clara relación, pero hai que destacar que os pacientes que tiveron mutacións aumentan o péptido Aβ no plasma. Pouco máis tarde descubriuse un novo xene que se denomina presenilina-2 (PS2) e tamén provoca o ascenso na concentración do péptido Aβ, aínda que as mutacións observadas son de menor cantidade que nos outros xenes (APP e PS1). A PS2 está formada por 8 ou 9 dominios transmembrana.
A maioría das mutacións no xene da APP e nos das presenilinas, aumentan a produción dunha pequena proteína chamada beta-amiloide (Abeta 2), a cal é o principal compoñente das placas senís.[81]
Aínda que a maioría dos casos de alzhéimer non se deben a unha herdanza familiar, certos xenes actúan como factores de risco. Un exemplo é a transmisión familiar do alelo e4 do xene da apolipoproteína E. Este xene considérase un factor de risco para a aparición do alzhéimer esporádico en fases tardías producindo un 50% dos casos de alzhéimer.[82] Ademais deste, ao redor de 400 xenes foron tamén investigados pola súa relación co alzhéimer esporádico en fase tardía.[78] Así pois, os xenetistas coinciden en que hai máis xenes que actúan como factores de risco, aínda que tamén afirman que existen outros que teñen certos efectos protectores que levan a atrasar a idade da aparición do alzhéimer.[78] Un exemplo é a alteración no xene da reelina, que contribúe a aumentar o risco de aparición do alzhéimer en mulleres.[83]
Características[editar | editar a fonte]
O transcurso da enfermidade divídese en catro etapas, con modelos progresivos de impedimentos cognitivos e funcionais.
Predemencia[editar | editar a fonte]
Os primeiros síntomas que se manifestan adoitan ser confundidos por simples efectos da idade ou causas do estrés.[8] Un test neuropsicolóxico detallado pode revelar lixeiras dificultades cognitivas ata oito anos antes de que a persoa cumpra os criterios clínicos que definen o diagnóstico de alzhéimer.[84] Estes primeiros síntomas poden afectar ás actividades cotiás máis complexas.[85] O déficit que máis destaca é a perda de memoria, que se expresa como unha dificultade para recordar feitos sucedidos recentemente e a incapacidade de reter nova información.[84][86]
Nestes primeiros momentos tamén resultan sintomáticamente significativos os problemas sutís con funcións executivas ou de atención, de planificar, de flexibilidade e de pensamento abstracto ou ben deterioración da memoria semántica (recordar o significado das palabras e poder relacionar conceptos ).[84] Tamén é probable observar apatía, que acaba sendo o síntoma neuropsiquiátrico máis persistente ao longo do desenvolvemento da enfermidade.[87] Este estadio preclínico tamén se chamou deterioración cognitiva leve,[86] pero discútese se este termo corresponde a unha fase de diagnóstico diferente ou se se identifica como o primeiro chanzo da enfermidade de Alzheimer.[88]
Demencia precoz[editar | editar a fonte]

Os síntomas nesta fase inicial van desde unha simple e insignificante, pero ás veces recorrente, perda de memoria (como a dificultade en orientarse un mesmo en lugares como rúas ao estar conducindo o automóbil), ata unha constante e máis persuasiva perda da memoria coñecida como memoria a curto prazo, presentando dificultades ao interactuar en áreas de índole familiar como a veciñanza onde o individuo habita. É frecuente que o diagnóstico definitivo se dea aos enfermos xa con deterioración na aprendizaxe e na memoria. Con todo. nunha pequena parte deles, as dificultades coa linguaxe, as funcións executivas, a percepción (agnosia) ou a execución de movementos (apraxia) son máis prominentes que os problemas de memoria.[89] Aínda así, o alzhéimer non afecta a todas as capacidades da memoria por igual: os feitos e os recordos recentes vense afectados en maior grado que os recordos antigos da propia vida (memoria episódica), os datos aprendidas (memoria semántica) e a memoria implícita (a memoria de como manexar o corpo para facer cousas, como usar un garfo para comer).[90][91]
Os problemas coa linguaxe, por outra banda, caracterízanse principalmente por unha diminución tanto do vocabulario como da fluidez da fala, o que implica un empobrecemento en xeral da linguaxe oral e escrita.[89][92] Neste punto, con todo, o paciente normalmente é capaz de comunicar adecuadamente as súas ideas básicas.[89][92][93] Aínda así, cando realiza tarefas de motricidad fina como escribir, pintar ou vestirse, adoita presentar algunha dificultade de coordinación ou planificación de movementos (apraxia), pero a miúdo adoitan pasar desapercibidas.[89] A medida que a enfermidade progresa, os pacientes con alzhéimer a miúdo poden continuar levando a cabo de forma independente algunhas tarefas, pero adoitan necesitar axuda, asistencia ou supervisión nalgunhas das actividades máis cognitivas.[89]
Demencia moderada[editar | editar a fonte]

A deterioración progresiva acaba dificultando a independencia, e os pacientes deixan de ser capaces de levar a cabo as actividades máis básicas do día a día.[89] Ademais, as dificultades no fala convértense evidentes debido a unha crecente incapacidade de recordar vocabulario, que conduce a frecuentes substitucións de palabras incorrectas (parafasia). Do mesmo xeito, a capacidade de escribir e ler tamén se perden progresivamente,[89][93] e as secuencias motoras complexas vólvense menos coordinadas a medida que a enfermidade avanza, incrementando o risco de caídas.[89] Durante esta fase, os problemas de memoria empeoran, e o paciente pode chegar a non recordar parentes próximos.[89] A memoria a longo prazo, que ata ese momento permanecía intacta, resulta totalmente deteriorada.[89]
Nesta etapa vólvense máis notorios os cambios na conduta. As manifestacións neuropsiquiátricas máis comúns son as distracciones, o desvarío e os episodios de confusión ao final do día (agravados pola fatiga, a pouca luz ou a escuridade),[95] así como a irritabilidade e a labilidade emocional, que inclúen choros ou risas inapropiadas, agresión non premeditada e ata a resistencia ás persoas a cargo dos seus coidados.[89] En aproximadamente o 30% dos pacientes aparecen ilusións no recoñecemento de persoas.[89] Ademais, tamén perden a noción do proceso da súa enfermidade e as súas limitacións (anosognosia),[89] desenvolvendo problemas como a incontinencia urinaria.[89] Estes síntomas estresan aos familiares e as persoas a cargo do coidado do paciente e poden verse reducidos se se traslada a un centro de coidados a longo prazo.[89].[96]
Demencia avanzada[editar | editar a fonte]
Durante esta etapa na enfermidade de alzhéimer, o paciente xa é completamente dependente dos seus coidadores.[89] A linguaxe quedou reducida a frases curtas e simples, ou ben a palabras soltas, e é moi frecuente que a persoa se trabuque completamente ao intentar falar.[89][93] Malia esta perda das habilidades lingüísticas, a miúdo os pacientes entenden e responden a sinais emocionais.[89] Aínda que a agresividade pode persistir, a apatía e o esgotamento son resultados moito máis comúns.[89] Ao cabo, os pacientes non poden levar a cabo nin as tarefas máis simples sen axuda.[89] A masa muscular e a mobilidade están totalmente deterioradas ata o punto de que os enfermos xacen prostrados na cama, e non poden nin alimentarse por si mesmos.[89][97] Neste punto se evidencia que o alzhéimer é unha enfermidade terminal, aínda que a causa de morte non adoita ser a enfermidade por si soa, senón un factor externo como unha infección das úlceras ou unha pneumonía.[89]
Diagnóstico[editar | editar a fonte]

O diagnóstico basase primeiro na historia e nas observacións clínicas, tanto do profesional da saude como a que é referida polos familiares, baseada nas características neurolóxicas e psicolóxicas, así como na ausencia de condicións alternativas: un diagnóstico de exclusión.[98][99] Durante unhas semanas ou meses realízanse probas de memoria e de funcionamento ou avaliación intelectual.[8] Tamén se efectúan análise de sangue e escáner para descartar diagnósticos alternativos. Non existe un test pre mortem para diagnosticar concluientemente o alzhéimer. Conseguiuse aproximar a certeza do diagnóstico a un 85%, pero o definitivo debe facerse con probas histolóxicas sobre tecido cerebral, xeralmente obtidas na autopsia.[100] As probas de imaxe cerebral —tomografía computadorizada (TC), resonancia magnética nuclear (RMN), tomografía por emisión de positróns (TEP) ou a tomografía computarizada por emisión de fotón único— poden mostrar diferentes signos de que existe unha demencia, pero non especifica de cal se trata.[101] Tralo seu diagnóstico, a expectativa media de vida dos pacientes que viven coa enfermidade de Alzheimer é de entre 7 e 10 anos.[2]
Criterios de diagnóstico[editar | editar a fonte]
A Asociación do Alzhéimer é o organismo que estableceu os criterios diagnósticos máis comunmente usados, rexistrados nos Criterios NINCDS-ADRDA do Alzhéimer.[102] Estas pautas requiren que a presenza dun trastorno cognitivo e a sospeita dunha síndrome demencial sexan confirmadas cunha avaliación neuropsicolóxica con vistas a categorizar o diagnóstico do alzhéimer en dous: posible ou probable. A confirmación histolóxica, que inclúe un exame microscópico do tecido cerebral, precísase para o diagnóstico definitivo do alzhéimer. Estes criterios inclúen que a presenza dun trastorno cognitivo e a sospeita dunha síndrome demencial sexan confirmados por avaliacións neuropsicolóxicas para distinguir entre un diagnóstico posible ou un probable da enfermidade de Alzheimer. Mostrouse fiabilidade e validez estatística entre os criterios diagnósticos e a confirmación histolóxica definitiva.[103] Son oito os dominios cognitivos que con máis frecuencia dánanse no alzhéimer: a memoria, a linguaxe, a percepción, a atención, as habilidades construtivas e de orientación, a resolución de problemas e as capacidades funcionais. Estes parámetros son equivalentes aos evaluados nos Criterios NINCDS-ADRDA publicados pola Asociación Americana de Psiquiatría.[104][105]
Ferramentas de diagnóstico[editar | editar a fonte]

As avaliacións neuropsicolóxicas, inclusive o exame minimental, son amplamente usadas para avaliar os trastornos cognitivos necesarios para o diagnóstico do alzhéimer. Outra serie de exames máis comprensivos son necesarios para unha maior fiabilidade nos resultados, especialmente nas fases iniciais da enfermidade.[106][107] O exame neurolóxico nos inicios do alzhéimer é crucial para o diagnóstico diferencial do alzhéimer e outras enfermidades.[8] As entrevistas a familiares tamén serven para avaliar a enfermidade. Os coidadores poden prover información e detalles importantes sobre as habilidades rutineiras, así como a diminución no tempo da función mental do paciente.[108] O punto de vista da persoa a cargo do paciente é de especial importancia debido a que o paciente, polo xeral, non está ao tanto das súas propias deficiencias.[109] Moitas veces, os familiares teñen desafíos na detección dos síntomas e signos iniciais da demencia e poida que non comuniquen a información de xeito acertado ao profesional de saúde especializado.[110]
Os exames adicionais poden proporcionar información dalgúns elementos da enfermidade e tenden a ser usados para descartar outros diagnósticos. Os exames de sangue poden identificar outras causas de demencia que non sexa o alzhéimer,[8] que poden ser, en poucos casos, enfermidades reversíbeis.[111] O exame psicolóxico para a depresión é de valor, posto que a depresión pode aparecer de xeito concomitante co alzhéimer, ou ben ser a causa dos trastornos cognitivos.[112][113]
Nos casos en que estean dispoñibles imaxes neurolóxicas especializadas, como a TEP ou a tomografía de fotón único, poden servir para confirmar o diagnóstico do alzhéimer xunto coas avaliacións do status mental do individuo.[114] A capacidade dunha tomografía computarizada por emisión de fotón único, para distinguir entre o alzhéimer e outras posibles causas en alguén que xa foi diagnosticado de demencia, parece ser superior aos intentos de diagnóstico mediante exames mentais e a historia do paciente.[115] Unha nova técnica, coñecida como PiB PET, desenvolveuse para tomar imaxes, directamente e de forma clara, dos depósitos beta-amiloides in vivo, co uso dun radiofármaco que se une selectivamente aos depósitos Aβ.[116] Outro marcado obxectivo recente da enfermidade de Alzheimer é a análise do líquido cefalorraquídeo en busca de amiloides beta ou proteínas tau.[117] Ambos avances da imaxe médica derivaron en propostas para cambiar os criterios diagnósticos.[102][118]
Tratamento[editar | editar a fonte]
O tratamento busca confortar o paciente e retardar o máximo posíbel a evolución da doenza. Algunhas drogas son útiles no inicio, e a súa dose debe personalizarse. Son os inhibidores da acetilcolinesterase, medicacións que inhiben a encima responsábel da degradación da acetilcolina producida e liberada por un núcleo na base do cerebro (núcleo basal de Meynert). A deficiencia de acetilcolina considérase epifenómeno da doenza de Alzheimer, mais non é o único evento bioquímico/fisiopatolóxico que ocorre. Máis recentemente, un grupo de medicacións coñecido como inhibidores dos receptores do tipo NMDA(N-Metil-D-Aspartato) do glutamato entrou no mercado. A memantina é tal droga, e a súa acción dáse pola inhibición da ligazón do glutamato, neurotransmisor excitatorio do sistema nervioso central aos seus receptores. O glutamato é responsábel das reaccións de excitotoxicidade con liberación de radicais libres e lesións de tecidos e neuronas.
Contorna social[editar | editar a fonte]
O avance da enfermidade pode ser máis rápido ou máis lento en función da contorna da persoa con alzhéimer. Os posibles factores sociais que poden acelerar o avance da enfermidade son o estrés na contorna familiar, escasa actividade intelectual ou a vida sedentaria. Por outra banda, un bo ambiente familiar, unha dieta axeitada, o exercicio e a socialización con outras persoas poden axudar a atrasar a aparición e avance da enfermidade.[119][120]
Tratamentos farmacolóxicos[editar | editar a fonte]
Probouse a eficacia de fármacos anticolinesterásicos que teñen unha acción inhibidora da colinesterase, a encima encargada de descompoñer a acetilcolina (neurotransmisor que falta na enfermidade de Alzheimer e que incide substancialmente na memoria e outras funcións cognitivas). Incorporáronse ao tratamento da enfermidade novos fármacos que interveñen na regulación da neurotransmisión glutaminérxica. Con todo isto mellorouse o comportamento do enfermo en canto á apatía, a iniciativa, a capacidade funcional e as alucinacións, mellorando a súa calidade de vida. Dende o ano 2008 a melloría obtida con devanditos fármacos é discreta, é dicir, non se conseguiu alterar o curso da demencia subxacente.[121][122]
O primeiro fármaco anticolinesterásico comercializado foi a tacrina, que deixouse de empregarse pola súa hepatotoxicidade. En 2008, en Europa e Norteamérica existían 4 fármacos dispoñibles, tres deles son inhibidores da acetilcolinesterase: donepezila (comercializado como Aricept),[123] rivastigmina (comercializado como Exelon o Prometax)[124] incluiendo o parche de Exelon,[125] e galantamina (comercializado como Reminyl).[126]
Os tres presentan un perfil de eficacia similar con parecidos efectos secundarios. Estes últimos adoitan ser alteracións gastrointestinais, anorexia e trastornos do ritmo cardíaco. O cuarto medicamento é un antagonista dos receptores NMDA, a memantina. Ningún dos catro é indicado para retardar ou deter o progreso da enfermidade.[121][122]
A redución na actividade das neuronas colinérxicas é unha das características recoñecidas da enfermidade de Alzheimer.[127] Os inhibidores da acetilcolinesterase empréganse para reducir a taxa de degradación da acetilcolina, mantendo así concentracións adecuadas do neurotransmisor no cerebro e detendo a súa perda causada pola morte das neuronas colinérxicas.[128] Existen evidencias de que estes medicamentos teñen eficacia nas etapas leves e moderadas da enfermidade,[129] aínda que un pouco menos de que sexan útiles na fase avanzada. Só a donepezila aprobouse para este estado da demencia.[122] O uso destes fármacos nos trastornos cognitivos leves non mostrou ser capaz de retardar a aparición do alzhéimer.[130] Os efectos adversos máis comúns inclúen náuseas e vómitos, ambos ligados ao exceso colinérxico que deles deriva. Estes efectos aparecen entre un 10 e un 20% aproximadamente dos tratados e teñen severidade leve a moderada. Entre os efectos secundarios menos frecuentes figuran cambras musculares, diminución da frecuencia cardíaca, diminución do apetito e do peso corporal e un incremento na produción de zume gástrico.[131]
A memantina é un fármaco cun mecanismo de acción diferente,[132] que está indicado nas fases moderadas e avanzadas da enfermidade. O seu mecanismo de acción teórico baséase en antagonizar os receptores NMDA glutaminérxicos, usado nun principio como un axente antigripal.[133] O glutamato é un neurotransmisor excitatorio do sistema nervioso central. Ao parecer, un exceso de estimulación glutaminérxica podería producir ou inducir unha serie de reaccións intraneuronais de carácter tóxico, causando a morte celular por un proceso chamado excitotoxicidade, que consiste nunha sobreestimulación dos receptores do glutamato. Esta excitotoxicidade non só ocorre en pacientes con alzhéimer, senón tamén noutras enfermidades neurodexenerativas, como a enfermidade de Parkinson e a esclerose múltiple.[133] Os ensaios clínicos demostraron unha eficacia moderada nestes pacientes e un perfil de efectos secundarios aceptable. No 2005 aprobouse tamén a súa indicación en fases moderadas da enfermidade, pero os efectos nas fases iniciais son aínda descoñecidos.[134] Os efectos adversos da memantina son infrecuentes e leves e inclúen alucinacións, confusión, mareos, dor de cabeza e fatiga.[135] A combinación de memantina e donepezila mostrou ser estadísticamente significativa pero marxinalmente exitosa desde o punto de vista clínico.[136]
Ademais existen fármacos que melloran algúns dos síntomas que produce esta enfermidade, entre os que se atopan ansiolíticos, hipnóticos, neurolépticos e antidepresivos. Os fármacos antipsicóticos indícanse para reducir a agresión e a psicose en pacientes con alzhéimer que teñen problemas de conduta, pero úsanse con moderación e non de forma rutineira por razón dos serios efectos secundarios, como eventos cerebrovasculares, trastornos extrapiramidais e unha redución cognitiva.[137]
Intervención psicosocial[editar | editar a fonte]
Existen certas evidencias de que a estimulación das capacidades cognitivas axuda a ralentizar a perda destas funcións e habilidades. Esta estimulación consiste en traballar aquelas áreas que aínda conserva o paciente, de forma que o adestramento permita compensar as perdas que o paciente está sufrindo coa enfermidade.[138]
As intervencións psicosociales úsanse conxuntamente co tratamento farmacolóxico e clasifícanse en abordaxes orientadas ao comportamento, as emocións, o cognitivo e a estimulación. As investigacións sobre a efectividade destas intervencións aínda non se atopan dispoñibles e, de feito, de cando en cando son específicas ao alzhéimer, enfocándose na demencia en xeral.[139]
As intervencións na área do comportamento intentan identificar e reducir os antecedentes e consecuencias dos problemas da conduta. Esta abordaxe non mostrou éxito en mellorar o funcionamento xeral do paciente, en especial en relación coa súa contorna,[140] pero puido axudar a reducir certos problemas específicos do comportamento, como a incontinencia urinaria.[141] Seguen faltando datos de calidade sobre a efectividade destas técnicas noutros problemas como as deambulacións do paciente.[142][143]
As intervencións orientadas ás emocións comprenden a terapia de validación, a terapia de reminiscencia, a psicoterapia de apoio, a integración sensorial (tamén denominada snoezelen) e a terapia de presenza estimuladora. A psicoterapia de apoio tivo pouco estudo científico formal, pero algúns especialistas atópana de utilidade en pacientes con trastornos leves.[139] A terapia de reminiscencia inclúe a discusión de experiencias do pasado de xeito individual ou en grupo, moitas veces coa axuda de fotografías, obxectos do fogar, música e gravacións ou outras pertenenzas do pasado. Nesta terapia, igualmente, non hai moitos estudos de calidade sobre a súa efectividade, aínda que pode resultar beneficiosa para a reestruturación cognitiva e o humor.[144] O tratamento con presenzas estimuladas baséase nas teorías da adherencia e implica escoitar voces gravadas dos familiares e seres máis próximos do paciente con alzhéimer. As evidencias preliminares indican que ditas actividades reducen a ansiedade e os comportamentos desafiantes.[145][146]
Finalmente, a terapia de validación baséase na aceptación da realidade e a experiencia persoal doutras persoas, mentres que a integración sensorial baséase en exercicios guiados que estimulan os sentidos. Aínda non hai suficientes evidencias que apoien o uso destas terapias en pacientes con alzhéimer.[147][148]
A finalidade das terapias cognitivo-condutuais, que inclúen a orientación e a rehabilitación cognitiva, é reducir as distorsións cognitivas. A orientación cara á realidade consiste en presentar información achega da época, o lugar ou a persoa, co fin de aliviar o seu entendemento achega dos seus arredores e o lugar que eles desempeñan en devanditos sitios. Doutra banda, o adestramento cognitivo intenta mellorar as capacidades debilitadas ao exercitar as habilidades mentais do paciente. Ambos exercicios mostraron certa efectividade no melloramento das capacidades cognitivas.[149][150]
Con todo, nalgúns estudos, estes efectos foron transitorios e noutros tiñan un efecto negativo, pois engadían frustración ao paciente, segundo os resultados.[139]
Os tratamentos orientados á estimulación inclúen a arteterapia, a musicoterapia e as terapias asistidas por mascotas, o exercicio físico e calquera actividade recreativa. A estimulación ten apoio modesto ao ser aplicada coa intención de mellorar a conduta, o humor e, en menor grado, o funcionamento do paciente. Aínda que son efectos importantes, o principal beneficio reportado entre as terapias de estimulación é o melloramento nas rutinas da vida diaria do paciente.[139]
Coidados[editar | editar a fonte]
Debido a que o alzhéimer non ten cura, co tempo o paciente cae nun estado de imposibilidade de autosuficiencia para coidar de el mesmo, polo que os coidados por terceiros son unha medida vital para esa deficiencia e deben ser abordados coidadosamente durante o curso da enfermidade.
Nas fases primeiras e moderadas, as modificacións ao ambiente onde vive o paciente e ao seu estilo de vida, poden darlle seguridade e reducirlle as cargas ao coidador.[151][152] Algúns exemplos de devanditas modificacións son a adherencia a rutinas simplificadas, como son a colocación de cadeados, o uso dunha pulsera co número de teléfono do coidador (ou solucións máis avanzadas como un localizador por GPS), o etiquetado dos obxectos do fogar e o uso de utensilios modificados para a vida diaria.[139][153][154] Pode chegar o punto en que o paciente non sexa capaz de alimentarse a si mesmo, de modo que debe empezar a inxerir os seus alimentos en porcións máis pequenas ou en dietas non sólidas coa axuda doutras persoas.[155] Cando apareza unha dificultade para tragar, poida que sexa indicado o uso de sondas gástricas. En tales casos, a efectividade médica e ética de ter que continuar alimentando ao paciente son consideracións importantes que deben tomar os coidadores e os familiares do individuo.[156][157] As restricións físicas de cando en cando están indicadas en calquera fase da enfermidade, aínda que hai situacións en que son necesarias para previr que o paciente con alzhéimer se dane a el mesmo ou a terceiros.[139]
A medida que progresa a enfermidade, poden aparecer distintas manifestacións médicas, como as enfermidades orais e dentais, úlceras de presión, desnutrición, problemas de hixiene ou infeccións respiratorias, urinarias, dermatolóxicas ou oculares, entre outras. O manexo coidadoso do paciente pode previr devanditos problemas, pero se chegan a producirse, deben ser tratados baixo supervisión médica.[97][158] Durante as etapas finais da enfermidade, o tratamento céntrase en manter a calidade de vida ata o falecemento.[159]
Tratamentos en fase de investigación[editar | editar a fonte]
Vacinas[editar | editar a fonte]
Igualmente estanse realizando experimentos con vacinas, baseados na idea de que se o sistema inmune pode ser adestrado para recoñecer e atacar a placa beta-amiloide, podería revertirse a deposición de amiloide e parar a enfermidade. Os resultados iniciais en animais foron prometedores. Con todo, cando as primeiras vacinas se probarón en seres humanos no 2002, produciuse inflamación cerebral, (meningoencefalite), nunha pequena proporción dos participantes no estudo, polo que se detiveron as probas. Continuouse estudando aos participantes e observouse unha mellora na lentitude do progreso da enfermidade. Recentemente descubriuse que a inflamación cerebral estaba producida por unha serie de péptidos que se incluían coa vacina AN-179, polo que se está investigando na creación dunha vacina que non teña devanditos péptidos na súa composición.
Estase probando unha vacina a ABvac40, como preventiva contra o alzhéimer desde o 2014. O seu obxectivo, é deter a produción de placas amiloides. A vacina produciría anticorpos encargados de eliminar os beta amiloides 40 e 42, que son os causantes da neurodexeneración cerebral. Os ensaios da vacina realizaranse sobre un total de 24 persoas: 16 pacientes diagnosticados e en estadio leve e oito pacientes que reciben placebo. Con todo de acreditarse a súa inocuidade, a vacina non estará no mercado antes do 2018.
Ultrasón[editar | editar a fonte]
En marzo de 2015 publicouse na revista científica Science-Translational Medicine unha aproximación completamente nova ao tema alzhéimer, que foi probada en ratos.[160] A mesma utiliza un xeito particular de aplicar ultrasón, dentro do tecido gris cerebral. Estas ondas de son resultaron capaces de abrir xentilmente a barreira hematoencefálica, que separa ao cerebro do sangue, e estimularon ás células de Hortega ou microglía. Estas células microgliales, unha vez activadas, resultaron capaces de ir desintegrando e eliminando as aglutinacións beta-amiloides do alzhéimer. Os autores da investigación informaron observar a restauración completa das memorias no 75% dos ratos nos que ensaiaron. Acharon que os ratos así tratados despregaron melloras da memoria en tres probas específicas. O equipo científico planea iniciar probas con animais de laboratorio superiores, como ovellas e simios, e espera ser autorizado a poñer en marcha ensaios sobre seres humanos no 2017.[161]
Pola súa banda, nas aproximaciones clínicas clásicas (farmacolóxicas), un estudo do 2014 afirmaba que nos ratos o antidepresivo citalopram detivo o crecemento das placas beta amiloides da enfermidade de Alzheimer existentes e reduciu a formación de novas placas nun 78%. Nun segundo experimento, os científicos administraron unha dose única de citalopram a 23 persoas de entre 18 e 50 anos que non estaban cognitivamente deterioradas nin padecían depresión. Cando obtiveron mostras de líquido cefalorraquídeo ás 24 horas, observaron unha redución do 37% na produción da proteína beta-amiloide.[162][163]
Se esta enfermidade está relacionada coa resistencia á insulina, preséntanse múltiples alternativas terapéuticas. Estase evaluando actualmente o uso de medicamentos empregados no tratamento da diabetes. Estudos recentes mostran que a administración de insulina por vía intranasal mellora a función cognitiva de pacientes normais e con alzhéimer.[Cómpre referencia] Unha revisión sistemática dos ensaios clínicos ata agora desenvolvidos mostra resultados esperanzadores. Por outra banda, propúxose o emprego de técnicas de indución enzimática, con enzimas activas pola insulina.[Cómpre referencia]
Células nai[editar | editar a fonte]
Outra das áreas de investigación é a medicina rexenerativa. Trátase de inxectar no cerebro do paciente células nai embrionarias ou adultas para intentar deter a deterioración cognitiva. Xa se fixeron experimentos en humanos con resultados positivos.[Cómpre referencia]
Marcapasos cerebral[editar | editar a fonte]
A estimulación cerebral intenta normalizar a actividade, cun dispositivo chamado neuroestimulador, similar a un marcapasos cardíaco. O dispositivo forma parte dun tratamento chamado estimulación cerebral profunda (ECP), que involucra a liberación de impulsos eléctricos para regular a actividade cerebral. A investigación, levada a cabo na Escola de Medicina Johns Hopkins, forma parte dun proxecto máis amplo iniciado no Canadá, onde xa se implantou o marcapasos a seis pacientes coa enfermidade. O tratamento logrou que os pacientes —todos con formas moderadas de alzhéimer— mostrasen un incremento na actividade neuronal durante 13 meses.
A terapia de estimulación cerebral profunda utilizouse con persoas que sofren a enfermidade de Parkinson. Agora, a terapia podería ser unha alternativa para reverter a deterioración cognitiva das persoas con alzhéimer. Esta neurocirurxiá funcional, busca reparar, modular ou corrixir un déficit nun sistema ou rede neurolóxica determinada. O que ocorre co alzhéimer é que se altera a química cerebral e isto conduce a unha actividade eléctrica anormal que pode expresarse en tremores, deterioración cognitiva ou trastornos psiquiátricos. A aplicación para o alzhéimer aínda está nas súas primeiras etapas.[164]
Prevención[editar | editar a fonte]

Os estudos globais sobre as diferentes medidas que se poden tomar para previr ou retardar a aparición da enfermidade de Alzheimer teñen resultados contraditorios e non se comprobou aínda unha relación causal entre os factores de risco e a enfermidade, nin se atribuíron a efectos secundarios específicos. Polo momento, non parece haber medidas definitivas para previr a aparición do alzhéimer.[165]
Varios estudos epidemiolóxicos propuxeron diversas relacións entre certos factores modificables, tales como a dieta, os riscos cardiovasculares, produtos farmacéuticos ou as actividades intelectuais entre outros, e a probabilidade de que nunha poboación apareza o alzhéimer. Por agora necesítanse máis investigacións e ensaios clínicos para comprobar se estes factores axudan a previla.[166]
Os compoñentes dunha dieta mediterránea, que comprende froitas e vexetais, pan, cebada e outros cereais, aceite de oliva, peixes e viño tinto, poden reducir de xeito individual ou colectiva o risco e o curso da enfermidade de Alzheimer.[167] Varias vitaminas, tales como a vitamina B12, B3, C ou o ácido fólico, parecen estar relacionadas cunha redución do risco de alzheimer.[168] Con todo, outros estudos indicaron que non teñen un efecto significativo no desenvolvemento ou o curso da enfermidade, ademais de que poden causar efectos secundarios importantes.[169]
A curcumina do curry mostrou en estudos do 2001 e 2007 certa eficacia na prevención de dano cerebral en modelos de ratos.[170]
Similares propiedades comunicáronse en 2010 e 2012 para ensaios en ratos da Withania somnifera (ashwagandha, ginseng indio).[171] [172]
A pesar de que os riscos cardiovasculares, como a hipercolesterolemia, hipertensión arterial, a diabetes e o tabaquismo, están asociados a un maior risco de desenvolvemento e progresión do alzheimer,[173][174] as estatinas, que son medicamentos que diminúen a concentración de colesterol no plasma sanguíneo, non foron efectivas na prevención ou melloramento do alzheimer.[175][176] Con todo, nalgúns individuos, o uso a longo prazo dos antiinflamatorios non esteroideos (AINEs) está vinculado cunha redución da probabilidade de padecela.[177] Outros fármacos e terapias, como a substitución de hormonas nas mulleres, deixaron de ser aconselladas como medidas preventivas do alzheimer.[178][179] Inclúese tamén un informe en 2007 que concluíu a falta de evidencias significativas e a presenza de inconsistencias no uso de ginkgo biloba para mellorar os trastornos cognitivos.[180]
Hai diferentes actividades intelectuais, como xogar o xadrez, go, a lectura, o completar encrucillados ou as interaccións sociais frecuentes, que parecen retardar a aparición e reducir a gravidade do alzheimer.[181][182] O falar varios idiomas tamén parece estar vinculado á aparición tardía da enfermidade.[183]
Notas[editar | editar a fonte]
- ↑ "Alzéimer". Dicionario da Real Academia Galega. Consultado o 7 de setembro de 2015.
- ↑ 2,0 2,1 As fontes indican que os enfermos de alzhéimer teñen unha esperanza de vida despois do diagnóstico entre:
- 10 anos: Muñoz Chacón, Yalile (xuño de 2003). "Demencia, el reto del presente siglo" (en castelán) 45 (2). Acta médica Costarricense. OCLC 54107198. Consultado o 2 de xaneiro de 2010.
- 8-10 anos: "La enfermedad de Alzheimer en el año 2000". Rev Panam Salud Publica (en castelán) 10 (4): 268–276. 2001. ISSN 1020-4989. doi:10.1590/S1020-49892001001000012. Consultado o 3 de xaneiro de 2010.
- 7-9 anos: Donoso S, Archibaldo; Behrens P., María Isabel (2005). "Variabilidad y variantesde la enfermedad de Alzheimer". Revista médica de Chile (en castelán) 133 (4): 477–482. ISSN 0034-9887. doi:10.4067/S0034-98872005000400013. Consultado o 2 de xaneiro de 2010.
- 7-8 anos: Donoso S, Archibaldo (2003). "La enfermedad de Alzheimer". Rev. chil. neuro-psiquiatr. (en castelán) (Santiago de Chile) 41 (2). ISSN 0717-9227. doi:10.4067/S0717-92272003041200003. Consultado o 28 de xullo de 2013.
- ↑ Brookmeyer R.; Gray S.; Kawas C. (1998). "Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset". American Journal of Public Health (en inglés) 88 (9): 1337–1342. PMC 1509089. PMID 9736873. doi:10.2105/AJPH.88.9.1337.
- ↑ Kraepelin, E. (1910). Psychiatrie: Ein Lehrbuch für Studierende und Ärzte. II. Band Klinische Psychiatrie. 1. Teil (8ª ed.). Leipzig: Barth Verlag.
- ↑ A. Alzheimer. (1907). Allg. Z. Psychiatr'. pp. 64,146.
- ↑ A. Alzheimer. Z. Ges. Neurol. Psychiat. 4, 356 (1911)
- ↑ 7,0 7,1 7,2 Berchtold N.C.; Cotman C.W. (1998). "Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s". Neurobiol. Aging (en inglés) 19 (3): 173–189. PMID 9661992. doi:10.1016/S0197-4580(98)00052-9.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 Waldemar G.; Dubois B.; Emre M. (2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". Eur. J. Neurol. (en inglés) 14 (1): e1–26. PMID 17222085. doi:10.1111/j.1468-1331.2006.01605.x.
- ↑ "Alzheimer's diagnosis of AD". Alzheimer's Research Trust (en inglés). Arquivado dende o orixinal o 22 de outubro de 2007. Consultado o 29 de febreiro de 2008.
- ↑ Tabert MH; Liu X; Doty RL; Serby M; Zamora D; Pelton GH; Marder K; Albers MW; Stern Y; Devanand DP (2005). "A 10-item smell identification scale related to risk for Alzheimer's disease". Ann. Neurol. (en inglés) 58 (1): 155–160. PMID 15984022. doi:10.1002/ana.20533.
- ↑ "Understanding stages and symptoms of Alzheimer's disease". National Institute on Aging (en inglés). 26 de outubro de 2007. Arquivado dende o orixinal o 16 de maio de 2008. Consultado o 21 de febreiro de 2008.
- ↑ Mölsä PK; Marttila RJ; Rinne UK (1986). "Survival and cause of death in Alzheimer's disease and multi-infarct dementia". Acta Neurol Scand (en inglés) 74 (2): 103–107. PMID 3776457. doi:10.1111/j.1600-0404.1986.tb04634.x.
- ↑ Mölsä PK; Marttila RJ; Rinne UK (1995). "Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia". ActaNeurol Scand (en inglés) 91 (3): 159–164. PMID 7793228.
- ↑ Kellett, KA; Hooper, NM (2009). "Prion protein and Alzheimer disease". Prion (en inglés) 3 (4): 190–194. PMC 2807690.
- ↑ 15,0 15,1 15,2 Tiraboschi P; Hansen LA; Thal LJ; Corey-Bloom J (2004). "The importance of neuritic plaques and tangles to the evelopment and evolution of AD". Neurology (en inglés) 62 (11): 1984–9. PMID 15184601.
- ↑ "Alzheimer's Disease Clinical Trials". US National Institutes of Health (en inglés). Consultado o 18 de agosto de 2008.
- ↑ "Can Alzheimer's disease be prevented" (PDF). National Institute on Aging (en inglés). 29 de agosto de 2006. Arquivado dende o orixinal (PDF) o 02 de outubro de 2006. Consultado o 29 de febreiro de 2008.
- ↑ "The MetLife study of Alzheimer's disease: The caregiving experience" (PDF). MetLife Mature Market Institute (en inglés). 2006. Arquivado dende o orixinal (PDF) o 25 de xuño de 2008. Consultado o 12 de febreiro de 2008.
- ↑ Thompson CA; Spilsbury K; Hall J; Birks Y; Barnes C; Adamson J (2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC Geriatr (en inglés) 7: 18. PMC 1951962. PMID 17662119. doi:10.1186/1471-2318-7-18.
- ↑ Schneider J; Murray J; Banerjee S; Mann A (1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden". International Journal of Geriatric Psychiatry 14 (8): 651–661. PMID 10489656. doi:10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B.
- ↑ Murray J; Schneider J; Banerjee S; Mann A (1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving". International Journal of Geriatric Psychiatry 14 (8): 662–667. PMID 10489657. doi:10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4.
- ↑ "About World Alzheimer's Month". Alzheimer's Disease International (en inglés). Consultado o 7 de setembro de 2015.
- ↑ Filloy, Laura (2023-11-16). "Sonia Villapol: "En 2050 os pacientes de alzhéimer vanse multiplicar por cinco"". GCiencia. Consultado o 2023-11-17.
- ↑ 24,0 24,1 24,2 24,3 Auguste D.:
- Alzheimer Alois (1907). "Über eine eigenartige Erikrankung der Hirnrinde" [Sobre unha peculiar enfermidade da cortiza cerebral]. Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin (en alemán) 64 (1–2): 146–148.
- Alzheimer Alois (1987). Traducido por L. Jarvik e H. Greenson. "About a peculiar disease of the cerebral cortex". Alzheimer Dis Assoc Disord (en inglés) 1 (1): 3–8. PMID 3331112.
- Maurer Ulrike; Maurer Konrad (2003). Alzheimer: the life of a physician and the career of a disease (en inglés). Nova York: Columbia University Press. p. 270. ISBN 0-231-11896-1.
- ↑ "Alois Alzheimer". Who Named It? (en inglés). Consultado o 21 de outubro de 2011.
- ↑ 26,0 26,1 26,2 Katzman Robert; Terry Robert D; Bick Katherine L, eds. (1978). Alzheimer's disease: senile dementia and related disorders (en inglés). Nova York: Raven Press. ISBN 0-89004-225-X.
- ↑ Berrios G E (1990). "Alzheimer's disease: a conceptual history". Int. J. Ger. Psychiatry (en inglés) 5: 355–365. doi:10.1002/gps.930050603.
- ↑ Kraepelin Emil (2007). Clinical Psychiatry: A Textbook For Students And Physicians. Traducido por Diefendorf A. Ross. Kessinger Publishing. ISBN 1-4325-0833-4.
- ↑ Boller F; Forbes MM (1998). "History of dementia and dementia in history: an overview". J. Neurol. Sci. (en inglés) 158 (2): 125–133. PMID 9702682. doi:10.1016/S0022-510X(98)00128-2.
- ↑ Giancarlo LA; Rocca WA; Schoenberg BS (1986). "Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosolog". Neurology (en inglés) 62 (41): 1497–9. PMID 3531918.
- ↑ "21 de septiembre, Día Mundial del Alzheimer" (en castelán). Consultado o 2022-11-20.
- ↑ 32,0 32,1 Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (2008). "Incidence and subtypes of dementia in three elderly populations of central Spain". J. Neurol. Sci. (en inglés) 264 (1-2): 63–72. PMID 17727890. doi:10.1016/j.jns.2007.07.021.
- ↑ 33,0 33,1 Di Carlo A, Baldereschi M, Amaducci L; et al. (2002). "Incidence of dementia, Alzheimers disease, and vascular dementia in Italy. The ILSA Study". J Am Geriatr Soc (en inglés) 50 (1): 41–48. PMID 12028245.
- ↑ Andersen K, Launer LJ, Dewey ME; et al. (1999). "Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group". Neurology 53 (9): 1992–7. PMID 10599770.
- ↑ Estimacións para 2000 U.S.A.:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (2003). "Alzheimer disease in the US population: prevalence estimates using the 2000 census". Arch. Neurol. (en inglés) 60 (8): 1119–22. PMID 12925369. doi:10.1001/archneur.60.8.1119.
- U.S. Census Bureau, ed. (2001). "Profiles of general demographic characteristics, 2000 census of population and housing, United States" (PDF) (en inglés). Consultado o 27 de agosto de 2008.
- ↑ 36,0 36,1 Ferri, CP,; Prince, M.; Brayne, C.; Brodaty, H.; Fratiglioni, L.; Ganguli, M.; Hall, K.; Hasegawa, K.; Hendrie, H.; Huang, Y.; Jorm, A.; Mathers, C.; Menezes, PR.; Rimmer, E.; Scazufca, M. (2005). "Global prevalence of dementia: a Delphi consensus study" (PDF). The Lancet (en inglés) (Alzheimer's Disease International) 366 (9503): 2112–7. PMID 16360788. doi:10.1016/S0140-6736(05)67889-0. Arquivado dende o orixinal (PDF) o 25 de xuño de 2008. Consultado o 13 de xullo de 2008.
- ↑ Neurological Disorders: Public Health Challenges (en inglés). Suíza: World Health Organization. 2006. pp. 204–207. ISBN 978-92-4-156336-9.
- ↑ World Alzheimer Report 2010: The Global Economic Impact of Dementia (PDF) (en inglés). Irlanda: Alzheimer's Disease International. 2010. p. 56.
- ↑ Estimacións para 2007:
- Brookmeyer R, Johnson E, Ziegler-Graham K, MH Arrighi (2007). "Forecasting the global burden of Alzheimer’s disease". Alzheimer's and Dementia (en inglés) 3 (3): 186–191. doi:10.1016/j.jalz.2007.04.381. Arquivado dende o orixinal o 07 de decembro de 2008. Consultado o 18 de xullo de 2008.
- "World population prospects: the 2006 revision, highlights" (PDF) (en inglés). Population Division, Department of Economic and Social Affairs, United Nations. 2007. Arquivado dende o orixinal (PDF) o 19 de agosto de 2008. Consultado o 27 de agosto de 2008.
- ↑ Shen ZX (2004). "Brain cholinesterases: II. The molecular and cellular basis of Alzheimer's disease". Med. Hypotheses (en inglés) 63 (2): 308–321. PMID 15236795. doi:10.1016/j.mehy.2004.02.031.
- ↑ 41,0 41,1 Wenk GL (2003). "Neuropathologic changes in Alzheimer's disease". J Clin Psychiatry (en inglés) 64 (9): 7–10. PMID 12934968.
- ↑ Hardy J, Allsop D (1991). "Amyloid deposition as the central event in the aetiology of Alzheimer's disease". Trends Pharmacol. Sci. (en inglés) 12 (10): 383–388. PMID 1763432.
- ↑ Mudher A, Lovestone S (2002). "Alzheimer's disease-do tauists and baptists finally shake hands?". Trends Neurosci. 25 (1): 22–26. PMID 11801334.
- ↑ 44,0 44,1 Nistor M, Don M, Parekh M; et al. (2007). "Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain". Neurobiol. Aging (en inglés) 28 (10): 1493–1506. PMID 16904243. doi:10.1016/j.neurobiolaging.2006.06.023.
- ↑ Lott IT, Head E (2005). "Alzheimer disease and Down syndrome: factors in pathogenesis". Neurobiol. Aging 26 (3): 383–389. PMID 15639317. doi:10.1016/j.neurobiolaging.2004.08.005.
- ↑ 46,0 46,1 Small D, Klaver D, Foa L. (2010). "Presenilins and the γ-secretase: still a complex problem". Mol Brain. (en inglés): 1–6. PMC 2845129. doi:10.1186/1756-6606-3-7.
- ↑ 47,0 47,1 García S, Vázquez R, Dávalos E, Castillo J, Martínez S, Ortiz A. (2009). "Enfermedad de Alzheimer: una panorámica de su primera descripción hacia una perspectiva molecular". Med Int Mex. (en castelán) 25: 300–312. PSEN2.
- ↑ 48,0 48,1 Vetrivel K, Zhang Y, Xu H, Thinakaran G. (2006). "Physiological and pathologycal functions of presenilines". J Mol Neurosci. (en inglés) 1: 1–12. PMC 1513131. doi:10.1186/1750-1326-1-4.
- ↑ Perez N, Menendez S, Rodriguez J. (2002). "inas, Apo E y enfermedad de Alzheimer.". Rev Cuba Inve Biom. (en castelán) 21: 262–269.
- ↑ Bekris L, Yu C, Bird T, Tsuang D. (2010). "Genetics of Alzheimer Disease". J Geri Psyc Neur. (en inglés) 23: 213–227. PMC 3044597. doi:10.1177/0891988710383571.
- ↑ Crews L, Masliah E. (2010). "Molecular mechanisms of neurodegeneration in Alzheimer’s disease.". Hum Mol Genet. (en inglés): 2–9. PMC 2875049. PMID 20413653.
- ↑ 52,0 52,1 Theuns J, Del-Favero J, Dermaut B, van Duijin C, Backhovens H, Van den Broeck M; et al. (2009). "Genetic variability in the regulatory region of presenilin 1 associated with risk for Alzheimer’s disease and variable expression". Hum Mol Genet. (en inglés) 9: 325–331. doi:10.1093/hmg/9.3.325.
- ↑ Tandun A, Fraser P (2002). "The presenilines". Geno Biol (en inglés) 3: 1–9. PMC 244923. PMID 12429067.
- ↑ Sherrington R, Froelich S, Sorbi S, Campion D, Chi H, Rogaeval EA; et al. (1996). "Alzheimer’s disease associated with mutations in presenilin 2 is rare and variably penetrant". Hum Mol Genet. (en inglés) 5: 985–988. PMID 8817335.
- ↑ Levy-Lahad E, Wasco W, Poorkaj P, Romano DM, Oshima J, Pettingell WH; et al. (1995). "Candidate gene for the chromosome 1 familial Alzheimer’ disease locus". Science (en inglés) 269: 973–977. PMID 7638622.
- ↑ Polvikoski T, Sulkava R, Haltia M; et al. (1995). "Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein". N. Engl. J. Med. (en inglés) 333 (19): 1242–47. PMID 7566000.
- ↑ Ratos trasxénicos:
- Games D, Adams D, Alessandrini R; et al. (1995). "Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein". Nature (en inglés) 373 (6514): 523–527. PMID 7845465. doi:10.1038/373523a0.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (1996). "Comparison of neurodegenerative pathology in transgenic mice overexpressing V717F beta-amyloid precursor protein and Alzheimer's disease". J. Neurosci. (en inglés) 16 (18): 5795–811. PMID 8795633.
- Hsiao K, Chapman P, Nilsen S; et al. (1996). "Correlative memory deficits, Abeta elevation, and amyloid plaques in transgenic mice". Science (journal) (en inglés) 274 (5284): 99–102. PMID 8810256.
- ↑ Holmes C, Boche D, Wilkinson D; et al. (2008). "Long-term effects of Abeta42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial". Lancet (en inglés) 372 (9634): 216–223. PMID 18640458. doi:10.1016/S0140-6736(08)61075-2.
- ↑ Schmitz C, Rutten BP, Pielen A; et al. (2004). "Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer's disease". Am. J. Pathol. (en inglés) 164 (4): 1495–1502. PMC 1615337. PMID 15039236.
- ↑ Goedert M, Spillantini MG, Crowther RA (1991). "Tau proteins and neurofibrillary degeneration". Brain Pathol. (en inglés) 1 (4): 279–286. PMID 1669718.
- ↑ Chun W, Johnson GV (2007). "The role of tau phosphorylation and cleavage in neuronal cell death". Front. Biosci. (en inglés) 12: 733–756. PMID 17127334.
- ↑ Stewart R; Liolitsa D. (1999). "Type 2 diabetes mellitus, cognitive impairment and dementia". Diabet Med (en inglés) 16 (2): 93–112. PMID 10229302.
- ↑ Diabete e alzhéimer:
- Biessels GJ; Kappelle LJ (2005). "Increased risk of Alzheimer's disease in Type II diabetes: insulin resistance of the brain or insulin-induced amyloid pathology?". Biochem Soc Trans. (en inglés) (Utrecht Diabetic Encephalopathy Study Group) 33 (5): 1041–4. PMID 16246041.
- Pasquier F, Boulogne A, Leys D, Fontaine P. (2006). "Diabetes mellitus and dementia". Diabetes Metab (en inglés) 32 (5): 403–14. PMID 17110895.
- Reed BR, Mungas DM, Kramer JH, Ellis W, Vinters HV, Zarow C, Jagust WJ, Chui HC (2007). "Profiles of neuropsychological impairment in autopsy-defined Alzheimer's disease and cerebrovascular disease.". Brain (en inglés) 130 (3): 731–9. PMID 17267522.
- ↑ Jagua A, Avila A. (2007). "Insulina y enfermedad de Alzhéimer: una diabetes tipo 3?". Rev Fac Med Univ Nac Colomb (en castelán) 55 (1): 6–70.
- ↑ Suay Llopis, Loreto; Ballester Díez, Ferran (2002). "Revisión de los estudios sobre exposición al aluminio y enfermedad de Alzheimer". Revista Española de Salud Pública (en castelán) (Ministerio de Sanidad y Consumo de España) 76 (6).
- ↑ Ferreira, Pricilla Costa; Piai, Kamila de Almeida; Takayanagui, Angela Maria Magosso; et al. (2008). "Aluminum as a risk factor for Alzheimer's disease". Rev. Latino-Am. Enfermagem (en inglés) 16 (1): 151–157. ISSN 0104-1169. doi:10.1590/S0104-11692008000100023.
- ↑ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). "Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital". Cereb. Cortex (en inglés) 4 (2): 138–50. PMID 8038565.
- ↑ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). "Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases". Neuromolecular Med. (en inglés) 4 (1-2): 21–36. PMID 14528050. doi:10.1385/NMM:4:1-2:21.
- ↑ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (2006). "Synapse formation and function is modulated by the amyloid precursor protein". J. Neurosci. (en inglés) 26 (27): 7212–21. PMID 16822978. doi:10.1523/JNEUROSCI.1450-06.2006.
- ↑ Turner PR, O'Connor K, Tate WP, Abraham WC (2003). "Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory". Prog. Neurobiol. (en inglés) 70 (1): 1–32. PMID 12927332.
- ↑ Hooper NM (2005). "Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein". Biochem. Soc. Trans. (en inglés) 33 (2): 335–8. PMID 15787600. doi:10.1042/BST0330335.
- ↑ Ohnishi S, Takano K (2004). "Amyloid fibrils from the viewpoint of protein folding". Cell. Mol. Life Sci. (en inglés) 61 (5): 511–24. PMID 15004691. doi:10.1007/s00018-003-3264-8.
- ↑ Hernández F, Avila J (2007). "Tauopathies". Cell. Mol. Life Sci. (en inglés) 64 (17): 2219–33. PMID 17604998. doi:10.1007/s00018-007-7220-x.
- ↑ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). "Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches". Neurodegener Dis (en inglés) 4 (5): 349–65. PMID 17622778. doi:10.1159/000105156.
- ↑ Yankner BA, Duffy LK, Kirschner DA (1990). "Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides". Science (en inglés) 250 (4978): 279–282. PMID 2218531.
- ↑ Chen X, Yan SD (2006). "Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease". IUBMB Life (en inglés) 58 (12): 686–694. PMID 17424907. doi:10.1080/15216540601047767.
- ↑ Greig NH, Mattson MP, Perry T; et al. (2004). "New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors". Ann. N. Y. Acad. Sci. (en inglés) 1035: 290–315. PMID 15681814. doi:10.1196/annals.1332.018.
- ↑ 78,0 78,1 78,2 78,3 78,4 Waring SC, Rosenberg RN (2008). "Genome-wide association studies in Alzheimer disease". Arch. Neurol. (en inglés) 65 (3): 329–334. PMID 18332245. doi:10.1001/archneur.65.3.329.
- ↑ Hoenicka J (2006). "Genes in Alzheimer's disease". Rev Neurol (en inglés) 42 (5): 302–05. PMID 16538594.
- ↑ Campion D, Dumanchin C, Hannequin D; et al. (1999). "Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum". Am. J. Hum. Genet. (en inglés) 65 (3): 664–670. PMC 1377972. PMID 10441572. doi:10.1086/302553.
- ↑ Selkoe DJ (1999). "Translating cell biology into therapeutic advances in Alzheimer's disease". Nature (en inglés) 399 (6738): A23–31. PMID 10392577.
- ↑ Strittmatter WJ, Saunders AM, Schmechel D; et al. (1993). "Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease". Proc. Natl. Acad. Sci. USA (en inglés) 90 (5): 1977–81. PMC 46003. PMID 8446617.
- ↑ Seripa D, Matera MG, Franceschi M; et al. (2008). "The RELN locus in Alzheimer's disease". J Alzheimers Dis. (en inglés) 14 (3): 335–44. PMID 18599960.
- ↑ 84,0 84,1 84,2 Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (2004). "Multiple cognitive deficits during the transition to Alzheimer's disease". J Intern Med (en inglés) 256 (3): 195–204. PMID 15324363. doi:10.1111/j.1365-2796.2004.01386.x.
- ↑ Nygård L (2003). "Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?". Acta Neurol Scand (en inglés) 179: 42–6. PMID 12603250. doi:10.1034/j.1600-0404.107.s179.8.x.
- ↑ 86,0 86,1 Arnáiz E, Almkvist O (2003). "Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease". Acta Neurol. Scand., Suppl. (en inglés) 179: 34–41. PMID 12603249. doi:10.1034/j.1600-0404.107.s179.7.x.
- ↑ Landes AM, Sperry SD, Strauss ME, Geldmacher DS (2001). "Apathy in Alzheimer's disease". J Am Geriatr Soc (en inglés) 49 (12): 1700–7. PMID 11844006. doi:10.1046/j.1532-5415.2001.49282.x.
- ↑ Petersen RC (2007). "The current status of mild cognitive impairment—what do we tell our patients?". Nat Clin Pract Neurol (en inglés) 3 (2): 60–1. PMID 17279076. doi:10.1038/ncpneuro0402.
- ↑ 89,00 89,01 89,02 89,03 89,04 89,05 89,06 89,07 89,08 89,09 89,10 89,11 89,12 89,13 89,14 89,15 89,16 89,17 89,18 89,19 89,20 89,21 89,22 Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". European Archives of Psychiatry and Clinical Neuroscience (en inglés) 249 (6): 288–290. PMID 10653284. doi:10.1007/s004060050101.
- ↑ Carlesimo GA, Oscar-Berman M (1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Neuropsychol Rev (en inglés) 3 (2): 119–69. PMID 1300219. doi:10.1007/BF01108841.
- ↑ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". International Psychogeriatrics (en inglés) 7 (3): 385–392. PMID 8821346. doi:10.1017/S1041610295002134.
- ↑ 92,0 92,1 Taler V, Phillips NA (2008). "Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review". J Clin Exp Neuropsychol (en inglés) 30 (5): 501–56. PMID 1856925. doi:10.1080/13803390701550128.
- ↑ 93,0 93,1 93,2 Frank EM (1994). "Effect of Alzheimer's disease on communication function". J S C Med Assoc (en inglés) 90 (9): 417–23. PMID 7967534.
- ↑ MedlinePlus (2008). "Úlcera de decúbito". Enciclopedia médica en español (en castelán). Consultado o 10 de setembro de 2008.
- ↑ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (2001). "Sundowning and circadian rhythms in Alzheimer's disease". Am J Psychiatry (en inglés) 158 (5): 704–11. PMID 11329390. Consultado o 27 de agosto de 2008.
- ↑ Gold DP, Reis MF, Markiewicz D, Andres D (1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". J Am Geriatr Soc (en inglés) 43 (1): 10–6. PMID 7806732.
- ↑ 97,0 97,1 Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (1999). "Predictors of mortality in patients with Alzheimer's disease living in nursing homes". J. Neurol. Neurosurg. Psychiatr. 67 (1): 59–65. PMC 1736445. PMID 10369823.
- ↑ Mendez MF (2006). "The accurate diagnosis of early-onset dementia". International Journal of Psychiatry Medicine (en inglés) 36 (4): 401–412. PMID 17407994.
- ↑ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (2006). "Therapeutic approaches to Alzheimer's disease". Brain (en inglés) 129 (11): 2840–55. PMID 17018549. doi:10.1093/brain/awl280.
- ↑ McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (1984). "Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease". Neurology (en inglés) 34 (7): 939–44. PMID 6610841.
- ↑ "Dementia: Quick reference guide" (PDF) (en inglés). National Institute for Health and Clinical Excellence. 2006. ISBN 1-84629-312-X. Consultado o 3 de novembro de 2014.
- ↑ 102,0 102,1 Dubois B, Feldman HH, Jacova C; et al. (2007). "Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria". Lancet Neurol (en inglés) 6 (8): 734–46. PMID 17616482. doi:10.1016/S1474-4422(07)70178-3.
- ↑ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (1994). "Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative". Arch. Neurol. (en inglés) 51 (12): 1198–204. PMID 7986174.
- ↑ American Psychiatric Association (2000). Diagnostic and Statistical Manual of Mental disorders, 4th Edition Text Revision (en inglés). Washington DC.
- ↑ 105,0 105,1 Ito N (1996). "[Clinical aspects of dementia]". Hokkaido Igaku Zasshi (en xaponés) 71 (3): 315–20. PMID 8752526.
- ↑ Tombaugh TN, McIntyre NJ (1992). "The mini-mental state examination: a comprehensive review". J Am Geriatr Soc (en inglés) 40 (9): 922–35. PMID 1512391.
- ↑ Pasquier F (1999). "Early diagnosis of dementia: neuropsychology". J. Neurol. (en inglés) 246 (1): 6–15. PMID 9987708.
- ↑ Harvey PD, Moriarty PJ, Kleinman L; et al. (2005). "The validation of a caregiver assessment of dementia: the Dementia Severity Scale". Alzheimer Dis Assoc Disord (en inglés) 19 (4): 186–94. PMID 16327345.
- ↑ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). "[Awareness of deficits and anosognosia in Alzheimer's disease.]". Encephale (en francés) 30 (6): 570–7. PMID 15738860.
- ↑ Cruz VT, Pais J, Teixeira A, Nunes B (2004). "The initial symptoms of Alzheimer disease: caregiver perception". Acta Med Port (en portugués) 17 (6): 435–44. PMID 16197855.
- ↑ Clarfield AM (2003). "The decreasing prevalence of reversible dementias: an updated meta-analysis". Arch. Intern. Med. (en inglés) 163 (18): 2219–29. PMID 14557220. doi:10.1001/archinte.163.18.2219.
- ↑ Geldmacher DS, Whitehouse PJ (1997). "Differential diagnosis of Alzheimer's disease". Neurology (en inglés) 48 (5 Suppl 6): S2–9. PMID 9153154.
- ↑ Potter GG, Steffens DC (2007). "Contribution of depression to cognitive impairment and dementia in older adults". Neurologist (en inglés) 13 (3): 105–17. PMID 17495754. doi:10.1097/01.nrl.0000252947.15389.a9.
- ↑ Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL (2006). "Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic confirmation". Clin Nucl Med (en inglés) 31 (7): 376–8. PMID 16785801. doi:10.1097/01.rlu.0000222736.81365.63.
- ↑ Dougall NJ, Bruggink S, Ebmeier KP (2004). "Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia". Am J Geriatr Psychiatry (en inglés) 12 (6): 554–70. PMID 15545324. doi:10.1176/appi.ajgp.12.6.554.
- ↑ Sobre o PiB PET:
- Kemppainen NM, Aalto S, Karrasch M; et al. (2008). "Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease". Ann. Neurol. (en inglés) 63 (1): 112–8. PMID 18023012. doi:10.1002/ana.21212.
- Ikonomovic MD, Klunk WE, Abrahamson EE; et al. (2008). "Post-mortem correlates of in vivo PiB-PET amyloid imaging in a typical case of Alzheimer's disease". Brain (en inglés) 131 (Pt 6): 1630–45. PMC 2408940. PMID 18339640. doi:10.1093/brain/awn016.
- Jack CR, Lowe VJ, Senjem ML; et al. (2008). "11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment". Brain (en inglés) 131 (3): 665–80. PMID 18263627. doi:10.1093/brain/awm336.
- ↑ Marksteiner J, Hinterhuber H, Humpel C (2007). "Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein". Drugs Today (en inglés) 43 (6): 423–31. PMID 17612711. doi:10.1358/dot.2007.43.6.1067341.
- ↑ Waldemar, G. and Dubois, B. and Emre, M. and Georges, J. and McKeith, IG and Rossor, M. and Scheltens, P. and Tariska, P. and Winblad, B. (2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline.". European Journal of Neurology (en inglés) 14 (1): e1.
- ↑ "Mal de Alzheimer". MedlinePlus (en castelán). Consultado o 7 de setembro de 2015.
- ↑ "La enfermedad de alzhéimer". AFA Las Rozas (en castelán). Arquivado dende o orixinal o 29 de abril de 2015. Consultado o 7 de setembro de 2015.
- ↑ 121,0 121,1 Commission de la transparence (2012). "Médicaments de la maladie d'Alzheimer". Prescrire International (en francés) 21 (128): 150. PMID 22822592.
- ↑ 122,0 122,1 122,2 Birks J, Harvey RJ (2006). "Donepezil for dementia due to Alzheimer's disease". Cochrane Database Syst Rev (en inglés) (1). PMID 16437430. doi:10.1002/14651858.CD001190.pub2.
- ↑ "Donepezil". Medline Plus (en castelán). 8 de xaneiro de 2007. Consultado o 18 de abril de 2015.
- ↑ "Rivastigmina". Medline Plus (en castelán). 8 de xaneiro de 2007. Consultado o 18 de abril de 2015.
- ↑ "Parche Transdérmico de Rivastigmina". Medline Plus (en castelán). 8 de xaneiro de 2007. Consultado o 18 de abril de 2015.
- ↑ "Galantamina". Medline Plus (en castelán). 8 de xaneiro de 2007. Consultado o 18 de abril de 2015.
- ↑ Geula C, Mesulam MM (1995). "Cholinesterases and the pathology of Alzheimer disease". Alzheimer Dis Assoc Disord (en inglés) 9 (2): 23–28. PMID 8534419.
- ↑ Stahl SM (2000). "The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action". J Clin Psychiatry (en inglés) 61 (11): 813–814. PMID 11105732.
- ↑ Birks J (2006). "Cholinesterase inhibitors for Alzheimer's disease". Cochrane Database Syst Rev (en inglés) (1). PMID 16437532. doi:10.1002/14651858.CD005593.
- ↑ Raschetti R, Albanese E, Vanacore N, Maggini M (2007). "Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials". PLoS Med (en inglés) 4 (11): e338. PMID 18044984. doi:10.1371/journal.pmed.0040338.
- ↑ Información sobre os inhibidores da acetilcolinesterasa:
- "Aricept Prescribing information" (PDF). Eisai and Pfizer (en inglés). Consultado o 18 de agosto de 2008.
- "Razadyne ER U.S. Full Prescribing Information" (PDF). Ortho-McNeil Neurologics (en inglés). Arquivado dende o orixinal (PDF) o 28 de maio de 2008. Consultado o 19 de febreiro de 2008.
- "Exelon ER U.S. Prescribing Information" (PDF). Novartis Pharmaceuticals (en inglés). Consultado o 18 de abril de 2015.
- "Exelon U.S. Prescribing Information" (PDF). Novartis Pharmaceuticals (en inglés). Consultado o 21 de febreiro de 2008.
- FDA (ed.). "Exelon Warning Letter" (PDF) (en inglés).
- ↑ "Memantina". MedLine Plus (en castelán). 4 de xaneiro de 2004. Consultado o 18 de abril de 2015.
- ↑ 133,0 133,1 Lipton SA (2006). "Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond". Nat Rev Drug Discov (en inglés) 5 (2): 160–170. PMID 16424917. doi:10.1038/nrd1958.
- ↑ Areosa Sastre A, McShane R, Sherriff F (2004). "Memantine for dementia". Cochrane Database Syst Rev (en inglés) (4). PMID 15495043. doi:10.1002/14651858.CD003154.pub2.
- ↑ "Namenda Prescribing Information" (PDF). Forest Pharmaceuticals (en inglés). Arquivado dende o orixinal (PDF) o 27 de febreiro de 2008. Consultado o 18 de abril de 2015.
- ↑ Raina P, Santaguida P, Ismaila A; et al. (2008). "Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline". Annals of Internal Medicine (en inglés) 148 (5): 379–397. PMID 18316756.
- ↑ Uso de antipsicóticos:
- Ballard C, Waite J (2006). "The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease". Cochrane Database Syst Rev (en inglés) (1). PMID 16437455. doi:10.1002/14651858.CD003476.pub2.
- Ballard C, Lana MM, Theodoulou M; et al. (2008). "A Randomised, Blinded, Placebo-Controlled Trial in Dementia Patients Continuing or Stopping Neuroleptics (The DART-AD Trial)". PLoS Med. (en inglés) 5 (4): e76. PMID 18384230. doi:10.1371/journal.pmed.0050076.
- Sink KM, Holden KF, Yaffe K (2005). "Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence". JAMA (en inglés) 293 (5): 596–608. PMID 15687315. doi:10.1001/jama.293.5.596.
- ↑ "Estimulación cognitiva en pacientes con Alzheimer". ISES (en castelán). Consultado o 7 de setembro de 2015.
- ↑ 139,0 139,1 139,2 139,3 139,4 139,5 American Psychiatric Association, ed. (outubro de 2007). "Practice Guideline for the Treatment of Patients with Alzheimer's disease and Other Dementias" (en inglés). doi:10.1176/appi.books.9780890423967.152139. Arquivado dende o orixinal (PDF) o 25/08/2011. Consultado o 24/05/2015.
- ↑ Bottino CM, Carvalho IA, Alvarez AM; et al. (2005). "Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study". Clin Rehabil (en inglés) 19 (8): 861–869. PMID 16323385. doi:10.1191/0269215505cr911oa.
- ↑ Doody RS, Stevens JC, Beck C; et al. (2001). "Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology (en inglés) 56 (9): 1154–1166. PMID 11342679.
- ↑ Hermans DG, Htay UH, McShane R (2007). "Non-pharmacological interventions for wandering of people with dementia in the domestic setting". Cochrane Database Syst Rev (1): CD005994. PMID 17253573. doi:10.1002/14651858.CD005994.pub2.
- ↑ Robinson L, Hutchings D, Dickinson HO; et al. (2007). "Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review". Int J Geriatr Psychiatry 22 (1): 9–22. PMID 17096455. doi:10.1002/gps.1643.
- ↑ Woods B, Spector A, Jones C, Orrell M, Davies S (2005). "Reminiscence therapy for dementia". Cochrane Database Syst Rev (2): CD001120. PMID 15846613. doi:10.1002/14651858.CD001120.pub2.
- ↑ Peak JS, Cheston RI (2002). "Using simulated presence therapy with people with dementia". Aging Ment Health 6 (1): 77–81. PMID 11827626. doi:10.1080/13607860120101095.
- ↑ Camberg L, Woods P, Ooi WL; et al. (1999). "Evaluation of Simulated Presence: a personalised approach to enhance well-being in persons with Alzheimer's disease". J Am Geriatr Soc 47 (4): 446–452. PMID 10203120.
- ↑ Neal M, Briggs M (2003). "Validation therapy for dementia". Cochrane Database Syst Rev (3): CD001394. PMID 12917907. doi:10.1002/14651858.CD001394.
- ↑ Chung JC, Lai CK, Chung PM, French HP (2002). "Snoezelen for dementia". Cochrane Database Syst Rev (4): CD003152. PMID 12519587. doi:10.1002/14651858.CD003152.
- ↑ Spector A, Orrell M, Davies S, Woods B (2000). "Withdrawn: Reality orientation for dementia". Cochrane Database Syst Rev (3): CD001119. PMID 17636652. doi:10.1002/14651858.CD001119.pub2.
- ↑ Spector A, Thorgrimsen L, Woods B; et al. (2003). "Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial". Br J Psychiatry 183: 248–254. PMID 12948999. doi:10.1192/bjp.183.3.248.
- ↑ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (2001). "A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia". Gerontologist 41 (1): 4–14. PMID 11220813. doi:10.1093/geront/41.1.4. Consultado o 15 de novembro de 2018.
- ↑ Gitlin LN, Hauck WW, Dennis MP, Winter L (2005). "Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders". J. Gerontol. A Biol. Sci. Med. Sci. 60 (3): 368–74. PMID 15860476.
- ↑ "Treating behavioral and psychiatric symptoms". Alzheimer's Association. 2006. Archived from the original on 25 de setembro de 2006. Consultado o 10 de outubro do 2015.
- ↑ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (2004). "Visual contrast enhances food and liquid intake in advanced Alzheimer's disease". Clinical Nutrition 23 (4): 533–538. PMID 15297089. doi:10.1016/j.clnu.2003.09.015.
- ↑ Dudek, Susan G. (2007). Nutrition essentials for nursing practice (en inglés). Hagerstown, Maryland: Lippincott Williams & Wilkins. p. 360. ISBN 0-7817-6651-6. Consultado o 10 de outubro do 2015.
- ↑ Dennehy C (2006). "Analysis of patients' rights: dementia and PEG insertion". Br J Nurs 15 (1): 18–20. PMID 16415742.
- ↑ Chernoff R (2006). "Tube feeding patients with dementia". Nutr Clin Pract 21 (2): 142–6. PMID 16556924.
- ↑ Problemas médicos:
- Head B (2003). "Palliative care for persons with dementia". Home Healthc Nurse 21 (1): 53–60; quiz 61. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (2006). "Alzheimer's disease: psychopathology, medical management and dental implications". J Am Dent Assoc 137 (9): 1240–51. PMID 16946428.
- Belmin J (2007). "Practical guidelines for the diagnosis and management of weight loss in Alzheimer's disease: a consensus from appropriateness ratings of a large expert panel". J Nutr Health Aging 11 (1): 33–7. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (2003). "Training caregivers to change the sleep hygiene practices of patients with dementia: the NITE-AD project". J Am Geriatr Soc 51 (10): 1455–60. PMID 14511168.
- Perls TT, Herget M (1995). "Higher respiratory infection rates on an Alzheimer's special care unit and successful intervention". J Am Geriatr Soc 43 (12): 1341–4. PMID 7490383.
- ↑ Shega JW, Levin A, Hougham GW; et al. (2003). "Palliative Excellence in Alzheimer Care Efforts (PEACE): a program description". J Palliat Med 6 (2): 315–20. PMID 12854952. doi:10.1089/109662103764978641.
- ↑ Gerhard Leinenga, Jürgen Götz (11 de marzo de 2015). "Scanning ultrasound removes amyloid-β and restores memory in an Alzheimer’s disease mouse model". Science Translational Medicine 7 (Issue 278): p. 278ra33. doi:10.1126/scitranslmed.aaa2512.
- ↑ Götz, Jürgen (16 de marzo de 2015). "Entrevista radial "16 March 2015 on Health Report", ABC Radio (Australia)" (en inglés). Consultado o 23 de marzo de 2015.
- ↑ Cf. Yvette I. Sheline, Tim West, Kevin Yarasheski et al. (14 maio 2014). ""An Antidepressant Decreases CSF Aβ Production in Healthy Individuals and in Transgenic AD Mice"". Science Translational Medicine 6: 236/4. Arquivado dende o orixinal o 16 de agosto de 2016. Consultado o 28 de xullo do 2016.
- ↑ ABC, ed. (16/05/2014). "Un antidepresivo detiene la formación de placas beta amiloide en alzhéimer". Salud (en castelán).
- ↑ Navas, María Elena (7 de decembro de 2012). "Marcapasos cerebral, un nuevo enfoque contra Alzheimer". BBC Mundo. Consultado o 8 de agosto de 2014.
- ↑ Non hai probas que recomenden medidas preventivas:
- Kawas CH (2006). "Medications and diet: protective factors for AD?". Alzheimer Dis Assoc Disord 20 (3 Suppl 2): S89–96. PMID 16917203.
- Luchsinger JA, Mayeux R (2004). "Dietary factors and Alzheimer's disease". Lancet Neurol 3 (10): 579–87. PMID 15380154. doi:10.1016/S1474-4422(04)00878-6.
- Luchsinger JA, Noble JM, Scarmeas N (2007). "Diet and Alzheimer's disease". Curr Neurol Neurosci Rep 7 (5): 366–72. PMID 17764625. doi:10.1007/s11910-007-0057-8.
- ↑ Szekely CA, Breitner JC, Zandi PP (2007). "Prevention of Alzheimer's disease". Int Rev Psychiatry 19 (6): 693–706. PMID 18092245. doi:10.1080/09540260701797944.
- ↑ Dieta mediterranea:
- Scarmeas N, Stern Y, Mayeux R, Luchsinger JA (2006). "Mediterranean diet, Alzheimer disease, and vascular mediation". Arch. Neurol. 63 (12): 1709–1717. PMID 17030648. doi:10.1001/archneur.63.12.noc60109.
- Scarmeas N, Luchsinger JA, Mayeux R, Stern Y (2007). "Mediterranean diet and Alzheimer disease mortality". Neurology 69 (11): 1084–93. PMID 17846408. doi:10.1212/01.wnl.0000277320.50685.7c.
- Barberger-Gateau P, Raffaitin C, Letenneur L, Berr C, Tzourio C, Dartigues JF, Alpérovitch A (2007). "Dietary patterns and risk of dementia: the Three-City cohort study". Neurology 69 (20): 1921–1930. PMID 17998483. doi:10.1212/01.wnl.0000278116.37320.52.
- Dai Q, Borenstein AR, Wu Y, Jackson JC, Larson EB (2006). "Fruit and vegetable juices and Alzheimer's disease: the Kame Project". American Journal of Medicine 119 (9): 751–759. PMID 16945610. doi:10.1016/j.amjmed.2006.03.045.
- Savaskan E, Olivieri G, Meier F, Seifritz E, Wirz-Justice A, Müller-Spahn F (2003). "Red wine ingredient resveratrol protects from beta-amyloid neurotoxicity". Gerontology 49 (6): 380–383. PMID 14624067. doi:10.1159/000073766.
- ↑ Presenza de vitaminas:
- Morris MC, Schneider JA, Tangney CC (2006). "Thoughts on B-vitamins and dementia". J. Alzheimers Dis. 9 (4): 429–33. PMID 16917152.
- Landmark K (2006). "[Could intake of vitamins C and E inhibit development of Alzheimer dementia?]". Tidsskr. Nor. Laegeforen. (en Norwegian) 126 (2): 159–61. PMID 16415937.
- Luchsinger JA, Tang MX, Miller J, Green R, Mayeux R (2007). "Relation of higher folate intake to lower risk of Alzheimer disease in the elderly". Arch. Neurol. 64 (1): 86–92. PMID 17210813. doi:10.1001/archneur.64.1.86.
- Morris MC, Evans DA, Bienias JL; et al. (agosto 2004). "Dietary niacin and the risk of incident Alzheimer's disease and of cognitive decline". J. Neurol. Neurosurg. Psychiatr. 75 (8): 1093–9. PMC 1739176. PMID 15258207. doi:10.1136/jnnp.2003.025858.
- ↑ Vitaminas non preveñen a enfermidade: * Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT (2006). "Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease". J. Alzheimers Dis. 9 (4): 435–43. PMID 16917153.
- Malouf M, Grimley EJ, Areosa SA (2003). "Folic acid with or without vitamin B12 for cognition and dementia". Cochrane Database Syst Rev (4): CD004514. PMID 14584018. doi:10.1002/14651858.CD004514.
- Sun Y, Lu CJ, Chien KL, Chen ST, Chen RC (2007). "Efficacy of multivitamin supplementation containing vitamins B6 and B12 and folic acid as adjunctive treatment with a cholinesterase inhibitor in Alzheimer's disease: a 26-week, randomised, double-blind, placebo-controlled study in Taiwanese patients". Clin Ther 29 (10): 2204–14. PMID 18042476. doi:10.1016/j.clinthera.2007.10.012.
- Boothby LA, Doering PL (2005). "Vitamin C and vitamin E for Alzheimer's disease". Ann Pharmacother 39 (12): 2073–80. PMID 16227450. doi:10.1345/aph.1E495.
- Gray SL, Anderson ML, Crane PK, Breitner JC, McCormick W, Bowen JD, Teri L, Larson E (2008). "Antioxidant vitamin supplement use and risk of dementia or Alzheimer's disease in older adults". J Am Geriatr Soc 56 (2): 291–295. PMID 18047492. doi:10.1111/j.1532-5415.2007.01531.x.
- ↑ Curcumina naa dieta:
- Garcia-Alloza M, Borrelli LA, Rozkalne A, Hyman BT, Bacskai BJ (2007). "Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model". Journal of Neurochemistry 102 (4): 1095–1104. PMID 17472706. doi:10.1111/j.1471-4159.2007.04613.x.
- Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM (2001). "The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse". Journal of Neuroscience 21 (21): 8370–8377. PMID 11606625.
- ↑ Sehgal N., Gupta A., Valli R.K., Joshi S.D., Mills J.T., Hamel E., Khanna P., Jain S.C., Thakur S.S. y Ravindranath V. (2012). "Withania somnifera reverses Alzheimer's disease pathology by enhancing low-density lipoprotein receptor-related protein in liver". Proc Natl Acad Sci U S A. (en inglés) 109 (9): 3510–3515. doi:10.1073/pnas.1112209109.
- ↑ Jayaprakasam B., Padmanabhan K. y Nair M.G. (2010). "Withanamides in Withania somnifera fruit protect PC-12 cells from beta-amyloid responsible for Alzheimer's disease". Phytother Res. (en inglés) 24 (6): 859–863. doi:10.1002/ptr.3033.
- ↑ Rosendorff C, Beeri MS, Silverman JM (2007). "Cardiovascular risk factors for Alzheimer's disease". Am J Geriatr Cardiol 16 (3): 143–9. PMID 17483665. doi:10.1111/j.1076-7460.2007.06696.x.
- ↑ Gustafson D, Rothenberg E, Blennow K, Steen B, Skoog I (2003). "An 18-year follow-up of overweight and risk of Alzheimer disease". Arch. Intern. Med. 163 (13): 1524–1528. PMID 12860573. doi:10.1001/archinte.163.13.1524.
- ↑ Reiss AB, Wirkowski E (2007). "Role of HMG-CoA reductase inhibitors in neurological disorders : progress to date". Drugs 67 (15): 2111–2120. PMID 17927279.
- ↑ Kuller LH (2007). "Statins and dementia". Current Atherosclerosis Reports 9 (2): 154–161. PMID 17877925. doi:10.1007/s11883-007-0012-9.
- ↑ Szekely CA, Breitner JC, Fitzpatrick AL, Rea TD, Psaty BM, Kuller LH, Zandi PP (2008). "NSAID use and dementia risk in the Cardiovascular Health Study: role of APOE and NSAID type". Neurology 70 (1): 17–24. PMID 18003940. doi:10.1212/01.wnl.0000284596.95156.48.
- ↑ Craig MC, Murphy DG (2007). "Estrogen: effects on normal brain function and neuropsychiatric disorders". Climacteric. 10 Suppl 2: 97–104. PMID 17882683. doi:10.1080/13697130701598746.
- ↑ Mori K, Takeda M (2007). "Hormone replacement Up-to-date. Hormone replacement therapy and brain function". Clin Calcium (en japonés) 17 (9): 1349–1354. PMID 17767023.
- ↑ Birks J, Grimley Evans J (2007). "Ginkgo biloba for cognitive impairment and dementia". Cochrane Database Syst Rev (2): CD003120. PMID 17443523. doi:10.1002/14651858.CD003120.pub2. Consultado o 22 de febreiro de 2008.
- ↑ Verghese J, Lipton R, Katz M, Hall C, Derby C, Kuslansky G, Ambrose A, Sliwinski M, Buschke H (2003). "Leisure activities and the risk of dementia in the elderly". N Engl J Med 348 (25): 2508–2516. PMID 12815136. doi:10.1056/NEJMoa022252.
- ↑ Bennett DA, Schneider JA, Tang Y, Arnold SE, Wilson RS (2006). "The effect of social networks on the relation between Alzheimer's disease pathology and level of cognitive function in old people: a longitudinal cohort study". Lancet Neurol 5 (5): 406–412. PMID 16632311. doi:10.1016/S1474-4422(06)70417-3.
- ↑ Bialystok E, Craik FIM, Freedman M (2007). "Bilingualism as a protection against the onset of symptoms of dementia". Neuropsychologia 42 (2): 459–464. doi:10.1016/j.neuropsychologia.2006.10.009.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Alzhéimer |

