Hidrocarburo aromático
Un hidrocarburo aromático ou areno[1][2] (ou ás veces aril hidrocarburo)[3] é un hidrocarburo con enlaces sigma e electróns pi deslocalizados entre átomos de carbono que forman un anel. A diferenza deles, os hidrocarburos alifáticos non presentan dita deslocalización. O termo 'aromático' foilles asignado antes de que se determinase o mecanismo físico da aromaticidade; o termo foi acuñado simplemente porque moitos dos compostos tiñan un cheiro doce e agradable, aínda que non todos. A configuración de seis átomos de carbono nos compostos aromáticos denomínase anel bencénico, polo nome do máis simple deste tipo de hidrocarburos, o benceno. Os hidrocarburos aromáticos poden ser monocíclicos (HAM) ou policíclicos (HAP).
Algúns compostos non baseados no benceno chamados heteroarenos, que seguen a regra de Hückel (para os aneis monocíclicos: cando o número dos seus electóns π é igul a 4n + 2, onde n = 0, 1, 2, 3,…), tamén se chaman compostos aromáticos. Nestes compostos, polo menos un átomo de carbono é substituído por un dos heteroátomos oxíxeno, nitróxeno ou xofre. Exemplos de compostos non bencénicos con propiedades aromáticas son o furano, un composto heterocíclico cun anel de cinco membros que contén un só átomo de oxíxeno, e a piridina, un composto heterocíclico cun anel de seis membros que contén un átomo de nitróxeno.[4]
Modelo do anel bencénico[editar | editar a fonte]

- Artigo principal: Aromaticidade.
O benceno, C6H6, é o hidrocarburo aromático máis simple e foi o primeiro en denominarse como tal. A natureza dos seus enlaces foi primeiro recoñecida por August Kekulé no século XIX. Cada átomo de carbono no ciclo hexagonal ten catro electróns para compartir. Un vai ao átomo de hidróxeno e outro a cada un dos dous carbonos veciños. Isto deixa dous electróns para compartir cun dos dous mencionados átomos de carbono veciños, o que crea un enlace dobre cun carbono e deixa un enlace simple co outro, ao cal se debe que a molécula de benceno se debuxe con enlaces simples e dobres alternos arredor do hexágono.
A estrutura debúxase tamén como un círculo arredor do interior do anel, que indica que seis electróns flotan arredor en orbitais moleculares deslocalizados do tamaño do propio anel. Esta representación mostra a natureza equivalente dos seis enlaces carbono–carbono todos con orde de enlace 1.5; a equivalencia explícase por formas resonantes. Os electróns son visualizados como se flotasen por riba e debaixo do anel e os campos electromagnéticos que xeran axudan a manter o plano do anel.
As propiedades xerais dos hidrocarburos aromáticos son:
- Presentan aromaticidade
- A proporción carbono-hidróxeno é alta
- Arden cunha forte labarada amarela ennegrecida debido á alta proporción de carbono
- Sofren reaccións de substitución electrofílicas e substitucións aromáticas nucleofílicas.
O símbolo do círculo usado para representar a aromaticidade foi introducido por Sir Robert Robinson e o seu estudante James Armit en 1925[5] e a súa popularización iniciouse en 1959 coa publicación do libro de texto de química orgánica de Morrison e Boyd. O propio uso do símbolo é discutido; utilízano para describir calquera sistema cíclico π nalgunhas publicacións, ou para representar só aqueles sistemas π que obedecen á regra de Hückel noutras. Jensen[6] argumenta que, en liña co propósito orixinal de Robinson, o uso do símbolo do círculo debería limitarse aos sistemas de e electróns π monocíclicos. Deste modo o símbolo do círculo para un sistema de seis electróns e seis centros pode compararse ao símbolo Y para un enlace de dous electróns e tres centros.
Síntese de arenos[editar | editar a fonte]
As reaccións que forman un composto areno a partir dun precursor cíclico insaturado ou parcialmente insaturado denomínanse aromatizacións. Existen moitos métodos de laboratorio para a síntese orgánica de arenos a partir de precursores non arenos. Moitos dos métodos dependen de reaccións de cicloadición. A trimerización de alquinos describe a ciclación [2+2+2] de tres alquinos; na reacción de Dötz os reactantes son un alquino, o monóxido de carbono e un complexo de cromo carbeno. Nas reaccións de Diels-Adler dos alquinos coa pirona ou ciclopentadienona con expulsión de dióxido de carbono ou monóxido de carbono fórmanse compostos arenos. Na ciclación de Bergman os reactivos son a enina e un doante de hidróxeno.
Outro conxunto de métodos é a aromatización de ciclohexanos e outros aneis alifáticos: os reactivos son catalizadores usados en hidroxenación como o platino, paladio e níquel (hidroxenación inversa), quinonas e os elementos xofre e selenio.[7]
Reaccións dos arenos[editar | editar a fonte]
Os arenos son reactivos en moitas reaccións orgánicas.
Substitución aromática[editar | editar a fonte]
- Artigo principal: Padróns de substitución en arenos.
Na substitución aromática un substituínte sobre o anel do areno, que xeralmente é o hidróxeno, é cambiado por outro substituínte. Os dous tipos principais son a substitución aromática electrofílica cando o reactivo activo é un electrófilo e a substitución aromática nucleofílica cando o reactivo é un nucleófilo. Na substitución aromática nucleofílica-radical o reactivo activo é un radical. Un exemplo de substitución aromática electrofílica é a nitración do ácido salicílico:[8]
Reaccións de acoplamento[editar | editar a fonte]
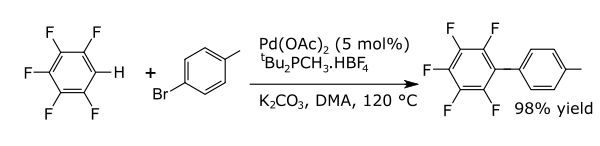
En reaccións de acoplamento un metal cataliza un acoplamento entre dous fragmentos radicais formais. As reaccións de acoplamento comúns con arenos teñen como resultado a formación de novos enlaces carbono-carbono, por exemplo, alquilarenos, vinil arenos, birarilos, novos enlaces carbono-nitróxeno (anilinas) ou novos enlaces carbono-oxíxeno (compostos ariloxi). Un exemplo é a arilación directa dos perfluorobencenos.[9]
Hidroxenación[editar | editar a fonte]
A hidroxenación de arenos crea aneis saturados. O composto 1-naftol é completamente reducido a unha mestura de isómeros decalin-ol.[10]
O composto resorcinol, hidroxenado con níquel de Raney en presenza de hidróxido sódico acuoso forma un enolato, que se alquila con ioduro de metilo para dar 2-metil-1,3-ciclohexandiona:[11]
Cicloadicións[editar | editar a fonte]
As reaccións de cicloadición non son comúns. A pouco común reactividade de Diels–Alder termal dos arenos pode encontrarse na reacción de Wagner-Jauregg. Outras cicloadicións fotoquímicas con alquenos prodúcense por medio de excímeros.
Benceno e derivados do benceno[editar | editar a fonte]
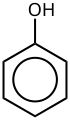
Os derivados do benceno teñen dun a seis substituíntes unidos ao núcleo bencénico central. Exemplos de compostos bencénicos con só un substituínte son o fenol, que leva un grupo hidroxilo, e o tolueno, cun grupo metilo. Cando no anel hai máis dun substituínte, as súas relacións espaciais fanse importantes polo cal se utilizan as denominacións orto, meta e para para os padróns de substitución de arenos. Por exemplo, existen tres isómeros do cresol porque o grupo metilo e o grupo hidroxilo poden situarse un ao lado do outro (orto), separados por unha posición (meta), ou por dúas posicións (para). O xilenol ten dous grupos metilo ademais do grupo hidroxilo, e, para esta estrutura hai 6 isómeros.
- Compostos arenos representativos
O anel areno ten a capacidade de estabilizar cargas. Isto obsérvase, por exemplo, no fenol (C6H5–OH), que é ácido no hidroxilo (OH), xa que a carga sobre este oxíxeno (alcóxido –O−) está parcialmente deslocalizado no anel bencénico.
Hidrocarburo aromático pollicíclico[editar | editar a fonte]
- Artigo principal: Hidrocarburo aromático policíclico.
Os hidrocarburos aromáticos policíclicos (HAPs) son hidrocarburos aromáticos que constan de aneis aromáticos fusionados e non conteñen heteroátomos ou levan substituíntes.[12] O naftaleno é o exemplo máis simple de HAP. Os HAPs aparecen no petróleo, carbón e depósitos de brea, e orixínanse como subprodutos da combustión do combustibles fósiles ou biomasa. Como contaminantes, son preocupantes porque algúns compostos foron identificados como carcinóxenos, mutaxénicos e teratoxénico. Os HAPs tamén se encontran en alimentos cociñados. Os estudos realizados mostraron que nels se encontraban altos niveis de HAPs; por exemplo, en carne cociñada a altas temperaturas como as das grellas ou barbacoas e no peixe afumado.[13][14][15]
Encóntranse tamén no espazo interestelar, en cometas e en meteoritos, e son moléculas candidatas a ser as que actuaron como base para que se orixinasen as primeiras formas de vida. No grafeno o motivo HAP ten unha extensión como a de dúas follas bidimensionais.
Notas[editar | editar a fonte]
- ↑ Definición no Gold Book da IUPAC Ligazón
- ↑ "bUSCatermos; hidrocarburos aromáticos, arenos". aplicacions.usc.es. Consultado o 2022-07-05.
- ↑ Mechanisms of Activation of the Aryl Hydrocarbon Receptor de Maria Backlund, Institute of Environmental Medicine, Karolinska Institutet
- ↑ HighBeam Encyclopedia: aromatic compound
- ↑ Armit, James Wilkins; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. 127: 1604–1618.
- ↑ Jensen, William B. (April 2009). "The circle symbol for aromaticity" (PDF). J. Chem. Educ. 86 (4): 423–424.
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ Webb, K.; Seneviratne, V. (1995). "A mild oxidation of aromatic amines". Tetrahedron Letters 36 (14): 2377–2378. doi:10.1016/0040-4039(95)00281-G.
- ↑ Lafrance, M.; Rowley, C.; Woo, T.; Fagnou, K. (2006). "Catalytic intermolecular direct arylation of perfluorobenzenes.". Journal of the American Chemical Society 128 (27): 8754–8756. PMID 16819868. doi:10.1021/ja062509l.
- ↑ Meyers, A. I.; Beverung, W. N.; Gault, R. "1-Naphthol". Org. Synth. 51. CV6P0371.
- ↑ Noland, Wayland E.; Baude, Frederic J. "Ethyl Indole-2-carboxylate". Org. Synth. 41. CV5P0567.
- ↑ Fetzer, J. C. (2000). "The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons". Polycyclic Aromatic Compounds (New York: Wiley) 27 (2): 143. ISBN 0-471-36354-5. doi:10.1080/10406630701268255.
- ↑ "Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects" (PDF). European Commission, Scientific Committee on Food. December 4, 2002.
- ↑ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA (1983). "Polycyclic aromatic hydrocarbons in grilled food". J. Agric. Food Chem. 31 (4): 867–873. PMID 6352775. doi:10.1021/jf00118a049.
- ↑ "Polycyclic Aromatic Hydrocarbons (PAHs)". Agency for Toxic Substances and Disease Registry. 1996.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Hidrocarburo aromático |