Ácido hialurónico

O ácido hialurónico,[1] tamén chamado hialurona ou hialuronato (desprotonado), é un heteropolisacárido aniónico, non sulfatado do grupo dos glicosaminoglicanos presente na matriz extracelular dos tecidos conectivos, epitelial, e nervioso. É único entre o grupo dos glicosaminoglicanos porque non está sulfatado, se forma na membrana plasmática e non no aparato de Golgi como os demais, e pode ser enorme, con pesos moleculares que a miúdo son de millóns de daltons.[2] É un dos compoñentes principais da matriz extracelular, e contribúe significativamente á proliferación e migración celular, e pode estar implicado na progresión dalgúns tumores malignos.
Unha persoa de 70 kg ten aproximadamente 15 g de ácido hialurónico no seu corpo, e un terzo do total é reciclado (degradado e sintetizado) cada día.[3] O ácido hialurónico é tamén un compoñente da cápsula extracelular das bacterias do grupo dos estreptococos A,[4] e crese que inflúe na virulencia da bacteria.[5][6]
A denominación "ácido hialurónico" procede do grego hyalos, que significa vítreo (porque foi inicialmente illado do humor vítreo) e do ácido glicurónico, que é un dos seus principais compoñentes. Porén, a molécula en condicións fisiolóxicas normais está na súa forma ionizada polianiónica, polo que moi a miúdo se lle denomina "hialurona". Finalmente, o termo "hialuronato" refírese á base conxugada do ácido hialurónico. Neste artigo utilizarase principalmente a denominación ácido hialurónico.
Funcións
[editar | editar a fonte]Ata finais da década de 1970, a hialurona describíase como un polisacárido pegañento moi ubicuo na matriz extracelular de moitos tecidos.[7] Por exemplo, era o principal compoñente do líquido sinovial, e sabíase que incrementaba a viscosidade dese fluído. Xunto coa lubricina, é un dos compoñentes lubricantes principais dos fluídos.
O ácido hialurónico é un importante compoñente do tecido cartilaxinoso articular, onde se presenta como un material que recobre a célula do tecido, o condrocito. Cando os monómeros de agrecán (un proteoglicano) se unen ao ácido hialurónico en presenza das proteínas de unión, fórmanse grandes agregados cargados negativamente. Desta maneira, aínda que o ácido hialurónico non forma proteoglicanos con proteínas, si pode unirse a outros proteoglicanos (que conteñen outros glicosaminoglicanos) e formar estes enormes agregados. Estes agregados reteñen auga e son responsables da resistencia á compresión da cartilaxe. O peso molecular do ácido hialurónico da cartilaxe decrece coa idade, pero a cantidade aumenta.[8]
O ácido hialurónico é tamén un compoñente principal da pel, onde está implicado na reparación do tecido danado. Cando a pel se expón de forma excesiva aos raios ultravioleta B, inflámase (queimadura solar) e as células da derme deixan de producir tanto ácido hialurónico, e incrementan o ritmo de degradación da molécula. Os produtos da degradación do ácido hialurónico tamén se acumulan na pel despois da exposición aos raios ultravioleta.[9]
Como é moi abondoso nas matrices extracelulares, o ácido hialurónico tamén contribúe á hidrodinámica do tecido, ao movemento e proliferación de células, e participa en diversas interaccións con receptores da superficie celular, notablemente naquelas células que teñen os seus receptores primarios, CD44 e RHAMM. O aumento de CD44 na célula acéptase como un marcador da activación celular en linfocitos. A contribución do ácido hialurónico ao crecemento tumoral pode deberse á súa interacción co CD44. O receptor CD44 participa nas interaccións da adhesión celular requiridas polas células tumorais.
Aínda que o ácido hialurónico se une ao receptor CD44, hai evidencias de que os produtos de degradación do ácido hialurónico transducen o seu sinal inflamatorio por medio do receptor TLR2 (toll-like receptor 2), do TLR4 ou de ambos os dous nos macrófagos e células dendríticas. O TLR e o ácido hialurónico xogan, pois, un papel na inmunidade innata.
As altas concentracións de ácido hialurónico observadas no cerebro de ratas novas, e as reducidas concentracións no cerebro dos adultos suxiren que o ácido hialurónico xoga un papel importante no desenvolvemento do cerebro.[10]
Estrutura
[editar | editar a fonte]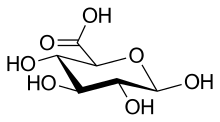

As propiedades do ácido hialurónico foron determinadas inicialmente na década de 1930 no laboratorio de Karl Meyer.[11]
O ácido hialurónico é un polímero dun disacárido que se repite, o cal está composto por ácido D-glicurónico e D-N-acetilglicosamina, unidos por enlaces glicosídicos alternantes β-1,4 e β-1,3. A molécula pode conter ata uns 25.000 destes disacáridos repetidos e pode ter un peso molecular que vai desde 5.000 a 20.000.000 de daltons in vivo, segundo a súa lonxitude. O peso molecular medio da molécula no líquido sinovial humano é de 3−4 millóns de Da, e o ácido hialurónico purificado de cordón umbilical humano é de 3.140.000 Da.[12]
O ácido hialurónico é enerxeticamente estable, en parte a causa da estereoquímica dos seus compoñentes disacáridos. Os grupos químicos voluminosos de cada azucre están en posicións estericamente favorecidas, mentres que os pequenos átomos de hidróxeno dispóense en posicións axiais menos favorables.
O ácido hialurónico non está sulfatado.
Biosíntese
[editar | editar a fonte]O ácido hialurónico sintetízase pola accións duns encimas que son un tipo de proteína integral de membrana chamadas hialurona sintases, das cales os vertebrados teñen tres tipos: HAS1, HAS2 e HAS3. Estes encimas alongan o ácido hialurónico ao engadir sucesivamente unidades de ácido glicurónico e N-acetilglicosamina ao polisacárido en formación a medida que este é extruído a través do transportador ABC atravesando a membrana e pasando ao espazo extracelular.[13]
A síntese do ácido hialurónico é inhibida pola 4-metilumbeliferona (himecromona, heparvit), que é un derivado da 7-hidroxi-4-metilcumarina.[14] Esta inhibición selectiva (que non inhibe a síntese doutros glicosaminoglicanos) pode ser útil na prevención das metástases de células tumorais malignas.[15]
Produción e importancia económica
[editar | editar a fonte]O uso cada vez maior do ácido hialurónico en cirurxía estética e outras aplicacións fixo que a produción da substancia adquirise cada vez máis importancia industrial. En 2004 o kg máis barato desta substancia estaba arredor de 5.000 euros.

O ácido hialurónico non pode obterse por síntese química, senón só por técnicas de bioenxeñaría con procesos de fermentación bacteriana do ácido urónico. O Bacillus subtilis foi modificado xeneticamente recentemente para producir hialurona humana por un método patentado [16]. Pero o máis común é a súa produción a partir de fontes naturais.[17] As fontes máis utilizadas son as cristas dos galos, as aletas de escualos e o cordón umbilical. En concreto, a crista dos galos é esencialmente unha gran superficie de pel, que contén ácido hialurónico e que aumenta a concentración desta substancia en resposta á testosterona. As galiñas tamén presentan este composto, pero en menor proporción.[18]
Outra das fontes principais era o humor vítreo e o líquido sinovial das articulaciones de gando vacún pero por mor da epidemia do mal das vacas tolas estas fontes foron cuestionadas. O grupo de Reciclado e valorización de residuos do Instituto de Investigacións Mariñas (IIM) español patentou unha forma de extraelo dos residuos do peixe.[17]
O desenvolvemento da súa produción e da dos seus derivados está promovendo a aparición de numerosas patentes. Algúns exemplos son o Ácido Hialurónico Non Animal Estabilizado (NAHSA), que como non contén proteínas de orixe animal non esixe que se faga un test da pel antes do tratamento, e o DXL™, fórmula de moléculas de ácido hialurónico de dobre entrecruzamento, que fai que o ácido hialurónico dure máis.[19]
Receptores celulares para o ácido hialurónico
[editar | editar a fonte]Ata o momento, os receptores celulares para o ácido hialurónico que foron identificados pertencen a tres grupos: CD44, receptor para a motilidade mediada polo ácido hialurónico (RHAMM) e a molécula 1 de adhesión intracelular (ICAM-1). O CD44 e a ICAM-1 xa se coñecían como moléculas que interviñan na adhesión celular doutros ligandos antes que se descubrise que tamén se unía a eles o ácido hialurónico.[20]
O CD44 está amplamente distribuído polo corpo, e a demostración formal da unión ácido hialurónico-CD44 fixérona Aruffo et al.[21] en 1990. Actualmente, considérase o principal receptor da superficie celular para o ácido hialurónico. O CD44 media a interacción da célula co ácido hialurónico e a unión de ambos é unha parte importante de varios procesos fisiolóxicos,[20][22] como a agregación, migración, proliferación e activación de células; a adhesión célula-célula e célula-substrato; a endocitose de ácido hialurónico, a cal conduce ao catabolismo do ácido hialurónico en macrófagos; a ensamblaxe de matrices a partir de ácido hialurónico e proteoglicanos. Kaya et al. propuxeron dous papeis importantes desempeñados polo CD44 na pel.[23] O primeiro é a regulación da proliferacíón dos queratinocitos en resposta a estímulos extracelulares, e o segundo é o mantemento da homeostase do ácido hialurónico local.[22]
O receptor ICAM-1 coñécese principalmente como un receptor metabólico da superficie celular para o ácido hialurónico, e esta proteína pode ser responsable da retirada do ácido hialurónico do plasma sanguíneo e linfa, o que supón probablemente a maioría da reciclaxe de ácido hialurónico no corpo [20][24] Deste modo, a unión de ligandos a este receptor inicia unha cascada moi coordinada de eventos que inclúen a formación dunha vesícula endocítica, a súa fusión cos lisosomas primarios, a dixestión encimática orixinando monosacáridos, o transporte activo transmembrana deses azucres ao citosol, a fosforilación da N-acetilglicosamina e a desacetilación encimática.[20][25][26] Como indica o seu nome, a ICAM-1 pode tamén servir como molécula para a adhesión celular, e a unión do ácido hialurónico ao receptor ICAM-1 pode contribuír ao control da activación inflamatoria mediada por ICAM-1.[22]
Degradación
[editar | editar a fonte]A hialurona degrádase por unha familia de encimas chamados hialuronidases. Nos humanos, hai polo menos sete tipos de encimas do tipo das hialuronidases, algúns dos cales son supresores de tumores. Os produtos de degradación da hialurona, que son oligosacáridos e hialuronas de peso molecular moi baixo, mostran propiedades proanxioxénicas [27]. Ademais, estudos recentes mostran que os fragmentos de hialurona, e non as hialuronas nativas de alto peso molecular, poden inducir respostas inflamatorias nos macrófagos [28] e células dendríticas cando hai danos tisulares e no rexeitamento dos transplantes de pel.
Papel do ácido hialurónico na curación de feridas
[editar | editar a fonte]A pel é unha barreira que nos separa do ambiente externo e actúa impedindo a entrada de axentes infecciosos no corpo.[29] Pero unha vez que a pel foi danada por unha ferida, os tecidos que están debaixo están expostos á infección; por tanto, é moi importante que exista unha curación rápida e efectiva que reconstrúa esta barreira. A curación das feridas na pel é un proceso complexo, e inclúe diversas interaccións que se inician pola hemostase e a liberación de factores derivados das plaquetas.[29] As seguintes fases polas que se pasa son: inflamación, formación de tecido granular, reepitelización e remodelación. O ácido hialurónico probablemente xoga un papel multifacético na mediación destes procesos que teñen lugar na célula e na matriz extracelular. As funcións que se propuxo que exerce o ácido hialurónico na curación das feridas explícanse a continuación.
Inflamación
[editar | editar a fonte]Nos procesos de inflamación xéranse moitos factores biolóxicos, como factores de crecemento, citocinas, eicosanoides etc. Estes factores son necesarios para as seguintes fases do proceso de curación da ferida porque promoven a migración de células inflamatorias, fibroblastos, e células endoteliais cara ao lugar da ferida.[22]
O tecido danado na fase inflamatoria inicial do proceso de reparación contén abundante ácido hialurónico, probablemente como resultado do incremento da súa síntese.[22] O ácido hialurónico actúa como un protmotor da inflamación inicial, o que é crucial para a reparación. Nun modelo murino (de ratos) de carraxenina/inflamación inducida por IL-1, observouse que o ácido hialurónico fai aumentar a infiltración celular.[22][30] Kobayashi e os seus colegas [22][31] mostraron que existía un incremento dependente da dose das citocinas proinflamatorias TNF-α e produción de IL-8 polos fibroblastos humanos uterinos a concentracións de ácido hialurónico de 10μg/ml a 1 mg/ml por medio dun mecanismo mediado por CD44. As células endoteliais, en resposta ás citocinas inflamatorias como TNF-α, e o lipopolisacárido das paredes bacterianas, tamén sintetiza ácido hialurónico, o cal facilita a adhesión primaria de linfocitos activados por citocinas que expresan as variedades de CD44 de unión ao ácido hialurónico en condicións de fluxo estático e laminar.[22][32] É interesante sinalar que o ácido hialurónico ten dúas funcións contraditorias no proceso inflamatorio. Non só promove a inflamación, como se dixo antes, senón que tamén pode moderar a resposta inflamatoria, o que pode contribuír á estabilización da matriz do tecido de granular, como se describe no seguinte apartado.
Granulación e organización da matriz do tecido granular
[editar | editar a fonte]O tecido granular (de cicatrización) é o tecido conectivo fibroso que perfunde e substitúe o coágulo de fibrina durante a curación dunha ferida. Crece xeralmente desde a base da ferida e pode encher feridas de case calquera tamaño durante a súa curación. O ácido hialurónico é abundante na matriz do tecido granular. Diversas funcións celulares que son esenciais para a reparación do tecido poden atribuírse a esta rede rica en ácido hialurónico. Estas funcións inclúen a facilitación da migración celular na matriz provisoria da ferida, a proliferación celular e a organización da matriz do tecido granular.[22] Como a iniciación da inflamación é crucial para a formación do tecido granular, o papel pro-inflamatorio do ácido hialurónico contribúe de forma determinante nesta fase da curación da ferida.[22]
O ácido hialurónico e a migración celular
[editar | editar a fonte]A migración celular é esencial para a formación do tecido granular.[22] A fase inicial da formación deste tecido está dominada pola matriz extracelular rica en ácido hialurónico, que se considera como un medio que conduce a migración de células á matriz temporal da ferida. O ácido hialurónico contribúe a esta migración debido ás súas propiedades fisicoquímicas e porque dirixe as interaccións coas células. Proporciona unha matriz hidratada aberta que facilita a migración celular,[22] e dirixe a migración e o control dos mecanismos locomotores celulares mediados por interaccións celulares específicas entre o ácido hialurónico e os receptores da superficie celular para o ácido hialurónico. Os tres receptores da superficie para o ácido hialurónico principais son CD44, RHAMM, e ICAM-1. O máis relacionado coa migración celular é RHAMM, que se une con varias proteína quinases asociadas co movemento celular, como por exemplo, a proteína quinase regulada por sinais extracelulares (ERK), p125fak, e pp60c-src.[33][34][35] Durante o desenvolvemento fetal, a vía de migración a través da cal migran as células da crista neural é rica en ácido hialurónico.[22] A degradación do ácido hialurónico ou o bloqueo do seu receptor inhibe, polo menos parcialmente, a migración celular pola matriz do tecido granular.[36] Basicamente o ácido hialurónico sintetízase na membrana plasmática e é liberado directamente no medio extracelular.[22] Isto pode contribuír a crear un microambiente hidratado nos sitios de síntese, e é esencial para a migración celular porque facilita a célula se despegue ou separe. Por tanto, a síntese de ácido hialurónico está asociada coa migración celular porque proporciona forza dinámica á célula.[37]
Papel do ácido hialurónico na moderación da resposta inflamatoria
[editar | editar a fonte]Aínda que a inflamación é unha parte integrante da formación do tecido granular de reparación, a inflamación debe ser moderada. O tecido granular inicial é altamente inflamatorio e ten un alto grao de reciclaxe tisular mediado polos encimas que degradan a matriz e os metabolitos reactivos do osíxeno que son producidos polas células inflamatorias.[22] A estabilización desta matriz conséguese moderando a inflamación. O ácido hialurónico funciona como un importante moderador deste proceso, malia que tamén estimula o inicio da inflamación, xa que protexe as células contra os danos producidos polos radicais libres,[38] o que foi demostrado en estudos con ratas [39]. Este tipo de protección contra os radicais libres é unha característica que comparten os polímeros poliiónicos.
Outra función do ácido hialurónico na moderación da resposta inflamatoria é a de desenvolver interaccións biolóxicas específicas coas moléculas que interveñen na inflamación.[22] O TNF-α, unha importante citocina xerada durante a inflamación, estimula a expresión do xene TSG-6 (xene 6 estimulado polo TNF) en fibroblastos e células inflamatorias. O produto deste xene é a TSG-6, unha proteína de unión ao ácido hialurónico, que tamén forma un complexo estable co inhibidor da proteinase sérica IαI (Inter-α-inhibitor) cun efecto sinérxico sobre a actividade inhibitoria da plasmina realizada por este último. A plasmina está implicada na activación da cascada proteolítica das metaloproteinases da matriz e outras proteinases, que orixina danos no tecido inflamado. Por tanto, a acción do complexo TSG-6/IαI, que pode ser adicionalmente organizado ao unirse ao ácido hialurónico na matriz extacelular, pode servir como un potente bucle de retroalimentación negativo que modera a intensidade da inflamación e estabiliza o tecido granular a medida que a cicatrización progresa.[22][40] En modelos murinos de carraxenina/IL-1 (interleucina-1β), onde se vira que o ácido hialurónico era pro-inflamatorio, pode conseguirse tamén a redución da inflamación administrando TSG-6, e o resultado é comparable cun tratamento sistémico con dexametasona.
Reepitelización
[editar | editar a fonte]O ácido hialurónico non só xoga un importante papel na epiderme normal, senón que ten tamén funcións cruciais no proceso de reepitelización. Serve como parte integral da matriz extracelular dos queratinocitos basais, que son os principais constituíntes da epiderme; ten a función de eliminación dos radicais libres, e un papel na proliferación de queratinocitos e na migración celular.[22]
Na pel normal (non ferida), o ácido hialurónico atópase en concentracións relativamente altas na capa basal da epiderme, onde se encontran os queratinocitos proliferantes.[41] O CD44 está situado xunto co ácido hialurónico na capa basal da epiderme onde se expresa preferentemente na parte da membrana plasmática que está fronte a bolsas da matriz ricas en ácido hialurónico.[22][42] As principais funcións do ácido hialurónico na epiderme son manter o espazo extracelular e proporcionar unha estrutura aberta e hidratada que permita o paso dos nutrientes. Comprobouse que o contido en ácido hialurónico se incrementa en presenza de ácido retinoico (derivado da vitamina A) [41]. Os efectos exercidos polo ácido retinoico na protección contra os danos producidos pola luz na pel e pola idade poden estar correlacionados, polo menos en parte, co incremento do contido en ácido hialurónico da pel, dando lugar a un aumento da hidratación do tecido. Suxeriuse que a eliminación de radicais libres por parte do ácido hialurónico contribúe á protección contra a radiación solar, apoiando o papel do CD44 como receptor do ácido hialurónico na epiderme.[22]
O ácido hialurónico epidérmico funciona tamén como un manipulador na proliferación dos queratinocitos, que é básico para o funcionamento normal da epiderme, e durante a fase de reepitelización da reparación do tecido. No proceso de curación de feridas, o ácido hialurónico exprésase nas marxes da ferida, na matriz do tecido conectivo, e situado xunto ao CD44 expresado nas células dos queratinocitos migrantes.[22][43] Kaya et al. descubriron que a supresión da expresión de CD44 por un transxene antisentido específico da epiderme orixina en animais unha acumulación deficiente de ácido hialurónico na derme superficial, acompañada de alteracións morfolóxicas distintivas dos queratinocitos basais e unha proliferación defectuosa dos queratinocitos en resposta a mitóxenos e factores de crecemento. Tamén se observaron certa perda de elasticidade da pel, unha resposta inflamatoria local alterada, e unha alteración na reparación do tecido.[22] As súas observacións son unha forte evidencia do importante papel do ácido hialurónico e do CD44 na fisioloxía da pel e na reparación do tecido.[22]
Curación das feridas e cicatrices fetais
[editar | editar a fonte]A característica principal da curación das feridas nos fetos é a ausencia de cicatrices fibrosas, que se producen na curación de feridas adultas. O contido en ácido hialurónico nas feridas fetais é aínda maior ca o das feridas adultas, o que suxire que o ácido hialurónico pode, polo menos en certo grao, reducir o depósito de coláxeno e dese modo reducir a cicatriz.[44] Isto está de acordo coas investigacións de West et al., que mostraban que, na curación de feridas nos adultos e fetos na fase final da xestación, a eliminación do ácido hialurónico causaba unha cicatriz fibrosa.[22] De todos os xeitos, o papel exacto do ácido hialurónico na cicatrización da pel está aínda investigándose, pero parece que debe contribuír a que se produza un menor grao de cicatrización fibrosa.
Papel do ácido hialurónico nas metástases do cáncer
[editar | editar a fonte]
Como se mostra na figura da dereita, varios tipos de moléculas que interaccionan co ácido hialurónico poden intervir en moitas das fases da metástase do cancro.
As hialurona sintases (HAS) desempeñan un papel en todas as fases da metástase do cáncer. Como producen ácido hialurónico antiadhesivo, as hialurona sintases permiten que as células tumorais se liberen da masa tumoral primaria, e se o ácido hialurónico se asocia con receptores como o CD44, a activación das GTPases Rho pode promover a transición epitelial-mesenquimal das células cancerosas. Durante os procesos de intravasación ou extravasación, a interacción do ácido hialurónico producido pola hialurona sintase con receptores como o CD44 ou o RHAMM promove cambios nas células que posibilitan que as células cancerosas se infiltren nos sistemas vascular ou linfático. Mentres viaxan a través de ditos sistemas, o ácido hialurónico producido polas hialurona sintetases protexe as células cancerosas de sufrir danos físicos. Finalmente, na formación de metástases, a hialurona sintase produce ácido hialurónico que permite ás células cancerosas interaccionar coas células nativas da zona secundaria e orixinar alí un tumor.[45]
As hialuronidases (HAase ou HYAL) son outros encimas que tamén xogan diversos papeis na metástase cancerosa. Ao axudaren a degradar a matriz extracelular que rodea o tumor, as hialuronidases axudan ás células cancerosas a escapar da masa tumoral primaria e desempeñan un papel principal na intravasación ao permitiren a degradación da membrana basal do vaso sanguíneo ou linfático. As hialuronidases axudan ao establecemento da metástase unha vez chegou á zona secundaria porque tamén alí axudan na extravasación e na eliminación da matriz extracelular de dita área.[46] Finalmente, as hialuronidases desempeñan unha función chave no proceso da anxioxénese. Os fragmentos de ácido hialurónico promoven a anxioxénese e as hialuronidases producen ditos fragmentos.[47] É interesante sinalar que a hipoxia tamén incrementa a produción de ácido hialurónico e a actividade das hialuronidases.[48]
Os receptores do ácido hialurónico CD44 e RHAMM foron estudados moi a fondo en relación cos seus papeis na metástase do cáncer. A expresión do CD44 incrementada clinicamente foi correlacionada positivamente coa metástase en varios tipos de tumores.[49] O CD44 afecta á adhesión das células cancerosas unhas a outras e coas células endoteliais, rearranxa o citoesqueleto por medio das GTPases Rho, e aumenta a actividade dos encimas que degradan a matriz extracelular.[50] O aumento da expresión do receptor RHAMM tamén foi clinicamente correlacionado coa metástase do cáncer. O RHAMM promove a motilidade das células cancerosas por diversas vías, entre as que están a quinase de adhesión focal (FAK), a quinase MAP (MAPK), a pp60(c-src), e as dianas da quinase Rho (ROK).[51] O receptor RHAMM pode tamén cooperar co CD44 para favorecer a anxioxénese en dirección á metástase.[52]
Aplicacións médicas
[editar | editar a fonte]O ácido hialurónico utilízase en aplicacións médicas sobre os tecidos nos que abunda, como a pel, cartilaxe, e humor vítreo.
Cirurxía ocular
[editar | editar a fonte]O primeiro produto biomédico con ácido hialurónico foi Healon, desenvolvido nas décadas de 1970 e 1980 por Pharmacia, cuxo uso está aprobado na cirurxía ocular (operacións de transplante de córnea, cataratas, glaucoma, desprendemento de retina). Outras compañías producen outras marcas similares utilizadas en cirurxía oftálmica.[53][54][55]
O ácido hialurónico nativo ten unha vida media no organismo relativamente curta, como se comprobou en coellos,[56] polo que se desenvolveron varias técnicas de fabricación que aumentan a lonxitude da cadea e estabilizan a molécula para o seu uso en aplicacións médicas. Téñense utilizado técnicas como a introdución de enlaces cruzados baseados en proteínas,[57] a introdución de moléculas que eliminan os radicais libres como o sorbitol[58] e unha mínima estabilización das cadeas de ácido hialurónico por medio de axentes químicos, como a estabilización NASHA.[59]
A finais da década de 1970, a implantación intraocular de lentes orixinaba a miúdo edemas corneais graves, debido aos danos producidos nas células endoteliais durante a cirurxía. Era evidente que era necesario un lubricante viscoso, transparente, fisiolóxico que previñese dito raspado das células endoteliais.[60][61] Endre Balazs patentou un proceso de purificación de ácido hialurónico, que chamou Healon, a partir de cristas de galo a principios da década de 1970. Ao primeiro, Balazs consideraba que Healon era principalmente un substituto vítreo non inflamatorio da substancia ocular. Posteriormente, incrementouse a viscosidade do preparado para aplicalo como axente inxectable no tratamento da artrite equina e humana, pero había pouco mercado para o produto e Pharmacia abandonou a produción de Healon.
Balazs acordou con Pharmacia enviar varios viais ao Dr. David Miller para que experimentase con eles con coellos [62] En 1976, Miller e os seus colegas publicaron un estudo que mostraba que Healon protexía o endotelio da córnea dos coellos nas implantación de lentes intraoculares. Nun ensaio clínico controlado amplo o Dr. Robert Stegmann, de Suráfrica cuantificou as vantaxes do uso de Healon na implantación intraocular de lentes, que mostraban unha vantaxe significativa con respecto ao grupo de control [63].
Nos Estados Unidos a FDA aprobou o uso en cirurxía de Healon en 1980[64].
Artrose
[editar | editar a fonte]O ácido hialurónico utilízase tamén no tratamento da artrose do xeonllo.[65] Tales tratamentos, chamados viscosuplementacións, adminístranse como unha serie de inxeccións na articulación do xeonllo, e pénsase que suplementan a viscosidade do líquido articular, polo que lubrican a articulación, amortecendo mecanicamente a articulación, e producindo un efecto analxésico. Tamén se suxeriu que o ácido hialurónico ten efectos bioquímicos positivos sobre as células cartilaxinosas, os condrocitos. Porén, algúns estudos controlados con placebo puxeron en dúbida a eficacia das inxeccións de ácido hialurónico, e o ácido hialurónico foi recomendado principalmente como a última alternativa antes de recorrer á cirurxía[66]. O uso oral do ácido hialurónico foi proposto recentemente, aínda que a súa efectividade aínda debe demostrarse. No momento actual, hai varios estudos clínicos preliminares que suxiren a administración oral do ácido hialurónico ten un efecto positivo sobre a artrose, pero precísanse máis estudos.
En 2007, a Axencia Europea de Medicinas EMA aprobou o uso de Hylan GF-20 (Synvisc) como tratamento das dores da artrose de nocello e ombro.[67]
Dermatite
[editar | editar a fonte]A pel seca e escamosa (xerose) como a causada pola dermatite atópica (eccema) por tratarse cunha loción tópica que conteña sodio hialuronato como ingrediente activo.[68]
Armazón biolóxico
[editar | editar a fonte]Debido á súa alta biocompatibilidade e a súa presenza común na matriz extracelular dos tecidos, o ácido hialurónico está utilizándose cada vez máis como biomaterial de armazón nas investigacións de enxeñaría de tecidos.[69][70] En particular, varios grupos de investigación encontraron que as propiedades do ácido hialurónico na enxeñaría de tecidos e medicina rexenerativa melloran significativamente co establecemento de enlaces cruzados no ácido hialurónico (crosslinking), producindo un hidroxel. Esta característica engadida permite aos investigadores orixinar unha forma determinada desexada, e introducir moléculas terapéuticas no hóspede.[71] Os enlaces cruzados no ácido hialurónico poden conseguirse unindo tiol (marca comercial: Extracel, HyStem),[71] metacrilatos,[72] e tiraminas (marca comercial: Corgel).[73] Este entramado de enlaces pode conseguirse tamén directamente con formaldehido (marca comercial: Hylan-A) ou con divinilsulfona (marca comercial: Hylan-B).[74]
O ácido hialurónico tamén se usa para a síntese de armazóns biolóxicos aplicados á curación de feridas. Estes armazóns normalmente conteñen proteínas como a fibronectina unidas ao ácido hialurónico que facilitan a migración celular á zona da ferida. Isto é especialmente importante para os individuos con diabetes que padecen de feridas persistentes, que non curan de forma normal.[75]
Outros usos
[editar | editar a fonte]Nalgúns cánceres, os niveis de ácido hialurónico están ben correlacionados coa malignidade do tumor e unha prognose máis grave. O ácido hialurónico é, deste modo, usado a miúdo como un marcador de tumores nos cánceres de próstata e mama. Pode usarse tamén para monitorizar a progresión da enfermidade [76].
O ácido hialurónico pode tamén utilizarse nos postoperatorios para inducir a curación dos tecidos, especialmente despois das operacións de cataratas.[77] Os modelos actuais de curación de feridas consideran que os grandes polímeros de ácido hialurónico aparecen nas fases iniciais da curación para facer sitio fisicamente para a intervención dos leucocitos, que median na resposta inmune.
A hialurona tamén se usa en produtos antiadhesivos como hialobarreira, usados amplamente na cirurxía pélvica e abdominal para previr adhesións postoperatorias [78].
Aplicacións en cosmética e estética
[editar | editar a fonte]O ácido hialurónico é un compoñente común en produtos cosméticos para o coidado da pel.
Diversas cremas de uso tópico que conteñen ácido hialurónico hidratan a pel en profundidade e combaten as engurras.
As inxeccións de ácido hialurónico para encher as zonas defectuosas dos tecidos brandos, como as engurras, son un tratamento común, que nos Estados Unidos foi aprobado pola FDA en 2003 [79] e en Europa en 1996 [80]. As inxeccións de ácido hialurónico suavizan as engurras temporalmente ao engadir volume baixo a pel, e os seus efectos adoitan durar uns seis meses. Un nome comercial común do produto é Restylane.
Juvéderm é outro reenchedor inxectable de ácido hialurónico de orixe bacteriana, similar a Restylane, pero que difire lixeiramente en termos de efectos e duración. Utilízase para o engrosamento dos beizos, redución de engurras, e eliminación de cicatrices. Os efectos dos tratamentos con Juvéderm son tamén temporais, e o seu custo é similar ao do Restylane. Nalgúns casos raros observáronse efectos adversos como reaccións alérxicas ou granulomas [81].
A presenza de ácido hialurónico no tecido epitelial promove a proliferación de queratinocitos e incrementa a presenza de ácido retinoico, hidratando a pel. A interacción do ácido hialurónico co receptor CD44 estimula a síntese de coláxeno e o funcionamento normal da pel. O ácido hialurónico presente na matriz extracelular dos queratinocitos basais é crítico para a integridade estrutural da matriz de coláxeno dérmica. Estes efectos benéficos fan que o ácido hialurónico sexa un humectnte tópico moi efectivo; pero os resultados só se manteñen se o uso forma parte dun programa de tratamento continuo.[82]
Aplicacións veterinarias nos cabalos
[editar | editar a fonte]O ácido hialurónico úsase no tratamento dos trastornos articulares dos cabalos, en particular nos de competición ou sometidos a duros traballos. Está indicado para as disfuncións da articulación carpal e metacarpofalánxica, pero non cando hai infección na articulación ou se sospeita que pode haber fractura. Utilízase principalmente para tratar a sinovite asociada a artrose equina. Pode inxectarse directamente na articulación afectada, ou por vía intravenosa nos trastornos menos localizados. Cando se inxecta directamente pode causar un suave quentamento da articulación, pero isto non afecta aos resultados clínicos finais. Administrado intraarticularmente metabolízase totalmente en menos dunha semana.[83]
Nalgúns países, como Canadá, o ácido hialurónico en preparation HY-50 non pode ser administrada a animais que vaian ser sacrificados para consumir a súa carne.[84] Pero en Europa a mesma preparación non se considera que afecte á carne de cabalo para o consumo.[85]
Notas
[editar | editar a fonte]- ↑ Coordinadores: Jaime Gómez Márquez, Ana Mª Viñas Díaz e Manuel González González. Redactores: David Villar Docampo e Luís Vale Ferreira. Revisores lingüísticos: Víctor Fresco e Mª Liliana Martínez Calvo. (2010). Dicionario de bioloxía galego-castelán-inglés. (PDF). Xunta de Galicia. p. 14. ISBN 978-84-453-4973-1.
- ↑ Frasher, J.R.E; Laurent, T. C.; Laurent, U. B. G.; et al. (1997). "Hyaluronan: its nature, distribution, functions and turnover". Journal of Internal Medicine 242: 27–33. PMID 9260563. doi:10.1046/j.1365-2796.1997.00170.x. Arquivado dende o orixinal (PDF) o 14 de decembro de 2012. Consultado o 2009-06-05. Arquivado 14 de decembro de 2012 en Archive.is
- ↑ Stern R (2004). "Hyaluronan catabolism: a new metabolic pathway". Eur J Cell Biol 83 (7): 317–25. PMID 15503855. doi:10.1078/0171-9335-00392.
- ↑ Sugahara, K.; N.B. Schwartz and A. Dorfman (1979). "Biosynthesis of hyaluronic acid by Streptococcus" (PDF). Journal of Biological Chemistry 254 (14): 6252–6261. PMID 376529.
- ↑ Wessels, M.R.; A.E. Moses, J.B. Goldberg and T.J. DiCesare (1991). "Hyaluronic acid capsule is a virulence factor for mucoid group A streptococci" (PDF). PNAS 88 (19): 8317–8321. PMC 52499. PMID 1656437. doi:10.1073/pnas.88.19.8317.
- ↑ Schrager, H.M.; J.G. Rheinwald and M.R. Wessels (1996). "Hyaluronic acid capsule and the role of streptococcal entry into keratinocytes in invasive skin infection". Journal of Clinical Investigation 98 (9): 1954–1958. PMC 507637. PMID 8903312. doi:10.1172/JCI118998.
- ↑ Toole, B.P. (2000). "Hyaluronan is not just a goo! (.pdf)". Journal of Clinical Investigation 106 (3): 335–336. PMC 314333. PMID 10930435. doi:10.1172/JCI10706.
- ↑ Holmes et al. (1988) Hyaluronic acid in human articular cartilage. Age-related changes in content and size. Biochem J 250:435-441.
- ↑ Averbeck M et al. (2007) Differential regulation of hyaluronan metabolism in the epidermal and dermal compartments of human skin by UVB irradiation. J Invest Dermatol 127:687-697.
- ↑ Glycosaminoglycans of Brain during Development. R. U. Margolis, R. K. Margolis, L. B. Chang, and C. Preti. BIOCHEMISTRY VOL. 14, NO. I , 1975. Pg. 85. Retrieved 1/17/08.
- ↑ Meyer K, Hobby GL, Chaffee E, Dawson MH (1940). "The hydrolysis of hyaluronic acid by bacterial enzymes". J Exp Med 71 (2): 137–46. PMC 2135078. PMID 19870951. doi:10.1084/jem.71.2.137.
- ↑ Saari H et al. (1993) Differential effects of reactive oxygen species on native synovial fluid and purified human umbilical cord hyaluronate. Inflammation 17:403-415.
- ↑ Schulz,T.; Schumacher,U.; Prehm,P. Hyaluronan export by the ABC transporter MRP5 and its modulation by intracellular cGMP. J.Biol.Chem.282,20999-21004
- ↑ Kakizaki, I.; Kojima, K.; Takagaki, K.; Endo, M.; Kannagi, R.; Ito, M.; Maruo, Y.; Sato, H.; Yasuda, T.; et al. (2004). "A novel mechanism for the inhibition of hyaluronan biosynthesis by 4-methylumbelliferone". J. Biol. Chem. 279 (32): 33281–33289. PMID 15190064. doi:10.1074/jbc.M405918200.
- ↑ Yoshihara, S; Kon, A; Kudo, D; Nakazawa, H; Kakizaki, I; Sasaki, M; Endo, M; Takagaki, K (2005). "A hyaluronan synthase suppressor, 4-methylumbelliferone, inhibits liver metastasis of melanoma cells.". FEBS letters 579 (12): 2722–6. PMID 15862315. doi:10.1016/j.febslet.2005.03.079.
- ↑ "Novozymes Biopharma .Produced without the use of animal-derived materials or solvents". Arquivado dende o orixinal o 15 de setembro de 2010. Consultado o 08 de outubro de 2011. Arquivado 15 de setembro de 2010 en Wayback Machine.
- ↑ 17,0 17,1 Nuevos productos de los residuos del litoral Arquivado 24 de outubro de 2011 en Wayback Machine., 12 de xaneiro de 2004, acceso 10 de outubro de 2011.
- ↑ The New York Times, From the Head of a Rooster to a Smiling Face Near You, publicado o 30 de decembro de 2003, Federation of Animal Science Societies ("Federación de Sociedades da Ciencia Animal"), acceso 10 de outubro de 2011. (en inglés)
- ↑ Puragen e DXL Arquivado 16 de outubro de 2011 en Wayback Machine., acceso 10 de outubro de 2011.
- ↑ 20,0 20,1 20,2 20,3 Wayne D. Comper, Extracellular Matrix Volume 2 Molecular Components and Interactions, 1996, Harwood Academic Publishers
- ↑ Aruffo A., et al. Cell, 1990, 61: 1303-1313
- ↑ 22,00 22,01 22,02 22,03 22,04 22,05 22,06 22,07 22,08 22,09 22,10 22,11 22,12 22,13 22,14 22,15 22,16 22,17 22,18 22,19 22,20 22,21 22,22 22,23 W. Y. John Chen and Giovanni Abatangelo, Wound Repair and Regeneration, 1999, 7: 79-89
- ↑ Kaya G. et al. Genes & Development, 1997, 15: 996-1007
- ↑ Laurent U. B. G. and Reed R. K. Advanced Drug Delivery Reviews, 1991, 7: 237-256
- ↑ Fraser J. R. E. et al. Biochemical Journal, 1988, 356: 153-158
- ↑ Campbell P. et al. Hepatology, 1990, 11: 199-204
- ↑ Angiogenesis induced by degradation products of hyaluronic acid. West DC, Hampson IN, Arnold F, Kumar S. PubMed Pub Med
- ↑ Hyaluronan (HA) fragments induce chemokine gene expression in alveolar macrophages. The role of HA size and CD44. McKee C.M. et al. PubMed PubMed
- ↑ 29,0 29,1 Kennndy J. F., et al., HA, Volume 2 Biomedical, Medical and Clinical Aspects, 2002, Woodhead Publishing Limited.
- ↑ Wisniewski H. G., et al., The Journal of Immunology, 1996, 156: 1609-1615
- ↑ Kobayashi H. and Terao T. American Journal of Physiology, 1997, 276: C1151-1159
- ↑ Mohamadzadeh M., et al., The Journal of Clinical Investigation, 1998, 101: 97-108
- ↑ Hall C. L., et al., The Journal of cell biology, 1992, 117: 1343-1350
- ↑ Wang C. et al., Clinical Cancer Research, 1998, 4: 567-576
- ↑ Hall C. L., et al., Oncogene, 1996. 13: 2213-2214
- ↑ Morriss-Kay G. M., et al., Journal of Embryology and Experimental Morphology, 1986, 98: 59-70
- ↑ Ellis I. R., et al., Experimental Cell Research, 1996, 228: 326-342
- ↑ Tammi R., et al., Journal of Investigative Dermatology, 1988, 90: 412-414
- ↑ Foschi D., et al., International Journal on Tissue Reaction, 1990, 12: 333-339
- ↑ Wisniewski H. G. and Vilcek J. Cytokine & Growth Factor Reviews, 1997, 8: 143-156
- ↑ 41,0 41,1 Tammi R, et al., Journal of Investigative Dermatology, 1989, 92: 326-332
- ↑ Tuhkanen A-L, et al., Journal of Histochemistry and Cytochemistry, 1998, 46: 241-248
- ↑ Kaya G. et al., Genes & Development, 1997, 15: 996-1007
- ↑ Longaker M. T., et al., Annals of Surgery, 1991, 213: 292-296
- ↑ Baradwaj AG, et al. Spontaneous metastasis of prostate cancer is promoted by excess hyaluornan synthesis and processing. Am J Path. 2009;174:1027-1036
- ↑ Bharadwaj AG, et al. Inducible hyaluornan production reveals differential effects of prostate tumor cell growth and tumor angiogenesis. J Cell Biol. 2007;282:20561-20572
- ↑ Gao F, et al. Hyaluronan oligosaccharides are potential stimulators to angiogenesis via RHAMM mediated signal pathway in wound healing. Clinical and Investigative Medicine. 2008;31:E106-116
- ↑ Gao, et al. Hypoxia-induced alterations in hyaluronan and hyaluronidase. Adv Exp Med Biol. 2005;566:249-256
- ↑ Ouhtit A, et al. In vivo evidence for the role of CD44s in promoting breast cancer metastasis to the liver. Am J Path. 2007;171:2033-2039
- ↑ Naor, et al. Involvement of CD44, a molecule with a thousand faces, in cancer dissemination. Sem Cancer Biol. 2008;18:260-267
- ↑ Hall CL, et al. Hyaluronan: RHAMM mediated cell locomotion and signaling in tumorigenesis. J Neuro-oncology. 1995;103:203-207
- ↑ Savani, et al. Differential involvement of the hyaluornan (HA) receptors CD44 and receptor for HA-mediated motility in endothelial cell function and angiogenesis. J Biol Chem. 2001;276:36770-36778
- ↑ "Error 404: Page Not Found Alcon". Arquivado dende o orixinal o 28 de setembro de 2011. Consultado o 08 de outubro de 2011. Arquivado 28 de setembro de 2011 en Wayback Machine.
- ↑ "Bausch & Lomb: Amvisc and Amvisc Plus - Brief Statement". Arquivado dende o orixinal o 21 de decembro de 2007. Consultado o 21 de decembro de 2007. Arquivado 21 de decembro de 2007 en Wayback Machine.
- ↑ Medical Grade Hyaluronan | Lifecore Biomedical
- ↑ >Brown TJ; Laurent UBJ Fraser JRE (1991). "Turnover of hyaluronan in synovial joints: elimination of labelled hyaluronan from the knee joint of the rabbit". Experimental Physiology 76 (1): 125–134. PMID 2015069.</
- ↑ Frampton JE (2010). "Hylan GF-20 Single injection formulation". Drugs Aging 27 (1): 77–85. PMID 20030435. doi:10.2165/11203900-000000000-00000.</
- ↑ Anteis | Change starts here
- ↑ Medicijnvrije behandeling van artrose en artritis
- ↑ 1. Miller D, O’Connor P,William J: Use of Na-Hyaluronate during intraocular lens implantation in rabbits. Ophthal Surg. 8:58-61, 1977
- ↑ 7. Miller D, Stegmann R: Healon: A Comprehensive Guide to it’s Use in Ophthalmic Surgery. J Wiley, NY, 1983
- ↑ "Copia arquivada" (PDF). Arquivado dende o orixinal (PDF) o 04 de maio de 2015. Consultado o 11 de outubro de 2011. Arquivado 04 de maio de 2015 en Wayback Machine.
- ↑ The history of modern cataract surgery.
- ↑ Stahl, Samantha (1 de xaneiro de 2011). "Insights on Viscoelastics Use" [Aprobación de Healon]. Arquivado dende o orixinal o 23 de abril de 2016. Consultado o 11 de outubro de 2011. Arquivado 23 de abril de 2016 en Wayback Machine.
- ↑ Puhl W; Scharf P (1997). "Intra-articular hyaluronan treatment for osteoarthritis". Ann Rheum Dis 56 (7): 637–40. PMC 1752402. PMID 9486013. doi:10.1136/ard.56.7.441.
- ↑ Comparison of two hyaluronan drugs and placebo in patients with knee osteoarthritis. A controlled, randomized, double-blind, parallel-design multicentre study - Karlsson et al. 41 (11): 1240 - Rheumatology
- ↑ Aprobación de Synvisc One
- ↑ Hylira. Sodium Hyaluronate Gel and Lotion.
- ↑ "doi=10.1016/j.biomaterials.2004.02.067" (PDF). Arquivado dende o orixinal (PDF) o 27 de setembro de 2007. Consultado o 08 de outubro de 2011. Arquivado 27 de setembro de 2007 en Wayback Machine.
- ↑ "Bio-skin FAQ". Arquivado dende o orixinal o 28 de maio de 2008. Consultado o 28 de maio de 2008. Arquivado 28 de maio de 2008 en Wayback Machine.
- ↑ 71,0 71,1 Shu XZ, Liu Y, Palumbo FS, Luo Y, Prestwich GD: In situ crosslinkable hyaluronan hydrogels for tissue engineering. Biomaterials, 25:1339-1348, 2004.
- ↑ Gerecht S, Burdick JA, Ferreira LS, Townsend SA, Langer R, and Vunjak-Novakovic G: Hyaluronic acid hydrogel for controlled self-renewal and differentiation of human embryonic stem cells. Proc Natl Acad Sci USA, 104:11298-11303, 2007.
- ↑ Dar A, Calabro A: Synthesis and characterization of tyramine-based hyaluronan hydrogels. J Mater Sci: Mater Med, 20:33-44, 2009.
- ↑ Wnek GE, Bowlin GL (editors): Encyclopedia of Biomaterials and Biomedical Engineering. Informa Healthcare, 2008.
- ↑ Shu XZ, Ghosh K, Liu Y, Palumbo FS, Luo Y, Clark RAF, Prestwich GD: Attachment and spreading of fibroblast on an RGD peptide-modified injectable hyaluronan hydrogel. J Biomed Materials Res, 68:365-75, 2004.
- ↑ Hyaluronan in Cancer Biology
- ↑ De Andrés Santos MI, Velasco-Martín A, Hernández-Velasco E, Martín-Gil J, Martín-Gil FJ (1994). "Thermal behaviour of aqueous solutions of sodium hyaluronate from different commercial sources". Thermochim Acta 242: 153–160. doi:10.1016/0040-6031(94)85017-8.
- ↑ Mais V, Bracco GL, Litta P, Gargiulo T, Melis GB (2006). "Reduction of postoperative adhesions with an auto-crosslinked hyaluronan gel in gynaecological laparoscopic surgery: a blinded, controlled, randomized, multicentre study". Hum. Reprod. 21 (5): 1248–54. PMID 16439505. doi:10.1093/humrep/dei488.
- ↑ FDA approval
- ↑ "Europa Press". Arquivado dende o orixinal o 06 de abril de 2004. Consultado o 10 de outubro de 2011.
- ↑ T. Lombardi, J. Samson, F. Plantier, C. Husson, R. Kuffer. Orofacial granulomas after injection of cosmetic fillers. Histopathologic and clinical study of 11 cases. Journal of Oral Path & Medicine, 33 (2), 115-120.
- ↑ Hyaluronic Acid Essential Actives, KAVI.
- ↑ Genitrix HY-50 Vet datasheet
- ↑ HY-50 for veterinary use
- ↑ "Genitrix HY-50 Vet brochure". Arquivado dende o orixinal o 01 de xuño de 2008. Consultado o 08 de outubro de 2011.
