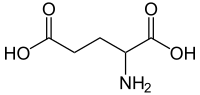
Ácido glutámico
| Ácido glutámico | |
|---|---|
 | |
 | |
Ácido 2-aminopentanedioico | |
Outros nomes Ácido 2-aminoglutárico | |
| Identificadores | |
| Número CAS | 617-65-2 |
| ChemSpider | 591 |
| UNII | 61LJO5I15S |
| KEGG | D04341 |
| ChEBI | CHEBI:18237 |
| ChEMBL | CHEMBL276389 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C5H9NO4 |
| Masa molar | 147,13 g mol−1 |
| Aspecto | po branco cristalino |
| Densidade | 1,4601 (20 °C) |
| Punto de fusión | 199 °C descomp. |
| Solubilidade en auga | 8,64 g/l (25 °C) [1] |
| Solubilidade | 0,00035g/100g etanol 25 °C [2] |
| Acidez (pKa) | 2.1, 4.07, 9.47 [3] |
| Perigosidade | |
| NFPA 704 | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

O ácido glutámico (abreviadamente Glu ou E) é un α-aminoácido que forma parte das proteínas, polo que é un aminoácido proteinoxénico. A súa cadea lateral é CH2-CH2-COOH, polo que leva un grupo carboxilo e ten carácter ácido. O grupo -COOH da súa cadea lateral ten un pKa de 4,1, polo que está desprotonado e cargado negativamente a pH fisiolóxico (entre 7,35 e 7,45). Cando está en forma de anión carboxilato (-COO- na cadea lateral) ou de sales recibe o nome de glutamato. O ácido glutámico tamén se chama ácido 2-aminopentanodioico.
Os seus codóns son GAA e GAG. Non é un aminoácido esencial, polo que non hai que consumilo na dieta. No sistema nervioso o glutamato funciona como un importante neurotransmisor, que intervén na chamada potenciación a longo prazo e é importante para os procesos da aprendizaxe e memoria.[4]
Foi descuberto e identificado en 1866 polo químico alemán Karl Heinrich Leopold Ritthausen. En 1907 foi cristalizado no Xapón por Kikunae Ikeda, que se decatou das súas propiedades como saborizante que reproducía o sabor que el mesmo denominou umami, e patentou un método para producir cristais de glutamato monosódico.[5][6]
Biosíntese
[editar | editar a fonte]| Reactivos | Produtos | Encimas |
|---|---|---|
| Glutamina + H2O | → Glu + NH3 | GLS, GLS2 |
| NAcGlu + H2O | → Glu + Acetato | (descoñecido) |
| α-cetoglutarato + NADPH + NH4+ | → Glu + NADP+ + H2O | GLUD1, GLUD2[7] |
| α-cetoglutarato + α-aminoácido | → Glu + α-cetoácido | transaminase |
| 1-Pirrolina-5-carboxilato + NAD+ + H2O | → Glu + NADH | ALDH4A1 |
| N-formimino-L-glutamato + FH4 | → Glu + 5-formimino-FH4 | FTCD |
Funcións e usos
[editar | editar a fonte]Metabolismo
[editar | editar a fonte]O glutamato é unha molécula chave no metabolismo celular. Nos humanos, as proteínas dos alimentos degrádanse durante a dixestión en aminoácidos. Un proceso básico no metabolismo dos aminoácidos é a transaminación, na cal un grupo amino dun aminoácido transfírese a un α-cetoácido nunha reacción catalizada por unha transaminase. A reacción pode ser descrita así:
- R1-aminoácido + R2-α-cetoácido ⇌ R1-α-cetoácido + R2-aminoácido
Un α-cetoácido moi común é o α-cetoglutarato, un intermediato no ciclo do ácido cítrico. A transaminación do α-cetoglutarato orixina glutamato. O α-cetoácido resultante é a miúdo tamén útil, e pode contribuír como combustible metabólico ou como substrato doutros procesos metabólicos. Como na degradación oxidativa do glutamato se orixina α-cetoglutarato, que pode entrar na gliconeoxénese, considérase un aminoácido glicoxénico. Exemplos son:
- Aspartato + α-cetoglutarato ⇌ oxalacetato + glutamato
Tanto o piruvato coma o oxalacetato son compostos importantes no metabolismo celular, no que contribúen como substratos ou intermediatos en procesos fundamentais como a glicólise, gliconeoxénese, e o ciclo do ácido cítrico.
O glutamato tamén desempeña importantes funcións no corpo, como eliminar o exceso de produtos nitroxenados. O glutamato sofre desaminación, unha reacción oxidativa catalizada pola glutamato deshidroxenase[7] da seguinte maneira:
O amoníaco (en forma de amonio) é despois predominantemente excretado como urea, a cal se sintetiza no fígado. Así, A transaminación pode asociarse á desaminación, o que permite que sexa eliminado o nitróxeno dos grupos amino dos aminoácidos, usando o glutamato como intermediato, e finalmente excretado do corpo en forma de urea.
Neurotransmisor
[editar | editar a fonte]O glutamato é o neurotransmisor excitatorio máis abundante no sistema nervioso dos vertebrados. Nas sinapses químicas o glutamato almacénase en vesículas. Os impulsos nerviosos desencadean a liberación de glutamato na célula pre-sináptica. Na célula postsináptica que está en fronte, o glutamato únese aos receptores de glutamato, como os receptores NMDA, que se activan. A causa do seu papel na plasticidade sináptica, o glutamato está implicado en funcións cognitivas cerebrais como a aprendizaxe e a memoria.[8] A forma de plasticidade denominada potenciación a longo prazo ten lugar nas sinapses glutamatérxicas do hipocampo, neocórtex, e outras partes do cerebro. O glutamato actúa non só como un transmisor dun punto a outro senón tamén interferindo con outras sinapses, nas cales a sumación de glutamato liberado nas sinapses veciñas orixina transmisións extrasinápticas.[9]
Os transportadores de glutamato[10] atópanse tanto nas membranas de neuronas coma de células da glia. Estes transportadores eliminan rapidamente o glutamato extracelular. Pero cando hai danos cerebrais, poden actuar á inversa, e pode acumularse un exceso de glutamato fóra das células. Este proceso causa que os ións calcio entren nas células polas canles dos receptores NMDA, causando danos nas neuronas e finalmente a morte celular, e isto recibe o nome de excitotoxicidade. Os mecanismos da apoptose inclúen:
- Dano nas mitocondrias por exceso de Ca2+ intracelular.[11]
- Promoción mediada por Glu/Ca2+ de factores de transcrición de xenes pro-apoptóticos, ou diminución dos factores de transcrición de xenes anti-apoptóticos.
A excitotoxicidade debida ao glutamato sucede como unha parte da cascada isquémica e está asociada co ictus cerebral[4] e doenzas como a esclerose amiotrófica lateral, latirismo, autismo, algunhas formas de retardo mental, e a enfermidade de Alzheimer.[4][12]
O ácido glutámico parece estar implicado nos ataques convulsivos epilépticos. A microinxección de ácido glutámico nas neuronas produce a despolarización espontánea cun patrón de envío de impulsos similar ao que nos ataques epilépticos se coñece como cambio de despolarización paroxísmico. Este cambio no potencial de membrana de repouso nas zonas afectadas polos ataques podería causar a apertura espontánea das canles de calcio reguladas por voltaxe, o que levaría á liberación do ácido glutámico e a unha adicional despolarización.
Entre as técnicas experimentais para detectar glutamato nas células intactas está o uso dun nanosensor fabricado por enxeñaría xenética.[13] Este sensor é unha fusión dunha proteína de unión ao glutamato e dúas proteínas fluorescentes. Cando se une o glutamato, a fluorescencia do sensor con luz ultravioleta cambia por resonancia entre os dous fluoróforos. A introdución do nanosensor nas células permite a detección óptica da concentración de glutamato. Tamén se describiron análogos sintéticos do ácido glutámico que poden ser activados por luz ultravioleta e microscopía de excitación de dous fotóns (unha técnica que usa fluorescencia).[14] Este método é útil para mapear as conexións entre neuronas, e comprender mellor a función sináptica.
A evolución dos receptores de glutamato é completamente diferente en invertebrados, en concreto en artrópodos e nematodos, nos que o glutamato estimula as canles de cloro de apertura dependente do glutamato. As subunidades beta do receptor responden ao glutamato e á glicina con moi alta afinidade.[15] Estes receptores son o obxectivo de terapias antihelmínticas (contra os vermes) como o uso das avermectinas. As avermectinas únense con alta afinidade á subunidade alfa das canles de cloro de apertura dependente do glutamato.[16] Estes receptores foron descritos tamén en artrópodos, como a mosca Drosophila melanogaster[17] e Lepeophtheirus salmonis.[18] A activación irreversible destes receptores con avermectinas causa hiperpolarización nas sinapses e unións neuromusculares, o que orixina parálise flácida e a morte dos nematodos e artrópodos.

Circuítos de sinalización glutamatérxicos non sinápticos cerebrais
[editar | editar a fonte]O glutamato extracelular no cerebro da mosca Drosophila regula a agrupación dos receptores de glutamato postsinápticos, por medio dun proceso que implica a desensibilización do receptor.[19] Un xene expresado nas células gliais orixina que se transporte activamente glutamato ao espazo extracelular,[19] mentres que nos receptores do glutamato metabotrópicos do grupo II estimuladores do nucleus accumbens, este xene parece que reduce os niveis extracelulares de glutamato.[20] Isto abre a posibilidade de que o glutamato exerza un papel "similar ao endócrino" como parte do sistema de homeostase.
Precursor do neurotransmisor GABA
[editar | editar a fonte]O glutamato tamén serve como precursor para a síntese do GABA inhibidor en neuronas GABA-érxicas. Esta reacción está catalizada pola glutamato descarboxilase (GAD), a cal é máis abondosa no cerebelo e páncreas.
A síndrome da persoa ríxida é un trastorno neurolóxico causado por anticorpos anti-GAD, que orixina unha diminución da síntese de GABA e, xa que logo, afecta a función motora provocando rixidez muscular e espasmos. Como no páncreas é tamén abundante o encima glutamato descarboxilase, este órgano sofre unha destrución inmunolóxica directa e os pacientes poden desenvolver diabetes mellitus.
Potenciador do sabor
[editar | editar a fonte]O ácido glutámico libre está presente en moitos alimentos, como queixo e prebe de soia, e é responsable do sabor umami, un dos cinco sabores básicos para os humanos. O ácido glutámico úsase a miúdo como aditivo alimentario e potenciador do sabor en forma de glutamato monosódico.
Nutriente
[editar | editar a fonte]Son excelentes fontes de ácido glutámico todas as carnes, aves, peixe, ovos, lácteos, e o kombu (algas). Alimentos vexetais ricos en proteínas son tamén fontes de ácido glutámico. Por exemplo, do 30 ao 35% do contido proteico do trigo é ácido glutámico. O 90 % do glutamato da dieta é metabolizado polas células intestinais inicialmente.[21]
Crecemento das plantas
[editar | editar a fonte]Auxigro é unha preparación para o crecemento das plantas que contén un 30% de ácido glutámico.
Espectroscopía de resonancia magnética nuclear
[editar | editar a fonte]Nos últimos anos, realizáronse moitas investigacións sobre o uso de acoplamento dipolar residual en espectroscopía de resonancia magnética nuclear. Un derivado do ácido glutámico, o poli-γ-bencil-L-glutamato (PBLG), é moi usado como un medio de aliñación para controlar a escala das interaccións dipolares observadas.[22]
Produción
[editar | editar a fonte]O maior produtor mundial de ácido glutámico é o Fufeng Group Limited chinés, e o maior consumo de glutamato faise na China, xa que a demanda mundial anual é de 1,7 toneladas, das cales 1,1 se consomen na China.
Farmacoloxía
[editar | editar a fonte]O fármaco fenciclidina (máis coñecido por PCP) é un antagonista non competitivo do ácido glutámico nos receptores NMDA. A ketamina a doses subanestésicas tamén é un competidor e causa fortes efectos alucinóxenos disociativos. O glutamato non atravesa facilmente a barreira hemato-encefálica, pero, é transportado por un sistema de transporte de alta afinidade.[23] Pode converterse tamén en glutamina.
Notas
[editar | editar a fonte]- ↑ "Copia arquivada". Arquivado dende o orixinal o 24 de marzo de 2017. Consultado o 15 de xaneiro de 2014.
- ↑ Belitz, H.-D; Grosch, Werner; Schieberle, Peter (2009-02-27). "Food Chemistry". ISBN 9783540699330.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 11 de febreiro de 1998. Consultado o 15 de xaneiro de 2014.
- ↑ 4,0 4,1 4,2 Robert Sapolsky (2005). "Biology and Human Behavior: The Neurological Origins of Individuality, 2nd edition". The Teaching Company.
see pages 19 and 20 of Guide Book
- ↑ Renton, Alex (2005-07-10). The Guardian, ed. "If MSG is so bad for you, why doesn't everyone in Asia have a headache?". Consultado o 2008-11-21.
- ↑ "Kikunae Ikeda Sodium Glutamate". Japan Patent Office. 2002-10-07. Arquivado dende o orixinal o 28 de outubro de 2007. Consultado o 2008-11-21. Arquivado 28 de outubro de 2007 en Wayback Machine.
- ↑ 7,0 7,1 Grabowska A, Nowicki M, Kwinta J. "Glutamate dehydrogenase of the germinating triticale seeds: gene expression, activity distribution and kinetic characteristics". Acta Phys. Plant. 2011. doi:10.1007/s11738-011-0801-1. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 28 de xullo de 2011. Arquivado 24 de setembro de 2019 en Wayback Machine.
- ↑ McEntee, W. & Crook, T (1993). "Glutamate: its role in learning, memory, and the aging brain.". Psychopharmacology 111 (4): 391–401. PMID 7870979. doi:10.1007/BF02253527.
- ↑ Okubo Y, Sekiya H, Namiki S, Sakamoto H, Iinuma S, Yamasaki M, Watanabe M, Hirose K, Iino M. (2010). Imaging extrasynaptic glutamate dynamics in the brain. Proc Natl Acad Sci U S A. 107:6526–6531. doi 10.1073/pnas.0913154107 PMID 20308566
- ↑ Shigeri Y, Seal RP, Shimamoto K (2004). "Molecular pharmacology of glutamate transporters, EAATs and VGLUTs". Brain Res. Brain Res. Rev. 45 (3): 250–65. PMID 15210307. doi:10.1016/j.brainresrev.2004.04.004.
- ↑ Manev H, Favaron M, Guidotti A, Costa E (1989). "Delayed increase of Ca2+ influx elicited by glutamate: role in neuronal death". Mol. Pharmacol. 36 (1): 106–12. PMID 2568579. Arquivado dende o orixinal o 24 de setembro de 2019. Consultado o 28 de xullo de 2011.
- ↑ Hynd MR, Scott HL, Dodd PR. (2004). "Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer's disease.". Neurochem Int. 45 (5): 583–95. PMID 15234100. doi:10.1016/j.neuint.2004.03.007.
- ↑ Okumoto, S.; et al. (2005). "Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors". Proceedings of the National Academy of Sciences U.S.A 102 (24): 8740–8745. PMC 1143584. PMID 15939876. doi:10.1073/pnas.0503274102.
- ↑ Ellis-Davies, G.C.R.; et al. (2007). "4-Carboxymethoxy-5,7-dinitroindolinyl-Glu: an improved caged glutamate for expeditious ultra-violet and 2-photon photolysis in brain slices". Journal of Neuroscience 27 (June): 6601–6604. PMID 17581946. doi:10.1523/JNEUROSCI.1519-07.2007.
- ↑ Laughton, D.L.; Wheeler, S.V.; Lunt, G.G.; Wolstenholme, A.J. (1995). "The beta-subunit of Caenorhabditis elegans avermectin receptor responds to glycine and is encoded by chromosome 1".". J. Neurochem 64 (5): 2354–2357. PMID 7536811. doi:10.1046/j.1471-4159.1995.64052354.x.
- ↑ Cully, D.F.; Vassilatis, D.K.; Liu, K.K.; Paress, P.S.; Van der Ploeg, LHT; Schaeffer, J.M.; Arena, J.P. (1994). "Cloning of an avermectin-sensitive glutamate gated choride channels from Caenorhabditis elegans".". Nature 371 (6499): 707–711. PMID 7935817. doi:10.1038/371707a0.
- ↑ Cully, D.F., Paress, P.S., Liu, K.K., Schaeffer, J.M. and Arena, J.P. 1996. "Identification of a Drosophila melanogaster glutamate-gated chloride channel sensitive to the antiparasitic agent avermectin". J. Biol. Chem. '271, 20187-20191'
- ↑ Tribble, N.D.; Burka, J.F.; Kibenge, F.S.B. (2007). "Identification of the genes encoding for putative gamma aminobutyric acid (GABA) and glutamate-gated chloride channel (GluCl) alpha receptor subunits in sea lice (Lepeophtheirus salmonis)".". J. Vet. Pharmacol. Ther. 30 (2): 163–167. PMID 17348903. doi:10.1111/j.1365-2885.2007.00823.x.
- ↑ 19,0 19,1 Augustin H, Grosjean Y, Chen K, Sheng Q, Featherstone DE (2007). "Nonvesicular release of glutamate by glial xCT transporters suppresses glutamate receptor clustering in vivo". Journal of Neuroscience 27 (1): 111–123. PMC 2193629. PMID 17202478. doi:10.1523/JNEUROSCI.4770-06.2007.
- ↑ Zheng Xi, Baker DA, Shen H, Carson DS, Kalivas PW (2002). "Group II metabotropic glutamate receptors modulate extracellular glutamate in the nucleus accumbens". Journal of Pharmacology and Experimental Therapeutics 300 (1): 162–171. PMID 11752112. doi:10.1124/jpet.300.1.162.
- ↑ Reeds, P.J.; et al. (1 April 2000). "Intestinal glutamate metabolism". Journal of Nutrition 130 (4s): 978S–982S. PMID 10736365.
- ↑ C. M. Thiele, Concepts Magn. Reson. A, 2007, 30A, 65-80
- ↑ Smith QR (2000). "Transport of glutamate and other amino acids at the blood-brain barrier". J. Nutr. 130 (4S Suppl): 1016S–22S. PMID 10736373.

