Radical (química)

En química, un radical, antes chamado radical libre, é un átomo, molécula, ou ión que ten electróns de valencia desapareados.[1]
Con algunhas excepcións, estes electróns desapareados orixinan radicais libres moi reactivos para con outras substancias, ou con eles mesmos: as súas moléculas a miúdo dimerízanse espontaneamente ou polimerízanse se están en contacto unhas con outras. A maioría dos radicais só son razoablemente estables se están en moi baixas concentracións en medios inertes ou no baleiro.
Un exemplo notable de radical libre é o radical hidroxilo (HO•), que é unha molécula que ten un electrón desapareado no átomo de oxíxeno. Outros dous exemplos son o oxíxeno triplete e o carbeno triplete (:CH2) que teñen dous electróns desapareados. Ao contrario, o anión hidróxido (HO-) non é un radical, xa que o electrón desapareado é resolto pola adición dun electrón; o oxíxeno singlete e o carbeno singlete tampouco son radicais, xa que os seus dous electróns están apareados.
Os radicais libres poden crearse de varias maneiras, incuíndo a síntese con reactivos rarificados moi diluídos, as reaccións a moi baixas temperaturas, ou a rotura de moléculas máis grandes. Isto último pode ser favorecido por calquera proceso que ceda suficiente enerxía á molécula parental, como unha radiación ionizante, calor, descargas eléctricas, electrólise, e reaccións químicas. Os radicais son estadios intermedios en moitas reaccións químicas.
Os radicais libres xogan un importante papel na combustión, química atmosférica, polimerización, química do plasma, bioquímica, e moitos outros procesos químicos. Nos organismos vivos, os radicais químicos superóxido e óxido nítrico e os seus produtos de reacción regulan moitos procesos, como o control do ton vascular e da presión arterial. Tamén xogan un papel clave no metabolismo intermediario de varios compostos biolóxicos. Eses radicais mesmo poden ser mensaxeiros nun proceso denominado sinalización redox. Un radical pode ser atrapado dentro dunha gaiola de solvente ou ser en caso contrario enlazado.
Cambios na terminoloxía
[editar | editar a fonte]Durante moito tempo o termo radical usouse significando grupo químico unido a outra molécula. Cando se quería especificar que non estaba unido a outra molécula denominábase radical libre. Actualmente as partes dunha molécula maior (por exemplo, un grupo carboxilo ou un grupo metilo) denomínanse grupos funcionais ou substituíntes, polo que non se usa radical con ese significado. As directrices actuais da IUPAC indican que aos grupos (xeralmente non unidos) con electróns desapareados se lles chame, simplemente, radicais, sen engadir o adxectivo "libre". Non obstante, o termo "radical libre" aínda aparece moito na literatura, e utilizarase tamén neste artigo para evitar toda ambigüidade.[1]
Historia
[editar | editar a fonte]O primeiro radical libre que se identificou foi o radical trifenilmetil. Esta especie química descubriuna Moses Gomberg en 1900 na Universidade de Míchigan, EUA.
O termo radical estaba xa en uso cando se desenvolveu a teoría dos radicais. Louis-Bernard Guyton de Morveau introducía o termo "radical" en 1785 e despois foi empregado por Antoine Lavoisier en 1789 no seu Traité Élémentaire de Chimie. Un radical foi identificado como a raíz básica de certos ácidos (a palabra latina "radix" significa "raíz"). Historicamente, o termo radical na teoría dos radicais tamén se utilizou para partes unidas a unha molécula, especialmente cando permanecen inalteradas nas reaccións. Estes radicais denomínanse agora grupos funcionais. Por exemplo, o metanol foi descrito como formado por un radical metilo e un radical hidroxilo. Pero ningún deles é un radical no sentido químico moderno do termo, xa que están permanentemente unidos entre si, e non teñen electróns desapareados reactivos; porén, estes grupos poden observarse como radicais na espectrometría de masas cando son separados por irradiación con electróns enerxéticos.
Representación en reaccións químicas
[editar | editar a fonte]En reaccións químicas, os radicais libres son normalmente representados por un punto situado inmediatamente á dereita do símbolo atómico ou fórmula molecular, tal como segue:
- O gas cloro pode ser escindido pola luz ultravioleta, orixinando dous radicais cloro atómicos.
Os mecanismos de reacción dos radicais usan frechas dunha soa cabeza (ver debuxo) para indicar o movemento dun electrón:
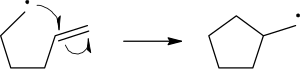
A clivaxe homolítica do enlace que rompe debúxase cunha frecha con punta de 'amocelo' para distinguila do movemento usual de dous electróns representado por unha frecha estándar curva[2]. Hai que salientar que o segundo electrón do enlace que rompe tamén se move para emparellarse co electrón do radical de ataque; isto non está explicitamente indicado neste caso.
Os radicais libres tamén forman parte da adición radical e da substitución radical como intermediarios reactivos. As cadeas de reaccións que implican radicais libres poden xeralmente dividirse en tres procesos diferentes, que son: iniciación, propagación, e terminación.
- Reaccións de iniciación son aquelas que teñen como resultado un incremento neto no número de radicais libres. Poden implicar a formación de radicais libres a partir de especies estables como na reacción de arriba ou poden implicar reaccións de radicais libres con especies estables para formar máis radicais libres.
- Reaccións de propagación son aquelas reaccións que implican radicais libres nas cales o número total de radicais libres permanece igual.
- Reaccións de terminación son aquelas que dan lugar a unha diminución neta no número de radicais libres. Tipicamente dous radicais libres combínanse para formar unha especie máis estable, por exemplo: 2Cl·→ Cl2
Formación
[editar | editar a fonte]A formación de radicais pode implicar a rotura de enlaces covalentes por homólise, un proceso que require cantidades significativas de enerxía. Tales enerxías denomínanse enerxías de disociación de enlace homolíticas, xeralmente abreviadas como "ΔH°". Ao escindirse o H2 en 2H•, por exemplo, require un ΔH° de +435 kJ·mol-1, mentres que a escisión de Cl2 en 2Cl• require un ΔH° de +243 kJ·mol−1.
A enerxía de enlace entre dous átomos enlazados covalentemente está afectada pola estrutura global da molécula, non simplemente pola identidade dos dous átomos. Igualmente, os radicais que requiren máis enerxía para formarse son menos estables que os que requiren menos enerxía. Unha barreira adicional pode ser a regra de selección. Porén, a propagación, é moi exotérmica.
A formación de radicais por medio de rotura de enlaces homolítica na maior parte dos casos ocorre entre dous átomos de electronegatividade similar; en química orgánica, isto está a miúdo entre o enlace O–O en especies de peróxido ou entre enlaces O–N. Os radicais poden tamén formarse por oxidación ou redución dun só electrón dun átomo ou molécula: un exemplo é a produción de superóxido pola cadea de transporte de electróns. Estudos iniciais de química organometálica (especialmente os de F. A. Paneth e K. Hahnfeld sobre especies de tetra-alquil chumbo feitos durante a década de 1930) apoiaron a fisión heterolítica de enlaces e un mecanismo baseado nos radicais. Aínda que existen os ións radicais, a maioría das especies son electricamente neutras.
Persistencia e estabilidade
[editar | editar a fonte]
Aínda que os radicais son xeralmente de vida curta debido á súa reactividade, hai tamén radicais de vida longa, que se clasifican da seguinte maneira:
Radicais estables
[editar | editar a fonte]O primeiro exemplo dun radical estable é o dioxíxeno molecular (O2). Outro exempolo común é o óxido nítrico (NO). Os radicais orgánicos poden ser de vida longa se aparecen nun sistema π conxugado, como o radical derivado do α-tocoferol (vitamina E). Hai tamén centos de exemplos de radicais tiazil, que presentan unha baixa reactividade e unha estabilidade termodinámica notable con só unha moi limitada estabilización de resonancia π.[3][4]
Radicais persistentes
[editar | editar a fonte]Os compostos radicais persistentes son aqueles que teñen unha lonxevidade debida a ateigamento estérico arredor do centro radical, o que fai fisicamente difícil para o radical reaccionar con outra molécula.[5] Exemplos son o radical trifenilmetil de Gomberg, o sal de Fremy (potasio nitrosodisulfonato, (KSO3)2NO·), os nitróxidos, (fórmula xeral R2NO·) como TEMPO, TEMPOL, nitronil nitróxidos, e azefenilenís e radicais derivados de PTM (radical perclorofenilmetil) e TTM (radical tris(2,4,6-triclorofenil)metil). Xéranse radicais persistentes en grandes cantidades durante a combustión, e "poden ser responsables do estrés oxidativo que se orixina na enfermidade cardiopulmonar e probablemente no cancro, que foi atribuído á exposición a partículas finas presentes no aire."[6]
Dirradicais
[editar | editar a fonte]Os dirradicais son moléculas que conteñen dous centros radicais. Nunha molécula poden existir moitos centros radicais. O oxíxeno atmosférico existe naturalmente como un dirradical no seu estado fundamental como oxíxeno triplete. A baixa reactividade do oxíxeno atmosférico débese ao seu estado dirradical. Os estados de non radical do dioxíxeno son en realidade menos estables que o de dirradical. A estabilidade relativa do dirradical oxíxeno é principalmente debida á natureza de spin prohibido da transición triplete-singlete requirida para que atrape electróns, é dicir, para que se "oxide". O estado dirradical do oxíxeno tamén se orixina polo seu carácter paramagnético, que se demostra pola súa atracción por un imán externo.[7]
Reactividade
[editar | editar a fonte]Os intermediarios alquilo radicais son estabilizados por procesos químicos similares aos dos carbocatións: como regra xeral, canto máis substituído está o centro radical, máis estable é. Isto é o que dirixe as súas reaccións. Así, a formación dun radical terciario (R3C·) está favorecida sobre a formación dun secundario (R2HC·), que á súa vez está favorecido con respecto á formación dun primario (RH2C·). Igualmente, os radicais que están ao lado de grupos funcionais como o carbonilo, nitrilo e éter son máis estables que os radicais alquilo terciarios.
Os radicais atacan dobres enlaces. Porén, a diferenza de ións similares, estas reaccións de radicais non están tan dirixidas por interaccións electrostáticas. Por exemplo, a reactividade de ións nucleofílicos con compostos α,β-insaturados (C=C–C=O) é dirixida polo efecto de retirada do electrón do oxíxeno, o que orixina unha carga parcial positiva situada sobre o carbono do carbonilo. Hai dúas reaccións que se observan no caso iónico: o carbonilo é atacado nunha adición directa ao carbonilo, ou o vinilo é atacado en adición conxugada, e en ambos os casos a carga sobre o nucleófilo é captada polo oxíxeno. Os radicais engádense rapidamente ao dobre enlace, e o α-radical carbonilo resultante é relativamente estable; pode acoplarse con outra molécula ou ser oxidado. Non obstante, o carácter electrofílico/neutrofílico dos radicais foi observado en varios casos. Un exemplo é a tendencia alternante da copolimerización do anhídrido maleico (electrofílico) e estireno (lixeiramente nucleofílico).
En reaccións intramoleculares, pode conseguirse un control preciso malia a extrema reactividade dos radicais. En xeral, os radicais atacan o sitio reactivo máis próximo con maior facilidade. Por tanto, cando hai elección, obsérvase unha preferencia por aneis de cinco membros: os aneis de cinco membros están demasiado tensionados, e as colisións con carbonos situados a seis ou máis átomos de distancia na cadea son infrecuentes.
Os carbenos tripletes e nitrenos, que son dirradicais, teñen unha química distintiva.
Combustión
[editar | editar a fonte]Unha reacción familiar de radicais libres é a combustión. A molécula de oxíxeno é un dirradical estable, que se representa máis apropiadamente como ·O-O·. Como os spins dos electróns son paralelos, esta molécula é estable. Aínda que o estado fundamental do oxíxeno é o dirradical (triplete) de spin desapareado non reactivo, existe tamén un estado (singlete) de spin apareado extremadamente reactivo. Para que ocorra a combustión, a barreira de enerxía entre estes debe ser superada. Esta barreira pode ser superada con calor, para o que cómpren altas temperaturas. A transición triplete-singlete é tamén unha transición "prohibida". Isto supón unha barreira adicional á reacción. Tamén significa que o oxíxeno molecular é relativamente non reactivo a temperatura moderada agás en presenza de átomos pesados catalíticos como o ferro ou o cobre.
A combustión consiste en varias reaccións en cadea de radicais que pode iniciar o oxíxeno singlete. A inflamabilidade dun material dado depende fortemente da concentración de radicais libres que se debe obter antes de que a iniciación e propagación das reaccións dominen orixinando a combustión do material. Unha vez que o material combustible se consumiu, as reaccións de terminación dominan outra vez e a chama apágase. Como se indicou, a promoción de reaccións de propagación ou terminación altera a inflamabilidade. Por exemplo, antes era común engadirlle á gasolina tetraetilo de chumbo, xa que o propio chumbo desactiva os radicais libres na mestura gasolina-aire (actualmente utilízase gasolina sen chumbo para evitar a contaminación). Isto impide que a combustión se inicie de maneira incontrolada ou en residuos non queimados (detonación ou picado do motor) ou a ignición prematura (autoencendido ou preignición).
Cando se queima un hidrocarburo, están implicados unha gran cantidade de radicais do oxíxeno diferentes. Inicialmente, fórmase o radical hidroxiperoxilo (HOO·). Estes radicais reaccionan despois para dar hidroperóxidos orgánicos que rompen orixinando radicais hidroxilo (HO·).
Polimerización
[editar | editar a fonte]Ademais da combustión, moitas reaccións de polimerización implican radicais libres. Como resultado, moitos plásticos, esmaltes, e outros polímeros fórmanse por polimerización de radicais. Por exemplo, os aceites de secado e pinturas alquido (con poliésteres modificados pola adicion de ácidos graxos e outros compoñentes) endurecen debido a enlaces cruzados de radicais por causa do oxíxeno atmosférico.
Avances recentes en métodos de polimerización de radicais, coñecidos como polimerización de radicais "vivos" (living radical polymerization) son:
- Transferencia de adición reversible-fragmentación de cadea (RAFT)
- Polimerización de radicais de transferencia de átomos (ATRP)
- Polimerización mediada por nitróxido (NMP)
Estes métodos producen polímeros cunha distribución máis estreita de pesos moleculares.
Radicais atmosféricos
[editar | editar a fonte]O radical máis común na baixa atmosfera é o dioxíxeno molecular. A fotodisociación de certas moléculas produce outros radicais libres. Na baixa atmosfera, os exemplos máis importantes da produción de radicais libres son a fotodisociación do dióxido de nitróxeno para dar un átomo de oxíxeno e óxido nítrico (ver ecuación 1 máis abaixo), o cal desempeña un papel clave na formación do smog, e na fotodisociación do ozono para dar o átomo de oxíxeno excitado O(1D) (ver ecuación 2 máis abaixo). As reaccións neta e de retorno móstranse tamén (ecuacións 3 e 4, respectivamente).
Na alta atmosfera, unha fonte especialmente importante de radicais é a fotodisociación de clorofluorocarbonos (CFCs) normalmente non reactivos pola radiación ultravioleta solar, ou por reaccións con outros constituíntes estratosféricos (ver ecuación 1 máis abaixo). Estas reaccións renden o radical cloro Cl•, que reacciona co ozono nunha reacción en cadea catalítica que acaba producindo unha diminución da capa de ozono e unha rexeneración do radical cloro, o que permite que volva a participar na reacción (ver ecuación 2–4 máis abaixo). Crese que ditas reaccións son a causa principal da diminución da capa de ozono (o resultado neto móstrase na ecuación 5 de máis abaixo), e a isto débese que se restrinxise o uso dos clorofluorocarbonos como refrixerantes.
En bioloxía
[editar | editar a fonte]Os radicais libres xogan un importante papel en varios procesos biolóxicos. Moitos deles son necesarios para a vida, como no proceso necesario para matar intracelularmente bacterias que ten lugar nas células fagocíticas como os granulocitos e os macrófagos. Os radicais libres foron implicados en certos procesos de transdución de sinais,[8] chamados sinalización redox.
Os dous radicais libres máis importantes centrados no oxíxeno son o superóxido e o radical hidroxilo. Derivan do oxíxeno molecular en condicións redutoras. Porén, debido á súa reactividade, estes mesmos radicais libres poden participar en reaccións laterais non desexadas que causan danos celulares. A presenza de cantidades excesivas destes radicais libres poden orixinar danos e morte celular, o cal pode contribuír a moitas doenzas como o cancro, accidente cerebrovascular, infarto agudo de miocardio, diabete e trastornos importantes.[9] Pénsase que moitas formas de cancro son o resultado de reaccións entre radicais libres e o ADN, que potencialmente teñen como resultado mutacións que pode afectar negativamente ao ciclo celular e poden levar á formación dun tumor maligno.[10] Algúns dos síntomas do envellecemento ou senescencia como a aterosclerose tamén se atribúen á oxidación do colesterol inducida polos radicais libres, que dá lugar a 7-cetocolesterol.[11] Ademais, os radicais libres contribúen ao danos hepáticos inducidos polo alcohol, quizais máis que o propio alcohol. Os radicais libres producidos polo fume dos cigarros están implicados na inactivación da alfa 1-antitripsina nos pulmóns; este proceso promove o desenvolvemento de enfisemas.
Os radicais libres poden tamén estar implicados na enfermidade de Parkinson, a xordeira senil e inducida por fármacos, esquizofrenia, e enfermidade de Alzheimer.[12] A síndrome de radicais libres clásica, a enfermidade de almacenamento de ferro chamada hemocromatose, está tipicamente asociada cunha constelación de síndromes relacionadas cos radicais libres que inclúen trastornos do movemento, psicoses, anormalidades da melanina pigmentaria da pel, xordeira, artrite, e diabetes mellitus. A teoría dos radicais libres sobre o envellecemento propón que a acción dos radicais libres subxace no proceso da senescencia. Por outra parte, o proceso da mitohormese (hormese mitocondrial) suxire que a exposición repetida a pequenas doses de radicais libres pode aumentar a duración da vida en condicións de restrición de glicosa e práctica regular de exercicio físico.
Como os radicais libres son necesarios para a vida, o corpo ten varios mecanismos para minimizar os danos inducidos polos radicais libres e para reparar os danos que se produzan, como poden ser encimas como a superóxido dismutase, catalase, glutatión peroxidase e glutatión redutase. Ademais, os antioxidantes xogan un papel clave nestes mecanismos de defensa. Entre eles están as tres vitaminas A, C e E e os antioxidantes polifenólicos. Ademais, non hai probas claras que indiquen que a bilirrubina e o ácido úrico poden actuar como antioxidantes para axudar a neutralizar certos radicais libres. A bilirrubina procede da degradación do contido dos eritrocitos mortos, mentres que o ácido úrico é un produto da degradación das purinas. Porén, demasiada bilirrubina pode orixinar ictericia, o cal pode finamente danar o sistema nervioso central, mentres que un exceso de ácido úrico causa a gota.[13]
Especies reactivas do oxíxeno
[editar | editar a fonte]As especies reactivas do oxíxeno (ERO ou ROS) son especies como o superóxido, peróxido de hidróxeno, e radical hidroxilo, asociados comunmente con danos celulares. As especies reactivas do oxíxeno son un subproduto natural do metabolismo normal do oxíxeno e teñen importantes papeis na sinalización celular.
A oxibenzona forma radicais libres á luz do sol, e, por tanto, pode ser asociada con danos celulares. Isto só ocorre cando é combinada con outros compoñentes que adoitan encontrarse en filtros solares, como o óxido de titanio e octil metoxicinamato.[14]
Definición menos estrita de radical
[editar | editar a fonte]Na maioría dos campos da química, a definición histórica de radical afirma que as moléculas teñen un spin distinto de cero. Porén, en campos como a espectroscopia, reaccións químicas, e astroquímica, a definición é lixeiramente diferente. Gerhard Herzberg, gañador do premio Nobel polas súas investigacións sobre a xeometría e estrutura electrónica dos radicais, suxeriu unha definición menos estrita de radical libre: "calquera especie transitoria (quimicamente inestable) sexa átomo, molécula ou ión".[15] O principal punto desta proposta é que hai moitas moléculas quimicamente inestables que teñen spin cero, como C2, C3, CH2 etc. Esta definición é máis conveniente para discusións de procesos químicos transitorios e en astroquímica; por tanto, os investigadores neses campos prefiren usar esta definición menos estrita.[16]
Detección e diagnóstico
[editar | editar a fonte]Entre as técnicas de detección e diagnóstico de radicais libres usadas en investigación están:
- Unha técnica amplamente usada para estudar os radicais libres, e outras especies paramagnéticas, é a espectroscopia de resonancia de spin do electrón (ESR), que tamén se pode denominar espectroscopia de "resonancia paramagnética do electrón" (EPR). Está relacionada conceptualmente coa resonancia magnética nuclear, aínda que os electróns presentan resonancia con campos de frecuencia máis alta nun determinado campo magnético fixado que a que presentan a maioría dos núcleos atómicos.
- Aplícase usando un fenómeno chamado CIDNP (chemically induced dynamic nuclear polarization, polarización nuclear dinámica inducida quimicamente).
- Etiquetaxe química.
- A etiquetaxe química por quenching con radicais libres, por exemplo con óxido nítrico (NO) ou DPPH (2,2-difenil-1-picrilhidrazil), seguido de uso de métodos de espectroscópicos como espectroscopia fotoelectrónica de raios X (XPS) ou espectroscopia de absorción, respectivamente.
- Uso de marcadores radicais libres.
- Poden medirse os derivados estables específicos ou non específicos de substancias fisiolóxicas, por exemplo produtos de peroxidación de lípidos (isoprostanos, TBARS), aminoácidos produtos de oxidación (meta-tirosina, orto-tirosina, hidroxi-leucina, ditirosina etc.), produtos da oxidación de péptidos (glutatión disulfuro ou oxidado, GSSG)
- O 2,2'-azobis(2-amidinopropano) dihidrocloruro (AAPH) é un composto químico usado para estudar a química da oxidación de fármacos.[17] É un composto azo que xera radicais libres. Está facéndose cada vez máis importante como oxidante modelo en terapéuticas que usan pequenas moléculas ou proteínas pola súa capacidade de iniciar reaccións de oxidación por medio tanto de mecanismos nucleofílicos coma de radicais libres.[18]
- Método indirecto.
- Medidas do decrecemento na cantidade de antioxidantes (por exemplo, TAS, glutatión reducido, GSH).
- Utiliza unha especie química que reacciona cos radicais libres para formar un produto estable, que pode despois ser medido facilmente (radical hidroxilo e ácido salicílico).
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 IUPAC Gold Book radical (free radical) PDF Arquivado 06 de xullo de 2017 en Wayback Machine.
- ↑ USING CURLY ARROWS IN REACTION MECHANISMS
- ↑ Oakley, Richard T. (1988). "Cyclic and Heterocyclic Thiazenes" (PDF). Progress in Inorganic Chemistry 36: 299–391. ISBN 978-0-470-16637-6. doi:10.1002/9780470166376.ch4. Arquivado dende o orixinal (PDF) o 23 de setembro de 2015. Consultado o 01 de xuño de 2015.
- ↑ Rawson, J; Banister, A; Lavender, I (1995). "The Chemistry of Dithiadiazolylium and Dithiadiazolyl Rings". Advances in Heterocyclic Chemistry 62: 137–247. ISBN 978-0-12-020762-6. doi:10.1016/S0065-2725(08)60422-5.
- ↑ Griller, David; Ingold, Keith U. (1976). "Persistent carbon-centered radicals". Accounts of Chemical Research 9: 13. doi:10.1021/ar50097a003.
- ↑ Lomnicki S.; Truong H.; Vejerano E.; Dellinger B. (2008). "Copper oxide-based model of persistent free radical formation on combustion-derived particulate matter". Environ. Sci. Technol. 42 (13): 4982–4988. PMID 18678037. doi:10.1021/es071708h.
- ↑ Porén, o paramagnetismo non implica necesariamente ter caracter de radical.
- ↑ Pacher P, Beckman JS, Liaudet L (2007). "Nitric oxide and peroxynitrite in health and disease". Physiol. Rev. 87 (1): 315–424. PMC 2248324. PMID 17237348. doi:10.1152/physrev.00029.2006.
- ↑ Rajamani Karthikeyan, Manivasagam T, Anantharaman P, Balasubramanian T, Somasundaram ST (2011). "Chemopreventive effect of Padina boergesenii extracts on ferric nitrilotriacetate (Fe-NTA)-induced oxidative damage in Wistar rats". J. Appl. Phycol. 23, Issue 2, Page 257 (2): 257–263. doi:10.1007/s10811-010-9564-0.
- ↑ Mukherjee, P. K., Marcheselli, V. L., Serhan, C. N., & Bazan, N. G. (2004). Neuroprotecin D1: A docosahexanoic acid-derived docosatriene protects human retinal pigment epithelial cells from oxidative stress. Proceedings of the National Academy of Sciences of the USA, 101(22), 8491–8496. doi 10.1073/pnas.0402531101
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/10224662
- ↑ Floyd, R. A., (1999). Neuroinflammatory processes are important in neurodegenerative diseases: An hypothesis to explain the increased formation of reactive oxygen and nitrogen species as major factors involved in neurodegenerative disease development. Free Radical Biology and Medicine, 26(9–10), 1346–1355. doi 10.1016/S0891-5849(98)002937
- ↑ Un resumo do papel dos radicais libres en bioloxía e do uso da resonancia de spin dos electróns para a súa detección pode encontrarse en Rhodes C.J. (2000). Toxicology of the Human Environment – the critical role of free radicals. London: Taylor and Francis. ISBN 0-7484-0916-5.
- ↑ Serpone N, Salinaro A, Emeline AV, Horikoshi S, Hidaka H, Zhao JC. 2002. An in vitro systematic spectroscopic examination of the photostabilities of a random set of commercial sunscreen lotions and their chemical UVB/UVA active agents. Photochemical & Photobiological Sciences 1(12): 970-981.
- ↑ G. Herzberg (1971), "The spectra and structures of simple free radicals", ISBN 0-486-65821-X.
- ↑ 28th International Symposium on Free Radicals Arquivado 16 de xullo de 2007 en Wayback Machine..
- ↑ Betigeri, Seema; Thakur, Ajit; Raghavan, Krishnaswamy (2005). "Use of 2,2?-Azobis(2-Amidinopropane) Dihydrochloride as a Reagent Tool for Evaluation of Oxidative Stability of Drugs". Pharmaceutical Research 22 (2): 310–7. PMID 15783080. doi:10.1007/s11095-004-1199-x.
- ↑ Werber, Jay; Wang, Y. John; Milligan, Michael; Li, Xiaohua; Ji, Junyan A. (2011). "Analysis of 2,2′-azobis (2-amidinopropane) dihydrochloride degradation and hydrolysis in aqueous solutions". Journal of Pharmaceutical Sciences 100 (8): 3307–15. PMID 21560126. doi:10.1002/jps.22578.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Cannabinoids as antioxidants and neuroprotectants Arquivado 06 de xullo de 2011 en Wayback Machine.- The United States of America - the Department of Health and Human Services (Washington, D.C.)










