Neurofilamento
Neurofilamento NF-L, polipéptido lixeiro ou baixo de ~68kDa
| |
| Identificadores | |
| Símbolo | NEFL |
| Entrez | 4747 |
| HUGO | 7739 |
| OMIM | |
| RefSeq | NM_006158 |
| UniProt | P07196 |
| Outros datos | |
| Locus | Cr. 8 p21 |
Neurofilamento NF-M 3 145-160kDa, subunidade de neurofilamento media
| |
| Identificadores | |
| Símbolo | NEF3 |
| Símbolos alt. | NEFM |
| Entrez | 4741 |
| HUGO | 7734 |
| OMIM | |
| RefSeq | NM_005382 |
| UniProt | P07197 |
| Outros datos | |
| Locus | Cr. 8 p21 |
NF-H 200-220kDa, subunidade de neurofilamento de peso molecular alto ou pesada
| |
| Identificadores | |
| Símbolo | NEFH |
| Entrez | 4744 |
| HUGO | 7737 |
| OMIM | |
| RefSeq | NM_021076 |
| UniProt | P12036 |
| Outros datos | |
| Locus | Cr. 22 q12.1-13.1 |
Proteína de filamento intermedio neuronal alfa-internexina
| |
| Identificadores | |
| Símbolo | INA |
| Símbolos alt. | NEF5 |
| Entrez | 9118 |
| HUGO | 6057 |
| OMIM | |
| RefSeq | NM_032727 |
| UniProt | Q5SYD2 |
| Outros datos | |
| Locus | Cr. 10 q24 |
Nestina, subunidade de filamento intermedio de células nai neuronais
| |
| Identificadores | |
| Símbolo | NES |
| Entrez | 10763 |
| HUGO | 7756 |
| OMIM | |
| RefSeq | NP_006608 |
| UniProt | P48681 |
| Outros datos | |
| Locus | Cr. 1 q23.1 |

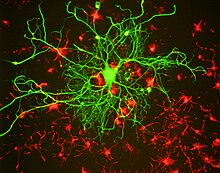

Os neurofilamentos (NF) son un tipo de filamentos intermedios de 10 nanómetros de grosor, que se encontran nas neuronas. Son un compoñente principal do citoesqueleto das neuronas, e crese que funcionan principalmente dando soporte estrutural ao axón, proporcionando forza mecánica e regulando o diámetro do axón. Os neurofilamentos están compostos de cadeas de polipéptidos ou subunidades proteicas que pertencen á mesma familia proteica ca os outros filamentos intermedios doutros tecidos, como as subunidades de queratina, que forman os filamentos intermedios que se expresan especificamente nos epitelios. A familia de proteínas que forma os filamentos intermedios divídese en 5 grandes clases, e as subunidades de neurofilamentos maiores pertencen á clase IV, xunto con outras proteínas filamentosas das neuronas, como a alfa-internexina e a nestina. Os xenes dos filamentos intermedios de clase IV comparten dous intróns peculiares que non se encontran noutras secuencias xénicas de filamentos intermedios, o que suxire que teñen unha orixe evolutiva común a partir dun xene primitivo de clase IV.
Clasificación[editar | editar a fonte]
Proteínas das subunidades[editar | editar a fonte]
As tres subunidades de neurofilamento principais foron descubertas ao estudar o transporte axonal. Estas proteínas sintetízanse no corpo celular, e deben viaxar desde alí todo ao longo do axón para chegaren ao seu destino final. Os nomes dados ás tres subunidades de neurofilamentos principais están baseados na súa masa molecular aparente das subunidades de mamífero ao facelas correr en xeles de electroforese SDS-PAGE:
- a lixeira ou de masa máis baixa (NF-L) ten 68-70 kDa
- a media ou mediana (NF-M) ten uns 145-160 kDa
- a pesada o de masa máis alta (NF-H) ten 200-220 kDa.
Estas tres proteínas denomínanse frecuentemente o "triplete do neurofilamento", e desenvolvéronse numerosos anticorpos específicos para estas proteínas e están dispoñibles comercialmente. Ditos anticorpos son moi utilizados para identificar as neuronas e os seus procesos nos cortes histolóxicos e en cultivos de tecidos. As masas moleculares obtidas na SDS-PAGE das proteínas do triplete varían entre as especies de mamíferos. As masas moleculares reais destas proteínas son considerablemente menores ca as estimadas baseándose na mobilidade en SDS-PAGE, particularmente no caso da NF-H e a NF-M. Isto débese ás rexións C-terminais moi cargadas das moléculas. As tres proteínas do triplete conteñen longas extensións da secuencia do péptido ricas en residuos de ácido glutámico, e a NF-M e especialmente a NF-H tamén conteñen sitios de fosforilación de serina repetidos en támdem múltiple. Estes sitios conteñen case todos o péptido lisina-serina-prolina (KSP), e a fosforilación encóntrase normalmente nos neurofilamentos axonais e non dendríticos. A NF-M humana ten 13 destes sitios KSP, e a NF-H humana exprésase a partir de dous alelos un dos cales produce 44 repeticións KSP e outro 45. A cuarta subunidade de clase IV alfa-internexina (NF66) descubriuse moito máis tarde ca a NF-L, NF-M e NF-H, e está copolimerizada con ditas proteínas na maioría das neuronas maduras. Exprésase xeralmente antes no desenvolvemento ca as outras proteínas de neurofilamentos e pode atoparse nalgunhas neuronas en ausencia aparente do triplete do neurofilamento.
A quinta proteína pertencente á clase IV, a nestina, encóntrase en neuronas en desenvolvemento e na glía, e a presenza desta proteína é moi utilizada para definir a neuroxénese. Esta proteína pérdese a medida que avanza o desenvolvemento.
A subunidade de filamentos intermedios de clase III periferina encóntrase tamén nos neurofilamentos xunto coas subunidades de clase IV, pero só nunhas poucas neuronas, principalmente no sistema nervioso periférico. Finalmente, outra subuinidade de filamentos intermedios de clase III, a vimentina, encóntrase en neuronas en desenvolvemento e nunhas poucas neuronas moi infrecuentes no adulto en asociación cos proteínas de clase IV, como son as neuronas ou células horizontais da retina.
No mamífero adulto as proteínas das subunidades dos neurofilamentos coensámblanse in vivo, formando un heteropolímero que contén a NF-L ou a alfa-internexina xunto con NF-M ou NF-H. A periferina e a vimentina poden incorporarse aos neurofilamentos xunto con ditas proteínas. As proteínas NF-H e NF-M teñen dominios de cola C-terminais longos que parecen controlar o espazado entre neurofilamentos veciños, xerando disposicións aliñadas cun espazado entre filamentos bastante uniforme como se ve nos axóns.
Crecemento[editar | editar a fonte]
Durante o crecemento do axón, incorpóranse novas subunidades de neurofilamentos ao longo do axón nun proceso dinámico que implica a adición de subunidades en toda a lonxitude do filamento e tamén nos extremos do filamento.
Desopois de que creceu un axón e se conectou coa súa célula obxectivo, o diámetro do axón pode incrementarse ata cinco veces.
Os neurofilamentos poden determinar o diámetro das dendritas e axóns porque a súa polaridade causa que se repelan uns a outros.
O nivel de expresión xénica dos neurofilamentos parece controlar directamente o diámetro axónico, que á súa vez controla como viaxan ao longo do axón os sinais eléctricos rápidos.[1]
Os ratos mutantes con anormalidades nos neurofilamentos teñen fenotipos que lembran a esclerose lateral amiotrófica.[2]
Uso en patoloxía diagnóstica[editar | editar a fonte]
A inmunomarcaxe de neurofilamentos é un método de diagnóstico común en neuropatoloxía. É útil para diferenciar as neuronas (positivas para os neurofilamentos) das células da glía (negativas para os neurofilamentos).
Notas[editar | editar a fonte]
- ↑ Alberts, Bruce (2002). Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1.
- ↑ Lalonde R, Strazielle C; Strazielle (2003). "Neurobehavioral characteristics of mice with modified intermediate filament genes". Rev Neurosci 14 (4): 369–85. PMID 14640321. doi:10.1515/REVNEURO.2003.14.4.369.
