Glicina
- Non confundir coa planta chamada glicinia (xénero 'Wisteria') ou co xénero de plantas 'Glycine' (ao que pertence a soia).
| Glicina[1] | |
|---|---|
|
|
|

|
Glicina | |
Outros nomes Ácido aminoetanoico | |
| Identificadores | |
| Abreviaturas | Gly, G |
| Número CAS | 56-40-6 |
| PubChem | 750 |
| ChemSpider | 730 |
| UNII | TE7660XO1C |
| Número CE | 200-272-2 |
| DrugBank | DB00145 |
| KEGG | D00011 |
| ChEBI | CHEBI:15428 |
| ChEMBL | CHEMBL773 |
| Ligando IUPHAR | 727 |
| Código ATC | B05 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C2H5NO2 |
| Masa molar | 75,07 g mol−1 |
| Aspecto | sólido branco |
| Densidade | 1,607 g/cm3 |
| Punto de fusión | 233 °C (descomposición) |
| Solubilidade en auga | 24,99 g/100 mL (25 °C)[2] |
| Solubilidade | soluble en etanol, piridina insoluble en éter |
| Acidez (pKa) | 2,34 (carboxilo), 9,6 (amino)[3] |
| Perigosidade | |
| LD50 | 2600 mg/kg (rato, oral) |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

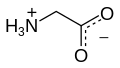
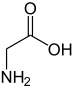
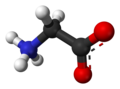
A glicina[4] (abreviadamente Gly ou G) é un α-aminoácido coa fórmula química NH2CH2COOH. A súa cadea lateral está formada só por un átomo de H, o que fai da glicina o aminoácido coa cadea lateral máis simple e o máis pequeno dos 20 aminoácidos proteicos. Os seus codóns son GGU, GGC, GGA e GGG.
A glicina é un sólido cristalino incoloro e doce. Forma parte das proteínas, pero tamén funciona como neurotransmisor. É único entre os aminoácidos en non ter un carbono asimétrico ou centro quiral (porque o seu carbono alfa está unido a dous substituíntes iguais, dous hidróxenos), polo que é o único aminoácido proteico que non ten isómeros D e L. Aínda que a súa cadea lateral formada por un só hidróxeno é hidrófoba, esta é tan pequena, que os grupos carboxilo e amino ionizados da molécula teñen grande influencia no conxunto, polo que pode existir establemente en medios hidrófilos ou hidrófobos.
Outro nome da glicina é glicocola[5], xa en desuso.
Produción e propiedades[editar | editar a fonte]
A glicina foi descuberta en 1820, por Henri Braconnot fervendo xelatina con ácido sulfúrico.[6]
A glicina elabórase industrialmente tratando ácido cloroacético con amoníaco:[7]
- ClCH2COOH + 2 NH3 → H2NCH2COOH + NH4Cl
Prodúcense desta maneira uns 15 millóns de kg anuais.[8]
Nos Estados Unidos e o Xapón prodúcese por medio da reacción de Strecker.[9] Segundo o proceso de fabricación que se utilice pode obterse un produto final con algúns residuos de cloruro pero ningún de sulfato ou o contrario.
Os seus valores de pK son 2,35 e 9,78, polo que por encima do pH 9,78, a maioría da glicina está en forma de amina aniónica co grupo carboxilo ionizado, H2NCH2CO2-. Por debaixo de pH 2,35, predomina a forma de carboxilo catiónico co grupo amino ionizado H3N+CH2CO2H. O seu punto isoeléctrico (pI) é 6,06.
A glicina en solución está en forma zwitteriónica. Nesta forma, as cargas parciais nos diferentes átomos determínanse usando o método de carga de Gasteiger, e son as seguintes: N (+0.2358), H (unido ao N) (+0.1964), C alfa (+0.001853), H (unido ao C alfa) (+0.08799), C do carbonilo (+0.085) e O do carbonilo (-0.5445).
Biosíntese[editar | editar a fonte]
A glicina non é esencial na dieta humana, xa que o corpo pode biosintetizala a partir de serina, que á súa vez deriva do 3-fosfoglicerato. Na maioría dos organismos, o encima serina hidroximetiltransferase cataliza esta transformación usando o cofactor fosfato de piridoxal:[10]
- serina + tetrahidrofolato → glicina + N5,N10-Metileno tetrahidrofolato + H2O
No fígado dos vertebrados, a síntese de glicina está catalizada pola glicina sintase. Esta conversión é doadamente reversible:[10]
- CO2 + NH4+ + N5,N10-Metileno tetrahidrofolato + NADH + H+ → Glicina + tetrahidrofolato + NAD+
A maioría das proteínas conteñen só pequenas cantidades de glicina. Unha notable excepción é o coláxeno, que contén un 35% de glicina.[10]
Degradación[editar | editar a fonte]
A glicina degrádase por tres posibles vías. A vía principal nos animais implica a catálise feita pola glicina sintase (ou encima que escinde a glicina), que é o mesmo que interviña na biosíntese, porque a vía de degradación é a inversa da de síntese:[10]
- Glicina + tetrahidrofolato + NAD+ → CO2 + NH4+ + N5,N10-Metileno tetrahidrofolato + NADH + H+
Unha segunda vía de degradación consta de dous pasos. O primeiro é o inverso da biosíntese a partir de serina coa hidroximetil transferase. A serina convértese despois en piruvato pola serina deshidratase.[10] Por orixinar piruvato, que pode entrar na gliconeoxénese, a glicina considérase un aminoácido glicoxénico.
Na terceira vía posible de degradación, a glicina convértese en glioxilato pola acción da D-aminoácido oxidase. O glioxilato é despois oxidado pola lactato deshidroxenase hepática a oxalato nunha reacción dependente do NAD+.[10]
A vida media da glicina e a súa eliminación do corpo varía significativamente dependendo da dose. Nun estudo obtívose unha vida media para a glicina de entre 0,5 e 4,0 horas. [11]
Funcións fisiolóxicas[editar | editar a fonte]
A glicina forma parte das proteínas, é precursor de diversos produtos naturais e funciona como neurotransmisor.
Papel como intermediario biosintético[editar | editar a fonte]
Nos eucariotas superiores, o ácido delta-aminolevulínico, precursor chave das porfirinas, biosintetízase a partir da glicina e o succinil-CoA. A glicina proporciona a subunidade central C2N de todas as purinas.[10]
Papel como neurotransmisor[editar | editar a fonte]
A glicina é un neurotransmisor inhibitorio que funciona no sistema nervioso central, especialmente na medula espiñal, tronco cerebral e retina. Cando os receptores de glicina das neuronas están activados, o cloruro entra na neurona polos receptores ionotrópicos, orixinando un potencial sináptico inhibitorio. A estricnina é un forte antagonista da glicina nos receptores de glicina ionotrópicos, e a bicuculina é outro antagonista máis feble.
A glicina requírese como co-agonista xunto co glutamato para os receptores NMDA (ambos os dous deben unirse ao receptor). A diferenza do papel inhibitorio da glicina na medula espiñal, nos receptores glutaminérxicos (NMDA) é excitatoria.
A dose media letal (LD50) da glicina é 7930 mg/kg en ratas (oral),[12] e xeralmente causa a morte por hiperexcitabilidade.
Algunhas probas indican que tomar 3000 mg de glicina antes de deitarse mellora a calidade do sono.[13]
Aplicacións[editar | editar a fonte]
Á parte dos seus usos farmacéuticos (a glicina favorece a absorción gástrica de certos medicamentos) e técnicos, a glicina é tamén un aditivo alimentario na comida para mascotas e alimentación animal, e úsase na alimentación humana como aditivo edulcorante e potenciador do sabor. Ademais a glicina serve como axente tamponante en antiácidos, analxésicos, antitranspirantes, cosméticos, e produtos de baño. Por último, a glicina ou os seus derivados, úsanse na produción de produtos de goma escuma, fertilizantes, ou complexantes de metais,[14] e é un intermediario na fabricación do herbicida glifosato.

Presenza de glicina no espazo[editar | editar a fonte]
A detección de glicina no medio interestelar é obxecto de debate.[15] En 2008, descubriuse unha molécula similar á glicina, o aminoacetonitrilo nunha nube de gas xigante da constelación de Saxitario polo Instituto de Radioastronomía Max Planck.[16] En 2009 confirmouse a detección de glicina nunha mostra recollida en 2004 procedente do cometa Wild 2 pola nave da NASA Stardust, o que foi o primeiro descubrimento de glicina extraterrestre. Os partidarios da teoría da panspermia utilizaron este dato para apoiar a súa idea de que "sementes" de vida poden viaxar polo espazo e chegar a outros planetas.[17]
Notas[editar | editar a fonte]
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (11th ed.), Merck, 1989, ISBN 0-911910-28-X, 4386.
- ↑ "Solubilities and densities". Prowl.rockefeller.edu. Arquivado dende o orixinal o 12 de setembro de 2017. Consultado o 2013-11-13.
- ↑ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para glicina.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para glicocola.
- ↑ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer & F.G. Hopkins, ed. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis (2nd ed.). London: Longmans, Green and Co. p. 82. Consultado o January 18, 2010.
- ↑ Ingersoll, A. W.; Babcock, S. H. (1932). "Hippuric acid". Org. Synth. 12: 40. cv2p0328..
- ↑ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker “Amino Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi 10.1002/14356007.a02_057.pub2
- ↑ "Copia arquivada". Arquivado dende o orixinal o 27 de xullo de 2011. Consultado o 10 de xullo de 2011.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 Lehninger. Biochemistry 4th. pp. 127, 675–77, 844, 854..
- ↑ Hahn RG (1993). "Dose-dependent half-life of glycine". Urological Research 21 (4): 289–291. doi:10.1007/BF00307714.
- ↑ "Safety (MSDS) data for glycine". The Physical and Theoretical Chemistry Laboratory Oxford University. 2005. Arquivado dende o orixinal o 20 de outubro de 2007. Consultado o 2006-11-01.
- ↑ Yamadera W, Inagawa K, Chiba S, Bannai M, Takahashi M, Nakayama K (2007). "Glycine ingestion improves subjective sleep quality in human volunteers, correlating with polysomnographic changes". Sleep and Biological rhythms 5 (2): 126–131. doi:10.1111/j.1479-8425.2007.00262.x.
- ↑ "Notice of Preliminary Determination of Sales at Less Than Fair Value: Glycine From India" Federal Register 72 (7 November 2007): 62827.
- ↑ Snyder LE, Lovas FJ, Hollis JM; et al. (2005). "A rigorous attempt to verify interstellar glycine". Astrophys J 619 (2): 914–930. Bibcode:2005ApJ...619..914S. arXiv:astro-ph/0410335. doi:10.1086/426677.
- ↑ Staff. "Organic Molecule, Amino Acid-Like, Found In Constellation Sagittarius 27 March 2008 - Science Daily". Consultado o 2008-09-16.
- ↑ Reuters (18 August 2009). "Building block of life found on comet - Thomson Reuters 2009". Consultado o 2009-08-18.
Véxase tamén[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Kuan YJ, Charnley SB, Huang HC; et al. (2003). "Interstellar glycine". Astrophys J 593 (2): 848–867. Bibcode:2003ApJ...593..848K. doi:10.1086/375637.
- Rachel Nowak. "Amino acid found in deep space - 18 July 2002 - New Scientist". Consultado o 2007-07-01.
Ligazóns externas[editar | editar a fonte]
- Glycine at PDRHealth.com. (en inglés)
- Glycine cleavage system (en inglés)
- Glycine Therapy - A New Direction for Schizophrenia Treatment? (en inglés)
- "Organic Molecule, Amino Acid-Like, Found In Constellation Sagittarius". ScienceDaily. 27 March 2008.
- Guochuan E. Tsai (1 December 2008). "A New Class of Antipsychotic Drugs: Enhancing Neurotransmission Mediated by NMDA Receptors". Psychiatric Times 25 (14). Arquivado dende o orixinal o 03 de outubro de 2012. Consultado o 10 de xullo de 2011.
- ChemSub Online (Glycine). (en inglés)
- NASA scientists have discovered glycine, a fundamental building block of life, in samples of comet Wild 2 returned by NASA's Stardust spacecraft. Arquivado 14 de xaneiro de 2012 en Wayback Machine. (en inglés)
