Neutrófilo
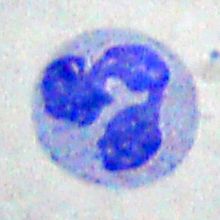

Os neutrófilos son o tipo de glóbulo branco máis abundante no sangue dos mamíferos e forman unha parte esencial do sistema inmunitario innato, no que funcionan como fagocitos. Forman parte do grupo dos glóbulos brancos polimorfonucleares (PMN) ou granulocitos (xunto cos basófilos e eosinófilos). Outros nomes con que se designan son: granulocitos neutrófilos ou neutrófilos polimorfonucleares, e subdivídense en neutrófilos segmentados e neutrófilos bandeados.[1][2][3]
O nome neutrófilo deriva das súas características tintoriais nas preparacións histolóxicas tinguidas con hematoxilina e eosina. As células sanguíneas basofílicas tínguense de cor azul escura, pero as eosinofílicas tínguense de vermello brillante, en tanto que os neutrófilos se tinguen de rosa neutro. Normalmente os neutrófilos teñen un núcleo dividido en lóbulos, xeralmente de 2 a 5.
Os neutrófilos atópanse normalmente no torrente sanguíneo, pero durante as fases iniciais (agudas) dunha inflamación, especialmente como resultado dunha infección bacteriana, exposición ao ambiente (polución),[4] e nalgúns cánceres,[5][6] os neutrófilos son unhas das primeiras células que responden á inflamación, ao migraren ao lugar da inflamación. Migran atravesando a parede dos vasos sanguíneos e polo tecido intersticial, seguindo sinais químicos como a interleucina-8 (IL-8), C5a, e o leucotrieno B4, proceso chamado quimiotaxe. Son as células predominantes no pus, e contribúen a darlle a este a súa aparencia branco-amarelenta.
Os neutrófilos son recrutados no sitio da inflamación en poucos minutos despois do trauma e son indicio dunha inflamación aguda.[7]
Características[editar | editar a fonte]

Os neutrófilos teñen un diámetro medio de 12–15 micrómetros (µm) nos frotis de sangue periférico, pero se os medimos en suspensións de neutrófilos puros nun contador automático de células, o seu diámetro é de 8–9 µm.
Xunto cos eosinófilos e basófilos, forman parte do grupo dos leucocitos polimorfonucleares, denominados así porque o seu núcleo é multilobulado (en contraposición aos linfocitos e monocitos, os outros tipos de células brancas sanguíneas). Os lóbulos do seu núcleo están conectados por porcións delgadas de cromatina. O nucléolo desaparece a medida que o neutrófilo maduro, que é algo que ocorre só en moi poucos tipos de células nucleadas.[8] No citoplasma, o aparato de Golgi é pequeno, as mitocondrias e ribosomas son escasos, e o retículo endoplasmático rugoso está ausente.[9] O citoplasma contén arredor de 200 gránulos, dos cales unha terceira parte son gránulos azurófilos; e por esta presenza abondosa de gránulos denomínanse granulocitos.[9]
Hai unha diferenza entre os neutrófilos de machos e femias: Nas femias o núcleo do neutrófilo presenta un dos seus cromosomas X condensado formando unha estrutura que sobresae chamada "pau de tambor", ausente nos machos[10] (ver corpo de Barr).
Cando hai deficiencia de vitamina B12 e folato, o núcleo dos neutrófilos sofre unha hipersegmentación (divídese en moitos segmentos).

Os neutrófilos son as células brancas máis abundantes do sangue humano, representan o 70% dos leucocitos, e prodúcense aproximadamente 1011 diariamente. Considérase xeralmente que unha cantidade normal en sangue de neutrófilos está entre 2,5 e 7,5 x 109/L. Persoas procedentes de África e Oriente Próximo poden presentar cantidades menores, pero que se consideran normais. As análises poden dividir os neutrófilos en dous grupos: segmentados e bandeados.
Cando os neutrófilos circulan polos vasos sanguíneos e non están activados, os neutrófilos son esféricos, pero unha vez activados, fanse máis ameboides e poden emitir pseudópodos para captar antíxenos.[11]
Tempo de vida[editar | editar a fonte]

A vida media dun neutrófilo (non activado) na circulación sanguínea é de arredor de 5,4 días.[12] Despois da súa activación, experimentan a "marxinación" (sitúanse sobre o endotelio do vaso sanguíneo), e sofren unha captura dependente da selectina seguida dunha adhesión dependente da integrina na maior parte dos casos, despois do cal migran aos tecidos, onde sobreviven durante 1 ou 2 días xealmente.[13]
Os neutrófilos son moito máis numerosos ca outras células fagocíticas de vida máis longa, como os monocitos/macrófagos. Un microorganismo patóxeno ou virus é probable que se atope primeiro cun neutrófilo ca con outros leucocitos. Algúns expertos hipotetizan que a curta vida media dos neutrófilos é unha adaptación evolutiva. A curta vida media dos neutrófilos minimiza a propagación de certos patóxenos que parasitan aos fagocitos, porque canto máis tempo permanezan eses parasitos fóra da célula hóspede, máis probable é que sexan destruídos por algún outro compoñente das defensas naturais do organismo. Ademais, como os produtos antimicrobianos dos neutrófilos poden danar tamén aos tecidos, a súa vida curta limita eses danos durante unha inflamación.[13]
Os neutrófilos son a miúdo fagocitados por macrófagos despois de dixeriren os patóxenos. A PECAM-1 e a fosfatidilserina da superficie celular están implicadas neste proceso.
Diapédese[editar | editar a fonte]
Os neutrófilos interaccionan con axentes quimiotácticos para migraren a sitios invadidos por microorganismos, nun proceso denominado diapédese ou extravasación. Este proceso consta de tres fases:
1. Na luz do vaso sanguíneo: marxinación, rotación e adhesión ao endotelio.
2. Migración a través da parede do vaso sanguíneo.
3. Migración no tecido cara a un estímulo quimiotáctico.
Adhesión ao endotelio[editar | editar a fonte]
Cando se inicia o proceso de inflamación, prodúcese unha vasodilatación iniciada por mediadores químicos, que provoca a saída de líquido do sangue cara aos tecidos, xerando un edema. Como consecuencia, a viscosidade do sangue aumenta, debido ao incremento na concentración de glóbulos vermellos, o que á súa vez causa un descenso no fluxo sanguíneo (estase). Nestas condicións hemodinámicas, os leucocitos redistribúense en posición periférica nos vasos, un fenómeno denominado marxinación. Seguidamente, os leucocitos rodan sobre a superficie do endotelio, establecendo contactos transitorios coas células endoteliais, soltándose e volvéndose a unir. Finalmente, os leucocitos adhiren firmemente ao endotelio, antes de iniciaren a migración.
Simultaneamente ao efecto vasodilatador, os mediadores da inflamación (TNF e IL-1) activan as células endoteliais, que expresan proteínas de adhesión para os leucocitos. A fase de rotación está mediada pola familia de proteínas de membrana denominadas selectinas, que poden ser de tres tipos:
- L-selectina, que se expresa nos leucocitos
- E-selectina, expresada nas células endoteliais
- P-selectina, nas plaquetas e nas células endoteliais
Os ligandos para selectinas son oligosacáridos sialilados unidos a cadeas de glicoproteínas. A interacción entre os receptores de selectina dos neutrófilos e as selectinas das células endoteliais dá lugar a que os neutrófilos roden con lentitude ao longo do recubrimento endotelial dos vasos.
Por outro lado, as quimiocinas (ou quimioquinas) da inflamación provocan un cambio de estado das integrinas da membrana dos polimorfonucleares, que pasan dunha conformación de baixa afinidade a unha conformación de alta afinidade, entanto que a interleucina 1 (IL-1) e o factor de necrose tumoral (TNF) inducen ás células endoteliais a que expresen moléculas de adherencia intercelular tipo 1 (ICAM-1) e VCAM-1 (vascular cell adhesion molecule-1), ás cales se unen con grande facilidade as moléculas de integrina de alta afinidade dos neutrófilos, provocando a adhesión firme dos polimorfonucleares ao endotelio.
Migración a través do endotelio[editar | editar a fonte]
É o fenómeno denominado diapédese ou extravasación, e ocorre fundamentalmente nas vénulas postcapilares. As quimiocinas liberadas polos macrófagos e os mastocitos tisulares en resposta á presenza de microorganismos, corpos estraños ou dano tisular, actúan sobre os polimorfonucleares adheridos ao endotelio, estimulando a súa migración a través dos espazos interendoteliais cara ao sitio danado ou infectado. Algunhas moléculas presentes nas unións entre as células endoteliais facilitan a migración dos neutrófilos, como CD31 ou PECAM-1, proteínas da familia das inmunoglobulinas. Despois de atravesaren o endotelio, os PMN deben romper a lámina basal, probablemente segregando colaxenases, e entraren no tecido extravascular. Para isto, os leucocitos adhiren á matriz extracelular por medio da unión das súas integrinas e CD44 ás proteínas da matriz.
Quimiotaxe[editar | editar a fonte]
Unha vez no compartimento de tecido conectivo, os leucocitos migran cara á zona danada por un proceso denominado quimiotaxe, que se define como o movemento celular dirixido ao longo dun gradiente químico. As substancias que xeran dito gradiente poden ser exóxenas (por exemplo, toxinas bacterianas) ou endóxenas, entre as que se encontran diferentes mediadores químicos:
- citocinas, sobre todo as da familia das quimiocinas (como IL-8);
- compoñentes do sistema do complemento, sobre todo C5a;
- metabolitos do ácido araquidónico, sobre todo o leucotrieno B4 (LTB4).
Todos estes axentes se unen a receptores transmembrana acoplados á proteína G na superficie dos leucocitos. Isto desencadea unha vía de sinalización que dá lugar á activación de segundos mensaxeiros que aumentan os niveis de calcio citosólico e activan GTPases e quinases. Como consecuencia, indúcese a polimerización da actina, que xera un aumento de actina polimerizada no extremo celular próximo á rexión danada, e localización dos filamentos de miosina na parte posterior celular. O leucocito móvese estendendo filopodios que tiran da parte posterior celular en dirección da extensión, como un coche con tracción dianteira. O resultado final é que o leucocito se move cara á zona obxectivo.
No caso concreto dos neutrófilos, estes teñen unha ampla variedade de receptores específicos como receptores do complemento, receptores de citocinas para interleucinas e o interferón gamma (IFN-gamma), receptores para quimiocinas, receptores para detectar e adherir ao endotelio, receptores para leptinas e proteínas, e o receptor Fc para opsoninas.[14]
Función antimicrobiana[editar | editar a fonte]

Como son moi móbiles, os neutrófilos poden congregarse rapidamente no foco da infección, atraídos polas citocinas expresadas polo endotelio activado, mastocitos, e macrófagos. Os neutrófilos expresan[15] e liberan citocinas, que á súa vez amplifican as reaccións inflamatorias doutros tipos celulares.
Ademais de recrutaren e activaren a outras células do sistema inmunitario, os neutrófilos desempeñan un papel chave na primeira liña de defensa contra os patóxenos invasores. Os neutrófilos teñen tres estratexias para atacar directamente aos microorganismos: fagocitose (inxestión), liberación de substancias antimicrobianas solubles (como as proteínas dos gránulos que conteñen) e formación de trampas extracelulares de neutrófilos (NETs).[16]
Fagocitose[editar | editar a fonte]
- Artigo principal: Fagocitose.

Os neutrófilos son fagocitos, que poden inxerir microorganismos ou partículas. Para que os obxectivos a fagocitar sexan recoñecidos, deben estar cubertos de opsoninas, por medio dun proceso chamado opsonización de anticorpos.[11] Poden internalizar e matar moitos microbios, e en cada fagocitación orixínase un fagosoma no cal se secretan especies reactivas do osíxeno e encimas hidrolíticos. O consumo de osíxeno durante a xeración de especies reactivas do osíxeno denomínase "explosión respiratoria", aínda que non está relacionado co verdadeiro proceso respiratorio produtor de enerxía.
A explosión respiratoria implica a activación do encima NADPH oxidase, que produce grandes cantidades de superóxido, unha especie reactiva do osíxeno. O superóxido orixina, espontaneamente ou por catálise encimática polas superóxido dismutases (Cu/ZnSOD e MnSOD), peróxido de hidróxeno, que é despois convertido en ácido hipocloroso (HClO), polo encima hemo verde mieloperoxidase. Pénsase que as propiedades bactericidas do HClO son dabondo para matar a bacteria fagocitada, pero podería ser tamén un paso necesario para a activación de proteases.[17]
Desgranulación[editar | editar a fonte]
A liberación do contido dos gránulos que presentan os neutrófilos denomínase desgranulación. Os neutrófilos conteñen fundamentalmente dous tipos de gránulos:
- os gránulos específicos (ou secundarios), máis grandes, que conteñen lisozima, colaxenase, xelatinase, lactoferrina, activador do plasminóxeno, histaminase e fosfatase alcalina;
- os gránulos azurófilos (ou primarios) conteñen mieloperoxidase, factores bactericidas (lisozima, defensinas), hidrolases ácidas e unha variedade de proteases neutras (elastase, catepsina G e outras). Ás veces uns gránulos con catepsina e xelatinase denomínanse terciarios.
Ambos os tipos de gránulos poden fusionarse cos vacúolos fagocíticos (fagosomas) que conteñen o material inxerido, vertendo o seu contido para dixerilo.
As bacterias non só se destrúen pola acción de encimas senón tamén e sobre todo pola formación de especies reactivas do osíxeno (ROS) e especies reactivas do nitróxeno (NOS) dentro dos fagosomas dos neutrófilos. Algúns destes compostos son:
- anións superóxidos, que se forman por acción da NADPH oxidase (tamén chamada fagocito oxidase) sobre o O2 nunha reacción oxidativa moi rápida que se denomina explosión respiratoria;
- o peróxido de hidróxeno (H2O2), formado pola acción da superóxido dismutase sobre o anión superóxido;
- hipoclorito (OCl*, o ingrediente activo da lixivia), formado pola acción da mieloperoxidase (MPO) sobre o peróxido de hidróxeno en presenza de ións cloruro; o sistema H2O2-MPO-Cloruro é o microbicida máis eficaz dos neutrófilos;
- a óxido nítrico sintase xera NO a partir de arxinina; o NO tamén ten efectos microbicidas;
- o NO pode reaccionar co anión superóxido para xerar o radical peroxinitrito (ONOO*), altamente reactivo.
Todos estes radicais libres do osíxeno e do nitróxeno atacan e danan os lípidos, proteínas e ácidos nucleicos dos microbios, pero tamén ao hóspede.
En ocasións libérase o contido dos gránulos azurófilos á matriz extracelular e causa dano tisular, pero polo xeral a catalase e a glutatión peroxidase degradan o peróxido de hidróxeno. Porén, os leucocitos poden causar danos importantes nas células normais e os tecidos nalgunhas circunstancias:
- en infeccións difíciles de erradicar, como a tuberculose e certas enfermidades virais, a resposta prolongada do hóspede contribúe máis á patoloxía ca o propio microbio, xa que os tecidos adxacentes á infección sofren danos colaterais de longa duración;
- cando a resposta inflamatoria se dirixe de forma inapropiada cara aos tecidos do hóspede, como en certas enfermidades autoinmunes;
- cando o hóspede reacciona de xeito esaxerado a substancias ambientais normalmente inocuas, en enfermidades alérxicas como o asma.
Nestes casos, os leucocitos danan os tecidos sans cos mesmos mecanismos cos que atacan aos microbios, xa que unha vez que son activados, non distinguen entre hóspede e patóxeno. Os encimas e as especies reactivas do osíxeno e nitróxeno liberadas ao espazo intracelular (fóra do fagosoma) poden danar os tecidos sans e o endotelio, amplificando a acción do patóxeno. De feito, nestes casos os propios leucocitos constitúen a ameaza maior, e subxacen como a causa principal das alteracións presentes en moitas doenzas humanas:
- agudas: asma, rexeitamento agudo dun trasplante, síndrome respiratoria aguda severa, glomerulonefrite, choque séptico ou absceso pulmonar;
- crónicas: artrite, asma, aterosclerose, rexeitamento crónico dun transplante, fibrose pulmonar, obesidade.
Os neutrófilos teñen unha vida media curta e morren por apoptose unhas poucas horas despois de deixaren o sangue, unha vez que levaron a cabo a súa función de destruíren microorganismos. Isto ten como efecto a formación de pus, no cal se produce a acumulación de leucocitos (sobre todo neutrófilos) e bacterias mortos e líquido extracelular.
Os neutrófilos tamén están sendo obxecto de debate nas terapias contra o cáncer.
Trampas extracelulares de neutrófilos (NETs)[editar | editar a fonte]
- Artigo principal: Trampa extracelular de neutrófilos.
Brinkmann e os seus colegas describiron recentemente unha observación sorprendente: a activación dos neutrófilos causa a liberación de estruturas de ADN reticulares; que representan un terceiro mecanismo para matar as bacterias.[18] Estas trampas extracelulares de neutrófilos (NETs) están formadas por unha rede de fibras compostas de cromatina e serina proteases que atrapan e matan microbios extracelularmente. Suxeriuse que as NETs facilitan que se produza unha elevada concentración local de compoñentes antimicrobianos, e únense, desarman, e matan os microbios independentemente da fagocitose. Ademais das súas posibles propiedades antimicrobianas, as NETs poden servir como unha barreira física que impide o espallamento do microbio polo organismo. Un importante papel das NETs na sepse pode ser atrapar as bacterias, ao formárense NETs dentro dos vasos sanguíneos.[19] Recentemente, viuse que as NETs xogan un papel nas enfermidades inflamatorias, xa que se poden detectar NETs en casos de preeclampsia, un trastorno inflamatorio relacionaddo co embarazo no cal se activan os neutrófilos.[20]
Papel en enfermidades[editar | editar a fonte]
Un reconto de neutrófilos baixo no sangue denomínase neutropenia. Pode ser un trastorno conxénito ou pode desenvolverse ao longo da vida, como ocorre en casos de anemia aplástica ou algúns tipos de leucemia. Pode ser tamén un efecto secundario de certas medicacións, como a quimioterapia. A neutropenia fai que un individuo sexa moi susceptible ás infeccións. A neutropenia pode ser o resultado da colonización por parasitos intracelulares dos neutrófilos.
Na deficiencia de alfa 1-antitripsina o importante encima neutrofílico elastase non é debidamente inhibido pola alfa 1-antitripsina, orixinando excesivos danos nos tecidos durante a inflamación, principalmente enfisema pulmonar.
Na febre mediterránea familiar (FMF), unha mutación no xene da pirina (ou marenostrina), que se expresa principalmente nos neutrófilos, causa unha resposta aguda constitutivamente activa e orixina ataques de febre, dores articulares, peritonite, e, finalmente, amiloidose.[21]
Media[editar | editar a fonte]
-
Pode verse un neutrófilo moi móbil fagocitando varios conidios de fungos (2 horas de imaxe cunha toma cada 30 s)
-
Pode verse un neutrófilo fagocitando selectivamente lévedos do xénero Candida (con marcado fluorescente verde), a pesar de que toma contacto con conidios de Aspergillus fumigatus (non marcados, brancos claros) aos que non fagocita, nunha matriz tridimensional de coláxeno (2 horas de imaxe cunha toma cada 30 s).
Os neutrófilos mostran unha mobilidade ameboide moi direccional en infeccións da planta dos pés e falanxes.[22]
Notas[editar | editar a fonte]
- ↑ Witko-Sarsat, V; Rieu P, Descamps-Latscha B, Lesavre P, Halbwachs-Mecarelli L (2000). "Neutrophils: molecules, functions and pathophysiological aspects". Lab Invest 80 (5): 617–53. PMID 10830774. doi:10.1038/labinvest.3780067.
- ↑ Klebanoff, SJ; Clark, RA (1978). "The Neutrophil: Function and Clinical Disorders". Elsevier/North-Holland Amsterdam. ISBN 0444800204.
- ↑ Nathan, Carl (2006). "Neutrophils and immunity: challenges and opportunities". Nature Reviews Immunology 6 (March): 173–82. ISSN 1474-1733. PMID 16498448. doi:10.1038/nri1785.
- ↑ Jacobs, L; Nawrot, Tim S; De Geus, Bas; Meeusen, Romain; Degraeuwe, Bart; Bernard, Alfred; Sughis, Muhammad; Nemery, Benoit; Panis, Luc (2010). "Subclinical responses in healthy cyclists briefly exposed to traffic-related air pollution". Environmental Health 9 (64): 64. doi:10.1186/1476-069X-9-64.
- ↑ Waugh, David J.J.; Wilson, Catherine (2008). "The interleukin-8 pathway in cancer". Clinical Cancer Research 14 (21): 6735–41. ISSN 1078-0432. PMID 18980965. doi:10.1158/1078-0432.CCR-07-4843.
- ↑ De Larco, JE; Wuertz, Beverly R.K.; Furcht, Leo T. (2004). "The Potential Role of Neutrophils in Promoting the Metastatic Phenotype of Tumors Releasing Interleukin-8". Clinical Cancer Research 10 (15): 4895–900. ISSN 1078-0432. PMID 15297389. doi:10.1158/1078-0432.CCR-03-0760.
- ↑ Cohen, Stephen. Burns, Richard C. Pathways of the Pulp, 8th Edition. St. Louis: Mosby, Inc. 2002. page 465.
- ↑ Zucker-Franklin, p. 168.
- ↑ 9,0 9,1 Zucker-Franklin, p. 170.
- ↑ Zucker-Franklin, p. 174.
- ↑ 11,0 11,1 Edwards, Steven W. (1994). Biochemistry and physiology of the neutrophil. Cambridge University Press. p. 6. ISBN 0521416981.
- ↑ Pillay J, den Braber I, Vrisekoop N, Kwast LM, de Boer RJ, Borghans JA, Tesselaar K, Koenderman L. In vivo labeling with 2H2O reveals a human neutrophil lifespan of 5.4 days Arquivado 19 de marzo de 2011 en Wayback Machine. Blood. 2010 Jul 29;116(4):625-7.
- ↑ 13,0 13,1 Wheater, Paul R.; Stevens, Alan (2002). Churchill Livingstone, ed. Wheater's basic histopathology: a colour atlas and text (PDF). Edinburgh. ISBN 0-443-07001-6. Arquivado dende o orixinal (PDF) o 22 de novembro de 2011.
- ↑ Charles N. Serhan, Peter A. Ward, Derek W. Gilroy (2010). Cambridge University Press, ed. Fundamentals of Inflammation. pp. 53–54. ISBN 0521887291.
- ↑ Ear T, McDonald PP (2008). "Cytokine generation, promoter activation, and oxidant-independent NF-kappaB activation in a transfectable human neutrophilic cellular model". BMC Immunol. 9: 14. PMC 2322942. PMID 18405381. doi:10.1186/1471-2172-9-14.
- ↑ Hickey, MJ; Kubes P (2009). "Intravascular immunity: the host–pathogen encounter in blood vessels". Nature Reviews Immunology (Nature Publishing Group) 9 ((5)): 364–75. PMID 19390567. doi:10.1038/nri2532.
- ↑ Segal, AW (2005). "How neutrophils kill microbes". Annu Rev Immunol 9 ((5)): 197–223. PMC 2092448. PMID 15771570. doi:10.1146/annurev.immunol.23.021704.115653.
- ↑ Brinkmann, Volker; Ulrike Reichard, Christian Goosmann, Beatrix Fauler, Yvonne Uhlemann, David S. Weiss, Yvette Weinrauch, Arturo Zychlinsky (5 March 2004). "Neutrophil Extracellular Traps Kill Bacteria". Science (AAAS) 303 (5663): 1532–1535. ISSN 0036-8075. PMID 15001782. doi:10.1126/science.1092385. Consultado o 2007-04-09.
- ↑ Clark, SR; Ma, AC; Tavener, SA; Mcdonald, B; Goodarzi, Z; Kelly, MM; et al. (2007). "Platelet Toll-Like Receptor-4 Activates Neutrophil Extracellular Traps to Ensnare Bacteria in Endotoxemic and Septic Blood" (PDF). Nature Medicine (Nature Publishing Group) 13 ((4)): 463–9. ISSN 1078-8956. PMID 17384648. doi:10.1038/nm1565.
- ↑ Gupta, AK; Hasler, P; Holzgreve, W; Hahn, S (2007). "Neutrophil NETs: a novel contributor to preeclampsia-associated placental hypoxia?". Semin Immunopathol 29 (2): 163–7. ISSN 1863-2297. PMID 17621701. doi:10.1007/s00281-007-0073-4.
- ↑ Ozen, S (2004). "Familial mediterranean fever: revisiting an ancient disease". European Journal of Pediatrics 162 (7–8): 449–54. ISSN 0340-6199. PMID 12751000. doi:10.1007/s00431-003-1223-x. Arquivado dende o orixinal o 12 de setembro de 2019. Consultado o 27 de novembro de 2011.
- ↑ Graham D.B., Zinselmeyer B.H., Mascarenhas F., Delgado R., Miller M.J., Swat W. (2009). "ITAM signaling by Vav family Rho guanine nucleotide exchange factors regulates interstitial transit rates of neutrophils in vivo". PLoS ONE (en inglés) 4: e4652. PMC 2645696. doi:10.1371/journal.pone.0004652.
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Neutrófilo |
Bibliografía[editar | editar a fonte]
- Zucker-Franklin Dorothy, Greaves, M.F.; Grossi, C.E.; Marmont, A.M. (1988). "Neutrophils". En Lea & Ferbiger - Philadelphia. Atlas of Blood Cells: Function and Pathology 1 (2nd ed. ed.). ISBN 0-8121-1094-3.
- Robbins and Cotran Pathologic Basis of Disease, 8th edición, Saunders (Elsevier) «Ch.2 Acute and chronic inflammation», (2009).
