Enzima

Os/as enzimas[1] (ou encimas)[2] son un grupo de compostos orgánicos de natureza en xeral proteica (existen tamén enzimas constituídos por ARN, chamados ribozimas)[3][4], con actividade intra ou extracelular que teñen funcións catalíticas, catalizando reaccións químicas, que, sen a súa presenza, serían imposibles ou non poderían ter lugar á velocidade axeitada. Isto conséguese a través da diminución da enerxía de activación precisa para que se dea unha reacción química, resultando no aumento da velocidade desta e posibilitando así o metabolismo dos seres vivos. A capacidade catalítica dos enzimas fainos adecuados para aplicacións industriais, como na industria farmacéutica ou na alimentaria.
En sistemas vivos, a maioría das reaccións bioquímicas danse en vías metabólicas, secuencias de reaccións nas que o produto dunha reacción utilízase como reactivo na seguinte. Diferentes enzimas catalizan os diferentes pasos das vías metabólicas, actuando de forma concertada de xeito que non se interrompa o fluxo nesas vías. Ademais, a actividade de cada enzima pode ser regulada, aumentándoa, diminuíndoa ou mesmo deténdoa, co obxectivo de modular o fluxo da vía metabólica na que se insire.
O ramo da bioquímica adicado ao estudo e caracterización dos enzimas é a enzimoloxía.
Actividade enzimática
[editar | editar a fonte]Os enzimas transforman unha substancia, chamada substrato, noutra diferente denominada produto, e son extremadamente específicas para a reacción que catalizan. Isto quere dicir que, en xeral, un mesmo enzima cataliza un e só un tipo de reacción química (aínda que poden existir varios enzimas que catalicen a mesma reacción). Consecuentemente, o tipo de enzimas atopados nunha célula determina o tipo de metabolismo que a célula efectúa.
A velocidade da reacción catalizada por un enzima aumenta debido á diminución da enerxía de activación necesaria para transformar o substrato no produto. A aceleración da reacción pode ser da orde de varios millóns de veces: por exemplo, o enzima orotidina-5'-fosfato descarboxilase diminúe o tempo da reacción que cataliza de 78 millóns de anos a 25 milisegundos.[5]
Ao seren catalizadores, os enzimas non son consumidos na reacción e non alteran o equilibrio químico da mesma.
A actividade enzimática pode depender da presenza ou non de determinadas moléculas, xenericamente chamadas cofactores. A natureza química dos cofactores é moi variable, podendo ser por exemplo un ou máis ións metálicos (coma o ferro), ou unha molécula orgánica (como a vitamina B12). Estes cofactores poden participar directamente na reacción enzimática, ou permitir ao enzima adoptar unha conformación idónea para a catálise.
Outras substancias son capaces de inhibir a actividade dalgúns enzimas, diminuíndoa ou eliminándoa totalmente; son os chamados inhibidores enzimáticos.
Polo feito de seren proteínas con estrutura terciaria ou cuaternaria, os enzimas presentan pregamentos tridimensionais nas súas cadeas polipeptídicas, o que lles confire unha forma característica e exclusiva. Así, diferentes enzimas presentan diferentes formas e polo tanto diferentes papeis biolóxicos. Para que un enzima actúe, é preciso que , por así dicilo, os substratos encaixen no centro activo do enzima. Este "encaixe" porén depende da forma, isto é, do contorno do enzima. Por iso os substratos que se axustan nun enzima determinado non o fan noutros diferentes e a reacción non ocorre; de aí a especificidade dos enzimas en canto aos substratos sobre os que actúan. Unha vez ocorrido o encaixe, fórmase o chamado complexo enzima-substrato, que se asemella ao sistema chave-pechadura. A parte do enzima onde se encaixa o substrado é denominado sitio ou centro activo). No caso de substancias que reaccionan entre si, a acción catalítica dos enzimas facilita dita reacción, tornándose máis rápida ao aproximárense as moléculas que tiñan que reaccionar. Trala reacción, o enzima deslígase do substrato e permanece intacto.
Localización
[editar | editar a fonte]Podemos atopar enzimas en case todas as estruturas celulares e fluídos corporais. Algúns teñen unha localización específica, de tal xeito que poden servir para indicar que estamos en presenza dun tecido, secreción ou fragmento celular determinado verificando a actividade dun enzima dado.
Historia
[editar | editar a fonte]
Entre o final do śeculo XVII e o inicio do XVIII xa se sabía que as secrecións estomacais eran capaces de dixerir a carne[6]; coñecíase tamén a conversión de amidón en azucres pola acción da saliva e extractos vexetais. O mecanismo subxacente a estas transformacións non era, porén, coñecido[7].
Os enzimas foron descubertos no século XIX, aparentemente por Pasteur, que concluíu que a fermentación do azucre en alcohol polo lévedo era catalizada por fermentos. Postulou, pois, que eses fermentos (os enzimas) eran inseparables da estrutura das células vivas do lévedo. Pasteur declarou que "a fermentación alcohólica é un acto correlacionado coa vida e organización das células do fermento, e non coa súa morte ou putrefacción"[8].
En 1878, Willhelm Kühne empregou por vez primeira o termo "enzima" para describir este fermento, facendo uso da palabra grega ενζυμον, que significa "levedar". O termo pasou a ser máis tarde usado para denominar ás proteínas con capacidade catalítica, mentres que o termo "fermento" refírese á actividade exercida por organismos vivos.
En 1897, Eduard Buchner descubriu que os extractos de lévedo podían fermentar o azucre ata alcohol e probou que os enzimas implicados na fermentación alcóholica continuaban a funcionar mesmo cando se eliminaban as células vivas. Este descubrimento valeulle o premio Nobel de Química en 1907[9].
Restaba por determinar cal era a natureza dos enzimas. Alguúns afirmaban que as proteínas, asociadas á actividade enzimática, non eran máis có soporte do verdadeiro enzima, e, por si mesmas, eran incapaces de catálise. En 1926, James B. Sumner pruficou e cristalizou a urease, amosando que se trataba dunha proteína pura, e fixo o mesmo, en 1937, coa catalase. A proba final foi feita por Northrop e Stanley en 1930, co estudo de tres enzimas dixestivos, a pepsina, a tripsina e a quimotripsina, polo que recibiron o premio Nobel de Química en 1946[10].
J.B.S. Haldane escribiu un tratado titulado "Enzimas", onde facía a suxestión de que as interaccións por enlaces químicos débiles entre o enzima e o substrato poderían permitir a separación da molécula do substrato e catalizar a reacción.
A cristalización de enzimas purificados permitiu que as súas estruturas moleculares puidesen ser examinadas por cristalografía de raios X, o que aconteceu primeiro coa lisozima, un enzima que aparece na saliva, bágoas e na clara de ovo e que destrúe a parede celular de bacterias, en 1965[11]. Comezan deste xeito a bioquímica e bioloxía estruturais, que se esforzan por comprender o funcionamento dos enzimas a nivel atómico.
A tentativa de comprender o mecanismo da catálise enzimática a nivel cuántico foi facilitada recentemente polo aumento da capacidade aritmética dos computadores.
Estruturas e mecanismos
[editar | editar a fonte]- Artigo principal: Catálise.

Os enzimas son proteínas, e aínda que son xeralmente grandes poden ter un tamaño moi variable, dende os 62 residuos de aminoácidos do monómero do enzima 4-oxalocrotonato tautomerase[12], ata un tamaño de 2500 residuos, como é o caso da ácido graxo sintase.[13] A actividade dos enzimas está determinada pola súa estrutura cuaternaria.[14] En calquera caso, a maioría de enzimas son moito maiores có substrato sobre o cal actúan, e só unha pequena porción do enzima (entre 3 e 4 aminoácidos) está envolta na catálise.[15] A rexión que contén estes residuos catalíticos, que se liga ao substrato e que leva a cabo a reacción, denomínase sitio ou centro activo. Os enzimas tamén poden posuír sitios aos que se ligan cofactores necesarios para o bo desempeño da reacción. Algúns enzimas tamén poden presentar centros de unión para outras moléculas de pequeno tamaño, que poden ser tanto produtos coma substratos, directos ou indirectos, da reacción catalizada. Estas ligazóns serven para aumentar ou diminuír a actividade do enzima, dando orixe a un modo de regulación por retroalimentación.
Coma todas as proteínas, os enzimas están formados por longas cadeas lineais de aminoácidos que sofren un pregamento que ten como resultado unha moilécula de estrutura tridimensional. Cada secuencia única de aminoácidos xera tamén unha estrutura tridimensional única que ten propiedades específicas. Cadeas individuais de proteínas poden agruparse ás veces e formar así un complexo proteico. A estrutura da proteína pode chegar a desagregarse ou mesmo perder a súa actividade por mor dunha desnaturalización, isto é, a alteración da conformación tridimensional polo aumento excesivo de temperatura, ou variacións fortes de pH. Segundo o enzima, a desnaturalización pode ter efectos reversibles ou irreversibles.
Especificidade
[editar | editar a fonte]Os enzimas posúen en xeral unha elevada especificidade en relación ás reaccións que catalizan e aos substratos implicados nelas. A conformación tridimensional, a carga e outras características hidrofílicas/hidrofóbicas da proteína son responsables desta especificidade. Os enzimas exhiben tamén niveis altos de estereoespecificidade, rexioselectividade e quimioselectividade,[16] chegando a poder distinguir ás veces entre a forma α e β dun substrato. A vantaxe desta especificidade é a formación do produto que se precisa sen que se xeren outros secundarios.
Algúns dos enzimas máis precisos e específicos interveñen na copia e expresión do xenoma. Estes enzimas posúen mecanismos de proof-reading (corrección de erros de lectura). Un destes casos é a DNA polimerase, que cataliza unha reacción nun primeiro paso, para de seguida confirmar, nun segundo paso, se o produto é o correcto.[17] Este proceso en dúas etapas ten como resultado taxas de erro ínfimas, na orde dunha por cada cen millóns de reaccións, no caso de polimerases de mamíferos.[18] Pódense atopar mecanismos de revisión semellantes na RNA polimerase,[19] na aminoacil-tRNA sintetase[20] e mais nos ribosomas.[21]
Algúns enzimas que producen metabolitos secundarios son descritos coma promiscuos, xa que poden actuar sobre un longo espectro de diferentes substratos. Ten sido suxerido que este tipo de especificidade elongada é importante nos procesos de evolución de novas vías de biosíntese.[22]
Modelo chave-pechadura
[editar | editar a fonte]Os enzimas exhiben unha elevada especificidade. Emil Fischer, en 1894, propuxo que ese feito era debido a que tanto os enzimas coma os substratos presentan formas xeométricas complementarias, de forma que encaixen de xeito máis preciso uns nos outros.[23] Este proceso é moitas veces coñecido como de chave-pechadura. Mais, a pesar de explicar a especificidade dos enzimas, este modelo falla en explicar a estabilización dos estados de transición que amosan os enzimas.
Modelo do encaixe inducido
[editar | editar a fonte]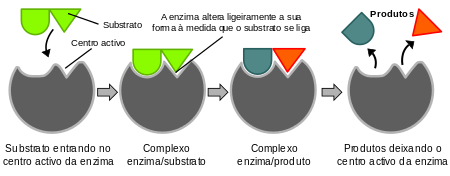
En 1958, Daniel Koshland suxeriu unha modificación ao modelo de chave-pechadura: dado que os enzimas son estruturas flexibles, a forma do centro activo varía constantemente ao interaccionar co substrato.[24] Como resultado disto, o substrato non se liga simplemente a un sitio activo ríxido, senón que as cadeas laterais dos aminoácidos que conforman os sitios activos sofren unha reorientación conforme o substrato entra, de xeito que as súas posicións potencien a acción catalítica do enzima. Nalgúns casos, coma nas glicosidases, a molécula de substrato tamén sofre alteracións na súa estrutura a medida que se achega ao sitio activo.[25] O sitio activo continúa a sufrir modificacións ata que o substrato se atope completamente ligado, e é neste momento cando se determinan a súa conformación final e a carga.[26]
Mecanismos
[editar | editar a fonte]Os enzimas actúan de diversas formas, todas elas diminuíndo o valor de ΔG‡:[27]
- Reducindo a enerxía de activación creando un medio no cal o estado de transición se estabiliza (por exemplo, deformando o substrato -gastando enerxía neste paso- de xeito que diminúa a enerxía do estado de transición da reacción catalizada, resultando nunha diminución global da enerxía requirida para completar a reacción).
- Proporcionando unha vía alternativa (por exemplo, reaccionando co substrato para formaren un complexo enzima-substrato, de existencia imposible sen a presenza do enzima).
- Reducindo a variación de entropía da reacción ao orientar os substratos da forma correcta para que a reacción sexa máis doada. En auxencia do enzima, as moléculas colisionan en todas as direccións posíbles de xeito aleatorio, un proceso moito menos eficiente ca en presenza do enzima. Isto pásase por alto ao considerar ΔG‡ soa.
Dinámica e funcións
[editar | editar a fonte]Investigacións recentes achegaron novos coñecementos sobre o xeito en que se ligan a dinámica interna dun enzima e o seu mecanismo de catálise[28][29][30]. A dinámica interna dun enzima é descrita como o movemento das partes internas (aminoácidos individuais, grupos de aminoácidos, un lazo da cadea, unha hélice α, follas β veciñas ou ata dominios proteicos enteiros) destas biomoléculas, que poden transcorrer a diversas escalas de tempo, dende femtosegundos a segundos. Redes de residuos de aminoácidos dunha estrutura poden contribuír á catálise a través de movementos dinámicos[31][32][33][34]. Estes de movementos nas proteínas son importantes na acción de diversos enzimas, mais o tipo de reacción que estes catalizan é o que determina que movementos son máis importantes: pequenas e rápidas vibracións ou lentas e significativas alteracións conformacionais. Estes estudos teñen consecuencias na comprensión dos efectos alostéricos, na produción industrial de enzimas e no desenvolvemento de novos fármacos.
Regulación alostérica
[editar | editar a fonte]- Artigo principal: Alostería.
Os centros alostéricos son sitios no enzima aos que se unen moléculas do medio celular. Os centros forman enlaces febles e non covalentes con estas moléculas, provocando un cambio na conformación do enzima. Este cambio na conformación afecta tamén ao centro activo, e polo tanto á eficiencia do enzima.[35]. As interaccións alostéricas poden tanto inhibir coma activar enzimas e é moi frecuente que os enzimas sexan controlados así no corpo.[36].
Cofactores e coenzimas
[editar | editar a fonte]Cofactores
[editar | editar a fonte]Algúns enzimas non necesitan compoñentes adicionais para mostraren unha actividade completa. Porén, outros requiren que se unan a eles moléculas non proteícas (cofactores) para poderen exercer a súa actividade. Os cofactores poden ser inorgánicos (ions metálicos e complexos ferro-xofre) ou compostos orgánicos (flavina ou hemo). Os cofactores orgánicos (coenzimas) son normalmente grupos prostéticos, que están intimamente ligados aos enzimas aos que lles prestan asistencia. Os cofactores que presentan unións fortes aos enzimas son distintos doutros coenzimas, tal como a NADH, xa que non son liberados do sitio activo durante a reacción catalizada.
Un exemplo dun enzima que contén un cofactor é a anhidrase carbónica, que se mostra na figura cun ión de cinc como cofactor.[37] Estas moléculas que posúen unha unión estreita cos enzimas atópanse normalmente no sitio activo e están envolvidas na reacción catalítica. Por exemplo, a flavina e grupos hemo están moitas veces implicados en reaccións de oxidación-redución.
Os enzimas que requiren un cofactor pero que non se ligan a estes denomínanse apoenzimas. Un apoenzima xuntamente co(s) seu(s) cofactor(es) denomínase holoenzima. A maioría dos cofactores non se ligan por covalencia a un enzima, senón que establecen enlaces menos fortes. Porén, os grupos prostéticos orgánicos poden ligarse de maneira covalente. Un exemplo diso é o enlace do pirofosfato de tiamina ao enzima piruvato deshidroxenase.
Coenzimas
[editar | editar a fonte]
Os coenzimas son pequenas moléculas que transportan grupos químicos dun enzima a outro.[38] Algúns destes compostos químicos, como a riboflavina, a tiamina e o ácido fólico, son vitaminas, compostos que non son sintetizados no organismo e que teñen que ser asimilados a través da dieta. Os grupos químicos transportados inclúen o ión hidruro (:H-) transportado polo NAD+ ou o NADP+, o grupo acetilo transportado polo coenzima A, os grupos formilo, metenilo e metilo transportados polo ácido fólico e o grupo metilo transportado pola S-adenosilmetionina.
Dado que os coenzimas son modificadas quimicamente como consecuencia da acción enzimática, é útil consideralos como unha clase especial de substratos, ou substratos secundarios, que son comúns en moitos tipos de enzimas diferentes. Por exemplo, sábese que existen cerca de 700 enzimas que utilizan o coenzima NADH.[39]
Os coenzimas sofren rexeneración e as súas concentracións son mantidas a un nivel estable dentro da célula. Por exemplo, o NADPH é rexenerado a través da vía da pentosa fosfato e a S-adenosilmetionina é rexenerada pola metionina adenosiltransferase.
Termodinámica
[editar | editar a fonte]
- Artigo principal: enerxía de activación, equilibrio termodinámico, equilibrio químico.
Tal e como acontece con todos os compostos catalizadores, os enzimas non alteran o punto do equilibrio químico da reacción. Normalmente, en presenza dun enzima, a reacción desenvólvese na mesma dirección que tomaría se el non estivese presente, pero de maneira máis rápida. Non obstante, en ausencia de enzima, outras posibles reaccións "espontáneas" non catalizadas poderían orixinar produtos diferentes, porque nesas condicións ditos produtos se forman máis rápido.
Ademais, os enzimas poden executar dúas ou máis reaccións, de tal maneira que a actuación nunha reacción termodinamicamente favorable poida facilitar a actuación nunha reacción menos favorable. Por exemplo, a enerxía dispoñibilizada pola hidrólise do ATP é normalmente utilizada para executar outras reaccións.
Os enzimas catalizan as reaccións en ambos os sentidos. Non alteran o equilibrio en si, senón a velocidade en que este é alcanzado. Por exemplo, a anhidrase carbónica cataliza a súa reacción nas dúas direccións, dependendo da concentración dos seus reaccionantes.
- (en tecidos; alta concentración de CO2)
- (nos pulmóns; baixa concentración de CO2)
Se o equilibrio estiver substancialmente desprazado para unha das direccións, isto é, se for unha reacción moi exergónica, a reacción é efectivamente irreversible. Nestas condicións, o enzima só catalizará a reacción na dirección termodinamicamente permitida.
Cinética
[editar | editar a fonte]
A cinética enzimática é o estudo do mecanismo polo cal os enzimas ligan substratos e os transformam en produtos. Para o seu estudo utilízanse datos sobre a velocidade de reacción de enzimas a través de ensaios enzimáticos.
En 1902, Victor Henri[40] propuxo unha teoría cuantitativa de cinética enzimática, mais os seus datos experimentais tiñan pouca utilidade porque non se consideraba entón a importancia da concentración do ion H+. Despois de que Peter Lauritz Sørensen definise a escala logarítmica de pH e introducise o concepto de solución tampón en 1909[41], o químico alemán Leonor Michaelis e a biomédica canadense Maud Leonora Menten repetiron as experiencias de Henri e confirmaron a súa ecuación, sendo esta cinética coñecida como cinética de Henri-Michaelis-Menten (moitas veces simplificado como cinética de Michaelis-Menten)[42]. Este traballo foi desenvolvido por G. E. Briggs e J. B. S. Haldane, que derivaron ecuacións cinéticas usadas aínda hoxe en día[43].
Henri contribuíu significativamente a este campo ao teorizar que as reaccións enzimáticas ocorrían en dous pasos. No primeiro, o substrato lígase de forma reversible ao enzima, formando o complexo enzima-substrato. Este complexo é por veces designado como complexo de Michaelis. O enzima cataliza entón o paso químico da reacción e libera o produto.

Os enzimas poden catalizar ata varios millóns de reaccións por segundo. Por exemplo, a reacción catalizada pola orotidina 5'-fosfato descarboxilase ten unha semivida de 78 millóns de anos en ausencia de enzima, diminuíndo a apenas 25 milisegundos en presenza deste[44]. As velocidades de reacción dependen das condicións en que os enzimas se encontran e da concentración de substrato. Condicións de alta temperatura, pH extremos ou altas concentracións salinas desestabilizan a estrutura da proteína, desnaturalizándoa. Por outro lado, en xeral, un aumento na concentración de substrato tende a aumentar a actividade enzimática.
Experimentalmete, encóntrase a velocidade máxima de reacción aumentando progresivamente a concentración de substrato, ata que se chega a unha velocidade constante de formación de produto. Tal cousa é visíble na curva de saturación do gráfico da dereita. A saturación acontece porque, a medida que aumentada a concentración de substrato, aumenta tamén a cantidade de enzima presente en forma de complexo enzima-substrato (ES). Á velocidade máxima, Vmax, todos os centros activos están ocupados (saturados) con substrato, ou sexa, non existe enzima libre para ligar máis substrato e a concentración de complexo ES é igual á concentración de enzima.
A actividade dun enzima é xeralmente descrita a través de Vmax e tamén da constante de Michaelis-Menten, KM, que representa a concentración de substrato á cal se detecta unha velocidade de reacción igual á metade de Vmax. Cada enzima posúe un KM característico para un substrato dado; este parâmetro é moitas veces usado para demostrar a forza de unión dun substrato ao enzima. Tamén se usa outra constante cinética, kcat, para describir o comportamento dun enzima, representando o número de moléculas de substrato que poden ser catalizadas por centro activo por segundo.
A eficiencia catalítica dun enzima pode expresarse a través da constante de especificidade, igual á razón kcat/Km. A constante de especificidade relaciónase tanto coa afinidade da unión do substrato ao enzima coma coa capacidade catalítica deste, polo que é útil para a comparación entre diferentes enzimas, ou o mesmo enzima con diferentes substratos. Existe un valor máximo teórico para esta constante, cerca de 108 to 109 M−1 s−1, denominado límite de difusión. Considerando que cada colisión entre enzima e substrato resulta en catálise, a velocidade global de formación do produto non estará limitada pola velocidade de reacción do enzima senón pola velocidade de difuson das moléculas en solución. Enzimas que posúan unha constante de especificidade preto deste valor son designados como enzimas cataliticamente (ou cineticamente) perfectos; alguús exemplos inclúen os enzimas triosa fosfato isomerase, anhidrase carbónica, acetilcolinesterase, catalase, fumarase, ß-lactamase e superóxido dismutase.
A cinética de Michaelis-Menten baséase na lei da acción das masas, que deriva das asuncións sobre difusión libre e sobre colisións aleatorias con base termodinámica. Non obstante, moitos dos procesos bioquímicos ou celulares non se comportan da forma prevista por estes modelos debido á alta concentración de substancias no medio celular, separación de fases entre enzima, substrato e produto e restrición do movemento molecular a unha ou dúas dimensións[45]. Nestas situacións, é aplicável un modelo fractal da cinética de Michaelis-Menten[46][47][48][49].
Algúns enzimas presentan unha cinética máis rápida que as velocidades de difusión, o que aparenta ser algo imposible. Téñense usado diversos mecanismos para explicar este fenómeno. Unha explicación é que algúns enzimas acelerasen a súa catálise ao captar e orientar o seu substrato usando dipolos eléctricos. Outros modelos usan un mecanismo cuántico-mecánico de tunneling, no que un protón ou electrón poden atravesar barreiras de activación, aínda que o modelo de tunneling de protóns sexa controvertido[50][51], tendo sido non obstante observado na triptamina [52]. Estes modelos suxiren que a catálise enzimática posiblemente pode describirse mellor en termos de "atravesar un barreira" en detrimento do modelo tradicional de "pasar por riba" dunha barreira enerxética diminuída.
Inhibición
[editar | editar a fonte]
- Artigo principal: Inhibidor enzimático.
As taxas de reacción enzimáticas poden ser diminuídas por acción de varios tipos de inhibidores enzimáticos.
- Inhibición competitiva
Na inhibición competitiva, o inhibidor e o substrato compiten polo enzima, isto é, non se poden unir ao mesmo tempo ao enzima. Os inhibidores son moitas veces semellantes ao substrato do enzima. Por exemplo, o metotrexato é un inhibidor competitivo do enzima dihidrofolato redutase, que cataliza a redución do dihidrofolato a tetrahidrofolato. A similitude entre as estruturas do ácido fólico e desta droga móstranse na figura adxacente. Na inhibición competitiva, a velocidade máxima da reacción non se ve alterada, pero requírense niveis máis altos de concentración do substrato para atinguir unha determinada velocidade máxima, aumentando o KM aparente. Na inhibición competitiva aumentando a concentración de substrato pode reverterse a inhibición.
- Inhibición acompetitiva ou incompetitiva
Na inhibición acompetitiva ou incompetitiva, o inhibidor non se pode ligar ao enzima no estado libre, senón soamente ao complexo E-S. O complexo E-I-S así formado, é enzimaticamente inactivo. Este tipo de inhibición é raro, mais pode ocorrer en enzimas multiméricos.
- Inhibición non-competitiva
Os inhibidores non-competitivos poden ligarse ao enzima e ao substrato ao mesmo tempo, ou sexa, nunca se ligan ao sitio activo. Quer o complexo E-I, quer o complexo E-I-S, son enzimaticamente inactivos. Tanto o KM aparente como o Vmax cambian neste caso, pois o inhibidor non pode ser desligado do enzima por un aumento da con•centración de substrato (en contraste co que acontece na inhibición competitiva).
- Inhibición mixta
Este tipo de inhibición aseméllase á inhibición non-competitiva. Neste caso, o complexo E-I-S posúe actividade enzimática residual.
En moitos organismos, os inhibidores poden actuar como parte do mecanismo de retroalimentación. Se un enzima produce unha determinada substancia en demasía, esa substancia poderá actuar como inhibidor do enzima, no inicio da vía que a produce, causando a redución ou parada da produción da substancia cando esta se acumula. Esta é unha forma de retroalimentación negativa. Enzimas que están suxeitos a esta forma de regulación son moitas veces multiméricos e posúen sitios de unión alostéricos para substancias reguladoras. Os seus gráficos substrato/velocidade non teñen a forma hiperbólica senón forma sigmoide (curva en forma de S)
Os inhibidores irreversibles reaccionan co enzima e formam enlaces covalentes coa cadea polipeptídica. Este tipo de inactivación é irreversible. Un exemplo de inhibidor irreversible é a eflornitina, unha substancia utilizada no tratamento da doenza do sono[53]. A penicilina e a aspirina tamén actúan deste modo. Nestes casos, o composto lígase ao centro activo e o enzima convérteo a unha forma activada que reacciona irreversibelmente cun ou máis residuos de aminoácidos.
Usos de inactivadores
[editar | editar a fonte]Os inactivadores son moitas veces usados como medicamentos, mais tamén poden actuar como velenos. De todos os xeitos, a diferenza entre un medicamento e un veleno é normalmente unha cuestión de dose, visto que a maior parte dos medicamentos e drogas son tóxicas a partir de certo nivel. Como dixo Paracelso: "Todas as cousas son un veleno e nada existe sen veleno, só a dose é razón para que unha cousa non sexa un veleno"[54] Igualmente, os antibióticos e outras drogas antiinfecciosas son simplemente velenos que matan o axente patogénico e non o hospedeiro deste.
Un exemplo dun inactivador que é usado como medicamento é a aspirina, que inhibe a ciclooxixenase 1 e a ciclooxixenase 2, que son enzimas que producen un mensaxeiro que actúa en casos de inflamación, neste caso unha prostaglandina, suprimindo así a dor e a inflamación. O cianuro é un inactivador enzimático irreversible, que se combina con cobre e cinc no sitio activo do enzima citocromo c oxidase, bloqueando a respiración celular.[55]
Funcións biolóxicas
[editar | editar a fonte]
Os enzimas exercen unha gran variedade de funcións nos organismos vivos. Son indispensables para a transdución de sinais, na regulación celular, moitas veces por acción de quinases e fosfatases.[56] A través da súa acción poden xerar movemento, como no caso da miosina que hidroliza ATP, xerando contraccións musculares. Tamén moven carga a través da célula, a través da acción do citoesqueleto.[57] Algúns enzimas son ATPases (funcionan como bombas iónicas), que se localizan na membrana celular, estando implicadas no proceso do transporte activo. Algunhas funcións máis exóticas son tamén operadas por enzimas, como é o caso da luciferase que xera luz nos vagalumes.[58] Os virus poden conter enzimas que os axudan na infección de células (HIV-integrase e transcriptase inversa) ou na liberación celular de virus (neuraminidase no virus influenza).
Os enzimas exercen importantes funcións no aparato dixestivo dos animais. Enzimas como as amilases e proteases, rompen grandes moléculas como o amidón e proteínas, respectivamente, en moléculas de menores dimensións, de maneira a que estas poidan ser absorbidas no intestino. O amidón non é absorbible no intestino, mais os enzimas hidrolizan as cadeas de amidón en moléculas menores tales como a maltosa e a glicosa, posibilitando desta maneira a súa absorción. Diferentes enzimas actúan sobre diferentes tipos de alimento. Nos ruminantes, que posúen unha dieta herbívora, as bacterias do seu aparato dixestivo producen un enzima denominado celulase que rompe as paredes celulares das células vexetais.
Os enzimas poden traballar en conxunto, seguindo unha orde de actuación específica. Desta maneira poden formar vías metabólicas. Nestas vías, un enzima procesa o produto da acción doutro enzima como o seu substrato. Despois da reacción catalítica, o produto é entregado ao seguinte enzima da vía. Ás veces, máis dun enzima pode catalizar a mesma reacción, en paralelo. Isto permite unha regulación máis complexa:
Os enzimas determinan os sucesivos pasos das vías metabólicas. Sen a presenza de enzimas, o metabolismo non progresaría a través dos mesmo pasos, nin sería suficientemente rápido servir ás necesidades da célula. De feito, unha vía metabólica tan importante como a glicólise non podería existir sen a presenza de enzimas. A glicosa, por exemplo, pode reaccionar directamente co ATP para dar orixe a un produto fosforilado nun ou máis carbonos. Na ausencia de enzimas, este proceso é tán lento que se volve insignificante. Polo contrario, se adicionamos o enzima hexoquinase, estas reacción lentas continúan a ser efectuadas, mais a fosforilación do carbono número 6 ocorre de maneira tan rápida que, se testamos a mestura pouco tempo despois, a glicosa-6-fosfato é o único produto significativo. Consecuentemente, pódese dicir que a rede de vías metabólicas existentes dentro de cada célula depende do conxunto de enzimas funcionais que están presentes.
Control da actividade
[editar | editar a fonte]A actividade enzimática na célula é controlada de cinco maneiras principais:
- A produción de enzima (transcrición e tradución dos xenes que codifican o enzima) pode ser aumentada ou diminuída pola célula en resposta a cambios no ambiente celular. Esta forma de regulación xenética é designada como indución ou inhibición da expresión enzimática. Por exemplo, as bacterias poden desenvolver resistencia a antibióticos como a penicilina porque son inducidas enzimas (β-lactamases) que hidrolizan o anel β-lactámico presente na estrutura do antibiótico e esencial para a súa actividade biolóxica. Outro exemplo é a importancia dos enzimas hepáticos citocromo P450 oxidases, implicadas no metabolismo de desintoxicación de xenobióticos.
- Os enzimas poden encontrarse compartimentados, de modo que difentes vías metabólicas (ou partes de vías metabólicas) ocorran en diferentes compartimentos celulares. Por exemplo, os ácidos graxos son sintetizados por un conxunto de enzimas no citoplasma, no retículo endoplasmático e no aparato de Golgi e usados por un conxunto diferente de enzimas como fonte de enerxía na mitocondria, a través da β-oxidación[59].
- Os enzimas poden ser regulados por inhibidores e activadores. Por exemplo, os produtos finais dunha vía metabólica dada son frecuentemente inhibidores dos enzimas que catalizan os primeiros pasos da vía (normalmente o primeiro paso factualmente irreversible), regulando así a cantidade de produto final producido pola vía. Este tipo de regulación denomínase mecanismo de feedback (ou retroalimentación) negativo porque a cantidade de produto final é regulada pola súa propia concentración. Na práctica, o feedback negativo axusta a velocidade de síntese de metabolitos intermediarios da vía de acordo coa necesidade da célula. Este mecanismo axuda na distribución económica e eficiente de compostos, evitando a produción excesiva de produtos finais. Tal como outros mecanismos homeostáticos, o control da actividade enzimática axuda no mantemento dun ambiente interno estable en organismos vivos.
- Os enzimas poden ser regulados a través da súa modificación postraducional. Este tipo de modificación inclúe a fosforilación, a miristoilación e a glicosilación. Por exemplo, a fosforilación de diversos enzimas, como a glicóxeno sintase, en resposta a un sinal da insulina, axuda no control da síntese ou degradación do glicóxeno e permite a resposta celular a variacións da glicemia[60]. Outro exemplo é a rotura da cadea polipeptídica da quimotripsina, unha protease dixestiva que é producida nunha forma inactiva (quimotripsinóxeno) no páncreas e transportada entón ao estómago, onde se activa. Este mecanismo evita a dixestión de tecidos pancreáticos (ou outros) pola quimotripsina antes de entrar no tracto dixestivo. Este tipo de precursor inactivo dun enzima denomínase zimóxeno.
- Algúns enzimas actívanse cando son colocadas nun ambiente diferente (por exemplo, pasan dun ambiente citoplasmático redutor a un ambiente periplasmático oxidativo). Un exemplo encóntrase na hemaglutinina dos virus Influenza (virus da gripe), que sofre un cambio conformacional cando encontra o ambiente acídico de vesículas da célula hospedeira, provocando a súa activación[61].
Implicación en doenzas
[editar | editar a fonte]
Dado que o control da actividade enzimática é esencial para a homeostase, calquera alteración en xenes que codifiquen enzimas (mutacións ou delecións) poderá ter como efecto a aparición de doenzas xenéticas. A importancia dos enzimas está demostrada polo feito de que unha doenza letal pode ser causada polo mal funcionamento dun único tipo de enzima entre os millares que están presentes no corpo humano.
Un exemplo diso é que o acontece co tipo mais común de fenilcetonuria. Unha mutación nun único aminoácido do enzima fenilalanina hidroxilase, que cataliza o primeiro paso na degradación da fenilalanina, ten como resultado a acumulación da fenilalanina e dos produtos asociados. Isto pode causar atraso mental se a doenza non for tratada.[62]
Outro exemplo acontece cando mutacións en xenes que codifican enzimas que interveñen na reparación do DNA causan certas síndromes de cancro hereditario, tal como o xeroderma pigmentoso. Defectos nestes enzimas diminúen a habilidade do noso organismo para reparar mutacións no xenoma. Isto causa unha lenta acumulación de mutacións e resulta no posible desenvolvemento de moitos tipos de cancro no paciente.
Nomenclatura
[editar | editar a fonte]A determinación do nome dos enzimas está normatizada por un comité especializado, o Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB).
Clases de enzimas
[editar | editar a fonte]| Clase 1 | Oxidorredutases | catalizan reaccións de oxirredución, transferindo electrons, hidruros (H-) ou protóns (H+). |
| Clase 2 | Transferases | Transfiren grupos químicos entre moléculas. |
| Clase 3 | Hidrolases | Utilizan a auga como receptor de grupos funcionais doutras moléculas. |
| Clase 4 | Liases | Forman ou destrúen dobres enlaces, respectivamente retirando ou adicionando grupos funcionais. |
| Clase 5 | Isomerases | Transforman unha molécula nun isómero seu. |
| Clase 6 | Ligases | Forman enlaces químicos por reaccións de condensación, consumindo enerxía en forma de ATP. |
A partir destas categorías principais, os enzimas aínda son subdivididos noutras categorías, podendo ser identificados polo seu número EC; por exemplo, EC 5.4.2.2 é a fosfoglicomutase.
Aplicacións
[editar | editar a fonte]Enzimas dixestivos tales como a amilase, protease e lipase, reducen os alimentos a compoñentes menores que son máis facilmente absorbidos no tracto dixestivo.
Os enzimas fan unha grande contribución a numerosas industrias. Enzimas que procesan os alimentos tales como a glicoamilase poden reducir o alimento a glicosa.
Unha aplicación industrial importante é a produción de antibióticos a larga escala. Encóntranse tamén determinados tipos de enzimas en produtos de limpeza, para axudar a dixerir graxas e proteínas presentes en nódoas.
Tamén se usan en investigación de laboratorio e na medición de concentracións de substancias con interese clínico (Patoloxía Clínica, análises clínicas).
Notas
[editar | editar a fonte]- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para enzima.
- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para encima.
- ↑ Lilley D (2005). "Structure, folding and mechanisms of ribozymes". Curr Opin Struct Biol 15 (3): 313–23.DOI:10.1016/j.sbi.2005.05.002 PMID 15919196
- ↑ Cech T (2000). "Structural biology. The ribosome is a ribozyme". Science 289 (5481): 878–9. DOI:PMID 9311771
- ↑ A. Radzicka, R. Wolfenden (1995), "A proficient enzyme.", Science, 6(267), p. 90-931
- ↑ René Antoine Ferchault de Réaumur (1752), "Observations sur la dixestion des oiseaux", Histoire de l'academie royale des sciences, 1752p. 266, 461
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York)
- ↑ J. Dubos (1951), "Louis Pasteur: Free Lance of Science, Gollancz." in K.L. Manchester (1995), "Louis Pasteur (1822–1895)--chance and the prepared mind.", Trends in Biotechnology, 13(12), p.511-515
- ↑ Nobel Laureate Biography of Eduard Buchner at http://nobelprize.org Accessed 04 April 2007
- ↑ 1946 Nobel prize for Chemistry laureates at http://nobelprize.org Accessed 04 April 2007
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution". Nature 22 (206): 757-761 PMID 5891407
- ↑ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP (1992). "4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer". J. Biol. Chem. 267 (25): 17716-21. PMID 1339435
- ↑ Smith S (1994). "The animal fatty acid synthase: one gene, one polypeptide, seven enzymes". FASEB J. 8 (15): 1248–59. PMID 8001737
- ↑ Anfinsen C.B. (1973). "Principles that Govern the Folding of Protein Chains". Science: 223–230. PMID 4124164
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute Arquivado 03 de agosto de 2013 en Wayback Machine. Accessed 04 April 2007
- ↑ Jaeger KE, Eggert T. (2004). "Enantioselective biocatalysis optimized by directed evolution.". Curr Opin Biotechnol. 15(4): 305–313. PMID 15358000
- ↑ Shevelev IV, Hubscher U. (2002). "The 3' 5' exonucleases.". Nat Rev Mol Cell Biol. 3 (5): 364–376. PMID 11988770
- ↑ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ↑ Zenkin N, Yuzenkova Y, Severinov K. (2006). "Transcript-assisted transcriptional proofreading.". Science. 313: 518–520. PMID 16873663
- ↑ Ibba M, Soll D. (2000). "Aminoacyl-tRNA synthesis.". Annu Rev Biochem. 69: 617–650 PMID 10966471
- ↑ Rodnina MV, Wintermeyer W. (2001). "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms.". Annu Rev Biochem. 70: 415–435. PMID 11395413
- ↑ Firn, Richard The Screening Hypothesis - a new explanation of secondary product diversity and function Arquivado 31 de outubro de 2006 en Wayback Machine.
- ↑ Jaeger KE, Eggert T. (2004). «Enantioselective biocatalysis optimized by directed evolution.». Curr Opin Biotechnol. 15(4): pp. 305-313. PMID 15358000
- ↑ Koshland D. E. (1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis Arquivado 03 de marzo de 2007 en Wayback Machine.". Proc. Natl. Acad. Sci. 44 (2): 98–104.[http://www.ncbi.nlm.nih.gov/pubmed/16590179?dopt=Abstract PMID 16590179
- ↑ Vasella A, Davies GJ, Bohm M. (2002). "Glycosidase mechanisms.". Curr Opin Chem Biol. 6 (5): 619–629.PMID 12413546
- ↑ Boyer, Rodney. Concepts in Biochemistry (en inglés). 2nd ed. ed. New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc.. p. 137–138.
- ↑ Fersht, A (1985) Enzyme Structure and Mechanism (2nd ed) p50–52 W H Freeman & co, New York ISBN 0-7167-1615-1
- ↑ Eisenmesser EZ, Bosco DA, Akke M, Kern D. Enzyme dynamics during catalysis. Science. 2002 February 22;295(5559):1520–3. PMID 11859194
- ↑ Agarwal PK. Role of protein dynamics in reaction rate enhancement by enzymes. J Am Chem Soc. 2005 November 2;127(43):15248-56. PMID 16248667
- ↑ Eisenmesser EZ, Millet O, Labeikovsky W, Korzhnev DM, Wolf-Watz M, Bosco DA, Skalicky JJ, Kay LE, Kern D. Intrinsic dynamics of an enzyme underlies catalysis. Nature. 2005 November 3;438(7064):117-21. PMID 16267559
- ↑ Agarwal PK, Billeter SR, Rajagopalan PT, Benkovic SJ, Hammes-Schiffer S. (March 2002). "Network of coupled promoting motions in enzyme catalysis. Arquivado 14 de febreiro de 2007 en Wayback Machine.".Proc. Natl. Acad. Sci. U S A. 99: 2794–9. PMID 11867722
- ↑ Agarwal PK, Geist A, Gorin A. Protein dynamics and enzymatic catalysis: investigating the peptidyl-prolyl cis-trans isomerization activity of cyclophilin A. Biochemistry. 2004 August 24;43(33):10605-18. PMID 15311922
- ↑ Tousignant A, Pelletier JN. (Aug 2004). "Protein motions promote catalysis. Arquivado 30 de novembro de 2009 en Wayback Machine.". Chem Biol. 11 (8): 1037–42. PMID 15324804
- ↑ Yang, Lee-Wei; Bahar, Ivet (2005-6). "Coupling between Catalytic Site and Collective Dynamics: A Requirement for Mechanochemical Activity of Enzymes". Structure (en inglés) 13 (6): 893–904. ISSN 0969-2126. PMC 1489920. PMID 15939021. doi:10.1016/j.str.2005.03.015.
- ↑ Neet KE (1995). "Cooperativity in enzyme function: equilibrium and kinetic aspects". Meth. Enzymol. 249: 519–67. DOI:10.1016/0076-6879(95)49048-5. PMID 7791626
- ↑ Changeux JP, Edelstein SJ (June 2005). "Allosteric mechanisms of signal transduction". Science 308 (5727): 1424–8. DOI:10.1126/science.1108595. PMID 15933191
- ↑ Fisher Z, Hernandez Prada JA, Tu C, Duda D, Yoshioka C, An H, Govindasamy L, Silverman DN and McKenna R. (2005). "Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II.". Biochemistry. 44(4): 1097–115. PMID 15667203.
- ↑ AF Wagner, KA Folkers (1975) Vitamins and coenzymes. Interscience Publishers New York| ISBN 0-88275-258-8
- ↑ BRENDA The Comprehensive Enzyme Information System Arquivado 11 de decembro de 2008 en Wayback Machine. Accessed 04 April 2007
- ↑ Henri,V. (1902). "Theorie generale de l'action de quelques diastases". Compt. rend. hebd. Acad. Sci. Paris 135: 916–919.
- ↑ Sørensen,P.L. (1909). "Enzymstudien {II}. Über die Messung und Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen". Biochem. Z. 21: 131–304.
- ↑ Michaelis L., Menten M. (1913). "Die Kinetik der Invertinwirkung". Biochem. Z. 49: 333–369. English translation Visitado o 6 de Abril de 2007
- ↑ Briggs G. E., Haldane J. B. S. (1925). "A note on the kinetics of enzyme action". Biochem. J. 19: 339–339. PMID 16743508.
- ↑ Radzicka A, Wolfenden R. (1995). "A proficient enzyme.". Science 6 (267): 90–931. PMID 7809611.
- ↑ Ellis RJ (2001). "Macromolecular crowding: obvious but underappreciated". Trends Biochem. Sci. 26 (10): 597–604. PMID 11590012.
- ↑ Kopelman R (1988). "Fractal Reaction Kinetics". Science 241 (4873): 1620–26. doi:10.1126/science.241.4873.1620.
- ↑ Savageau MA (1995). "Michaelis-Menten mechanism reconsidered: implications of fractal kinetics". J. Theor. Biol. 176 (1): 115–24. PMID 7475096.
- ↑ Schnell S, Turner TE (2004). "Reaction kinetics in intracellular environments with macromolecular crowding: simulations and rate laws". Prog. Biophys. Mol. Biol. 85 (2–3): 235–60. PMID 15142746.
- ↑ Xu F, Ding H (2007). "A new kinetic model for heterogeneous (or spatially confined) enzymatic catalysis: Contributions from the fractal and jamming (overcrowding) effects". Appl. Catal. A: Gen. 317 (1): 70–81. doi:10.1016/j.apcata.2006.10.014.
- ↑ Garcia-Viloca M., Gao J., Karplus M., Truhlar D. G. (2004). "How enzymes work: analysis by modern rate theory and computer simulations.". Science 303 (5655): 186–195. PMID 14716003.
- ↑ Olsson M. H., Siegbahn P. E., Warshel A. (2004). "Simulations of the large kinetic isotope effect and the temperature dependence of the hydrogen atom transfer in lipoxygenase". J. Am. Chem. Soc. 126 (9): 2820–1828. PMID 14995199.
- ↑ Masgrau L., Roujeinikova A., Johannissen L. O., Hothi P., Basran J., Ranaghan K. E., Mulholland A. J., Sutcliffe M. J., Scrutton N. S., Leys D. (2006). "Atomic Description of an Enzyme Reaction Dominated by Proton Tunneling". Science 312 (5771): 237–241. PMID 16614214.
- ↑ Poulin R, Lu L, Ackermann B, Bey P, Pegg AE. Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites. Arquivado 24 de xaneiro de 2009 en Wayback Machine. J Biol Chem. 1992 Jan 5;267(1):150–8. PMID 1730582
- ↑ Ball, Philip (2006) The Devil's Doctor: Paracelsus and the World of Renaissance Magic and Science. Farrar, Straus and Giroux ISBN 0-374-22979-1
- ↑ Yoshikawa S and Caughey WS. (1990). "Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction.". J Biol Chem. 265 (14): 7945–7958. PMID 2159465. Arquivado dende o orixinal o 25 de setembro de 2008. Consultado o 15 de agosto de 2010.
- ↑ Hunter T. (1995). "Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling.". Cell. 80(2): 225–236. PMID 7834742.
- ↑ Berg JS, Powell BC, Cheney RE. (2001). "A millennial myosin census.". Mol Biol Cell. 12(4): 780–794. PMID 11294886.
- ↑ Meighen EA. (1991). "Molecular biology of bacterial bioluminescence.". Microbiol Rev. 55(1): 123–142. PMID 2030669.
- ↑ Faergeman N. J, Knudsen J. (1997). "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". Biochem J 323: 1–12. PMID 9173866.
- ↑ Doble B. W., Woodgett J. R. (2003). "GSK-3: tricks of the trade for a multi-tasking kinase". J. Cell. Sci. 116: 1175–1186. PMID 12615961.
- ↑ Carr C. M., Kim P. S. (2003). "A spring-loaded mechanism for the conformational change of influenza hemagglutinin". Cell 73: 823–832. PMID 8500173.
- ↑ Phenylketonuria: NCBI Genes and Disease Accessed 04 April 2007
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Enzima |


