Flavina


A flavina (7,8-dimetil-isoaloxazina) é unha base nitroxenada derivada da substancia heterocíclica nitroxenada de tres aneis e dous grupos oxo, chamada isoaloxazina, baseada na pteridina. O seu nome procede do latín flavus (amarelo), xa que a súa forma oxidade é amarela (e a súa forma reducida é incolora).
Da flavina deriva o grupo flavina ou grupo flavínico que aparece en moitos compostos orgánicos importantes. A fonte bioquímica deste grupo é a vitamina riboflavina (vitamina B2). Na riboflavina, a flavina está unida a unha unidade de (1,2,3,4,5-pentanopentol), o cal se obtén da modificacion do grupo aldehido dunua ribosa liñal. O grupo flavínico pode unirse á adenosina difosfato (ADP) para formar o coencima flavín adenín dinucleótido (FAD), ou pode formar unha forma fosforilada da riboflavina, que é o coencima flavín mononucleótido (FMN), os cales interveñen en deshidroxenacións. Estes dous coencimas poden ser grupos prostéticos de proteínas chamadas flavoproteínas.
O grupo flavina pode sufrir reaccións de oxidación-redución, xa que pode aceptar dous electróns (un electrón á vez nun proceso en dous pasos ou dous electróns á vez). A súa redución realízase coa adición de átomos de hidróxeno a átomos específicos de nitróxeno dos aneis de isoaloxazina:

As formas oxidadas e reducidas están en rápido equilibrio coa forma semiquinona (radical), xa que o radical dura moi pouco:[1]
- Flox + FlredH2 ⇌ FlH•
onde Flox é a flavina oxidada, FlredH2 é a flavina reducida (ao captar dous hidróxenos) e FlH• é a forma semiquinona (adición dun só hidróxeno).
En 1937, Paul Karrer recibiu o Premio Nobel de Química polas súas investigacións sobre os carotenoides, flavinas e as vitaminas A e B2.
Fotorredución
[editar | editar a fonte]Tanto as flavinas libres coma as unidas a proteínas son fotorreducibles, é dicir, poden ser reducidas pola luz, por medio dun mecanismo mediado por varios compostos orgánicos, como algúns aminoácidos, ácidos carboxílicos e aminas.[1]
FAD/FADH2
[editar | editar a fonte]
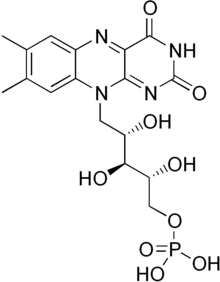
O flavín adenín dinucleótido ou dinucleótido de flavina e adenina (FAD) é un grupo que está unido a moitos encimas como, por exemplo, a ferredoxina-NADP+ redutase, a monoamino oxidase, a D-aminoácido oxidase, glicosa oxidase, xantina oxidase, e acil-CoA deshidroxenase.
O FADH2 é a forma totalmente reducida do FAD. O FADH2 é un grupo prostético que se forma na succinato deshidroxenase, un encima que intervén no ciclo do ácido cítrico. Na fosforilación oxidativa, o FADH2 cede electróns á cadea de transporte de electróns mitocondrial.
FMN/FMNH2
[editar | editar a fonte]O flavín mononucleótido ou mononucleótido de flavina (FMN) funciona como grupo prostético que se atopa en encimas como a NADH deshidroxenase, E.coli nitrorredutase e NADPH deshidroxenase. A súa forma reducida é o FMNH2, formada por captación polo FMN de hidróxenos do substrato encimático, reducíndose e oxidando o substrato.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Massey, Vincent; M. Stankovich, Peter Hemmerich (1978). "Light-Mediated Reduction of Flavoproteins with Flavins as Catalysts" (PDF). Biochemistry 17 (1): 1–8. PMID 618535. doi:10.1021/bi00594a001. Consultado o 2013-01-12.
- Voet, D.; Voet, J.G. (2004). Biochemistry (3rd ed.). John Wiley & Sons. ISBN 0-471-39223-5
