Pseudomonas aeruginosa
| Pseudomonas aeruginosa | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
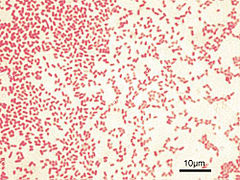
 Colonias de P. aeruginosa nunha placa de ágar XLD | |||||||||||||||
| Clasificación científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| 'Pseudomonas aeruginosa' (Schröter 1872) Migula 1900 | |||||||||||||||
| Sinonimia | |||||||||||||||
|
Bacterium aeruginosum Schroeter 1872 | |||||||||||||||
Pseudomonas aeruginosa é unha especie de bacterias común que pode causar enfermidades nos animais, incluíndo os humanos. Encóntrase no solo, auga, flora da pel, e na maioría dos ambientes creados polo ser humano por todo o mundo. Prospera non só en atmosferas normais, senón tamén en atmosferas hipóxicas (con pouco osíxeno), o que lle permitiu colonizar moitos ambientes diferentes naturais e artificiais. Utiliza unha ampla variedade de compostos orgánicos para a súa nutrición; nos animais, a súa versatilidade capacita ao organismo para infectar os tecidos lesionados ou aos individuos con inmunidade reducida. Os síntomas que se presentan nas infeccións por esta bacteria son a inflamación xeneralizada e a sepse. Se coloniza órganos corporais vitais, como os pulmóns, o tracto urinario, e os riles, o resultado pode ser mortal.[1] Como pode vivir na maioría das superficies, esta bacteria tamén se atopa mesmo no equipamento médico, como en catéteres, causando infeccións cruzadas en hospitais e clínicas. Está implicada en certas dermatites collidas nas bañeiras de hidromasaxe. Tamén pode descompoñer hidrocarburos e foi utilizada para degradar cru de verteduras petrolíferas.[2][3]
Identificación[editar | editar a fonte]
É unha bacteria gramnegativa, aerobia, de tipo cocobacilo cun só flaxelo.[4] É un patóxeno humano oportunista e tamén patóxeno de plantas.[5] P. aeruginosa é a especie tipo do xénero Pseudomonas.[6]
P. aeruginosa segrega diversos pigmentos, como a piocianina (azul verdoso), pioverdina (verde amarelento e fluorescente), e piorrubina (verde castaño). King, Ward, e Raney desenvolveron o medio Pseudomonas Agar P (medio King A) para potenciar a produción de piocianina e piorrubina por parte da bacteria, e o medio Pseudomonas Agar F (medio King B) para potenciar a produción de fluoresceína.[7]

P. aeruginosa é a miúdo identificada preliminarmente pola súa aparencia nacarada e olor parecido ao das uvas ou de tortilla in vitro. A identificación clínica definitiva de P. aeruginosa con frecuencia implica a identificación da produción de piocianina e fluoresceína, e a súa capacidade de crecemento a 42 °C. P. aeruginosa pode crecer en combustible diésel e en combustible para avións a propulsión, xa que o seu metabolismo pode utilizar os hidrocarburos, causando corrosión microbiana.[3]
Aínda que se clasifica como organismo aerobio, P. aeruginosa é considerado moitas veces un organismo anaerobio facultativo, xa que está ben adaptado para proliferar en condicións de depleción de oxíxeno total ou parcial. Este organismo pode conseguir crecer anaerobiamente con nitrato como aceptor final de electróns, e, na súa ausencia, tamén pode fermentar arxinina e realizar fosforilación a nivel de substrato.[8][9] A adaptación a ambientes anaerobios ou microanaerobios é esencial para certos modos de vida de P. aeruginosa, como por exemplo, durante as infeccións pulmonares en pacientes de fibrose quística, nas que as grosas capas de mucus pulmonar e os alxinatos que rodean as células bacterianas mucoides poden limitar a difusión do oxíxeno.[10][11][12][13]
Nomenclatura[editar | editar a fonte]
- A palabra Pseudomonas significa "falsa unidade", do grego pseudo, ψευδο e monas, μονος. A raíz mon empezou a utilizarse moi cedo na historia da bacterioloxía para referirse aos xermes e deu lugar por exemplo ao termo Monera co que se designou o reino das bacterias.
- O nome específico aeruginosa procede do latín e significa pátina verdosa de "óxido de cobre"[14]. Fai referencia ao pigmento azul verdoso bacteriano que se observa nos cultivos de laboratorio desta especie, o cal é unha combinación de dous metabolitos de P. aeruginosa, a piocianina (azul) e a pioverdina (verde). A biosíntese da piocianina está regulada polo fenómeno da percepción do quórum (quorum sensing), como ocorre nas biopelículas asociadas coa colonización por esta bacteria dos pulmóns en pacientes de fibrose quística.
Xenoma[editar | editar a fonte]
O xenoma de P. aeruginosa é relativamente grande (6-7 Mb) e codifica arredor de 6.000 marcos de lectura abertos ou ORFs (preditos); o número exacto depende da cepa. Hai 5.021 xenes que están conservados nos cinco xenomas que foron analizados, con polo menos un 70% de identidade de secuencia. Este conxunto de xenes constitúe o núcleo (core) do xenoma de P. aeruginosa.[15]
| cepa: | PA2192 | C3719 | PA01 | PA14 | PACS2 |
|---|---|---|---|---|---|
| tamaño do xenoma (bp) | 6.905.121 | 6.222.097 | 6.264.404 | 6.537.648 | 6.492.423 |
| ORFs | 6.191 | 5.578 | 5.571 | 5.905 | 5.676 |
O cromosoma de P. aeruginosa é rico en G+C e consiste nun núcleo xenómico conservado e unha parte accesoria variable. Os xenomas dese núcleo básico das cepas de P. aeruginosa son principalmente colineares, mostran un baixo grao de polimorfismo na secuencia, e conteñen poucos loci con diversidade de secuencia alta, os máis notables dos cales son o locus da pioverdina, o regulón flaxelar, pilA, e o locus para a biosíntese do antíxeno O. Os segmentos variables están espallados por todo o xenoma, e un terzo deles están inmediatamente adxacentes aos xenes do ARNt ou ARNtm. Tres puntos quentes coñecidos de diversidade xenómica son causados pola integración de illas xenómicas da familia pKLC102/PAGI-2 nos xenes do ARNtLys ou ARNtGly. As illas difiren unhas doutras no seu repertorio de xenes metabólicos, mais comparten un conxunto de xenes sinténicos que lle confiren o seu espallamento horizontal cara a outros clons e especies. A colonización de hábitats de enfermidades atípicos predispón a delecións, rearranxos xenómicos, e acumulación de mutacións de perda de función no cromosoma de P. aeruginosa. A poboación de P. aeruginosa caracterízase por ter uns poucos clons dominantes moi comúns nos hábitats do medio ambiente e de enfermidades. O xenoma está composto de segmentos típicos dos clons no núcleo xenómico e no xenoma accesorio, e de bloques no núcleo xenómico con fluxo xénico non restrinxido na poboación.[16]
Polisacáridos da superficie celular[editar | editar a fonte]
Os polisacáridos da superficie celular xogan diversas funcións no modo de vida das bacterias. Serven como barreira entre a parede celular e o ambiente que as rodea, median as interaccións hóspede-patóxeno, e forman compoñentes estruturais das biopelículas. Estes polisacáridos sintetízanse a partir de precursores activados por nucleótidos, e, en moitos casos, todos os encimas necesarios para a biosíntese, ensamblaxe, e transporte do polímero completo están codificados por xenes organizados en clusters específicos do xenoma do organismo. O lipopolisacárido é un dos máis importantes polisacáridos da superficie celular, xa que xoga un papel estrutural na integridade da membrana externa, e é un importante mediador das interaccións hóspede-patóxeno. Foi claramente definida a xenética para a biosíntese dos chamados antíxenos O de banda A (homopolimérica) e banda B (heteropolimérica), e avanzouse moito na comprensión das vías bioquímicas da súa biosíntese. O exopolisacárido alxinato é un copolímero linear de residuos de ácido D-manurónico e ácido L-glicurónico unidos por enlace glicosídico β-1,4, e é responsble do fenotipo mucoide da bacteria nas últimas fases da fibrose quística. Os loci pel e psl son dous clusters de xenes recentemente descubertos, que tamén codifican exopolisacáridos importantes para a formación de biopelículas. Os ramnolípidos son biosurfactantes cuxa produción está estreitamente regulada a nivel transcricional, pero o papel preciso que xogan na enfermidade non se comprende aínda ben. A glicosilación de proteínas, especialmente da pilina e flaxelina, é un foco recente de investigación, e é importante para a adhesión e invasión durante as infeccións bacterianas.[16]
Patoxénese[editar | editar a fonte]
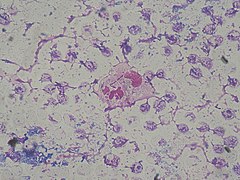
P. aeruginosa causa infeccións oportunistas, infeccción nosocomiais (en hospitais) en individuos inmunocomprometidos. P. aeruginosa infecta xeralmente os tractos pulmonar e urinario, queimaduras, feridas e tamén causa outras infeccións do sangue.[17]
| Infeccións | Detalles e asociacións comúns | Grupos de alto risco |
|---|---|---|
| Pneumonía | Broncopneumonía difusa | Pacientes de fibrose quística |
| Choque séptico | Asociados coa lesión cutánea negra púrpura ectima gangrenoso | Pacientes con neutropenia |
| Infeccións do tracto urinario | Cateterización do tracto urinario | |
| Infección gastrointestinal | Enterocolite necrotizante (NEC) | Meniños prematuros e pacientes de cancro neutropénicos |
| Infeccións da pel e tecidos brandos | Hemorraxia e necrose | Vítimas de queimaduras e pacientes con feridas infectadas |
É a causa máis común de infeccións nas queimaduras e de oído externo (otite externa), e é o colonizador máis frecuente de dispositivos médicos (como catéteres). Pseudomonas pode, en raras circunstancias, causar pneumonía adquirida na comunidade (non en hospitais)[18] e pneumonías asociadas a respiradores artificiais médicos, e é un dos axentes máis comúns que se illaron en varios estudos.[19] A piocianina é un factor de virulencia da baceria e sábese que causa a morte no verme C. elegans por estrés oxidativo. Porén, o ácido salicílico pode inhibir a produción de piocianina.[20] Unha de cada dez infeccións adquiridas nos hospitais é debida a Pseudomonas. Os pacientes de fibrose quística están tamén predispostos a infeccións de P. aeruginosa nos pulmóns. P. aeruginosa pode tamén ser unha causa común da foliculite das bañeiras de hidromasaxe (dermatite), causada polo incorrecto mantemento da calidade da auga. A causa máis común de infeccións en queimaduras é P. aeruginosa. Pseudomonas é tamén unha causa común de infección postoperatoria nos pacientes que foron sometidos a queratoromía radial. O microorganismo está tamén asociado coa lesión da pel chamada ectima gangrenoso. P. aeruginosa está frecuentemente asociada con osteomielite na que están implicadas feridas por picazos nos pés, que se cre se produce polo inoculación directa de P. aeruginosa desde o recheo acolchado de escuma dos zapatos tipo tenis, e o maior risco dáse en pacientes diabéticos.
Toxinas[editar | editar a fonte]
P. aeruginosa utiliza o factor de virulencia exotoxina A para inactivar por ADP-ribosilación o factor de elongación eucariótico 2 na célula hóspede, de xeito similar ao que fai a toxina diftérica. Sen o factor de elongación 2, as células eucariotas non poden sintetizar proteínas e sofren necrose. A liberación dos contidos intracelulares induce unha resposta inmunolóxica en pacientes inmunocompetentes. Ademais, P. aeruginosa utiliza un exoencima, ExoU, que degrada a membrana plasmática das células eucariotas, o que orixina a súa lise.
Activación[editar | editar a fonte]
Cando hai niveis baixos de fosfato, P. aeruginosa actívase e pasa de ser un simbionte benigno a expresar toxinas letais no tracto intestinal e dana gravemente ou mata ao seu hóspede. Isto pode mitigarse proporcionando un exceso de fosfato en vez de utilizar antibióticos.[21]
Plantas e invertebrados[editar | editar a fonte]
Nas plantas superiores, P. aeruginosa induce síntomas de pudrición branda, por exemplo en Arabidopsis thaliana[22] e Lactuca sativa (leituga).[23][24] Tamén é patoxénica para animais invertebrados, como o nematodo Caenorhabditis elegans,[25][26] a mosca da froita Drosophila[27] e a avelaíña Galleria mellonella.[28] As asociacións de factores de virulencia son as mesmas para as infeccións de plantas e animais.[23][29]
Percepción do quórum[editar | editar a fonte]
A regulación da expresión xénica pode facerse por medio da comunicación célula a célula ou percepción do quórum (quorum sensing) a través da produción de pequenas moléculas denominadas autoindutores. A percepción do quórum controla a expresión de diversos factores de virulencia. Outra forma de regulación xénica que permite que as bacterias se adapten rapidamente aos cambios no medio que as rodea é por medio de sinalización ambiental. Recentes estudos descubriron que a anaerobiose pode impactar significativamente o principal circuíto regulatorio da percepción do quórum. Esta importante ligazón entre a percepción do quórum e a anaerobiose ten unha influencia significativa na produción de factores de virulencia deste organismo.[16] O allo bloquea experimentalmente a percepción do quórum en P. aeruginosa.[30]
Biopelículas e resistencia ao tratamento[editar | editar a fonte]
As biopelículas que forma P. aeruginosa poden causar infeccións oportunistas crónicas, as cales son un serio problema nos servizos de atención médica dos países industrializados, especialmente para os pacientes inmunocomprometidos e os vellos, os cales con frecuencia non poden ser tratados de forma efectiva con terapias de antibióticos tradicionais. As biopelículas protexen a estas bacterias dos factores ambientais adversos. P. aeruginosa pode causar infeccións nosocomiais (hospitalarias) e considérase un organismo modelo para o estudo de bacterias resistentes a antibióticos. Os investigadores consideran importante aprender máis sobre os mecanismos moleculares que causan o cambio dun crecemento bacteriano de tipo planctónico a un fenotipo de crecemento en biopelícula e sobre o papel da comunicación interbacteriana nas bacterias resistentes aos tratamentos como P. aeruginosa. Isto debería contribuír a manexar clinicamente mellor os pacientes con infeccións crónicas, e debería levar ao desenvolvemento de novas drogas terapéuticas.[16]
Diagnose[editar | editar a fonte]

Para a diagnose, dependendo da natureza da infección, recóllese unha mostra apropiada e envíase ao laboratorio de bacterioloxía para a súa identificación. Realízase unha tinguidura de Gram, que mostrará os bacilos gramnegativos e/ou glóbulos brancos do sangue. P. aeruginosa produce colonias cun característico cheiro a uvas no medio bacteriolóxico. En cultivos mixtos, esta especie pode illarse en forma de colonias claras en ágar MacConkey (xa que non fermenta a lactosa), as cales dan positivo na proba da oxidase. Entre as probas de confirmación están a produción do pigmento azul verdoso piocianina en ágar cetrimida e o crecemento a 42 °C. A miúdo utilízanse tubos inclinados de ágar TSI (Triple Sugar Iron, Triplo Azucre Ferro) para distinguir as especies de Pseudomonas non fermentadoras dos espécimes patóxenos entéricos fecais.
Tratamento[editar | editar a fonte]
P. aeruginosa íllase frecuentemente de sitios non estériles (frotis bucais, esputos etc.), e, baixo esas circunstancias, a miúdo a súa presenza representa colonización en vez de infección. O illamento de P. aeruginosa a partir de mostras non estériles debería, por tanto, interpretarse con cautela, e moitas veces non é necesario o tatamento. Polo contrario, cando se illa P. aeruginosa dun sitio estéril (sangue, ósos, mostras profundas), a súa presenza pode ser máis seria e requirir tratamento. Xeralmente úsanse tratamentos combinados con dous antibióticos.[31]
P. aeruginosa é de forma natural resistente a un gran número de antibióticos e pode presentar unha resistencia adicional despois dun tratamento sen éxito, concretamente debido á modificación dunha porina. Debería xeralmente ser posible dirixir o tratamento segundo as sensibilidades mostradas pola bacteria no laboratorio, en troques de elixir o antibiótico empiricamente. Se o tratamento empezou sendo empírico, despois debe procurarse obter canto antes cultivos da bacteria, e a escolla do antibiótico usado debería ser revisada cando se dispoña dos resultados do cultivo.
A terapia de fagos contra P. aeruginosa é un dos tratamentos máis efectivos, o cal pode combinarse coa administración de antibióticos, e non ten contraindicacións e presenta mínimos efectos adversos. Os fagos prepáranse nun líquido estéril, axeitado para a súa administración.[32] Aplicouse a terapia de fagos contra as infeccións de oído causadas por P. aeruginosa[33]
Entre os antibióticos que teñen actividade contra P. aeruginosa pódense incluír os seguintes:
- aminoglicósidos (xentamicina, amicacina, tobramicina, pero non kanamicina)
- quinolonas (ciprofloxacina, levofloxacina, pero non moxifloxacina)
- cefalosporinas (ceftazidime, cefepime, cefoperazona, cefpirome, ceftobiprole, pero non cefuroxime, ceftriaxone, cefotaxime)
- penicilinas antipseudomonas: carboxipenicilinas (carbenicilina e ticarcilina), e ureidopenicilinas (mezlocilina, azlocilina, e piperacilina). P. aeruginosa é intrinsicamente resistente a todas as demais penicilinas.
- carbapenems (meropenem, imipenem, doripenem, pero non ertapenem)
- polimixinas (polimixina B e colistina)[34]
- monobactams (aztreonam)
Estes antibióticos deben todos administrarse por inxección, coa excepción das fluoroquinolonas, tobramicina en aerosol e aztreonam en aerosol. Por esta razón, nalgúns hospitais, o uso de fluoroquinolona está moi restrinxido para evitar o desenvolvemento de cepas resistentes de P. aeruginosa. Nos raros casos en que a infección é superficial e limitada (por exemplo, infeccións óticas ou nas uñas), poden empregarse a xentamicina ou colistina de uso tópico.
Resistencia a antibióticos[editar | editar a fonte]
Unha das características máis preocupantes de P. aeruginosa é a súa baixa susceptibilidade aos antibióticos, o cal se atribúe á acción concertada de bombas de fluxo multidrogas con xenes de resistencia a antibióticos codificados no xenoma (por exemplo, mexAB, mexXY etc.[35]) e a baixa permeabilidade das envoltas celulares bacterianas. Ademais desta resistencia intrínseca, P. aeruginosa desenvolve doadamente unha resistencia adquirida a un antibiótico ou ben por mutacións en xenes codificados no xenoma ou ben por transferencia horizontal de xenes de determinantes de resistencia a antibióticos. O desenvolvemento de resistencia a múltiples drogas polos illados de P. aeruginosa require que se produzan varios eventos xenéticos, como a adquisición de diferentes mutacións e/ou a transferencia horizontal de xenes de resistencia a antibióticos. A hipermutación favorece a selección de resistencia a antibióticos dirixida por mutacións en cepas de P. aeruginosa que producen infeccións crónicas, mentres que a agrupación de varios xenes distintos de resistencia aos antibióticos en integróns favorece a adquisición concertada de determinantes de resistencia a antibióticos. Algúns estudos recentes mostraron que a resistencia fenotípica asociada á formación de biopelículas ou para a emerxencia de variantes de pequenas colonias pode ser importante na resposta das poboacións de P. aeruginosa aos tratamentos con antibióticos.[16]
Prevención[editar | editar a fonte]
A profilaxe probiótica pode impedir a colonización e atrasar o comezo dunha infeccin por pseudomonas nas unidades de coidados intensivos dos hospitais.[36] Estase a investigar tamén a inmunoprofilaxe contra pseudomonas.[37]
Notas[editar | editar a fonte]
- ↑ Balcht, Aldona & Smith, Raymond (1994). Pseudomonas Aeruginosa: Infections and Treatment. Informa Health Care. pp. 83–84. ISBN 0-8247-9210-6.
- ↑ A. Y. Itah and J. P. Essien (2005). "Growth Profile and Hydrocarbonoclastic Potential of Microorganisms Isolated from Tarballs in the Bight of Bonny, Nigeria". World Journal of Microbiology and Biotechnology 21 (6–7): 1317–22. doi:10.1007/s11274-004-6694-z.
- ↑ 3,0 3,1 AVI Biopharma (2007-01-18). "Antisense antibacterial method and compound". World Intellectual Property Organization. Consultado o 2008-10-18.
- ↑ Ryan KJ, Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ Iglewski BH (1996). Pseudomonas. In: Baron's Medical Microbiology (Baron S et al., eds.) (4th ed.). Univ of Texas Medical Branch. ISBN 0-9631172-1-1.
- ↑ Anzai; Kim, H; Park, JY; Wakabayashi, H; Oyaizu, H (2000, Jul). "Phylogenetic affiliation of the pseudomonads based on 16S rRNA sequence". Int J Syst Evol Microbiol 50 (4): 1563–89. PMID 10939664. doi:10.1099/00207713-50-4-1563.
- ↑ King EO, Ward MK, Raney DE (1954). "Two simple media for the demonstration of pyocyanin and fluorescein". J Lab Clin Med 44 (2): 301–7. PMID 13184240.
- ↑ Palmer KL, Brown SA, Whiteley M (2007). "Membrane-bound nitrate reductase is required for anaerobic growth in cystic fibrosis sputum". J. Bacteriol. 189 (12): 4449–55. PMC 1913347. PMID 17400735. doi:10.1128/JB.00162-07.
- ↑ Vander Wauven C, Piérard A, Kley-Raymann M, Haas D (1984). "Pseudomonas aeruginosa mutants affected in anaerobic growth on arginine: evidence for a four-gene cluster encoding the arginine deiminase pathway". J. Bacteriol. 160 (3): 928–34. PMC 215798. PMID 6438064.
- ↑ Hassett DJ (1996). "Anaerobic production of alginate by Pseudomonas aeruginosa: alginate restricts diffusion of oxygen". J. Bacteriol. 178 (24): 7322–5. PMC 178651. PMID 8955420.
- ↑ Worlitzsch D; Tarran R; Ulrich M; Schwab, Ute; Cekici, Aynur; Meyer, Keith C.; Birrer, Peter; Bellon, Gabriel; Berger, Jürgen (2002). "Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients". J. Clin. Invest. 109 (3): 317–325. PMC 150856. PMID 11827991. doi:10.1172/JCI13870.
- ↑ Cooper M, Tavankar GR, Williams HD (2003). "Regulation of expression of the cyanide-insensitive terminal oxidase in Pseudomonas aeruginosa". Microbiology 149 (Pt 5): 1275–84. PMID 12724389. doi:10.1099/mic.0.26017-0.
- ↑ Williams HD, Zlosnik JE, Ryall B (2007). "Oxygen, cyanide and energy generation in the cystic fibrosis pathogen Pseudomonas aeruginosa". Adv. Microb. Physiol. 52: 1–71. PMID 17027370. doi:10.1016/S0065-2911(06)52001-6.
- ↑ "List of Prokaryotic Names with Standing in Nomenclature". Arquivado dende o orixinal o 06 de decembro de 2006. Consultado o 26 de abril de 2013.
- ↑ Mathee, K.; Narasimhan, G.; Valdes, C.; Qiu, X.; Matewish, J. M.; Koehrsen, M.; Rokas, A.; Yandava, C. N. et al. (2008). "Dynamics of Pseudomonas aeruginosa genome evolution". Proceedings of the National Academy of Sciences 105 (8): 3100–3105. doi:10.1073/pnas.0711982105. PMC 2268591. PMID 18287045.
- ↑ 16,0 16,1 16,2 16,3 16,4 Cornelis P (editor). (2008). Pseudomonas: Genomics and Molecular Biology (1st ed.). Caister Academic Press. ISBN 1-904455-19-0.
- ↑ Todar's Online Textbook of Bacteriology. Textbookofbacteriology.net (2004-06-04). Retrieved on 2011-10-09.
- ↑ Fine MJ; Smith MA; Carson CA; Mutha, SS; Sankey, SS; Weissfeld, LA; Kapoor, WN (1996). "Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis". JAMA 275 (2): 134–141. PMID 8531309. doi:10.1001/jama.275.2.134.
- ↑ Diekema DJ; Pfaller MA; Jones RN; Doern, GV; Winokur, PL; Gales, AC; Sader, HS; Kugler, K; Beach, M (1999). "Survey of bloodstream infections due to Gram-negative bacilli: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, and Latin America for the SENTRY Antimicrobial Surveillance Program, 1997". Clin. Infect. Dis. 29 (3): 595–607. PMID 10530454. doi:10.1086/598640.
- ↑ Prithiviraj B, Bais H, Weir T, Suresh B, Najarro E, Dayakar B, Schweizer H, Vivanco J (2005). "Down regulation of virulence factors of Pseudomonas aeruginosa by salicylic acid attenuates its virulence on Arabidopsis thaliana and Caenorhabditis elegans". Infect Immun 73 (9): 5319–5328. PMC 1231131. PMID 16113247. doi:10.1128/IAI.73.9.5319-5328.2005.
- ↑ Research could lead to new non-antibiotic drugs to counter hospital infections. University of Chicago Medical Center. 2009-04-14. Acceso 26-04-2013. [1]
- ↑ Walker TS; Bais HP; Déziel E; Schweizer, HP; Rahme, LG; Fall, R; Vivanco, JM (2004). "Pseudomonas aeruginosa-plant root interactions. Pathogenicity, biofilm formation, and root exudation". Plant Physiol. 134 (1): 320–331. PMC 316311. PMID 14701912. doi:10.1104/pp.103.027888.
- ↑ 23,0 23,1 Rahme LG, Stevens EJ, Wolfort SF, Shao J, Tompkins RG, Ausubel FM (1995). "Common virulence factors for bacterial pathogenicity in plants and animals". Science 268 (5219): 1899–1902. PMID 7604262. doi:10.1126/science.7604262.
- ↑ Rahme LG; Tan MW; Le L; Wong, SM; Tompkins, RG; Calderwood, SB; Ausubel, FM (1997). "Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors". Proc. Natl. Acad. Sci. U.S.A. 94 (24): 13245–50. PMC 24294. PMID 9371831. doi:10.1073/pnas.94.24.13245.
- ↑ Mahajan-Miklos S, Tan MW, Rahme LG, Ausubel FM (1999). "Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model". Cell 96 (1): 47–56. PMID 9989496. doi:10.1016/S0092-8674(00)80958-7.
- ↑ Martínez C, Pons E, Prats G, León J (2004). "Salicylic acid regulates flowering time and links defence responses and reproductive development". Plant J. 37 (2): 209–17. PMID 14690505. doi:10.1046/j.1365-313X.2003.01954.x.
- ↑ D'Argenio DA, Gallagher LA, Berg CA, Manoil C (2001). "Drosophila as a model host for Pseudomonas aeruginosa infection". J. Bacteriol. 183 (4): 1466–71. PMC 95024. PMID 11157963. doi:10.1128/JB.183.4.1466-1471.2001.
- ↑ Miyata S, Casey M, Frank DW, Ausubel FM, Drenkard E (2003). "Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis". Infect. Immun. 71 (5): 2404–13. PMC 153283. PMID 12704110. doi:10.1128/IAI.71.5.2404-2413.2003.
- ↑ Rahme LG; Ausubel FM; Cao H; Drenkard, E; Goumnerov, BC; Lau, GW; Mahajan-Miklos, S; Plotnikova, J; Tan, MW (2000). "Plants and animals share functionally common bacterial virulence factors". Proc. Natl. Acad. Sci. U.S.A. 97 (16): 8815–21. PMC 34017. PMID 10922040. doi:10.1073/pnas.97.16.8815.
- ↑ Thomas Bjarnsholt,1 Peter Østrup Jensen,2 Thomas B. Rasmussen,1 Lars Christophersen,2 Henrik Calum,2 Morten Hentzer,3 Hans-Petter Hougen,4 Jørgen Rygaard,5 Claus Moser,2 Leo Eberl,6 Niels Høiby2 and Michael Givskov1 (2005). "Garlic blocks quorum sensing and promotes rapid clearing of pulmonary Pseudomonas aeruginosa infections". Microbiology 151 (4): 3873–80. PMID 16339933. doi:10.1099/mic.0.27955-0.
- ↑ Pseudomonas aeruginosa: tratamiento combinado frente a monoterapia. Med. Intensiva v.31 n.2 Madrid mar. 2007. [2]
- ↑ A. Sulakvelidze, Z. Alavidze and J.G. Morris, Jr. (2001). "Bacteriophage therapy". Antimicrobial Agents and Chemotherapy 45 (3): 649–659. PMC 90351. PMID 11181338. doi:10.1128/AAC.45.3.649-659.2001.
- ↑ Wright, A.; Hawkins, C.; Anggård, E.; Harper, D. (2009). "A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy". Clinical Otolaryngology 34 (4): 349–357. doi:10.1111/j.1749-4486.2009.01973.x. PMID 19673983.
- ↑ Hachem RY; Chemaly RF; Ahmar CA; Jiang, Y.; Boktour, M. R.; Rjaili, G. A.; Bodey, G. P.; Raad, I. I. (2007). "Colistin is effective in treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in cancer patients". Antimicrob. Agents Chemother. 51 (6): 1905–11. PMC 1891378. PMID 17387153. doi:10.1128/AAC.01015-06.
- ↑ Poole, K. (2004). "Efflux-mediated multiresistance in Gram-negative bacteria". Clinical Microbiology and Infection 10 (1): 12–26. doi:10.1111/j.1469-0691.2004.00763.x. PMID 14706082.
- ↑ Forestier C, Guelon D, Cluytens V, Gillart T, Sirot J, de Champs C. (2008). "Oral probiotic and prevention of Pseudomonas aeruginosa infections: a randomized, double-blind, placebo-controlled pilot study in ICU-patients". Crit Care 12 (3): R69. PMC 2481460. PMID 18489775. doi:10.1186/cc6907.
- ↑ Döring G, Pier GB (2008). "Vaccines and immunotherapy against Pseudomonas aeruginosa". Vaccine 26 (8): 1011–24. PMID 18242792. doi:10.1016/j.vaccine.2007.12.007.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
| Commons ten máis contidos multimedia sobre: Pseudomonas aeruginosa |
Bibliografía[editar | editar a fonte]
- Breidenstein EB.; de la Fuente-Núñez, C.; Hancock, RE. "Pseudomonas aeruginosa: all roads lead to resistence". En Trends Microbiol. 19 (8): 419-26.
