Toxina diftérica
| Precursor da toxina diftérica tox | |
|---|---|
| |
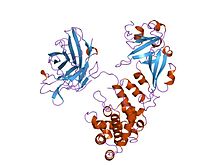
| Representación da proteína da toxina difteria | |
| Identificadores | |
| Organismo | |
| Símbolo | tox |
| Entrez | 2650491 |
| RefSeq (Prot) | NP_938615 |
| UniProt | P00587 |
| Outros datos | |
| Número EC | 2.4.2.36 |
| Cromosoma | xenoma: 0.19 - 0.19 Mb |
| Toxina diftérica, dominio C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Diphtheria_C | ||||||||
| Pfam | PF02763 | ||||||||
| Pfam clan | CL0084 | ||||||||
| InterPro | IPR022406 | ||||||||
| SCOPe | 1ddt / SUPFAM | ||||||||
| TCDB | 1.C.7 | ||||||||
| |||||||||
| Toxina diftérica, dominio T | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Diphtheria_T | ||||||||
| Pfam | PF02764 | ||||||||
| InterPro | IPR022405 | ||||||||
| SCOPe | 1ddt / SUPFAM | ||||||||
| TCDB | 1.C.7 | ||||||||
| |||||||||
| Toxina diftérica, dominio R | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Diphtheria_R | ||||||||
| Pfam | PF01324 | ||||||||
| InterPro | IPR022404 | ||||||||
| SCOPe | 1ddt / SUPFAM | ||||||||
| TCDB | 1.C.7 | ||||||||
| |||||||||
A toxina diftérica é unha exotoxina segregada principalmente pola bacteria Corynebacterium diphtheriae causante da difteria, pero tamén por Corynebacterium ulcerans e Corynebacterium pseudotuberculosis. O xene da toxina está codificado por un profago (virus bacteriófago co seu xenoma inserido no xenoma da bacteria hóspede), chamado corinefago β.[1][2] A toxina causa a difteria en humanos ao entrar no citoplasma da célula e inhibir a síntese de proteínas.[3]
Estrutura[editar | editar a fonte]
A toxina diftérica é unha cadea polipeptídica de 535 aminoácidos que consta de dúas subunidades enlazadas por pontes disulfuro, coñecida como toxina A-B. Como a subunidade B se une á superficie celular e esta é a menos estable das subunidades, a subunidade A (máis estable) pode penetrar na célula hóspede.[4]
A estrutura cristalina da toxina diftérica homodímera foi determinada con resolución de 2,5 Å. A estrutura revela que é unha molécula con forma de Y que consta de tres dominios. O fragmento A contén o dominio catalítico C, e o fragmento B consta dos dominios T e R:[5]
- O dominio catalítico amino terminal, chamado dominio C, ten un pregamento beta+alfa pouco común.[6] O domino C bloquea a síntese de proteínas por tansferencia de ADP-ribosa desde o NAD+ a un residuo do aminoácido diftamida do factor de elongación eucariótico 2 (eEF-2).[7][8]
- Un dominio de translocación central, coñecido como dominio T ou TM, ten un pregamento multi-helicoidal similar á globina con dúas hélices adicionais no amino terminal, pero sen contraparte da primeira hélice de globina. Este dominio pénsase que perde o seu pregamento na membrana celular.[9] Un cambio conformacional inducido polo pH no domino T desencadea a inserción na membrana endosómica e facilita a transferencia do dominio C no citoplasma.[7][8]
- Un domino de unión ao receptor carboxilo terminal, coñecido como dominio R, ten un pregamento de sándwich beta que consta de nove febras en dúas follas con topoloxía de greca; é unha subclase de pregamento similar á inmunoglobulina.[6] O domino R únese a un receptor da superficie celular, o que permite que a toxina entre na célula por endocitose mediada por receptor.[7][8]
Mecanismo[editar | editar a fonte]

- Procesamento
- A rexión líder é cortada durante a secreción.
- Pequenos cortes proteolíticos separan as subunidades A e B, que permanecen unidas por pontes disulfuro ata que chegan ao citosol.
- A toxina únese ao factor de crecemento epidérmico que se une á heparina (HB-EGF).
- O complexo sofre endocitose pola célula hóspede.
- A acidificación dentro do endosoma induce a translocación da subunidade A ao citosol.
- Rompen as pontes disulfuro.
- A subunidade B permanece no endosoma como un poro.
- A subunidade A realiza a ADP-ribosilación do eEF-2 do hóspede. Como o eEF-2 é necesario para a síntese proteica; cando é inactivado, o hóspede non pode fabricar proteínas e así morre.
A toxina diftérica ten o mesmo mecanismo de acción que o encima NAD(+)—diftamida ADP-ribosiltransferase (EC 2.4.2.36). Cataliza a ADP-ribosilación do aminoácido pouco común diftamida no eEF-2 transferindo o grupo ADP-ribosil desde o NAD+. A ADP-ribosilación da diftamida inactiva a proteína eEF-2, inhibindo dese modo a tradución do ARNm. A reacción catalizada é a seguinte:
- NAD+ + péptido diftamida nicotinamida + péptido N-(ADP-D-ribosil)diftamida.
A exotoxina A de Pseudomonas aeruginosa usa un mecanismo de acción similar.
Dose letal e efectos[editar | editar a fonte]
A toxina diftérica é extraordinariamente potente.[4] A dose letal para as persoas é de 0,1 μg de toxina por kg de peso corporal. A morte ocorre pola necrose do corazón e o fígado.[10] A toxina diftérica tamén foi asociada co desenvolvemento da miocardite. A miocardite secundaria para a toxina diftérica é considerada un dos maiores riscos para nenos inmunizados.
Historia[editar | editar a fonte]
A toxina diftérica descubrírona en 1888 Émile Roux e Alexandre Yersin. En 1890, Emil Adolf von Behring desenvolveu unha antitoxina obtida de sangue de cabalos inmunizados con bacterias atenuadas.[11] En 1951, Freeman atopou que o xene da toxina non estaba codificado no cromosoma bacteriano, senón por un fago lisoxénico (o corinefago β)[2] que infecta todas as cepas toxixénicas da bacteria.[12][13][14]
Uso clínico[editar | editar a fonte]
O fármaco denileukin diftitox usa a toxina da difteria como axente antineoplástico.
Resimmune é unha inmunotoxina que está en ensaios clínicos en pacientes de lifoma de células T cutáneo. Usa a toxina diftérica (truncada polo dominio de unión á célula) acoplada a un anticorpo para a CD3ε (UCHT1).[15]
Investigación[editar | editar a fonte]
Igual que outras toxinas A-B, a toxina diftérica está especializada en transportar proteínas exóxenas a través da membrana de membranas celulares de mamíferos, que adoitan ser impermeables ás grandes proteínas. Esta capacidade exclusiva pode ser reorientada para a entrega de proteínas terapéuticas, en vez do dominio catalítico da toxina.[16][17]
Esta toxina tamén foi utilizada en investigacións neurocientíficas e do cancro para eliminar poboacións específicas de células que expresan o receptor da toxina diftérica (HB-EGF). A administración da toxina no organismo que non expresa de forma natural este receptor (por exemplo, ratos) ten como resultado a eliminación selectiva da poboación celular que o expresa.[18][19]
Notas[editar | editar a fonte]
- ↑ TABLE 1. Bacterial virulence properties altered by bacteriophages from Wagner PL, Waldor MK (agosto de 2002). "Bacteriophage control of bacterial virulence". Infection and Immunity 70 (8): 3985–93. PMC 128183. PMID 12117903. doi:10.1128/IAI.70.8.3985-3993.2002.
- ↑ 2,0 2,1 Johnson LP, Tomai MA, Schlievert PM (maio de 1986). "Bacteriophage Involvement in Group A Streptococcal Pyrogenic Exotoxin A Production". Journal of Bacteriology 166 (2): 623–7. PMC 214650. PMID 3009415. doi:10.1128/jb.166.2.623-627.1986.
- ↑ Bell CE, Eisenberg D (xaneiro de 1996). "Crystal structure of diphtheria toxin bound to nicotinamide adenine dinucleotide". Biochemistry 35 (4): 1137–49. PMID 8573568. doi:10.1021/bi9520848.
- ↑ 4,0 4,1 Murphy JR (1996). "Corynebacterium Diphtheriae: Diphtheria Toxin Production". En Baron S, et al. Medical microbiology (4ª ed.). Galveston, Texas: Univ. of Texas Medical Branch. ISBN 978-0-9631172-1-2. PMID 21413281.
- ↑ Choe S, Bennett MJ, Fujii G, Curmi PM, Kantardjieff KA, Collier RJ, Eisenberg D (May 1992). "The crystal structure of diphtheria toxin". Nature 357 (6375): 216–22. Bibcode:1992Natur.357..216C. PMID 1589020. doi:10.1038/357216a0.
- ↑ 6,0 6,1 Bell CE, Eisenberg D (xaneiro de 1997). "Crystal structure of nucleotide-free diphtheria toxin". Biochemistry 36 (3): 481–8. PMID 9012663. doi:10.1021/bi962214s.
- ↑ 7,0 7,1 7,2 Bennett MJ, Eisenberg D (setembro de 1994). "Refined structure of monomeric diphtheria toxin at 2.3 A resolution". Protein Science 3 (9): 1464–75. PMC 2142954. PMID 7833808. doi:10.1002/pro.5560030912.
- ↑ 8,0 8,1 8,2 Bell CE, Eisenberg D (xaneiro de 1996). "Crystal structure of diphtheria toxin bound to nicotinamide adenine dinucleotide". Biochemistry 35 (4): 1137–49. PMID 8573568. doi:10.1021/bi9520848.
- ↑ Bennett MJ, Choe S, Eisenberg D (setembro de 1994). "Refined structure of dimeric diphtheria toxin at 2.0 A resolution". Protein Science 3 (9): 1444–63. PMC 2142933. PMID 7833807. doi:10.1002/pro.5560030911.
- ↑ Pappenheimer AM (1977). "Diphtheria toxin". Annual Review of Biochemistry 46 (1): 69–94. PMID 20040. doi:10.1146/annurev.bi.46.070177.000441.
- ↑ Enke U (2015). "125 Jahre Diphtherieheilserum: Das Behring'sche Gold" [125 years of diphtheria healing serum: Behring’s gold]. Deutsches Ärzteblatt (en German) 112 (49): A–2088.
- ↑ Freeman VJ (xuño de 1951). "Studies on the virulence of bacteriophage-infected strains of Corynebacterium diphtheriae". Journal of Bacteriology 61 (6): 675–88. PMC 386063. PMID 14850426. doi:10.1128/JB.61.6.675-688.1951.
- ↑ Freeman VJ, Morse IU (marzo de 1952). "Further observations on the change to virulence of bacteriophage-infected a virulent strains of Corynebacterium diphtheria". Journal of Bacteriology 63 (3): 407–14. PMC 169283. PMID 14927573. doi:10.1128/JB.63.3.407-414.1952.
- ↑ Todar K (2009). "Diphtheria". Todar's Online Textbook of Bacteriology. Universidade de Wisconsin.
- ↑ Woo JH, Lee YJ, Neville DM, Frankel AE (2010). "Pharmacology of anti-CD3 diphtheria immunotoxin in CD3 positive T-cell lymphoma trials". Immunotherapy of Cancer. Methods in Molecular Biology 651. pp. 157–75. ISBN 978-1-60761-785-3. PMID 20686966. doi:10.1007/978-1-60761-786-0_10.
- ↑ Auger A, Park M, Nitschke F, Minassian LM, Beilhartz GL, Minassian BA, Melnyk RA (agosto de 2015). "Efficient Delivery of Structurally Diverse Protein Cargo into Mammalian Cells by a Bacterial Toxin". Molecular Pharmaceutics 12 (8): 2962–71. PMID 26103531. doi:10.1021/acs.molpharmaceut.5b00233.
- ↑ Beilhartz GL, Sugiman-Marangos SN, Melnyk RA (outubro de 2017). "Repurposing bacterial toxins for intracellular delivery of therapeutic proteins". Biochemical Pharmacology 142: 13–20. PMID 28408344. doi:10.1016/j.bcp.2017.04.009.
- ↑ Han JH, Kushner SA, Yiu AP, Hsiang HL, Buch T, Waisman A, et al. (marzo de 2009). "Selective erasure of a fear memory". Science 323 (5920): 1492–6. Bibcode:2009Sci...323.1492H. PMID 19286560. doi:10.1126/science.1164139.
- ↑ Tammela T, Sage J (2020). "Investigating Tumor Heterogeneity in Mouse Models". Annual Review of Cancer Biology 4 (1): 99–119. PMC 8218894. PMID 34164589. doi:10.1146/annurev-cancerbio-030419-033413.
Véxase tamén[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Diphtheria Toxin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
Este artigo incorpora textos en dominio público procedentes de Pfam e InterPro IPR022406
Este artigo incorpora textos en dominio público procedentes de Pfam e InterPro IPR022405
Este artigo incorpora textos en dominio público procedentes de Pfam e InterPro IPR022404

