Lipopolisacárido
Suxeriuse que "Endotoxina" sexa fusionado con este artigo ou apartado (conversa). Para realizar a fusión dos artigos sigue estes pasos. |

Os lipopolisacáridos (LPS), tamén chamados endotoxinas polos seus efectos tóxicos, son grandes moléculas que constan dun lípido e un polisacárido composto por tres porcións: o antíxeno O, o núcleo interno e o núcleo externo, unidos por enlace covalente. Encóntranse na membrana externa de bacterias gramnegativas.
O termo lipooligosacárido (LOS) utilízase para referirse a unha forma de baixo peso molecular de lipopolisacáridos bacterianos.
Descubrimento
[editar | editar a fonte]A actividade tóxica do LPS descubriuna Richard Friedrich Johannes Pfeiffer e denominouna "endotoxina" para distinguila das exotoxinas, que el clasificou como toxinas liberadas pola bacteria no ambiente que a rodea, mentres que el cosideraba que as endotoxinas se mantiñan "dentro" da célula bacteriana e só se liberaban despois da destrución da parede celular bacteriana.[1]:84 Traballos posteriores demostraron que a liberación de LPS dos microbios gramnegativos non require necesariamente a destrución da parece bacteriana, senón que o LPS se segrega como parte da actividade fisiolóxica normal do tráfico de vesículas de membrana en forma de vesículas da membrana externa bacteriana, que poden conter tamén outros facores de virulencia e proteínas.[2]
Hoxe, o termo "endotoxina" utilízase principalmente como sinónimo de LPS,[3] aínda que hai unhas poucas endotoxinas que non están relacionadas co LPS, como as denominadas proteínas delta endotoxinas segregadas polo Bacillus thuringiensis (que é grampositivo). Outras bacterias grampositivas, como Listeria monocytogenes teñen na membrana ácidos lipoteicoicos con funcións e estrutura similares ás das endotoxinas lipopolisacáridas.[4][5]
Funcións nas bacterias
[editar | editar a fonte]O LPS é o principal compoñente da membrana externa das bacterias gramnegativas, contribuíndo grandemente á integridade estrutural das bacterias e protexendo a membrana de certos tipos de ataques químicos. O LPS tamén incrementa a carga negativa da membrana celular e axuda a estabilizar toda a estrutura da membrana. É de vital importancia para moitas bacterias gramnegativas, que morren se este muta ou é eliminado; malia todo, parece que o LPS non é esencial en polo menos algunhas bacterias gramnegativas, como Neisseria meningitidis, Moraxella catarrhalis e Acinetobacter baumannii.[6] O LPS induce unha forte resposta dos sistemas inmunitarios animais en estado normal. Tamén foi implicado en aspectos non patoxénicos da ecoloxía bacteriana, como a adhesión a superficies, sensibilidade a bacteriófagos e interaccións con predadores como as amebas.
O LPS é necesario para a correcta conformación da actividade omptina; porén, o LPS liso interfire estericamene coas omptinas.
Composición
[editar | editar a fonte]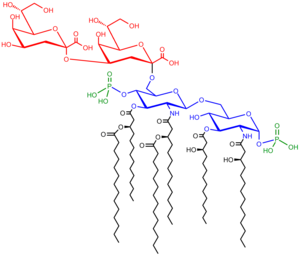
Comprende tres partes:
- Antíxeno O (ou polisacárido O). Situado no extremo da molécula.
- Oligosacárido do núcleo (core) da molécula. Situado na base da molécula e dividido en núcleo interno e externo.
- Lípido A. Ancorado na membrana externa bacteriana.
Antíxeno O
[editar | editar a fonte]Un polímero repetitivo de glicano contido no LPS da bacteria denomínase antíxeno O, polisacárido O ou cadea lateral O. O antíxeno O está unido ao oligosacárido que forma o núcleo da molécula e comprende o dominio máis externo da molécula de LPS. A composición da cadea O varía de cepa a cepa. Por exemplo, hai unhas 160 estruturas diferentes de antíxeno O producidas por distintas cepas de E. coli.[7] A presenza ou ausencia de cadeas O determina se o LPS se considera rugoso ou liso. As cadeas O de lonxitude completa orixinan LPS lisos, mentres que a ausencia ou redución das cadeas O dan lugar ao LPS rugoso.[8] As bacterias con LPS rugoso xeralmente teñen membranas celulares máis penetrables por antibióticos hidrófobos, xa que un LPS rugoso é máis hidrófobo.[9] O antíxeno O está exposto na superficie externa da célula bacteriana e, en consecuencia, é unha diana para o recoñecemento polos anticorpos do hóspede.
Núcleo
[editar | editar a fonte]O dominio do núcleo (core) sempre contén un compoñente oligosacárido (oligosacárido do núcleo) que se une directamente ao lípido A e normalmente contén azucres como a heptosa e a ácido 3-desoxi-D-mano-oct-2-ulosónico (tamén chamado KDO, ceto-desoxioctulosonato).[10] Os núcleos do LPS de moitas bacterias tamén conteñen compoñentes non carbohidratos, como substituíntes fosfato, aminoácidos e etanolamina.
Lípido A
[editar | editar a fonte]O lípido A é, en circunstancias normais, un disacárido de glicosamina fosforilado decorado con múltiples ácidos graxos. Estas cadeas de ácidos graxos hidrófobos ancoran o LPS na membrana bacteriana e o resto do LPS proxéctase desde a superficie da célula. O dominio do lípido A é responsable de gran parte da toxicidade das bacterias gramnegativas. Cando as células bacterianas son lisadas polo sistema inmunitario, fragmentos da membrana que conteñen o lípido A son liberados á circulación, causando febre, diarrea e un posible choque endotóxico letal (chamado choque séptico). O residuo de lípido A é un compoñente moi conservado do LPS.[11] Porén, a estrutura do lípido A varía entre especies bacterianas e dita estrutura define a activación global do sistema inmnitario do hóspede.[12]
Lipooligosacáridos
[editar | editar a fonte]Os lipoologosacáridos (LOS) son glicolípidos que se encontran na membrana externa dalgúns tipos de bacterias gramnegativas, como Neisseria spp. e Haemophilus spp. O termo é sinónimo de forma de baixo peso molecular do LPS bacteriano.[13] Os LOS teñen un papel central no mantemento da integridade e funcionalidade da membrana externa da envoltura gramnegativa. Os lipooligosacáridos xogan un importante papel na patoxénese de certas infeccións bacterianas porque poden actuar como inmunoestimuladores e inmunomoduladores.[13] Ademais, as moléculas de LOS son responsables da capacidade que teñen algunhas cepas de bacterias de presentar mimetismo molecular e diversidade antixénica, que axuda á evasión das defensas inmunitarias do hóspede e así contribúe á virulencia destas cepas de bacterias.
Quimicamente, os lipooligosacáridos carecen de antíxenos O e só posúen un residuo para a ancoraxe na membrana externa baseado no lípido A e un núcleo oligosacárido.[14] No caso de Neisseria meningitidis, a porción de lípido A da molécula ten unha estrutura simétrica e o núcleo interno está composto por ácido 3-desoxi-D-mano-2-octulosónico (KDO) e restos de heptosa (Hep). A cadea oligosacárida do núcleo externo varía dependendo da cepa bacteriana.[13][14] O lipopolisacárido bacteriano pode clasificarse en dúas formas: a forma de alto peso molecular (Mr, ou lisa) posúe unha cadea repetitiva de polisacárido O (antíxeno O) de alto peso molecular, e a forma de baixo peso molecular (baixo Mr ou rugosa ou oligosacárido, LOS), carece de cadea O, pero posúe un curto oligosacárido no seu lugar.[13]
Modificacións do LPS
[editar | editar a fonte]A produción do LPS na bacteria pode ser modificada para que este teña unha estrutura de azucres específica. Estas estruturas poden ser recoñecidas por outros LPS (o cal permite inhibir toxinas LPSs) ou por glicosiltransferases que utilizan esas estruturas de azucres para engadir máis azucres específicos. Un encima lipase do hóspede moi conservado pode detoxificar o LPS cando este entra ou é producido nos tecidos animais. Pode tamén converter o LPS no intestino nun inhibidor de LPS. Os neutrófilos, macrófagos e células dendríticas producen esta lipase, a aciloxiacil hidrolase (AOAH), que inactiva o LPS ao eliminar as dúas cadeas acilo secundarias do lípido A para producir tetraacil LPS. Nos ratos se se administra LPS por vía parenteral, aqueles ratos que carecen de AOAH desenvolven altos títulos de anticorpos non específicos, desenvolvendo unha prolongada hepatomegalia, e experimentando unha prolongada tolerancia á endotoxina. Para que os animais recuperen a homeostase despois dunha exposición parenteral ao LPS pode ser necesaria a inactivación do LPS.[15] Aínda que os ratos teñen moitos outros mecanismos para inhibir a sinalización por LPS, ningún pode impedir estes cambios en animais que carecen de AOAH.
Biosíntese e transporte
[editar | editar a fonte]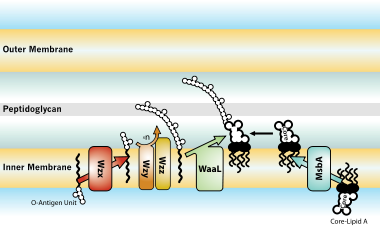

Efectos biolóxicos sobre hóspedes infectados por bacterias gramnegativas
[editar | editar a fonte]Resposta inmune
[editar | editar a fonte]O LPS actúa como a endotoxina prototípica porque se une ao complexo receptor CD14/TLR4/MD2 en moitos tipos celulares, pero especialmente en monocitos, células dendríticas, macrófagos e células B, o cal promove a secreción de citocinas proinflamatorias, óxido nítrico e eicosanoides.[18]
Como parte da resposta ao estrés celular, o superóxido é unha das principais especies reactivas do oxíxeno inducida polo LPS en varios tipos celulares que expresan o TLR (receptor de tipo Toll).
O LPS é tamén un piróxeno exóxeno (substancia que induce a febre).
Como esta molécula é de crucial importancia para as bacterias gramnegativas, estas moléculas son dianas candidatas para novos axentes antimicrobianos.
Algúns investigadores dubidan dos informes de efectos tóxicos xeneralizados atribuídos a todos os lipopolisacáridos, en especial para o caso das cianobacterias.[19]
A función do LPS estivo en investigación experimental durante varios anos debido ao seu papel na activación de moitos factores de transcrición. O LPS tamén produce smoitos tipos de mediadores implicados no choque séptico. Os humanos son máis sensibles ao LPS que outros animais (por exemplo, os ratos). Unha dose de 1 µg/kg induce un shock en humanos, pero os ratos toleran unha dose ata mil veces máis alta.[20] Isto pode estar relacionado con diferenzas no nivel de anticorpos naturais circulantes entre as dúas especies.[21][22] Said et al. demostraron que o LPS causa unha inhibición dependente da IL-10 da expansión e función de células T CD4 ao regular á alza os niveis de PD-1 en monocitos, o que orixina a produción de IL-10 polos monocitos despois de unirse o PD-1 ao PD-L1.[23]
As endotoxinas son en gran parte responsables das intensas manifestacións clínicas das infeccións por bacterias patóxenas gramnegativas, como Neisseria meningitidis, o patóxeno que causa a enfermidade meningocócica, incluíndo a meningococcemia, a síndrome de Waterhouse–Friderichsen e a meninxite. A fosfatase alcalina impide a inflamación intestinal (e a elevada permeabilidade intestinal) causada polas bacterias ao desfosforilaren a porción do lípido A do LPS.[24][25][26]
Bruce Beutler compartiu o Premio Nobel de Medicina ou Fisioloxía de 2011 polo seu traballo que demostraba que o TLR4 é o receptor do LPS.[27][28]
Demostrouse que porcións do LPS de varias cepas bacterianas son quimicamente similares ás moléculas da superficie de células hóspede humanas; a capacidade dalgunhas bacterias de presentar moléculas na súa superficie que son quimicamene idénticas ou similares ás moléculas da superficie dalgúns tipos de células do hóspede denomínase mimetismo molecular.[29] Por exemplo, en Neisseria meningitidis L2,3,5,7,9, a porción terminal tetrasacárida do oligosacárido (lacto-N-neotetraosa) é o mesmo tetrasacárido que se encontra no paraglobósido, un precursor dos antíxenos glicolipídicos ABH que se encontran nos eritrocitos humanos.[13] Outro exemplo é a porción terminal trisacárida (lactotriaosa) do oligosacárido de Neisseria spp patóxena. O LOS tamén se encontra en glicoesfingolípidos lactoneoseries de células humanas.[13] A maioría dos meningococos dos grupos B e C, e tamén os gonococos teñen este trisacárido formando parte da estrutura dos LOS.[13] A presenza deste 'imitadores' da superficie celular humana pode, ademais de actuar como unha 'camuflaxe' ante o sistema inmunitario, ter un papel na supresión da tolerancia inmunitaria cando se infecta o hóspede con certas xenotipos de antíxeno leucocitario humano (HLA), como HLA-B35.[13]
Recentemente, un novo estudo publicado descubriu que o LPS pode ser detectado directamente polas células nais hematopoéticas por medio da súa unión ao TLR4, causando que proliferen en reacción á infección sistémica. Esta resposta activa a sinalización de TLR4-TRIF-ROS-p38 dentro da célula nai e por medio dunha activación sostida de TLR4 pode causar un estrés proliferativo, que conduce a alterar a súa capacidade de repoboación competitiva.[30] A infección en ratos por Salmonella typhimurium mostrou resultados similares, validando o modelo experimental in vivo.
Efecto da variabilidade na resposta inmune
[editar | editar a fonte]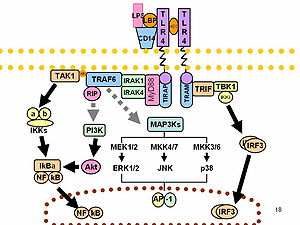
Os antíxenos O (os carbohidratos externos) son a porción máis variable da molécula de LPS, e danlle a especificidade antixénica. En contraste, o lípido A é a parte máis conservada. Porén, a composición do lípido A tamén pode variar (por exemplo, no número e natureza das cadeas acilo tanto entre distintos xéneros coma dentro do mesmo xénero). Algunhas destas variacións poden darlle propiedades antagonistas a estes LPS. Por exemplo, o lípido A difosforilo de Rhodobacter sphaeroides (RsDPLA) é un potente antagonista do LPS en células humanas, pero é un agonista en células de hámster e de equinos.[31]
Especulouse que os lípidos A cónicos (por exemplo o de E. coli) son moi agonistas, e os lípidos A menos cónicos, como os de Porphyromonas gingivalis, poden activar un sinal diferente (o TLR2 en troques do TLR4), e os lípidos A completamente cilíndricos, como o de Rhodobacter sphaeroides, son antagonistas dos TLRs.[32][33]
Os clústers de xenes para a prodción de LPS son moi variables entre diferentes cepas, subespecies e especies de patóxenos bacterianos de plantas e animais.[34][35]
O soro sanguíneo humano normal contén anticorpos anti-LOS que son bactericidas e os pacientes que teñen infeccións causadas por cepas serotipicamente distintas posúen anticorpos anti-LOS que difiren na súa especificidade comparados co soro normal.[36] Estas diferenzas na resposta inmune humoral a diferentes tipos de LOS poden atribuírse á estrutura da molécula do LOS, principalmente dentro da estrutura da porción oligosacárida do LOS.[36] En Neisseria gonorrhoeae demostrouse que a antixenidade das moléculas de LOS pode cambiar durante unha infección debido á capacidade destas bacterias de sintetizar máis dun tipo de LOS,[36] unha característica coñecida como variación de fase. Adicionalmente, Neisseria gonorrhoeae, así como Neisseria meningitidis e Haemophilus influenzae,[13] poden modificar máis os seus LOS in vitro, por exemplo por sialilación (modificación con residuos de ácido siálico) e como resultado poden incrementar a súa resistencia á morte mediada polo complemento [36] ou mesmo regulan á baixa a activación do complemento[13] ou evádense dos efectos de anticorpos bactericidas.[13] A sialilación pode tamén contribuír a dificultar a adhesión e fagocitose de neutrófilos polas células do sistema inmunitario e tamén a reducir a explosión oxidativa.[13] Haemophilus somnus, un patóxeno do gando vacún, tamén presenta variación de fase de LOS, unha característica que pode axudar a evasdirse das defensas inmunitarias do hóspede bovino.[37] En conxunto, estas observacións suxiren que as variacións nas moléculas da superficie de bacterias como os LOS poden axudar a que o patóxeno se evada tanto das defensas inmunes do hóspede humorais (mediadas polos anticorpos e complemento) coma das celulares (matanza realizada polos neutrófilos, por exemplo).
Vías non canónicas de recoñecemento do LPS
[editar | editar a fonte]Recentemente, demostrouse que ademais das vías mediadas por TLR4, certos membros da familia das canles iónicas de potencial receptor transitorio (TRP) recoñecen o LPS.[38] A activación mediada por LPS de TRPA1 demostouse en ratos[39] e moscas Drosophila melanogaster.[40] A altas concentracións, o LPS activa tamén outros membros da familia da canle TRP, como TRPV1, TRPM3 e en certa medida TRPM8.[41] O LPS é recoñecido polo TRPV4 en células epiteliais. A activación de TRPV4 polo LPS era necesaria e suficiente para inducir a produción de óxido nítrico con efectos bactericidas.[42]
Efectos sobre a saúde
[editar | editar a fonte]Endotoxemia
[editar | editar a fonte]A presenza de endotoxinas no sangue denomínase endotoxemia. Pode orixinar un choque séptico se a resposta inmune é excesivamente pronunciada.[43]
Porén, a endotoxemia de orixe intestinal, especialmente na interface hóspede-patóxeno, considérase un importante factor no desenvolvemento da hapatite alcohólica,[44] que probablemente se desenvolve sobre a base do síndrome de sobrecrecemento bacteriano no intestino delgado e un incremento na permeabilidade intestinal.[45]
O lípido A pode causar unha activación incontrolada dos sistemas inmunitarios de mamíferos con produción de mediadores inflamatorios que pode causar un choque séptico.[14] Esta reacción inflamatoria é mediada polo TLR 4, que é responsable da activación de células do sistema inmunitario.[14] Os danos na capa endotelial de vasos sanguíneos causados por estes mediadores inflamatorios pode orixinar unha síndrome de permeabilidade capilar, dilatación de vasos sanguíneos e un decrecemento da función cardíaca e pode conducir a un choque séptico.[46] Unha activación do complemento demasiado pronunciada pode observarse tamén posteriormente no curso da infección a medida que as bacterias se multiplican no sangue.[46] Unha elevada proliferación de bacterias que desencadea un dano endotelial destrutivo pode igualmete levar a unha coagulación intravascular diseminada con perda da función de certos órganos internos como os riles, glándulas adrenais e pulmóns debido a que o rego sanguíneo se ve comprometido. A pel pode mostrar os efectos do dano vascular a miúdo acoplados con diminución dos factores de coagulación en forma de petequias, púrpura e equimoses. As extremidades poden tamén ser afectadas, ás veces con consecuencias devastadoras como o desenvolvemento de gangrena, que pode requirir amputación.[46] A perda de función das glándulas adrenais pode causar insuficiencia adrenal e hemorraxias adicionais nas adrenais causan a síndrome de Waterhouse-Friderichsen, ambas as cales poden ser mortais. Tamén se informou que os LOS de gonococos poden causar danos nas trompas de Falopio das mulleres.[36]
Enfermidades autoinmunes
[editar | editar a fonte]O mimetismo molecular dalgunhas moléculas de LOS pénsase que causa respostas do hóspede baseadas na autoinmunidade, como gromos de esclerose múltiple.[13][29] Outros exemplos de mimetismo bacteriano de estruturas do hóspede por medio do LOS poden encontrarse nas bacterias Helicobacter pylori e Campylobacter jejuni, organismos que causan enfermidade gastrointestinal en humanos, e en Haemophilus ducreyi, que causa o chancroide. Certos serotipos de LPS de C. jejuni (atribuídos a certos residuos de tetra- e pentasacárido do núcleo oligosacarídico) foron tamén implicados na síndrome de Guillain–Barré e unha variante da Guillain–Barré chamada síndrome de Miller-Fisher.[13]
Ligazón coa obesidade
[editar | editar a fonte]Demostrouse en estudos epidemiolóxicos que un incremento da carga de endotoxinas, que pode ser o resultado do incremento de poboacións de bacterias produtoras de endotoxinas no tracto intestinal, está asociado con certos grupos de pacientes relacionados coa obesidade.[47][48][49] Outros estudos mostraron que a endotoxina purificada de Escherichia coli pode inducir obesidade e resistencia á insulina cando se inxecta en modelos de ratos libres de xermes.[50] Un estudo máis recente descubriu unha posible contribución en Enterobacter cloacae B29 á obesidade e á resistencia á insulina nun paciente humano.[51] O mecanismo que se supón para a asociación da endotoxina coa obesidade é que a endotoxina induce unha vía mediada pola inflamación que explica a obesidade e resistencia á insulina observadas.[50] Entre os xéneros bacterianos asociados cos efectos sobre a obesidade relacionados coa endotoxina están Escherichia e Enterobacter.
Investigacións de laboratorio e sistemas de produción biotecnolóxicos
[editar | editar a fonte]Os lipopolisacáridos son frecuentes contaminantes do ADN de plásmidos preparados a partir de bacterias ou proteínas expresadas por bacterias, e deben ser eliminados deses ADN e proteínas para evitar contaminar os experimentos e evitar a toxicidade dos produtos fabricados usando a fermentación industrial.[52]
Ademais, a ovoalbumina está frecuentemente contaminada con endotoxinas. A ovoalbumina é unha das proteínas máis estudadas en modelos animais e tamén un modelo establecido de alérxeno para a hipersensibilidade das vías aéreas. A ovoalbúmina dispoñible comercialmente que está contaminada con LPS pode activar completamente as células endoteliais nun ensaio in vitro da primeira etapa da inflamación e falsea os resultados das investigacións, xa que non reflicte con exactitude o efecto dos antíxenos proteicos na fisioloxía animal.[53]
Na produción farmacéutica cómpre eliminar todas as trazas de endotoxina dos recipientes dos medicamentos, xa que mesmo pequenas cantidades de endotoxina causan enfermidade en humanos. Para este propósito utilízase un forno de despiroxenación. Necesítanse temperaturas por riba de 300 °C para destruír esta substancia. Unha taxa de redución de endotoxina definida é unha correlación entre o tempo e a temperatura. Baseándose no material de empaquetado primario, como viais ou xiringas, para conseguir unha redución de niveis de endotoxina á milésima parte o típico é chegar unha temperatura do vidro de 250 °C e mantela durante un tempo de 30 minutos.[54]
O ensaio estándar para detectar a presenza de endotoxina é o ensaio Lisado de Amebocito de Limulus (LAL), no que se utiliza sangue do artrópodo mariño Limulus polyphemus (cangrexo de ferradura).[55] Niveis moi baixos de LPS poden causar coagulación do lisado de Limulus debido a unha potente amplificación por medio dunha fervenza encimática. Porén, debido á minguante poboación destes animais, e ao feito de que hai factores que interfiren co ensaio LAL, estanse facendo intentos de desenvolver ensaios alternativos, e os máis prometedores son os tests ELISA que usan unha versión recombinante dunha proteína do ensaio LAL, o factor C.[56]
Notas
[editar | editar a fonte]- ↑ Parija SC (Jan 1, 2009). Textbook of Microbiology & Immunology. India: Elsevier. ISBN 978-8131221631.
- ↑ Kulp A, Kuehn MJ (2010). "Biological functions and biogenesis of secreted bacterial outer membrane vesicles". Annu. Rev. Microbiol. 64: 163–84. PMC 3525469. PMID 20825345. doi:10.1146/annurev.micro.091208.073413.
- ↑ Rietschel ET, Kirikae T, Schade FU, Mamat U, Schmidt G, Loppnow H, Ulmer AJ, Zähringer U, Seydel U, Di Padova F (1994). "Bacterial endotoxin: molecular relationships of structure to activity and function". FASEB J. 8 (2): 217–25. PMID 8119492. doi:10.1096/fasebj.8.2.8119492.
- ↑ Fiedler, F (1988). "Biochemistry of the cell surface of Listeria strains: a locating general view". Infection. 16 Suppl 2: S92–7. PMID 3417357.
- ↑ Farber, JM; Peterkin, PI (1991). "Listeria monocytogenes, a food-borne pathogen". Microbiological reviews 55 (3): 476–511. PMC 372831. PMID 1943998.
- ↑ Zhang G, Meredith TC, Kahne D (2013). "On the essentiality of lipopolysaccharide to Gram-negative bacteria". Curr. Opin. Microbiol. 16 (6): 779–785. PMC 3974409. PMID 24148302. doi:10.1016/j.mib.2013.09.007.
- ↑ Raetz CR, Whitfield C (2002). "Lipopolysaccharide endotoxins". Annu. Rev. Biochem. 71: 635–700. PMC 2569852. PMID 12045108. doi:10.1146/annurev.biochem.71.110601.135414.
- ↑ Rittig MG, Kaufmann A, Robins A, Shaw B, Sprenger H, Gemsa D, Foulongne V, Rouot B, Dornand J (2003). "Smooth and rough lipopolysaccharide phenotypes of Brucella induce different intracellular trafficking and cytokine/chemokine release in human monocytes". J. Leukoc. Biol. 74 (6): 1045–55. PMID 12960272. doi:10.1189/jlb.0103015.
- ↑ Tsujimoto H, Gotoh N, Nishino T (1999). "Diffusion of macrolide antibiotics through the outer membrane of Moraxella catarrhalis". J. Infect. Chemother. 5 (4): 196–200. PMID 11810516. doi:10.1007/s101560050034.
- ↑ Hershberger, C.; Binkley, S. B. (1968-04-10). "Chemistry and metabolism of 3-deoxy-D-mannooctulosonic acid. I. Stereochemical determination". The Journal of Biological Chemistry 243 (7): 1578–1584. ISSN 0021-9258. PMID 4296687.
- ↑ Tzeng YL, Datta A, Kolli VK, Carlson RW, Stephens DS (May 2002). "Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase". J. Bacteriol. 184 (9): 2379–88. PMC 134985. PMID 11948150. doi:10.1128/JB.184.9.2379-2388.2002.
- ↑ Khan, Mohd M.; Ernst, Orna; Sun, Jing; Fraser, Iain D. C.; Ernst, Robert K.; Goodlett, David R.; Nita-Lazar, Aleksandra (2018-06-24). "Mass Spectrometry-based Structural Analysis and Systems Immunoproteomics Strategies for Deciphering the Host Response to Endotoxin". Journal of Molecular Biology 430 (17): 2641–2660. ISSN 1089-8638. PMID 29949751. doi:10.1016/j.jmb.2018.06.032.
- ↑ 13,00 13,01 13,02 13,03 13,04 13,05 13,06 13,07 13,08 13,09 13,10 13,11 13,12 13,13 Moran AP, Prendergast MM, Appelmelk BJ (1996). "Molecular mimicry of host structures by bacterial lipopolysaccharides and its contribution to disease". FEMS Immunol. Med. Microbiol. 16 (2): 105–15. PMID 8988391. doi:10.1016/s0928-8244(96)00072-7. Arquivado dende o orixinal o 2016-09-23.
- ↑ 14,0 14,1 14,2 14,3 Kilár A, Dörnyei Á, Kocsis B (2013). "Structural characterization of bacterial lipopolysaccharides with mass spectrometry and on- and off-line separation techniques". Mass Spectrom Rev 32 (2): 90–117. Bibcode:2013MSRv...32...90K. PMID 23165926. doi:10.1002/mas.21352.
- ↑ Munford R, Lu M, Varley AW (2009). Kill the Bacteria...and Also Their Messengers?. Advances in Immunology 103. pp. 29–48. ISBN 9780123748324. PMC 2812913. PMID 19755182. doi:10.1016/S0065-2776(09)03002-8.
- ↑ Wang X, Quinn PJ (2010). "Lipopolysaccharide: Biosynthetic pathway and structure modification". Prog. Lipid Res. 49 (2): 97–107. PMID 19815028. doi:10.1016/j.plipres.2009.06.002.
- ↑ Ruiz N, Kahne D, Silhavy TJ (2009). "Transport of lipopolysaccharide across the cell envelope: the long road of discovery". Nat. Rev. Microbiol. 7 (9): 677–83. PMC 2790178. PMID 19633680. doi:10.1038/nrmicro2184.
- ↑ Abbas, Abul (2006). Basic Immunology. Elsevier. ISBN 978-1-4160-2974-8.
- ↑ Stewart I, Schluter PJ, Shaw GR (2006). "Cyanobacterial lipopolysaccharides and human health - a review". Environ Health 5: 7. PMC 1489932. PMID 16563160. doi:10.1186/1476-069X-5-7.
- ↑ Warren HS, Fitting C, Hoff E, Adib-Conquy M, Beasley-Topliffe L, Tesini B, Liang X, Valentine C, Hellman J, Hayden D, Cavaillon JM (2010). "Resilience to bacterial infection: difference between species could be due to proteins in serum". J. Infect. Dis. 201 (2): 223–32. PMC 2798011. PMID 20001600. doi:10.1086/649557.
- ↑ Reid RR, Prodeus AP, Khan W, Hsu T, Rosen FS, Carroll MC (1997). "Endotoxin shock in antibody-deficient mice: unraveling the role of natural antibody and complement in the clearance of lipopolysaccharide". J. Immunol. 159 (2): 970–5. PMID 9218618.
- ↑ Boes M, Prodeus AP, Schmidt T, Carroll MC, Chen J (1998). "A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection". J. Exp. Med. 188 (12): 2381–6. PMC 2212438. PMID 9858525. doi:10.1084/jem.188.12.2381.
- ↑ Said EA, Dupuy FP, Trautmann L, Zhang Y, Shi Y, El-Far M, Hill BJ, Noto A, Ancuta P, Peretz Y, Fonseca SG, Van Grevenynghe J, Boulassel MR, Bruneau J, Shoukry NH, Routy JP, Douek DC, Haddad EK, Sekaly RP (2010). "Programmed death-1-induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection". Nat. Med. 16 (4): 452–9. PMC 4229134. PMID 20208540. doi:10.1038/nm.2106.
- ↑ Bates JM, Akerlund J, Mittge E, Guillemin K (2007). "Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota". Cell Host & Microbe 2 (6): 371–382. PMC 2730374. PMID 18078689. doi:10.1016/j.chom.2007.10.010.
- ↑ Alam SN, Yammine H, Moaven O, Ahmed R, Moss AK, Biswas B, Muhammad N, Biswas R, Raychowdhury A, Kaliannan K, Ghosh S, Ray M, Hamarneh SR, Barua S, Malo NS, Bhan AK, Malo MS, Hodin RA (April 2014). "Intestinal alkaline phosphatase prevents antibiotic-induced susceptibility to enteric pathogens". Annals of Surgery 259 (4): 715–22. PMC 3855644. PMID 23598380. doi:10.1097/sla.0b013e31828fae14.
- ↑ Lallès JP (February 2014). "Intestinal alkaline phosphatase: novel functions and protective effects". Nutrition Reviews 72 (2): 82–94. PMID 24506153. doi:10.1111/nure.12082.
- ↑ Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C, Freudenberg M, Ricciardi-Castagnoli P, Layton B, Beutler B (1998). "Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene". Science 282 (5396): 2085–8. Bibcode:1998Sci...282.2085P. PMID 9851930. doi:10.1126/science.282.5396.2085.
- ↑ "The 2011 Nobel Prize in Physiology or Medicine - Press Release". www.nobelprize.org. Arquivado dende o orixinal o 23 March 2018. Consultado o 28 April 2018.
- ↑ 29,0 29,1 Chastain EM, Miller SD (2012). "Molecular mimicry as an inducing trigger for CNS autoimmune demyelinating disease". Immunol. Rev. 245 (1): 227–38. PMC 3586283. PMID 22168423. doi:10.1111/j.1600-065X.2011.01076.x.
- ↑ Takizawa, Hitoshi; Fritsch, Kristin; Kovtonyuk, Larisa V.; Saito, Yasuyuki; Yakkala, Chakradhar; Jacobs, Kurt; Ahuja, Akshay K.; Lopes, Massimo; Hausmann, Annika (2017-08-03). "Pathogen-Induced TLR4-TRIF Innate Immune Signaling in Hematopoietic Stem Cells Promotes Proliferation but Reduces Competitive Fitness". Cell Stem Cell 21 (2): 225–240.e5. ISSN 1875-9777. PMID 28736216. doi:10.1016/j.stem.2017.06.013.
- ↑ Katharina L Lohmann 1, Michel Vandenplas, Michelle H Barton, James N Moore. Lipopolysaccharide from Rhodobacter sphaeroides is an agonist in equine cells. J Endotoxin Res. 2003;9(1):33-7. doi: 10.1179/096805103125001315. [1]
- ↑ Netea MG, van Deuren M, Kullberg BJ, Cavaillon JM, Van der Meer JW (2002). "Does the shape of lipid A determine the interaction of LPS with Toll-like receptors?". Trends Immunol. 23 (3): 135–9. PMID 11864841. doi:10.1016/S1471-4906(01)02169-X.
- ↑ Seydel U, Oikawa M, Fukase K, Kusumoto S, Brandenburg K (2000). "Intrinsic conformation of lipid A is responsible for agonistic and antagonistic activity". Eur. J. Biochem. 267 (10): 3032–9. PMID 10806403. doi:10.1046/j.1432-1033.2000.01326.x.
- ↑ Reeves PP, Wang L (2002). Genomic organization of LPS-specific loci. Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology 264. pp. 109–35. ISBN 978-3-540-42682-0. PMID 12014174. doi:10.1007/978-3-642-56031-6_7.
- ↑ Patil PB, Sonti RV (2004). "Variation suggestive of horizontal gene transfer at a lipopolysaccharide (lps) biosynthetic locus in Xanthomonas oryzae pv. oryzae, the bacterial leaf blight pathogen of rice". BMC Microbiol. 4: 40. PMC 524487. PMID 15473911. doi:10.1186/1471-2180-4-40.
- ↑ 36,0 36,1 36,2 36,3 36,4 Yamasaki R, Kerwood DE, Schneider H, Quinn KP, Griffiss JM, Mandrell RE (1994). "The structure of lipooligosaccharide produced by Neisseria gonorrhoeae, strain 15253, isolated from a patient with disseminated infection. Evidence for a new glycosylation pathway of the gonococcal lipooligosaccharide". J. Biol. Chem. 269 (48): 30345–51. PMID 7982947.
- ↑ Howard MD, Cox AD, Weiser JN, Schurig GG, Inzana TJ (2000). "Antigenic diversity of Haemophilus somnus lipooligosaccharide: phase-variable accessibility of the phosphorylcholine epitope". J. Clin. Microbiol. 38 (12): 4412–9. PMC 87614. PMID 11101573. doi:10.1128/JCM.38.12.4412-4419.2000.
- ↑ Boonen, Brett; Alpizar, Yeranddy; Meseguer, Victor; Talavera, Karel; Boonen, Brett; Alpizar, Yeranddy A.; Meseguer, Victor M.; Talavera, Karel (2018-08-11). "TRP Channels as Sensors of Bacterial Endotoxins". Toxins (en inglés) 10 (8): 326. PMC 6115757. PMID 30103489. doi:10.3390/toxins10080326.
- ↑ Meseguer, Victor; Alpizar, Yeranddy A.; Luis, Enoch; Tajada, Sendoa; Denlinger, Bristol; Fajardo, Otto; Manenschijn, Jan-Albert; Fernández-Peña, Carlos; Talavera, Arturo; Kichko, Tatiana; Navia, Belén; Sánchez, Alicia; Señarís, Rosa; Reeh, Peter; Pérez-García, María Teresa; López-López, José Ramón; Voets, Thomas; Belmonte, Carlos; Talavera, Karel; Viana, Félix (20 January 2014). "TRPA1 channels mediate acute neurogenic inflammation and pain produced by bacterial endotoxins". Nature Communications 5: 3125. Bibcode:2014NatCo...5.3125M. PMC 3905718. PMID 24445575. doi:10.1038/ncomms4125.
- ↑ Soldano, Alessia; Alpizar, Yeranddy A; Boonen, Brett; Franco, Luis; López-Requena, Alejandro; Liu, Guangda; Mora, Natalia; Yaksi, Emre; Voets, Thomas; Vennekens, Rudi; Hassan, Bassem A; Talavera, Karel (14 June 2016). "Gustatory-mediated avoidance of bacterial lipopolysaccharides via TRPA1 activation in Drosophila". eLife 5. PMC 4907694. PMID 27296646. doi:10.7554/eLife.13133.
- ↑ Boonen, Brett; Alpizar, Yeranddy A.; Sanchez, Alicia; López-Requena, Alejandro; Voets, Thomas; Talavera, Karel (July 2018). "Differential effects of lipopolysaccharide on mouse sensory TRP channels". Cell Calcium 73: 72–81. PMID 29689522. doi:10.1016/j.ceca.2018.04.004.
- ↑ Alpizar, Yeranddy A.; Boonen, Brett; Sanchez, Alicia; Jung, Carole; López-Requena, Alejandro; Naert, Robbe; Steelant, Brecht; Luyts, Katrien; Plata, Cristina; De Vooght, Vanessa; Vanoirbeek, Jeroen A. J.; Meseguer, Victor M.; Voets, Thomas; Alvarez, Julio L.; Hellings, Peter W.; Hoet, Peter H. M.; Nemery, Benoit; Valverde, Miguel A.; Talavera, Karel (20 October 2017). "TRPV4 activation triggers protective responses to bacterial lipopolysaccharides in airway epithelial cells". Nature Communications 8 (1): 1059. Bibcode:2017NatCo...8.1059A. PMC 5651912. PMID 29057902. doi:10.1038/s41467-017-01201-3.
- ↑ Opal SM (2010). Endotoxins and other sepsis triggers. Contrib Nephrol. Contributions to Nephrology 167. pp. 14–24. ISBN 978-3-8055-9484-4. PMID 20519895. doi:10.1159/000315915.
- ↑ Ceccanti M, Attili A, Balducci G, Attilia F, Giacomelli S, Rotondo C, Sasso GF, Xirouchakis E, Attilia ML (2006). "Acute alcoholic hepatitis". J. Clin. Gastroenterol. 40 (9): 833–41. PMID 17016141. doi:10.1097/01.mcg.0000225570.04773.5d.
- ↑ Parlesak A, Schäfer C, Schütz T, Bode JC, Bode C (2000). "Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease". J. Hepatol. 32 (5): 742–7. PMID 10845660. doi:10.1016/S0168-8278(00)80242-1.
- ↑ 46,0 46,1 46,2 Stephens DS, Greenwood B, Brandtzaeg P (2007). "Epidemic meningitis, meningococcaemia, and Neisseria meningitidis". Lancet 369 (9580): 2196–210. PMID 17604802. doi:10.1016/S0140-6736(07)61016-2.
- ↑ Moreno-Navarrete JM, Ortega F, Serino M, Luche E, Waget A, Pardo G, Salvador J, Ricart W, Frühbeck G, Burcelin R, Fernández-Real JM (2012). "Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance". Int J Obes (Lond) 36 (11): 1442–9. PMID 22184060. doi:10.1038/ijo.2011.256.
- ↑ Lepper PM, Schumann C, Triantafilou K, Rasche FM, Schuster T, Frank H, Schneider EM, Triantafilou M, von Eynatten M (2007). "Association of lipopolysaccharide-binding protein and coronary artery disease in men". J. Am. Coll. Cardiol. 50 (1): 25–31. PMID 17601541. doi:10.1016/j.jacc.2007.02.070.
- ↑ Ruiz AG, Casafont F, Crespo J, Cayón A, Mayorga M, Estebanez A, Fernadez-Escalante JC, Pons-Romero F (2007). "Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients: evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis". Obes Surg 17 (10): 1374–80. PMID 18000721. doi:10.1007/s11695-007-9243-7.
- ↑ 50,0 50,1 Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R (2007). "Metabolic endotoxemia initiates obesity and insulin resistance". Diabetes 56 (7): 1761–72. PMID 17456850. doi:10.2337/db06-1491.
- ↑ Fei N, Zhao L (December 2012). "An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice". ISME J 7 (4): 880–4. PMC 3603399. PMID 23235292. doi:10.1038/ismej.2012.153.
- ↑ Wicks, Ian P.; Howell, Meredith L.; Hancock, Tuesday; Kohsaka, Hitoshi; Olee, Tsaiwei; Carson, Dennis A. (March 1995). "Bacterial Lipopolysaccharide Copurifies with Plasmid DNA: Implications for Animal Models and Human Gene Therapy". Human Gene Therapy 6 (3): 317–323. PMID 7779915. doi:10.1089/hum.1995.6.3-317.
- ↑ Junji Watanabe, Yasunari Miyazaki, Guy A Zimmerman, Kurt H Albertine, Thomas M McIntyre. Endotoxin contamination of ovalbumin suppresses murine immunologic responses and development of airway hyper-reactivity. J Biol Chem. 2003 Oct 24;278(43):42361-8. doi: 10.1074/jbc.M307752200. Epub 2003 Aug 8. PMID: 12909619 DOI: 10.1074/jbc.M307752200 [2]
- ↑ 16 December 2014. "The Detection of Endotoxins Via the LAL Test, the Chromogenic Method". Arquivado dende o orixinal o 29 March 2015. Consultado o 14 March 2015.
- ↑ Iwanaga S (2007). "Biochemical principle of Limulus test for detecting bacterial endotoxins". Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci. 83 (4): 110–9. Bibcode:2007PJAB...83..110I. PMC 3756735. PMID 24019589. doi:10.2183/pjab.83.110.
- ↑ Ding JL, Ho B (2001). "A new era in pyrogen testing" (PDF). Trends Biotechnol. 19 (8): 277–81. PMID 11451451. doi:10.1016/s0167-7799(01)01694-8. Arquivado dende o orixinal (PDF) o 2 January 2014. Consultado o 2 January 2014.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Lipopolysaccharides Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
