Arxinina
| Arxinina | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 7200-25-1, 157-06-2 R, 74-79-3 S |
| PubChem | 232, 71070 R, 6322 S |
| ChemSpider | 227, 64224 R, 6082 S |
| UNII | 94ZLA3W45F |
| Número CE | 230-571-3 |
| DrugBank | DB00125 |
| KEGG | C02385 |
| MeSH | Arginine |
| ChEBI | CHEBI:29016 |
| ChEMBL | CHEMBL212301, CHEMBL1485 |
| Ligando IUPHAR | 721 |
| Número RTECS | CF1934200 S |
| Código ATC | B05XB01 (WHO) S |
| 3DMet | B01331 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H14N4O2 |
| Masa molar | 174,20 g mol−1 |
| Aspecto | cristais brancos |
| Olor | inodoro |
| Punto de fusión | 260 °C; 500 °F; 533 K |
| Punto de ebulición | 368 °C; 694 °F; 641 K |
| Solubilidade en auga | 14,87 g/100 mL (20 °C) |
| Solubilidade | lixeiramente soluble en etanol insoluble en etil éter |
| log P | −1,652 |
| Acidez (pKa) | 2,488 |
| Basicidade (pKb) | 11,509 |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
−624,9–−622.3 kJ mol−1 |
| Entalpía estándar de combustión ΔcH |
−3,7396–−3.7370 MJ mol−1 |
| Entropía molar estándar S |
250,6 J K−1 mol−1 |
| Capacidade calorífica, C | 232,8 J K−1 mol−1 (a 23,7 °C) |
| Perigosidade | |
| MSDS | Sigma-Aldrich |
| Pictogramas GHS | 
|
| Palabra sinal GHS | WARNING |
| declaración de perigosidade GHS | 319 |
| declaración de precaución GHS | 305+351+338 |
| Clasificación da UE | |
| Frases R | r36 |
| Frases S | s26 |
| LD50 | 5110 mg/kg (rata, oral) |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

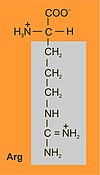
A arxinina[1] (abreviadamente Arg ou R)[2] é un α-aminoácido cunha cadea lateral formada por unha cadea alifática de 3 carbonos, que leva ao final un grupo guanidinio con características básicas, xa que o grupo guanidinio está cargado positivamente a pH celulares (neutros), pero tamén en pH ácidos e na maioría dos básicos, presentando un pKa de 12,48. A situación do seu dobre enlace fai que a súa carga positiva estea deslocalizada, o que permite que poida formar múltiples pontes de hidróxeno. O seu nome IUPAC é ácido (S)-2-amino-5-guanidinopentanoico.
Os seus codóns son CGU, CGC, CGA, CGG, AGA e AGG.
A L-arxinina é un dos 20 aminoácidos proteicos ou proteinoxénico. Nos mamíferos a arxinina está clasificada como aminoácido semiesencial, xa que o noso organismo ten rutas metabólicas para sintetizalo e a maioría da xente sintetiza o suficiente no seu corpo. Pero dependendo do estado do desenvolvemento ou de saúde pode ser necesario tomalo na dieta como un aminoácido esencial.[3] Os bebés prematuros non poden sintetizar suficiente arxinina, polo que é esencial para eles.[4] Algunhas situacións que requiren un suplemento de arxinina poden ser cirurxía ou outros traumas, sepse (infeccións) ou queimaduras.
A arxinina foi illada por primeira vez da leguminosa do xénero Lupinus en 1886 polo químico suízo Ernst Schultze.

Fontes de arxinina
[editar | editar a fonte]Alimentos
[editar | editar a fonte]A arxinina atópase nunha ampla variedade de alimentos, entre os que están [5]: produtos lácteos, carne, porco, xelatina, aves, peixes, mariscos, xerme de trigo e fariña, fariña de avea, cacahuetes, froitos secos, sésamo, garavanzos, soia etc.
Biosíntese
[editar | editar a fonte]A arxinina sintetízase a partir da citrulina pola acción secuencial dos encimas citosólicos arxininosuccinato sintetase e arxininosuccinato liase. Isto é custoso enerxeticamente, porque a síntese de cada molécula de arxininosuccinato require a hidrólise de ATP a AMP, o que supón o gasto de dous enlaces enerxéticos do fosfato.
A citrulina pode obterse de múltiples fontes:
- da propia arxinina previamente existente por acción da óxido nítrico sintase.
- da ornitina vía catabolismo da prolina ou glutamina/glutamato.
- da dimetilarxinina asimétrica vía DDAH.
As vías metabólicas que ligan a arxinina, glutamina, e prolina son bidireccionais. De modo que, a utilización ou a produción neta destes aminoácidos depende do tipo de célula e do seu estado de desenvolvemento.
No organismo a síntese de arxinina ocorre principalmente no eixe intestinal–renal, no cal as células do epitelio do intestino delgado, que producen citrulina principalmente a partir da glutamina e o glutamato, colaboran coas células do túbulo proximal do ril, que toman citrulina do sangue e a converten en arxinina, que se devolve á circulación sanguínea. En consecuencia, o mal funcionamento do intestino delgado ou da función renal pode reducir a síntese endóxena de arxinina, incrementándose a necesidade de obtela da dieta.
A síntese de arxinina a partir de citrulina tamén acontece con menor intensidade en moitas outras células, e a capacidade celular de síntese de arxinina pode incrementarse significativamente en circunstancias que tamén inducen a óxido nítrico sintase. Así, a citrulina, un coproduto da reacción catalizada pola óxido nítrico sintase, pode ser reciclada a arxinina nunha vía coñecida como a vía citrulina-óxido nítrico ou vía arxinina-citrulina. Isto pode demostrarse polo feito de que en moitos tipos celulares, a arxinina pode en certo grao substituírse por citrulina en favorecer a síntese de óxido nítrico. Porén, a reciclaxe non é cuantitativa porque a citrulina se acumula xunto con nitrato e nitrito, os produtos finais estables do óxido nítrico, nas células que producen óxido nítrico.[6]
Degradación
[editar | editar a fonte]Na degradación oxidativa da arxinina orixínase alfa-cetoglutarato, que pode entrar na gliconeoxénese, polo que é un aminoácido glicoxénico.
Funcións
[editar | editar a fonte]A arxinina desempeña un importante papel na división celular, a cura de feridas, eliminación do amoníaco do corpo, na función inmunitaria, e na liberación de hormonas.[3][7][8] A arxinina tomada en combinación con proantocianidinas[9] ou yohimbina,[10] úsase como tratamento contra a disfunción eréctil.
Os beneficios e funcións que se lle atribúen á suplementación alimentaria con L-arxinina inclúen:
- É precursor da síntese de óxido nítrico (NO)[11].
- Reduce o tempo de curación das feridas (especialmente óseas)[7][8].
- Acelera a reparación de tecidos danados[7][8].
- Axuda a baixar a presión sanguínea[12][13].
Proteínas
[editar | editar a fonte]A estrutura da arxinina en canto a xeometría, distribución de carga e capacidade de formar múltiples pontes de hidróxeno fan da arxinina unha molécula ideal para unirse a grupos cargados negativamente. Por esta razón, a arxinina adoita estar situada na parte externa das proteínas, onde pode interaccionar co ambiente polar que as rodea.
Mesmo se está incorporada ás proteínas, a arxinina pode tamén ser convertida en citrulina por encimas PAD. Ademais, a arxinina pode ser metilada por encimas metiltransferases.
Precursor
[editar | editar a fonte]A arxinina é o precursor inmediato do óxido nítrico (NO), urea, ornitina e agmatina; é necesaria para a síntese de creatina; e pode tamén ser usado para a síntese de poliaminas (principalmente a través da ornitina e en menor grao agmatina), citrulina, e glutamato. Como precursor do óxido nítrico, a arxinina pode ser útil en tratamentos nos que se require unha vasodilatación.[3] A presenza de dimetilarxinina asimétrica (ADMA), un derivado, inhibe a reacción do óxido nítrico; por tanto, a dimetilarxinina asimétrica considérase un marcador para as enfermidades vasculares, igual que a L-arxinina se considera un indicador de boa saúde do endotelio vascular.
Tratamento da hipersensibilidade da dentina
[editar | editar a fonte]A arxinina en produtos como a pasta de dentes proporciona un alivio efectivo para os dentes ultrasensibles ao depositar un mineral similar á dentina, que contén calcio e fosfato, que tapa os túbulos da dentina e forma unha capa protectora sobre a superficie da dentina.[14]
Tratamento de infeccións polo virus herpex simplex
[editar | editar a fonte]Un efecto da arxinina que aínda non foi suficientemente probado é que unha razón baixa arxinina/lisina pode ser beneficiosa no tratamento do virus herpes simplex.[15]
Posible aumento do risco de morte despois da suplementación posterior a un ataque cardíaco
[editar | editar a fonte]Un ensaio clínico atopou que nos pacientes que tomaban un suplemento de L-arxinina despois dun ataque cardíaco non se observaban cambios no ton vascular do corazón nin melloraba a capacidade de bombear do corazón. O estudo concluíu recomendando que non se tome un suplemento de arxinina despois dun fallo cardíaco.[16][17][18] Malia estes feitos, o suplemento segue vendéndose como beneficioso para o corazón en xeral.
Usos médicos potenciais
[editar | editar a fonte]Inflamación pulmonar e asma
[editar | editar a fonte]A páxina web Clínica Mayo informa sobre a L-arxinina que a súa inhalación pode incrementar a inflamación pulmonar e empeorar a asma.[19]
Hormona do crecemento
[editar | editar a fonte]A arxinina pode estimular a secreción da hormona do crecemento,[20] e úsase nas probas de estimulación da hormona do crecemento.[21]
Síndrome MELAS
[editar | editar a fonte]Varios ensaios estudaron os efectos da L-arxinina na enfermidade mitocondrial coñecida como síndrome MELAS (Mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes syndrome).[22][23][24][25]
Procesos infecciosos
[editar | editar a fonte]A capacidade de biosíntese celular da arxinina determinada pola actividade da arxininosuccinato sintetase é inducida polos mesmos mediadores da resposta ás infeccións ou sepses (endotoxina e citocinas) que inducen a óxido nítrico sintase, o encima responsable da síntese de óxido nítrico.[26]
Sal de malato
[editar | editar a fonte]O sal de arxinina do ácido málico pode usarse durante o tratamento da hepatite alcohólica e a cirrose avanzada.[27]
Pre-eclampsia
[editar | editar a fonte]Un estudo preliminar de suplementación con L-arxinina e vitaminas antioxidantes mostrou que esta combinación podía axudar a combater a presión sanguínea anormalmente alta observada en embarazos de alto risco.[28]
Notas
[editar | editar a fonte]- ↑ Definición de arxinina no Dicionario de Galego de Ir Indo e a Xunta de Galicia.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. "Nomenclature and Symbolism for Amino Acids and Peptides". Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado o 2007-05-17.
- ↑ 3,0 3,1 3,2 Tapiero, H.; et al. (2002). "L-Arginine". Biomedicine and Pharmacotherapy 56 (9): 439–445 REVIEW. PMID 12481980. doi:10.1161/hc3301.094910.
- ↑ Wu, G.; et al. (2004). "Arginine deficiency in preterm infants: biochemical mechanisms and nutritional implications". Journal of Nutritional Biochemistry 15 (8): 332–451 REVIEW. PMID 15302078. doi:10.1016/j.jnutbio.2003.11.010.
- ↑ "L-Arginine Supplements Nitric Oxide Scientific Studies Food Sources". Arquivado dende o orixinal o 13 de xullo de 2011. Consultado o 2007-02-20.
- ↑ Morris Jr, SM (2004). "Enzymes of arginine metabolism.". The Journal of nutrition 134 (10 Suppl): 2743S–2747S. PMID 15465778. Arquivado dende o orixinal o 21 de setembro de 2005. Consultado o 15 de xullo de 2011.
- ↑ 7,0 7,1 7,2 Stechmiller, J.K.; et al. (2005). "Arginine supplementation and wound healing". Nutrition in Clinical Practice 20 (13): 52–61 REVIEW. PMID 16207646. doi:10.1177/011542650502000152.
- ↑ 8,0 8,1 8,2 Witte, M.B.; Barbul, A (2003). "Arginine physiology and its implication for wound healing". Wound Repair and Regeneration 11 (6): 419–423 REVIEW. PMID 14617280. doi:10.1046/j.1524-475X.2003.11605.x.
- ↑ Stanislavov, R.; Nikolova, V (2003). "Treatment of Erectile Dysfunction with Pycnogenol and L-arginine". Journal of Sex and Marital Therapy 29 (3): 207–213. PMID 12851125. doi:10.1080/00926230390155104.
- ↑ Lebret, T.; Hervéa, J. M.; Gornyb, P.; Worcelc, M.; Botto, H. (2002). "Efficacy and Safety of a Novel Combination of L-Arginine Glutamate and Yohimbine Hydrochloride: A New Oral Therapy for Erectile Dysfunction". European Urology 41 (6): 608–613. PMID 12074777. doi:10.1016/S0302-2838(02)00175-6.
- ↑ Andrew, P.J.; Myer, B. (1999). "Enzymatic function of nitric oxide synthases". Cardiovascular Research 43 (3): 521–531 REVIEW. PMID 10690324. doi:10.1016/S0008-6363(99)00115-7. [1]
- ↑ Gokce, N.. (2004). "L-Arginine and hypertension". Journal of Nutrition 134 (10 Suppl): 2807S–2811S REVIEW. PMID 15465790.
- ↑ Rajapakse, N.W.; et al. (2008). "Exogenous L-arginine ameliorates angiotensin II-induced hypertension and renal damage in rats". Hypertension 52 (6): 1084–1090. PMC 2680209. PMID 18981330. doi:10.1161/HYPERTENSIONAHA.108.114298. [2] Arquivado 27 de marzo de 2011 en Wayback Machine.
- ↑ Petrou, I.; et al. (2009). "A breakthrough therapy for dentin hypersensitivity: how dental products containing 8% arginine and calcium carbonate work to deliver effective relief of sensitive teeth.". The Journal of Clinical Dentisry 20 (1): 23–31. PMID 19489189.
- ↑ Takeshi Naito, Hiroshi Irie, Kazuko Tsujimoto, Keiko Ikeda, Tsutomu Arakawa, A. Hajime Koyama (2009). "Antiviral effect of arginine against herpes simplex virus type 1". International Journal of Molecular Medicine 23 (4): 495–499. PMID 19288025. doi:10.3892/ijmm_00000156. Consultado o 2010-10-18.
- ↑ Medical College of Georgia. "Diabetes Makes It Hard For Blood Vessels To Relax." ScienceDaily 1 February 2008. 1 February 2008
- ↑ Schulman, SP; Becker, LC; Kass, DA; Champion, HC; Terrin, ML; Forman, S; Ernst, KV; Kelemen, MD; Townsend, SN (2006). "L-arginine therapy in acute myocardial infarction: the Vascular Interaction With Age in Myocardial Infarction (VINTAGE MI) randomized clinical trial.". JAMA : the journal of the American Medical Association 295 (1): 58–64. PMID 16391217. doi:10.1001/jama.295.1.58.
- ↑ This study has been discussed in some detail in : "Reverse Heart Disease Now" by Stephen T Sinatra MD and James C Roberts MD, publ. Wiley 2006 ISBN 0-471-74704-1 at pp 111-113.
- ↑ Sapienza MA, Kharitonov SA, Horvath I, Chung KF, Barnes PJ. "Effect of inhaled L-arginine on exhaled nitric oxide in normal and asthmatic subjects." Thorax. 1998 Mar;53(3):172-5.
- ↑ Alba-Roth J, Müller O, Schopohl J, von Werder K (1988). "Arginine stimulates growth hormone secretion by suppressing endogenous somatostatin secretion". J Clin Endocrinol Metab 67 (6): 1186–9. PMID 2903866. doi:10.1210/jcem-67-6-1186.
- ↑ U.S. National Library of Medicine (September 2009). Growth hormone stimulation test
- ↑ Koga Y, Akita Y, Junko N, Yatsuga S, Povalko N, Fukiyama R, Ishii M, Matsuishi T (2006). "Endothelial dysfunction in MELAS improved by l-arginine supplementation". Neurology 66 (11): 1766–9. PMID 16769961. doi:10.1212/01.wnl.0000220197.36849.1e.
- ↑ Koga Y (2008). "[L-arginine therapy on MELAS]". Rinsho Shinkeigaku (en Japanese) 48 (11): 1010–2. PMID 19198147.
- ↑ Koga Y, Akita Y, Nishioka J, Yatsuga S, Povalko N, Katayama K, Matsuishi T (2007). "MELAS and L-arginine therapy". Mitochondrion 7 (1–2): 133–9. PMID 17276739. doi:10.1016/j.mito.2006.11.006.
- ↑ Finsterer J (2009). "Management of mitochondrial stroke-like-episodes". Eur. J. Neurol. 16 (11): 1178–84. PMID 19780807. doi:10.1111/j.1468-1331.2009.02789.x.
- ↑ MORRIS SM (1995). "ROLE OF ARGININE SYNTHESIS IN SURGICAL SEPSIS". Crisp Data Base National Institutes Of Health. Consultado o 2010-02-22.
- ↑ Tissot-Favre A, Brette R (1970). "Therapeutic effects of arginine malate in alcoholic cirrhosis". Therapie 25 (3): 629–33. PMID 5431854.
- ↑ Vadillo-Ortega F; et al. (2011). "Effect of supplementation during pregnancy with L-arginine and antioxidant vitamins in medical food on pre-eclampsia in high risk population: randomised controlled trial". British Medical Journal 342: d2901–d2901. doi:10.1136/bmj.d2901.
