Helicobacter pylori
| Helicobacter pylori | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||
| Clasificación científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| Helicobacter pylori (Marshall et al. 1985) Goodwin et al. 1989) | |||||||||||||||
Helicobacter pylori é unha especie bacteriana que infecta o epitelio gástrico humano. Moitas úlceras e algúns tipos de gastrite débense a infeccións por H. pylori. Calcúlase que un 50% da poboación humana ten H. pylori no seu estómago, pero a gran maioría dos suxeitos infectados (un 80%) nunca chega a desenvolver ningún tipo de síntoma. Tamén foi asociada co desenvolvemento de cancro gástrico.[1] Esta bacteria vive exclusivamente no estómago humano, sendo o único organismo coñecido que pode subsistir nun ambiente tan extremadamente ácido. É unha bacteria espiral e pode «aparafusarse» literalmente para colonizar o epitelio estomacal.[2][3][4][5]
Orixe do nome
[editar | editar a fonte]O nome inicial que recibiu esta bacteria foi Campylobacter pyloridis, despois chamouse Campylobacter pylori (ao corrixirse por erros no latín) e en 1989, despois de secuenciar o seu ADN, viuse que non pertencía ao xénero Campylobacter, e foi reclasificada no xénero Helicobacter (nome que deriva da súa forma espiral). O nome pylori vén do latín pylorus, que significa ‘gardabarreira’, e fai referencia ao píloro (abertura final do estómago que dá paso ao duodeno).
Historia
[editar | editar a fonte]Primeiras evidencias
[editar | editar a fonte]En 1875, científicos alemáns descubriron bacterias espirais no epitelio do estómago humano. Estas bacterias non podían cultivarse, polo que o descubrimento foi esquecido.[6] En 1892, o investigador italiano Giulio Bizzozero describiu unha serie de bacterias espirais que vivían no ambiente ácido do estómago de cans.
En 1899 o profesor Walery Jaworski, da Universidade Jagellónica en Cracovia, investigou sedimentos de lavados gástricos obtidos de humanos nos que, ademais dunhas bacterias alongadas, tamén encontrou bacterias cunha característica forma espiral, ás cales chamou Vibrio rugula. Este investigador foi o primeiro en suxerir a participación deste microorganismo en enfermidades gástricas. Aínda que este traballo foi incluído no Manual de enfermidades gástricas, non tivo moito impacto, debido a que estaba escrito en polaco.[7]
Redescubrimento e caracterización
[editar | editar a fonte]A bacteria foi redescuberta en 1979 polo patólogo australiano Robin Warren, quen en investigacións posteriores (a partir de 1981), xunto a Barry Marshall, illou este microorganismo das mucosas de estómagos humanos e foi o primeiro que conseguiu cultivala.[8] No traballo orixinal, Warren e Marshall afirmaron que moitas das úlceras estomacais e gastrites eran causadas pola colonización do estómago por esta bacteria, e non por estrés ou comida picante, como se sostiña ata entón.[9]
Implicación en patoxénese
[editar | editar a fonte]A comunidade médica foi moi reticente a recoñecer o feito de que esta bacteria fose a causante de úlceras estomacais ou gastrites, xa que se cría que as bacterias non podían sobrevivir moito tempo no medio ácido do estómago. A comunidade empezou a cambiar de idea baseándose en estudos posteriores que reafirmaron esta idea, incluíndo un no que Marshall bebeu un cultivo de H. pylori, desenvolvendo unha gastrite e recuperando a bacteria do seu propio revestimento estomacal; con isto, cumpría con tres dos cinco postulados de Koch. A gastrite de Marshall curouse sen ningún tratamento.
Marshall e Warren posteriormente descubriron que os antibióticos eran efectivos para o tratamento da gastrite. En 1994, os Institutos Nacionais da Saúde dos Estados Unidos (National Institutes of Health) informaron que as úlceras gástricas máis comúns eran causadas por H. pylori, e recomendaron o uso de antibióticos, sendo incluídos no réxime de tratamento.[10] En 2005, Warren e Marshall foron galardoados co Premio Nobel de Medicina polos seus traballos sobre H. pylori.[11]
Antes de comprobarse a implicación de H. pylori en doenzas estomacais, as úlceras estomacais tratábanse con medicamentos que neutralizaban a acidez. Isto facía moitas veces que as úlceras reaparecesen despois de deixar o tratamento. A medicación tradicional para a gastrite eran os sales de bismuto (subcitrato de bismuto coloidal ou subsalicilato de bismuto).[12] Este tratamento a miúdo era efectivo, pero a súa efectividade diminuía cun uso prolongado, ademais de descoñecerse o mecanismo de acción deste fármaco. Aínda non está claro se o bismuto pode actuar como antibiótico. Actualmente, moitas úlceras son tratadas de forma efectiva utilizando antibióticos fronte a H. pylori (2006).
Mentres H. pylori segue sendo a bacteria máis importante coñecida que habita no estómago humano, algunhas especies máis do xénero Helicobacter foron identificadas agora noutros mamíferos e nalgunhas aves. Comprobouse que algunhas destas poden infectar a humanos. Existen especies de Helicobacter que poden infectar o fígado de certos mamíferos, causando, por tanto, diversas doenzas hepáticas.
Características da bacteria
[editar | editar a fonte]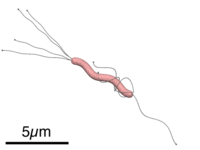
H. pylori é unha bacteria gramnegativa de forma espiral, de arredor de 3 microns de longo e cun diámetro aproximado duns 0,5 microns, flaxelada. É microaerófila, é dicir, require osíxeno pero a concentracións máis baixas que as atmosféricas. Usa hidróxeno e metanoxénese como fonte de enerxía, xa que contén unha hidroxenase coa cal oxida o H2 producido pola flora intestinal.[13] Ademais é oxidase e catalase positiva e produce urease.

Pode producir biopelículas[14] e pode pasar da súa forma espiral a unha forma cocoide viable pero non cultivable,[15] o que é importante para a súa supervivencia e epidemioloxía.
Cos seus flaxelos e a súa forma espiral, a bacteria perfora como un "trade" literalmente a capa de mucus do estómago, e despois pode quedar suspendida na mucosa gástrica ou adherir a células epiteliais. H. pylori produce adhesinas, proteínas que se unen a lípidos asociados a membranas e a carbohidratos.
H. pylori posúe cinco familias de proteínas da membrana externa principais (OMP).[16] A maior destas familias inclúe proteínas adhesinas. As outras catro familias inclúen porinas, transportadores de ferro, proteínas asociadas ao flaxelo e proteínas de funcións descoñecidas. Igual que noutras bacterias gramnegativas, a membrana externa de H. pylori consta de fosfolípidos e lipopolisacárido (LPS). O antíxeno O do LPS pode ser fucosilado e asemellarse aos antíxenos dos grupos sanguíneos de Lewis que se encontran no epitelio gástrico.[16] A membrana externa contén tamén colesterol glicósidos, que se atopan en poucas outras bacterias.[16]
Ten uns 4–6 flaxelos lofotricos.[17] Os característicos filamentos flaxelares envaiñados do xénero Helicobacter están compostos por dúas flaxelinas copolimerizadas chamadas FlaA e FlaB.[18]
Infección
[editar | editar a fonte]
A infección por H. pylori pode ser sintomática ou asintomática (sen efectos visibles na persoa); estímase que máis do 70% das infeccións son asintomáticas. En ausencia dun tratamento baseado en antibióticos, unha infección por H. pylori persiste aparentemente durante toda a vida na maioría das persoas (parece que pode desaparecer nalgúns casos en anciáns[19]). Ao sistema inmune humano non lle é posible erradicala.
Vía de infección
[editar | editar a fonte]A bacteria illouse das feces, da saliva e da placa dental dos pacientes infectados, o cal suxire unha ruta gastro-oral ou fecal-oral como posible vía de transmisión. Outros medios de infección suxeridos son inxerir auga e alimentos contaminados ou mesmo o traspaso oral de fluídos dunha persoa contaminada.
Epidemioloxía
[editar | editar a fonte]Calcúlase que máis de dous terzos da poboación mundial se encontra infectada por esta bacteria. A proporción de infección varía de nación a nación. No mundo occidental (Oeste de Europa, Norteamérica e Australia), a proporción é de arredor dun 25 % da poboación, e é moito maior no terceiro mundo. Neste último caso, é común, probablemente polas malas condicións sanitarias, encontrar infeccións en nenos. No caso de Estados Unidos, a infección dáse principalmente en persoas vellas (máis do 50% ocorren en persoas de máis de 60 anos, fronte a un 20% que se presentan en persoas de menos de 40) e nos sectores máis pobres.
Estas discrepancias atribúense a unha maior hixiene e ao maior uso de antibióticos en países máis ricos. De calquera forma, nos últimos anos están aparecendo cepas de H. pylori que presentan resistencia a antibióticos. No Reino Unido hai mesmo cepas resistentes a metronidazol.

1. H. pylori penetra na capa mucosa do estómago e adhire á superficie da capa mucosa epitelial gástrica.
2. Produce amoníaco a partir de urea, para neutralizar o ácido gástrico.
3. Migración e proliferación de H. pylori ao foco de infección.
4. Desenvólvese a ulceración gástrica con destrución da mucosa, inflamación e morte das células mucosas.
Fisiopatoloxía
[editar | editar a fonte]Para colonizar o estómago H. pylori debe poder sobrevivir no lume ácido do estómago e para iso utiliza os flaxelos para soterrarse no mucus e chegar preto da capa de células epiteliais do estómago, onde atopa o seu nicho ecolóxico.[20] Poden encontrarse moitas bacterias en zonas profundas do mucus, o cal é segregado polas células secretoras de mucus e eliminado na zona luminal. H. pylori, para evitar ser arrastrada ao lume, ten a capacidade de detectar o gradiente de pH na capa de mucus por quimiotaxe e nada lonxe da zona ácida do lume cara á zona máis neutra da superficie epitelial.[21] H. pylori tamén se pode encontrar sobre a superficie mesma do epitelio estomacal e ás veces dentro das células epiteliais estomacais.[22] Produce adhesinas, que se unen a lípidos asociados a membranas e a carbohidratos e axudan a adherirse ás células epiteliais. Por exemplo, a adhesina BabA únese ao antíxeno b de Lewis que se encontra na superficie das células epiteliais estomacias.[23]
H. pylori produce grandes cantidades do encima urease, e moléculas deste encima foron localizadas dentro e fóra da bacteria. A urease degrada a urea (que se segrega normalmente ao estómago) a dióxido de carbono e amoníaco. É un metalo-encima, dependente do níquel, que obtén do sangue, no que aparece como elemento de traza. O amoníaco convértese en amonio ao aceptar un protón (H+), o cal neutraliza o ácido gástrico. A supervivencia de H. pylori no estómago ácido depende da urease. O amoníaco producido é tóxico para as células epiteliais, e, xunto cos outros produtos de H. pylori, como proteases, citotoxina vacuolante A (VacA), e certas fosfolipases, causa un dano a ditas células.[24]
Os procesos inflamatorios das infeccións por H. pylori tamén están mediados por proteínas con moitas pontes disulfuro. As proteínas ricas en cisteína de H. pylori (Hcp), particularmente HcpA (hp0211), desencadean unha resposta inmune por medio da diferenciación dos monocitos Thp1 mieloides humanos en macrófagos. Analogamente ás citocinas eucarióticas, estas proteínas interfiren co funcionamento da célula hóspede e cambian a morfoloxía dos monocitos, inducindo a expresión da proteína marcadora de superficie CD11b, da actividade fagocítica, e da adherencia celular, todos os cales son indicativos da diferenciación dun monocito en macrófago.[25]
A colonización do estómago por H. pylori dá lugar a unha gastrite crónica, unha inflamación do revestimento do estómago. A gravidade da inflamación probablemente é a verdadeira razón das enfermidades relacionadas coas infeccións por H. pylori.[26] As úlceras de duodeno e estómago orixínanse cando as consecuencias da inflamación fan que o ácido e a pepsina do lume do estómago sobrepase os mecanismos de protección da mucosa do estómago e duodeno contra esas substancias cáusticas. O tipo de úlcera que se desenvolve depende da localización da gastrite crónica, que aparece no sitio de colonización de H. pylori.[27] A acidez no lume estomacal afecta ao padrón de colonización de H. pylori, e finalmente determina se se formará unha úlcera duodenal ou gástrica. Nas persoas que producen unha gran cantidade de ácido, H. pylori coloniza o antro do estómago para evitar as células parietais secretoras de ácido localizadas no corpo do estómago.[16] A resposta inflamatoria á bacteria induce ás células G do antro a segregar a hormona gastrina, que viaxa a través da corrente sanguínea ata o corpo do estómago.[28] A gastrina estimula as células parietais do corpo estomacal a segregar aínda máis ácido ao lume. Os niveis de gastrina incrementados cronicamente causan finalmente que aumente o número de células parietais, provocando unha escalada na cantidade de ácido segregada.[29] A carga ácida incrementada do duodeno, e a ulceración poden ser o resultado final. A diferenza das úlceras de duodeno, as gástricas están con frecuencia asociadas cunha produción de ácido normal ou reducida, o que suxire que os mecanismos que protexen a mucosa gástrica son defectuosos.[29] Neses pacientes, H. pylori pode tamén colonizar o corpo do estómago, onde se localizan as células parietais secretoras de ácido. Porén, a inflamación crónica inducida polas bacterias causa unha maior redución da produción de ácido e, finalmente, a atrofia do revestimento estomacal, o cal pode orixinar unha úlcera gástrica e incrementar o risco de cancro de estómago.[30]
Nos países occidentais, arredor do 50–70% das cepas de H. pylori levan nos seus xenomas a chamada illa de patoxenicidade cag (cag PAI).[31] Os pacientes deses países infectados con cepas que levan o cag PAI presentan unha forte resposta inflamatoria no estómago e teñen un maior risco de desenvolver úlceras pépticas ou cancro de estómago que os infectados con cepas que carecen de dita illa.[16] Despois de que H. pylori se une ás células epiteliais do estómago, o sistema de secreción de tipo IV expresado polo cag PAI "inxecta" o axente que induce a inflamación, que é o peptidoglicano, da súa propia parede celular nas células epiteliais. O peptidoglicano inxectado é recoñecido polo receptor de recoñecemento de padrón citoplasmático Nod1 (un inmunosensor), o cal despois estimula a expresión de citocinas que promoven a inflamación.[32]
Diagnóstico
[editar | editar a fonte]Existen diferentes métodos para diagnosticar unha infección de H. pylori. Un consiste en detectar anticorpos específicos nunha mostra de sangue do paciente ou de feces, utilizando antíxenos. Tamén se utiliza a proba do alento con urea, na cal o paciente bebe urea marcada con 14C ou 13C, producíndose posteriormente (debido ao metabolismo da bacteria) dióxido de carbono marcado, o cal é detectado na respiración. Outro método de diagnóstico é a biopsia, na cal se mide a urease activa na mostra extraída (a denominado "proba rápida de urease"). Tamén se pode facer a proba de alento da urea. Outra forma de diagnosticar unha infección de H. pylori é por medio dunha mostra histolóxica ou dun cultivo celular. Un dos métodos de detección máis sensibles é a PCR (reacción en cadea da polimerase), a cal permite tamén identificar xenes asociados á virulencia (CagA e VacA), xenes asociados á adhesión (BabA) e xenes de resistencia a antibióticos (claritromicina).
Ningún destes métodos é completamente infalible. A proba de anticorpos sanguíneos, por exemplo, ten tan só entre un 76 e un 84 % de sensibilidade. A medicación, por outro lado, pode afectar á actividade da urease e dar falsos positivos nos métodos baseados nela.
Prevención
[editar | editar a fonte]Un estudo publicado en 2008 no Diario Coreano de Microbioloxía e Biotecnoloxía revelou que o kimchi (prato tradicional coreano a base de verduras fermentadas) contén unha cepa dun tipo de bacteria "que mostra unha forte actividade antagonista contra a H. pylori." Demostrouse que a variedade illada da bacteria do kimchi, denominada Lactobacillus plantarum NO1, reduce a actividade da urease da H. pylori nun 40-60% e anula o desenvolvemento de células canceríxenas en máis dun 33%.[33]
As bacterias ácidas lácticas do iogur parece que son tamén beneficiosas nesta doenza segundo algún estudo.[34]
Un estudo de 2009 revela que o té verde pode previr a inflamación producida pola H. pylori.[35][36]
Vacinas
[editar | editar a fonte]O incremento da resistencia a antibióticos que presenta esta bacteria fai que sexa conveniente ensaiar outras estratexias terapéuticas como a vacinación. Non existe vacina para a H. pylori, pero si hai varias en fase de ensaio clínico.[37] Fixéronse amplos estudos en modelos de ratos con estas vacinas con resultados prometedores.[38] Os investigadores están estudando diferentes adxuvantes, antíxenos, e rutas de inmunización para comprobar cal é o sistema máis apropiado de protección inmune; pero só recentemente se pasou dos ensaios en animais aos ensaios en humanos.[39]
Estas vacinas poden ser vacinas profilácticas (para previr a infección) ou terapéuticas (para curala) que erradican ou reducen a densidade da bacteria na mucosa gástrica. Utilizáronse para elaborar as vacinas antíxenos de H. pylori como a urease, CagA, HP-NAP, HspA ou combinacións, e moitos adxuvantes e rutas de inmunización. Polo momento aínda non se obtivo unha vacina suficientemente efectiva e segura. As liñas de investigación máis recentes utilizan ADN, vectores vivos, microsferas etc.[40][41]
Resistencias
[editar | editar a fonte]O tratamento máis utilizado para combater esta infección é a tripla terapia. Isto, máis o mal uso que se lle deu durante moitos anos aos antibióticos en xeral fixo que se crearan numerosas resistencias. A claritromicina é un macrólido, cuxo mecanismo de acción consiste en evitar a traspeptidación, uníndose ao dominio V do RNA ribosomal 23S de H. pylori. Mutacións puntuais neste dominio xeran unha perda de afinidade á claritromicina, facendo que esta sexa ineficaz.
Outro exemplo de resistencia que presentan algunhas cepas de H. pylori é a conversión a unha forma cocoide que fan estas bacterias diante de condicións adversas. Cando adoptan esta forma, son insensibéis á presenza do antibiótico, e cando acaba a terapia voltan á forma normal. A resitencia a metronidazol é debida a mutacións no xene rdxA que codifica para a nitroreductasa NADPH insensible ao osíxeno, que se encargan de producir compostos que contenen ntróxeno e hridoxilamina, que danan o DNA.[42]
Tratamento
[editar | editar a fonte]Inicialmente utilizábase metronidazol, o cal, actualmente, presenta resistencia en máis do 80% dos casos. Posteriormente tratábase só cando se presentaba infección sintomática, utilizando claritromicina, amoxicilina e tetraciclina. Hoxe utilízanse antibióticos de amplo espectro como a azitromicina durante 5 días ou a levofloxacina durante 7 días, dependendo da gravidade do caso. Nalgúns casos utilízase tratamento intravenoso.
Unha vez que se detecta o H. pylori en pacientes cunha úlcera péptica, o procedemento normal é erradicala e permitir que sande a úlcera. A terapia tradicional de primeira liña é unha semana de terapia tripla consistente nos antibióticos amoxicilina e claritromicina e un inhibidor de bomba de protóns como o omeprazol.[43][44] O gastroenterólogo australiano Thomas Borody inventou a primeira terapia tripla en 1987.[45] Co paso dos anos desenvolvéronse variacións da terapia tripla, tales como o uso de diferentes inhibidores da bomba de protóns, como o pantoprazol ou o rabeprazol, ou o cambio da amoxicilina por metronidazol para as persoas que son alérxicas á penicilina.[46] Tales terapias revolucionaron o tratamento das úlceras pépticas e fixeron posible a curación da doenza.
Recentemente descubriuse que unha terapia concomitante que combinaba catro antibióticos: rabeprazol, amoxicilina, claritromicina e metronidazol obtiña a mellor taxa de erradicación de H. pylori, fronte a outras terapias. Porén isto só é aplicable na primeira liña de erradicación.[47]
Observouse que cada vez máis individuos infectados teñen bacterias resistentes aos antibióticos. Isto dá lugar ao fallo do tratamento inicial e require roldas adicionais de terapias con antibióticos ou estratexias alternativas tales como unha terapia cuádrupla. Os compostos de bismuto tamén son efectivos en combinación co tratamento tradicional.
Pensábase que, en ausencia de tratamento, unha vez que unha infección de H. pylori se estableceu no seu nicho gástrico, persistirá de por vida.[5] Porén, na xente anciá, é posible que a infección poida desaparecer conforme a mucosa estomacal se volve cada vez máis atrófica e inhóspita para a colonización. A proporción de infeccións agudas que persisten non se coñece, mais varios estudos que seguiron a historia natural en diversas poboacións informaron que se producía unha eliminación espontánea aparente.[19][48]

Científicos da Universidade de Kyoto, Xapón, concluíron que o aceite esencial de Cymbopogon citratus demostrou plenamente a súa efectividade contra a bacteria Helicobacter pylori, sen que dita bacteria presentase resistencia ao tratamento con este aceite esencial.[49]
Infección asintomática
[editar | editar a fonte]En pacientes que presentan unha infección asintomática, xeralmente non se recomenda o tratamento. Débense atender as manifestacións sintomáticas particulares de cada paciente.
Infección sintomática
[editar | editar a fonte]En pacientes con úlceras gástricas onde se detecta H. pylori, o procedemento habitual é erradicalo ata que a úlcera cure. O tratamento máis estendido é a terapia tripla inventada por Thomas Borody en 1987. Hoxe, a terapia tripla estándar xa explicada é o tratamento común, que con diferentes variantes permitiu a curación da doenza. Anteriormente só se controlaban os síntomas utilizando antiácidos, antagonistas dos receptores H2 ou inhibidores da bomba de protóns.[50][51]
Desafortunadamente, aumentou a proporción de infeccións individuais por cepas resistentes a este primeiro tratamento con antibióticos. Isto fixo que o tratamento inicial falle e se requiran aplicacións adicionais de terapia antibiótica. Utilízase entón unha cuádrupla terapia, incorporándose o bismuto, un metal que é tamén efectivo en combinación con outros fármacos.[52][53][54]
En casos de resistencia á claritromicina recoméndase o uso de levofloxacina como parte da terapia.[55][56]
Cancro e H. pylori
[editar | editar a fonte]O cancro gástrico e o linfoma de MALT (linfoma do tecido linfoide asociado á mucosa) relacionáronse con H. pylori, polo que esta bacteria foi clasificada dentro do grupo I de carcinóxenos pola Axencia Internacional de Investigación do Cancro. Aínda que a asociación destas enfermidades con H. pylori está apoiada por sospeitas razoables, non está totalmente claro que haxa unha relación causal.
Mecanismos de acción
[editar | editar a fonte]Investíganse dous mecanismos relacionados con esta suposta capacidade de H. pylori de producir cancro. O primeiro envolve a posibilidade de xerar radicais libres asociada a unha infección de H. pylori, o cal produciría un aumento na taxa de mutación da célula hóspede. O segundo mecanismo denominouse ruta perixenética[57] e implica a trasformación do fenotipo da célula hóspede por medio de alteracións en proteínas celulares tales como as proteínas de adhesión. Propúxose a posibilidade de que H. pylori induza inflamación e niveis localmente altos de TNF-alfa ou interleucina 6. De acordo co mecanismo perixenético proposto, as moléculas sinalizadoras de inflamación, tales como TNF-alfa, poderían alterar a capacidade de adhesión das células epiteliais do estómago e orixinar a dispersión e migración destas células epiteliais mutadas, sen necesidade de alteracións adicionais en xenes supresores de tumores (como, por exemplo, os xenes que codifican para proteínas de adhesión celular).
Refluxo ácido e cancro de esófago
[editar | editar a fonte]A taxa de infección por H. pylori foi decreciendo en países desenvolvidos, presuntamente debido ás melloras na hixiene e ao incremento do uso de antibióticos. Por exemplo, en EEUU a incidencia de cancro de estómago descendeu nun 80 % durante o período entre 1900 e 2000. Porén, viuse un drástico incremento nese mesmo período de certas enfermidades relacionadas co refluxo gastroesofáxico e o cancro de esófago.
Estudos xenómicos de diferentes cepas
[editar | editar a fonte]
Coñécense varias cepas de H. pylori, e o xenoma de tres delas foi secuenciado completamente.[58][59][60][61][62][63]
O xenoma da cepa "26695" consta de 1,7 millóns de pares de bases, cun total de aproximadamente 1.550 xenes. As dúas cepas secuenciadas mostran moitas diferenzas xenéticas, con máis dun 6 % de nucleótidos diferentes.
O estudo do xenoma de H. pylori céntrase en aspectos relacionados coa patoxenicidade, é dicir, coa capacidade deste organismo de causar enfermidades. Na base de datos do xenoma de H. pylori existen uns 62 xenes na categoría de patoxénese.
Illa Cag de patoxenicidade
[editar | editar a fonte]Ambas as cepas secuenciadas teñen unha illa de patoxenicidade (unha secuencia de xenes que se cre que participa na capacidade infecciosa da bacteria) chamada Cag: Mide 40 quilobases de tamaño e contén uns 40 xenes. Esta illa de patoxenicidade está xeralmente ausente en cepas de H. pylori illadas de humanos con infecciones asintomáticas.
O xene cagA codifica para unha das proteínas de virulencia maioritarias en H. pylori. As cepas bacterianas que teñen o xene cagA, están asociadas coa habilidade de causar úlceras severas. Este xene codifica para a síntese dunha proteína relativamente grande (1.186 aminoácidos). A proteína CagA entra nas células humanas, onde interrompe o normal funcionamento do citoesqueleto. A illa de patoxenicidade Cag ten uns 30 xenes que codifican para un complexo de transporte (sistema de secreción de tipo IV). Despois de fixarse ás células epiteliais do estómago, a proteína CagA inxéctase dentro da célula a través deste sistema de secreción. A proteína CagA é fosforilada nun residuo específico de tirosina por proteínas de membrana da célula hóspede. Viuse que as cepas patoxénicas de H. pylori activan o receptor do factor de crecemento epidérmico (EGFR, en inglés), unha proteína de membrana con actividade de tirosina quinase. A activación do EGFR por H. pylori está asociada con alteracións nos sinais de transdución e de expresión xénica nas células hóspedes, e este feito pode contribuír á súa patoxenicidade. Tamén se suxeriu que a rexión C-terminal da proteína CagA (aminoácidos 873-1002) podería regular a transcrición xenética da célula hóspede, independentemente da fosforilación. Pénsase que debido ao baixo contido GC do xene cagA en comparación co resto do xenoma, este xene foi adquirido por transferencia horizontal de xenes desde outra bacteria cagA+.[64][65][66][67]
Implicacións nas migracións humanas prehistóricas
[editar | editar a fonte]Cada poboación humana posúe unha distribución característica de cepas de H. pylori que tipicamente infectan a membros da súa poboación. Esta característica levou aos investigadores a usar H. pylori para estudar os padróns de migración en humanos. Así, as variedades atopadas estarían relacionadas coa orixe dos humanos modernos e as súas migracións prehistóricas.
A medida que os grupos humanos orixinados en África se estenderon polo planeta, disgregándose e diversificando gradualmente as súas características xenéticas, as poboacións de H. pylori que levaban con eles fixeron o mesmo. Así, a cepa que infecta os habitantes de Europa, por exemplo, é a hpEurope, mentres que as cepas hpAsia2 e hpEastasia están presentes na poboación asiática.[68] En Oceanía hai dous tipos principais: hpSahul que se originou hai entre 31.000 e 37.000 anos no chamado continente Sahul (Australia + Nova Guinea + Tasmania) e é típico de nativos australianos e papúas, e a cepa hspMaori relacionada coa cepa hpEastAsia e que ao parecer saíu de Taiwán hai uns 5.000 anos e se espallou cos pobos malaio-polinesios.[69]
Distribución filoxeográfica
[editar | editar a fonte]Como xa se mencionou, H. pylori está presente na metade da poboación mundial e foi posible relacionala coas migracións humanas e a súa distribución global, identificándose as seguintes cepas:[70]
- hpAfrica1
- hspSAfrica: Típico de África Austral
- hspWAfrica: Común en África e en afroamericanos. Típico de África Occidental.
- hpAfrica2: Común en África Austral.
- hpNEAfrica: Típico do Corno de África e de pobos nilosaharianos. Pouco en Europa e Asia.
- hpEurope: Típico de Eurasia Occidental, o que inclúe Europa, Próximo Oriente, Asia Central e parte do Norte de África. A colonización europea dispersouno por todo o mundo.
- hpEastAsia
- hspEAsia: Típico do Extremo Oriente.
- hspAmerind: Típico de pobos indíxenas americanos.
- hspMaori: Típico dos pobos malaio-polinesios.
- hpAsia2: No Subcontinente indio, parte do Sueste de Asia e outras zonas de Eurasia.
- hpSahul: En nativos australianos e papúas.
Presenza na América prehispánica
[editar | editar a fonte]Pode establecerse que as cepas de H. pylori en nativos amazónicos teñen a súa orixe no leste de Asia, máis que en Europa, o que suxire que estas poboacións chegaron a América polo menos hai 11.000 anos.
Un estudo realizado por expertos do Departamento de Microbioloxía e Parasitoloxía da Facultade de Medicina da UNAM (Universidade Nacional Autónoma de México) liderados por Gonzalo Castillo, e publicado en BMC Microbiology e impulsado polo INAH (Instituto Nacional de Antropoloxía e Historia de México), suxire a presenza de H. pylori nas sociedades prehispánicas. Durante a investigación usáronse mostras de tecido estomacal de 6 momias (5 procedentes da cova La Ventana en Chihuahua e outra de Durango, México) que datan de 1350.[71]
Notas
[editar | editar a fonte]- ↑ Blaser MJ (2006). "Who are we? Indigenous microbes and the ecology of human diseases" (PDF). EMBO Reports 7 (10): 956–60. PMC 1618379. PMID 17016449. doi:10.1038/sj.embor.7400812.
- ↑ Capítulo 23: "Campylobacter and Helicobacter". En Samuel Baron (editor): Medical Microbiology. Cuarta edición, 1996.
- ↑ Blaser, M. J. (2006). "Who are we? Indigenous microbes and the ecology of human diseases". EMBO Reports 7 (10): 956–60. doi:10.1038/sj.embor.7400812. PMC 1618379. PMID 17016449. [1]
- ↑ Yamaoka, Yoshio (2008). Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Pr. ISBN 1-904455-31-X.
- ↑ 5,0 5,1 Brown LM (2000). "Helicobacter pylori: epidemiology and routes of transmission" (PDF). Epidemiol Rev 22 (2): 283–97. PMID 11218379.
- ↑ Blaser MJ (2005). "An Endangered Species in the Stomach". Scientific American 292 (2): 38–45. PMID 15715390.
- ↑ Konturek JW (2003 Dec). "Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer". J Physiol Pharmacol. 54 Suppl 3: 23–41. PMID 15075463. Arquivado dende o orixinal o 28 de agosto de 2006. Consultado o 15 de xaneiro de 2013.
- ↑ Marshall BJ (1983). "Unidentified curved bacillus on gastric epithelium in active chronic gastritis". Lancet 1 (8336): 1273–1275. PMID 6134060.
- ↑ Marshall BJ, Warren JR (1984). "Unidentified curved bacilli in the stomach patients with gastritis and peptic ulceration". Lancet 1 (8390): 1311–1315. PMID 6145023.
- ↑ "Helicobacter pylori in peptic ulcer disease". NIH Consensus Statement Online Jan 7–9;12(1):1-23. Arquivado dende o orixinal o 19 de agosto de 2011. Consultado o 21 de dicembro de 2004.
- ↑ The Nobel Prize in Physiology or Medicine 2005 awarded to Barry J. Marshall and J. Robin Warren "for their discovery of the bacterium Helicobacter pylori and its role in gastritis and peptic ulcer disease".
- ↑ Hernández Tapias S. et al.. "Tratamiento de la úlcera péptica por Helicobacter pylori." Farm Hosp 1996;20(1):17-22. Dispoñible en liña (documento PDF)
- ↑ Olson JW, Maier RJ (2002). "Molecular hydrogen as an energy source for Helicobacter pylori". Science 298 (5599): 1788–90. PMID 12459589. doi:10.1126/science.1077123.
- ↑ Stark RM; Gerwig GJ; Pitman RS; et al. (1999). "Biofilm formation by Helicobacter pylori". Lett Appl Microbiol 28 (2): 121–6. PMID 10063642. doi:10.1046/j.1365-2672.1999.00481.x.
- ↑ Chan WY, Hui PK, Leung KM, Chow J, Kwok F, Ng CS (1994). "Coccoid forms of Helicobacter pylori in the human stomach". Am J Clin Pathol 102 (4): 503–7. PMID 7524304.
- ↑ 16,0 16,1 16,2 16,3 16,4 Kusters JG, van Vliet AH, Kuipers EJ (2006). "Pathogenesis of Helicobacter pylori Infection". Clin Microbiol Rev 19 (3): 449–90. PMC 1539101. PMID 16847081. doi:10.1128/CMR.00054-05.
- ↑ Josenhans C, Eaton KA, Thevenot T, Suerbaum S (2000). "Switching of Flagellar Motility in Helicobacter pylori by Reversible Length Variation of a Short Homopolymeric Sequence Repeat in fliP, a Gene Encoding a Basal Body Protein". Infect Immun 68 (8): 4598–603. PMC 98385. PMID 10899861. doi:10.1128/IAI.68.8.4598-4603.2000.
- ↑ Rust M, Schweinitzer T, Josenhans C (2008). "Helicobacter Flagella, Motility and Chemotaxis". En Yamaoka Y. Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press. ISBN 1-904455-31-X.
- ↑ 19,0 19,1 Goodman KJ, O'rourke K, Day RS; et al. (2005). "Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life". Int J Epidemiol 34 (6): 1348–55. PMID 16076858. doi:10.1093/ije/dyi152.
- ↑ Amieva MR, El-Omar EM (2008). "Host-bacterial interactions in Helicobacter pylori infection". Gastroenterology 134 (1): 306–23. PMID 18166359. doi:10.1053/j.gastro.2007.11.009.
- ↑ Schreiber S; Konradt M; Groll C; et al. (2004). "The spatial orientation of Helicobacter pylori in the gastric mucus". Proc. Natl. Acad. Sci. U.S.A. 101 (14): 5024–9. PMC 387367. PMID 15044704. doi:10.1073/pnas.0308386101.
- ↑ Petersen AM, Krogfelt KA (2003). "Helicobacter pylori: an invading microorganism? A review". FEMS Immunol. Med. Microbiol. 36 (3): 117–26. PMID 12738380. doi:10.1016/S0928-8244(03)00020-8.
- ↑ Ilver D; Arnqvist A; Ogren J; et al. (1998). "Helicobacter pylori adhesin binding fucosylated histo-blood group antigens revealed by retagging". Science 279 (5349): 373–7. PMID 9430586. doi:10.1126/science.279.5349.373.
- ↑ Smoot DT (1997). "How does Helicobacter pylori cause mucosal damage? Direct mechanisms". Gastroenterology 113 (6 Suppl): S31–4; discussion S50. PMID 9394757.
- ↑ Dumrese C; Slomianka L; Ziegler U; et al. (2009). "The secreted Helicobacter cysteine-rich protein A causes adherence of human monocytes and differentiation into a macrophage-like phenotype". FEBS Letters 583 (10): 1637–43. PMC 2764743. PMID 19393649. doi:10.1016/j.febslet.2009.04.027.
- ↑ Shiotani A, Graham DY (2002). "Pathogenesis and therapy of gastric and duodenal ulcer disease". Med. Clin. North Am. 86 (6): 1447–66, viii. PMID 12510460. doi:10.1016/S0025-7125(02)00083-4.
- ↑ Dixon MF (2000). "Patterns of inflammation linked to ulcer disease". Baillieres Best Pract Res Clin Gastroenterol 14 (1): 27–40. PMID 10749087. doi:10.1053/bega.1999.0057.
- ↑ Blaser MJ, Atherton JC (2004). "Helicobacter pylori persistence: biology and disease". J. Clin. Invest. 113 (3): 321–33. PMC 324548. PMID 14755326. doi:10.1172/JCI20925.
- ↑ 29,0 29,1 Schubert ML, Peura DA (2008). "Control of gastric acid secretion in health and disease". Gastroenterology 134 (7): 1842–60. PMID 18474247. doi:10.1053/j.gastro.2008.05.021.
- ↑ Suerbaum S, Michetti P (2002). "Helicobacter pylori infection". N. Engl. J. Med. 347 (15): 1175–86. PMID 12374879. doi:10.1056/NEJMra020542.
- ↑ Peek RM, Crabtree JE (2006). "Helicobacter infection and gastric neoplasia". J. Pathol. 208 (2): 233–48. PMID 16362989. doi:10.1002/path.1868.
- ↑ Viala J. "Nod1 responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island". Nat. Immunol. 5 (11): 1166–74wo.
- ↑ Youl Lee and Hae Choon Chang (2008). "Isolation and Characterization of Kimchi Lactic Acid Bacteria Showing Anti-Helicobacter pylori Activity". Diario Coreano de Microbiología y Biotecnología 2: 106–114.
- ↑ Wang KY; Li SN; Liu CS; et al. (2004). "Effects of ingesting Lactobacillus- and Bifidobacterium-containing yogurt in subjects with colonized Helicobacter pylori" (PDF). The American Journal of Clinical Nutrition 80 (3): 737–41. PMID 15321816.
- ↑ Stoicov, C.; Saffari, R.; Houghton, J. (2009). "Green tea inhibits Helicobacter growth in vivo and in vitro". International journal of antimicrobial agents 33 (5): 473–478. PMC 2694061. PMID 19157800. doi:10.1016/j.ijantimicag.2008.10.032.
- ↑ Lee, S. .; Shin, Y. .; Hahm, K. . (2008). "Phytoceuticals: mighty but ignored weapons against Helicobacter pylori infection". Journal of digestive diseases 9 (3): 129–139. PMID 18956590. doi:10.1111/j.1751-2980.2008.00334.x.
- ↑ Selgrad M, Malfertheiner P (2008). "New strategies for Helicobacter pylori eradication". Curr Opin Pharmacol 8 (5): 593–7. PMID 18555746. doi:10.1016/j.coph.2008.04.010.
- ↑ Hoffelner H, Rieder G, Haas R (2008). "Helicobacter pylori vaccine development: optimisation of strategies and importance of challenging strain and animal model". Int. J. Med. Microbiol. 298 (1–2): 151–9. PMID 17714988. doi:10.1016/j.ijmm.2007.07.006.
- ↑ Kabir S (2007). "The current status of Helicobacter pylori vaccines: a review". Helicobacter 12 (2): 89–102. PMID 17309745. doi:10.1111/j.1523-5378.2007.00478.x.
- ↑ Boyanova, L (editor) (2011). Helicobacter pylori. Caister Academic Press. ISBN 978-1-904455-84-4.
- ↑ Malfertheiner P; Schultze V; Rosenkranz B; et al. (2008). "Safety and Immunogenicity of an Intramuscular Helicobacter pylori Vaccine in Noninfected Volunteers: A Phase I Study". Gastroenterology 135 (3): 787–95. PMID 18619971. doi:10.1053/j.gastro.2008.05.054.
- ↑ Nishizawa, Toshihiro; Suzuki, Hidekazu (2014-10-24). "Mechanisms of Helicobacter pylori antibiotic resistance and molecular testing". Frontiers in Molecular Biosciences 1. ISSN 2296-889X. PMC 4428472. PMID 25988160. doi:10.3389/fmolb.2014.00019.
- ↑ Malfertheiner, P; Megraud, F; O'Morain, CA; Atherton, J; Axon, AT; Bazzoli, F; Gensini, GF; Gisbert, JP; Graham, DY; Rokkas, T; El-Omar, EM; Kuipers, EJ; European Helicobacter Study, Group (2012 May). "Management of Helicobacter pylori infection—the Maastricht IV/ Florence Consensus Report.". Gut 61 (5): 646–64. PMID 22491499.
- ↑ Mirbagheri, Seyed Amir; Mehrdad Hasibi, Mehdi Abouzari, and Armin Rashidi (14 de agosto de 2006). "Triple, standard quadruple and ampicillin-sulbactam-based quadruple therapies for H. pylori eradication: A comparative three-armed randomized clinical trial". World Journal of Gastroenterology 12 (30): 4888–4891. PMID 16937475. Arquivado dende o orixinal o 27/09/2007. Consultado o 15/01/2013.
- ↑ Borody, Thomas J.; P. Cole, S. Noonan, A. Morgan, J. Lenne, L. Hyland, S. Brandl, E. G. Borody, and L. L. George (16 de outubro de 1989). "Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication". Medical Journal of Australia 151 (8): 431–435. PMID 2687668.
- ↑ European Helicobacter pylori Study Group. "Current Concepts in the Management of Helicobacter pylori Infection". The Maastricht 2-2000 Consensus Report. Arquivado dende o orixinal o 26 de agosto de 2011. Consultado o 30 de setembro de 2006.
- ↑ Lee, Hyun Jeong (2015). "Concomitant therapy achieved the best eradication rate for Helicobacter pylori among various treatment strategies". World Journal of Gastroenterology (en inglés) 21 (1): 351. ISSN 1007-9327. PMC 4284355. PMID 25574111. doi:10.3748/wjg.v21.i1.351.
- ↑ Goodman K, Cockburn M (2001). "The role of epidemiology in understanding the health effects of Helicobacter pylori.". Epidemiology 12 (2): 266–71. PMID 11246592. doi:10.1097/00001648-200103000-00023.
- ↑ Ohno, Tomoyuki; Kita, Masakazu; Yamaoka, Yoshio; Imamura, Shigeyoshi; Yamamoto, Toshiro; Mitsufuji, Shoji; Kodama, Tadashi; Kashima, Kei; Imanishi, JirO (2003-6). "Antimicrobial Activity of Essential Oils against Helicobacter pylori". Helicobacter (en inglés) 8 (3): 207–215. ISSN 1083-4389. doi:10.1046/j.1523-5378.2003.00146.x.
- ↑ Rauws EA, Tytgat GN (1990). "Cure of duodenal ulcer associated with eradication of Helicobacter pylori". Lancet 335 (8700): 1233–5. PMID 1971318. doi:10.1016/0140-6736(90)91301-P.
- ↑ Graham DY, Lew GM, Evans DG, Evans DJ, Klein PD (1991). "Effect of triple therapy (antibiotics plus bismuth) on duodenal ulcer healing. A randomized controlled trial". Ann. Intern. Med. 115 (4): 266–9. PMID 1854110.
- ↑ Stenström B, Mendis A, Marshall B (August 2008). "Helicobacter pylori—The latest in diagnosis and treatment". Aust Fam Physician 37 (8): 608–12. PMID 18704207.
- ↑ Fischbach L, Evans EL (2007). "Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori". Aliment. Pharmacol. Ther. 26 (3): 343–57. PMID 17635369. doi:10.1111/j.1365-2036.2007.03386.x.
- ↑ Graham DY, Shiotani A (2008). "Newer concepts regarding resistance in the treatment Helicobacter pylori infections". Nat Clin Pract Gastroenterol Hepatol 5 (6): 321–31. PMC 2841357. PMID 18446147. doi:10.1038/ncpgasthep1138.
- ↑ Perna F, Zullo A, Ricci C, Hassan C, Morini S, Vaira D (2007). "Levofloxacin-based triple therapy for Helicobacter pylori re-treatment: role of bacterial resistance". Dig Liver Dis 39 (11): 1001–5. PMID 17889627. doi:10.1016/j.dld.2007.06.016.
- ↑ Hsu PI; Wu DC; Chen A; et al. (2008). "Quadruple rescue therapy for Helicobacter pylori infection after two treatment failures". Eur. J. Clin. Invest. 38 (6): 404–9. PMID 18435764. doi:10.1111/j.1365-2362.2008.01951.x.
- ↑ Tsuji S, Kawai N, Tsujii M, Kawano S, Hori M (2003). "Review article: inflammation-related promotion of gastrointestinal carcinogenesis - a perigenetic pathway". Aliment Pharmacol Ther 18 (Suppl 1): 82–9. PMID 12925144.
- ↑ Tomb JF; White O; Kerlavage AR; et al. (1997). "The complete genome sequence of the gastric pathogen Helicobacter pylori". Nature 388 (6642): 539–47. PMID 9252185. doi:10.1038/41483.
- ↑ "Genome information for the H. pylori 26695 and J99 strains". Institut Pasteur. 2002. Consultado o 2008-09-01.
- ↑ "Helicobacter pylori 26695, complete genome". National Center for Biotechnology Information. Consultado o 2008-09-01.
- ↑ "Helicobacter pylori J99, complete genome". National Center for Biotechnology Information. Consultado o 2008-09-01.
- ↑ Oh JD, LA; Kling-Bäckhed H; Giannakis M; et al. (2006). "The complete genome sequence of a chronic atrophic gastritis Helicobacter pylori strain: Evolution during disease progression". Proc Natl Acad Sci U.S.A. 103 (26): 9999–10004. PMC 1480403. PMID 16788065. doi:10.1073/pnas.0603784103.
- ↑ O sitio Pylori Gene dá acceso á información xenómica das cepas 26695 e J99 de H. pylori. Outra base de datos xenómica é a que ofrece o Centro Nacional de Información Biotecnolóxica (National Center for Biotechnology Information; 26695, J99). Son páxinas en inglés.
- ↑ Backert S, Selbach M (2008). "Role of type IV secretion in Helicobacter pylori pathogenesis". Cell. Microbiol. 10 (8): 1573–81. PMID 18410539. doi:10.1111/j.1462-5822.2008.01156.x.
- ↑ Hatakeyama, M (2004). "Oncogenic mechanisms of the Helicobacter pylori CagA protein". Nat Rev Cancer (United States) 4 (9): 688–94. PMID 15343275. doi:10.1038/nrc1433.
- ↑ Baldwin DN, Shepherd B, Kraemer P et al. (February 2007). "Identification of Helicobacter pylori Genes That Contribute to Stomach Colonization". Infect Immun 75 (2): 1005–16. doi:10.1128/IAI.01176-06. PMC 1828534. PMID 17101654. //www.ncbi.nlm.nih.gov/pmc/articles/PMC1828534/.
- ↑ Broutet N, Marais A, Lamouliatte H et al. (April 2001). "cagA Status and Eradication Treatment Outcome of Anti-Helicobacter pylori Triple Therapies in Patients with Nonulcer Dyspepsia". J Clin Microbiol 39 (4): 1319–22. doi:10.1128/JCM.39.4.1319-1322.2001. PMC 87932. PMID 11283049. http://jcm.asm.org/content/39/4/1319.full.pdf Arquivado 23 de xullo de 2018 en Wayback Machine..
- ↑ Blog Homo sapiens Una bacteria del estómago da luz sobre migraciones humanas.
- ↑ Yoshan Moodley et al 2009, The Peopling of the Pacific from a Bacterial Perspective
- ↑ Bodo Linz et al 2007, An African origin for the intimate association between humans and Helicobacter pylori
- ↑ "Tienen momias tarahumaras añeja bacteria". Arquivado dende o orixinal o 20 de febreiro de 2014. Consultado o 15 de xaneiro de 2013.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Helicobacter pylori |
Outros artigos
[editar | editar a fonte]| Wikispecies posúe unha páxina sobre: Helicobacter pylori |
Bibliografía
[editar | editar a fonte]- Varis K., Samloff I.M., Ihamäki T., Siurala M. An appraisal of tests for severe atrophic gastritis in relatives of patients with pernicious anaemia. Dig Dis Sci, 1979; 24:187-191.
- Sipponen P., Kekki M., Haapakoski J., Ihamäki T., Siurala M. Gastric cancer risk in chronic atrophic gastritis: Statistical calculations of cross-sectional data. Int J Cancer 1985; 35:173-177.
- Wadstrom T. (1995). An update on Helicobacter pylori. Current Opinion in Gastroenterology, 11:69-75.
- Northfield T.C., Mendall M., Goggin P.C. (1994). H. pylori Infection Pathophysiology, Epidemiology and Management. Kluwer Academic Press Dortrecth.
- Logan, Robert P H; Walker, Marjorie M (20 de outubro de 2001). "Clinical review: ABC of the upper gastrointestinal tract. Epidemiology and diagnosis of Helicobacter pylori infection". BMJ 323: 920–922. PMID 11668141.
Ligazóns externas
[editar | editar a fonte]- Helicobacter Pylori and other Gastric Helicobacter-Like Organisms enlace directo á sección específica. (NB: enlace a texto incompleto agás subscrición).
- "Helicobacter pylori and peptic ulcer". Centers for Disease Control and Prevention. Arquivado dende o orixinal o 21 de xuño de 2013. Consultado o 21 de decembro de 2004.
- The Helicobacter Foundation ofrece información sobre Helicobacter pylori e os seus efectos - fundada por Dr. Barry J. Marshall, un dos descubridores de H. pylori.
- Helicobacter pylori persistence: biology and disease por Martin J. Blaser e John C. Atherton en Journal of Clinical Investigations (2004), 113:321–333.
- Helicobacter pylori: Physiology and Genetics Texto en liña do libro de Mobley et al. (vía NCBI).
- European Helicobacter Study Group patrocina obradoiros, anuarios e protocolos clínicos a nivel internacional.
- The Year in Helicobacter pylori 2005 Helicobacter journal set 2005
- The Year in Helicobacter pylori 2004 Helicobacter journal agosto de 2004
- Atwood KC. Bacteria, Ulcers, and Ostracism?: H. pylori and the Making of a Myth. Skeptical Inquirer, novembro de 2004. Texto completo
- Imaxe microscópica de H. pylori
- National Digestive Diseases Information Clearinghouse (NDDIC) Publicado baixo dominio público.
- H. pylori - Interaccións hóspede patóxeno
