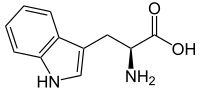
Triptófano
| L-Triptófano | |
|---|---|
 | |
 | |
Tryptophan ou ácido (2S)-2-amino-3-(1H-indol-3-il)propanoico | |
Outros nomes Ácido 2-amino-3-(1H-indol-3-il)propanoico | |
| Identificadores | |
| Número CAS | 73-22-3 |
| PubChem | 6305 |
| ChemSpider | 6066 |
| UNII | 8DUH1N11BX |
| DrugBank | DB00150 |
| KEGG | D00020 |
| ChEBI | CHEBI:27897 |
| ChEMBL | CHEMBL54976 |
| Ligando IUPHAR | 717 |
| Código ATC | N06 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C11H12N2O2 |
| Masa molar | 204,23 g mol−1 |
| Solubilidade en auga | Soluble: 0,23 g/L a 0 °C, 11,4 g/L a 25 °C, |
| Solubilidade | Soluble en alcohol quente, hidróxidos alcalis; insoluble en cloroformo. |
| Acidez (pKa) | 2,38 (carboxilo), 9,39 (amino)[1] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

O triptófano[2] (abreviadamente Trp ou W)[3] é un dos 20 α-aminoácidos que forma parte das proteínas. A cadea lateral do triptófano contén un grupo funcional cíclico indol, polo que é aromático e hidrófobo.
É un aminoácido esencial, é dicir, o noso metabolismo non o pode sintetizar e debemos tomalo na dieta. Está codificado por un só codón do código xenético, o UGG (só hai outro aminoácido, a metionina, codificado por un só codón).[4] O estereoisómero do triptófano que aparece en practicamente todas as proteínas é o L-triptófano, pero o D-triptófano pódese atopar en certos péptidos naturais, como os do veleno contryphan do gasterópodo mariño Conus.[5]
Foi illado por primeira vez por Frederick Hopkins en 1901[6] por hidrólise da caseína. De 600 g de caseína crúa poden obterse 4-8 g de triptófano [7].
Biosíntese e síntese industrial[editar | editar a fonte]
O home non o pode biosintetizar, pero as plantas e os microorganismos normalmente poden sintetizar triptófano a partir de ácido siquímico ou ácido antranílico.[8] Este último condénsase con fosforribosil pirofosfato (PRPP), liberando pirofosfato. Despois de abrir o anel de ribosa e sufrir unha descarboxilación redutiva (véxase a figura), prodúcese indol-3-glicerinofosfato, que á súa vez se transforma en indol. No último paso da síntese, a triptófano sintase cataliza a formación do triptófano a partir de indol e o aminoácido serina.
A produción industrial de triptófano é tamén biosintética porque está baseada na fermentación de serina e indol usando unha bacteria salvaxe ou xeneticamente modificada das especies Bacillus amyloliquefaciens, Bacillus subtilis, Corynebacterium glutamicum ou Escherichia coli. Estas estirpes bacterianas teñen mutacións que impiden a recaptación de aminoácidos aromáticos ou operóns trp múltiples ou sobreexpresados. A conversión está catalizada polo encima triptófano sintase.[9]
Degradación[editar | editar a fonte]
Na degradación oxidativa do triptófano orixínase acetoacetil-CoA e alanina, a cal pode orixinar piruvato, polo que é un aminoácido que é tanto cetoxénico coma glicoxénico.
Funcións[editar | editar a fonte]

Para moitos organismos, incluídos os humanos o triptófano é un aminoácido esencial. Necesítase como constituínte das proteínas. Ademais, o triptófano funciona como un precursor para a síntese dos seguintes compostos:
- Serotonina (un neurotransmisor), sintetizado pola triptófano hidroxilase.[10][11] A serotonina á súa vez pode converterse en melatonina (unha hormona) coa intervención da N-acetiltransferase e a 5-hidroxiindol-O-metiltransferase.[12]
- Niacina, sintetizada a partir de triptófano vía os intermediatos principais kynurenina e ácidos quinolínicos.[13]
- Auxina (unha hormona vexetal). Cando os elementos dos tubos cribosos (células do floema) sofren apoptose o triptófano convértese en auxinas.[14]
Os trastornos denominados mala absorción de frutosa e intolerancia á lactosa causan unha absorción deficiente de triptófano no intestino, orixinan niveis de triptófano reducidos no sangue [15] e depresión.[16]
Nas bacterias que sintetizan triptófano, os niveis celulares altos deste aminoácido activan unha proteína represora, que se une ao operón trp.[17] A unión deste represor ao operón do triptófano impide a transcrición do ADN situado máis adiante, que codifica os encimas implicados na biosíntese de triptófano. Deste modo, niveis altos de triptófano impiden a síntese de triptófano por medio dun bucle de retroalimentación negativa e, cando os niveis de triptófano celulares se reducen, a transcrición no operón trp comeza de novo.
Fontes alimentarias[editar | editar a fonte]
O triptófano é un compoñente abundante en moitos alimentos ricos en proteínas. É especialmente abondoso no chocolate, avea, dátiles secos, leite, iogur, queixo fresco, carne vermella, ovos, peixe, aves, sésamo, garavanzos, pipas de xirasol, e de cabaza, e cacahuetes.[18]
Uso como suplemento alimentario[editar | editar a fonte]
Hai probas de que é improbable que se alteren os niveis sanguíneos de triptófano por un cambio de dieta,[19] pero por algún tempo estivo vendéndose triptófano como suplemento alimentario nas tendas dietéticas. Moita xente atopaba que o triptófano axudaba a durmir, quizais porque aumentaba os niveis de serotonina (un neurotransmisor que a niveis moderados funciona como calmante)[20] e melatonina (hormona que induce o sono).[21][22]
Os resultados das probas clínicas realizadas obtiveron resultados contraditorios en canto á efectividade do triptófano como sedativo, especialmente en individuos normais.[23][24][25] Ademais, o triptófano mostrou certa efectividade no tratamento doutras condicións tipicamente asociadas con niveis cerebrais de serotonina baixos[26] como desordes premenstruais[27] e depresións estacionais.[28][29] En particular, o triptófano mostrou ser moi prometedor como antidepresivo administrado só[30] ou xunto con fármacos antidepresivos.[30][31] Porén, a fiabilidade destas probas clínicas foi cuestionada.[32][33]
Fármacos derivados do triptófano[editar | editar a fonte]
Un derivado do triptófano, o 5-Hidroxitriptófano (5-HTP) propúxose como tratamento da epilepsia[34] e da depresión, aínda que as probas clínicas realizadas non foron concuíntes nin completas.[35]
Envellecemento[editar | editar a fonte]
Ratas alimentadas con pouco triptófano mostraron niveis sanguíneos reducidos de triiodotironina, o que se suxeriu retarda o proceso de envellecemento.[36] As ratas con dietas con triptófano reducido mostraron un incremento da súa esperanza de vida e melloraron algúns biomarcadores do envellecemento.[37] Os resultados foron atribuídos aos efectos nocivos do incremento de serotonina cerebral relacionado coa idade, que a dieta baixa en triptófano evitaba.
Notas[editar | editar a fonte]
- ↑ Dawson RMC; et al. (1969). Data for Biochemical Research. Oxford: Clarendon Press. ISBN 0-19-855338-2.
- ↑ Definición de triptófano no Dicionario de Galego de Ir Indo e a Xunta de Galicia.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. "Nomenclature and Symbolism for Amino Acids and Peptides". Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado o 2007-05-17.
- ↑ "Dr. Margaret Oakley Dayhoff". The Chemistry of Amino Acids. University of Arizona. Consultado o 7 September 2010.
- ↑ Pallaghy PK, Melnikova AP, Jimenez EC, Olivera BM, Norton RS (1999). "Solution structure of contryphan-R, a naturally-occurring disulfide-bridged octapeptide containing D-tryptophan: comparison with protein loops". Biochemistry 38 (35): 11553–9. PMID 10471307. doi:10.1021/bi990685j.
- ↑ Hopkienns FG, Cole SW (1901). "A contribution to the chemistry of proteids: Part I. A preliminary study of a hitherto undescribed product of tryptic digestion". J. Physiol. (Lond.) 27 (4-5): 418–28. PMC 1540554. PMID 16992614.
- ↑ Cox GJ, King H (1943). "L-Tryptophane". OrgSyn 2: 612–616. CV2P0612.
- ↑ Radwanski ER, Last RL (1995). "Tryptophan biosynthesis and metabolism: biochemical and molecular genetics". Plant Cell 7 (7): 921–34. PMC 160888. PMID 7640526. doi:10.1105/tpc.7.7.921.
- ↑ Ikeda M (2002). "Amino acid production processes". Adv. Biochem. Eng. Biotechnol. 79: 1–35. PMID 12523387. doi:10.1007/3-540-45989-8_1.
- ↑ Fernstrom JD (1983). "Role of precursor availability in control of monoamine biosynthesis in brain". Physiol. Rev. 63 (2): 484–546. PMID 6132421.
- ↑ Schaechter JD, Wurtman RJ (1990). "Serotonin release varies with brain tryptophan levels" (PDF). Brain Res. 532 (1-2): 203–10. PMID 1704290. doi:10.1016/0006-8993(90)91761-5. Arquivado dende o orixinal (PDF) o 14 de xullo de 2010. Consultado o 21 de xullo de 2011.
- ↑ Wurtman RJ, Anton-Tay F (1969). "The mammalian pineal as a neuroendocrine transducer" (PDF). Recent Prog. Horm. Res. 25: 493–522. PMID 4391290. Arquivado dende o orixinal (PDF) o 02 de xuño de 2010. Consultado o 21 de xullo de 2011.
- ↑ Ikeda M, Tsuji H, Nakamura S, Ichiyama A, Nishizuka Y, Hayaishi O (1965). "Studies on the biosynthesis of nicotinamide adenine dinucleotide. II. A role of picolinic carboxylase in the biosynthesis of nicotinamide adenine dinucleotide from tryptophan in mammals". J. Biol. Chem. 240: 1395–401. PMID 14284754. Arquivado dende o orixinal o 13 de outubro de 2008. Consultado o 21 de xullo de 2011.
- ↑ Palme K, Nagy F (2008). "A new gene for auxin synthesis". Cell 133 (1): 31–2. PMID 18394986. doi:10.1016/j.cell.2008.03.014.
- ↑ Ledochowski M, Widner B, Murr C, Sperner-Unterweger B, Fuchs D (2001). "Fructose malabsorption is associated with decreased plasma tryptophan". Scand. J. Gastroenterol. 36 (4): 367–71. PMID 11336160. doi:10.1080/003655201300051135.
- ↑ Ledochowski M, Sperner-Unterweger B, Widner B, Fuchs D (1998). "Fructose malabsorption is associated with early signs of mental depression". Eur. J. Med. Res. 3 (6): 295–8. PMID 9620891.
- ↑ Gollnick P, Babitzke P, Antson A, Yanofsky C (2005). "Complexity in regulation of tryptophan biosynthesis in Bacillus subtilis". Annu. Rev. Genet. 39: 47–68. PMID 16285852. doi:10.1146/annurev.genet.39.073003.093745.
- ↑ "Tryptophan background". Arquivado dende o orixinal o 21 de xuño de 2011. Consultado o 21 de xullo de 2011.
- ↑ Soh, Nerissa L. AU - Walter, Garry TI (2011). "Tryptophan and depression: can diet alone be the answer?". Acta Neuropsychiatrica VL 23 (1): 1601–5215;. doi:10.1111/j.1601-5215.2010.00508.x.
- ↑ Wurtman RJ, Hefti F, Melamed E (1980). "Precursor control of neurotransmitter synthesis" (PDF). Pharmacol. Rev. 32 (4): 315–35. PMID 6115400. Arquivado dende o orixinal (PDF) o 27 de setembro de 2007. Consultado o 21 de xullo de 2011.
- ↑ Wurtman RJ, Larin F, Axelrod J, Shein HM, Rosasco K (1968). "Formation of melatonin and 5-hydroxyindole acetic acid from 14C-tryptophan by rat pineal glands in organ culture". Nature 217 (5132): 953–4. PMID 5300432. doi:10.1038/217953a0.
- ↑ Ruddick JP, Evans AK, Nutt DJ, Lightman SL, Rook GA, Lowry CA (2006). "Tryptophan metabolism in the central nervous system: medical implications". Expert reviews in molecular medicine 8 (20): 1–27. PMID 16942634. doi:10.1017/S1462399406000068.
- ↑ Hartmann E (1982). "Effects of L-tryptophan on sleepiness and on sleep". Journal of psychiatric research 17 (2): 107–13. PMID 6764927. doi:10.1016/0022-3956(82)90012-7.
- ↑ Schneider-Helmert D, Spinweber CL (1986). "Evaluation of L-tryptophan for treatment of insomnia: a review". Psychopharmacology (Berl.) 89 (1): 1–7. PMID 3090582. doi:10.1007/BF00175180.
- ↑ Wyatt RJ, Engelman K, Kupfer DJ, Fram DH, Sjoerdsma A, Snyder F. (1970 Oct 24). "Effects of L-tryptophan (a natural sedative) on human sleep". Lancet. 1970 Oct 24,2 (7678): 842–6. ISSN 0140-6736. PMID 4097755.
- ↑ "research summary of Dr. Richard Wurtman, MIT". Arquivado dende o orixinal o 25 de maio de 2009. Consultado o 2007-08-12.
- ↑ Steinberg S, Annable L, Young SN, Liyanage N (1999). "A placebo-controlled clinical trial of L-tryptophan in premenstrual dysphoria". Biol. Psychiatry 45 (3): 313–20. PMID 10023508. doi:10.1016/S0006-3223(98)00005-5.
- ↑ Lam RW, Levitan RD, Tam EM, Yatham LN, Lamoureux S, Zis AP (1997). "L-tryptophan augmentation of light therapy in patients with seasonal affective disorder". Canadian Journal of Psychiatry 42 (3): 303–6. PMID 9114947.
- ↑ Jepson TL, Ernst ME, Kelly MW (1999). "Current perspectives on the management of seasonal affective disorder". J Am Pharm Assoc (Wash) 39 (6): 822–9. PMID 10609448.
- ↑ 30,0 30,1 Thomson J, Rankin H, Ashcroft GW, Yates CM, McQueen JK, Cummings SW (1982). "The treatment of depression in general practice: a comparison of L-tryptophan, amitriptyline, and a combination of L-tryptophan and amitriptyline with placebo". Psychological medicine 12 (4): 741–51. PMID 7156248. doi:10.1017/S0033291700049047.
- ↑ Levitan RD, Shen JH, Jindal R, Driver HS, Kennedy SH, Shapiro CM (2000). "Preliminary randomized double-blind placebo-controlled trial of tryptophan combined with fluoxetine to treat major depressive disorder: antidepressant and hypnotic effects". Journal of psychiatry & neuroscience : JPN 25 (4): 337–46. PMC 1407729. PMID 11022398. Arquivado dende o orixinal o 06 de marzo de 2016. Consultado o 21 de xullo de 2011.
- ↑ Meyers S (2000). "Use of neurotransmitter precursors for treatment of depression" (PDF). Alternative medicine review : a journal of clinical therapeutic 5 (1): 64–71. PMID 10696120. Arquivado dende o orixinal (PDF) o 05 de agosto de 2004. Consultado o 21 de xullo de 2011.
- ↑ Shaw K, Turner J, Del Mar C (2002). Shaw, Kelly A, ed. "Tryptophan and 5-hydroxytryptophan for depression". Cochrane database of systematic reviews (Online) (1): CD003198. PMID 11869656. doi:10.1002/14651858.CD003198.
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). "Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study". Pol J Pharmacol Pharm 30 (1): 41–7. PMID 148040.
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). "Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan". Pharmacol Ther 109 (3): 325–38. PMID 16023217. doi:10.1016/j.pharmthera.2005.06.004.
- ↑ Ooka H, Segall PE, Timiras PS (1978). "Neural and endocrine development after chronic tryptophan deficiency in rats: II. Pituitary-thyroid axis". Mech. Ageing Dev. 7 (1): 19–24. PMID 625148. doi:10.1016/0047-6374(78)90049-0.
- ↑ Ooka H, Segall PE, Timiras PS (1988). "Histology and survival in age-delayed low-tryptophan-fed rats". Mech. Ageing Dev. 43 (1): 79–98. PMID 3374178. doi:10.1016/0047-6374(88)90099-1.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- "KEGG PATHWAY: Tryptophan metabolism - Homo sapiens". KEGG: Kyoto Encyclopedia of Genes and Genomes. 2006-08-23. Consultado o 2008-04-20.
- G.P. Moss. "Tryptophan Catabolism (early stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Arquivado dende o orixinal o 13 de setembro de 2003. Consultado o 2008-04-20.
- G.P. Moss. "Tryptophan Catabolism (later stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Arquivado dende o orixinal o 13 de setembro de 2003. Consultado o 2008-04-20.
- B Mikkelson, DP Mikkelson (2007-11-22). "Turkey Causes Sleepiness". Urban Legends Reference Pages. Snopes.com. Consultado o 2008-04-20.
- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (2006). "Effects of tryptophan depletion on the performance of an iterated Prisoner's Dilemma game in healthy adults". Neuropsychopharmacology 31 (5): 1075–84. PMID 16407905. doi:10.1038/sj.npp.1300932.

