Fenilalanina
| Fenilalanina | |
|---|---|
 | |
 | |
Fenilalanina | |
Outros nomes Ácido 2-amino-3-fenilpropanoico | |
| Identificadores | |
| Número CAS | 150-30-1 (DL), 63-91-2 (L) |
| PubChem | 994 |
| ChemSpider | 5910 |
| UNII | 8P946UF12S |
| DrugBank | DB00120 |
| KEGG | D00021 |
| ChEBI | CHEBI:58095 |
| ChEMBL | CHEMBL301523 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C9H11NO2 |
| Masa molar | 165,19 g mol−1 |
| Acidez (pKa) | 1,83 (carboxilo), 9,13 (amino)[1] |
| Perigosidade | |
| NFPA 704 | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

A fenilalanina (abreviadamente Phe ou F)[2] é un α-aminoácido coa fórmula C6H5CH2CH(NH2)COOH, que é un constituínte das proteínas. A súa cadea lateral está formada por un CH2 unido a un grupo bencénico cíclico, aromático, hidrófobo e neutro, polo que se clasifica como aminoácido hidrófobo non polar. É moi similar á tirosina, pero sen o grupo -OH que ten esta. Nas proteínas aparece o isómero L-fenilalanina.
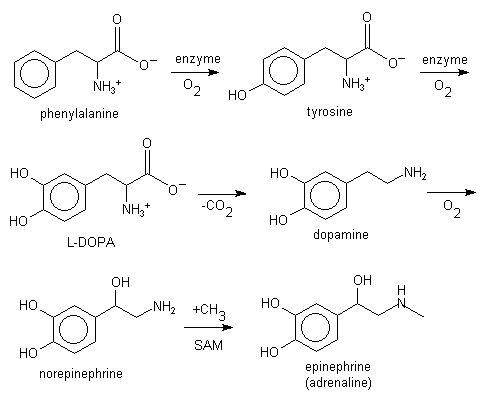
É un aminoácido esencial, xa que non se pode sintetizar no noso metabolismo e debemos tomalo na dieta. Os codóns que o codifican no código xenético son UUU e UUC. A fenilalanina é un precursor da tirosina, dopamina, norepinefrina (noradrenalina), e epinefrina (adrenalina), e do pigmento cutáneo melanina.
A fenilalanina atópase de forma natural no leite dos mamíferos. Úsase elaboración de alimentos e bebidas e véndese como complemento nutricional polas propiedades analxésicas e antidepresivas que se lle atribúen. É un precursor directo do neuromodulador feniletilamina, un suplemento dietario común.
Outras funcións biolóxicas[editar | editar a fonte]
A L-fenilalanina convértese no organismo no aminoácido L-tirosina. A L-tirosina despois pode converterse en L-DOPA, que finalmente orixina as catecolaminas dopamina, norepinefrina (noradrenalina), e epinefrina (adrenalina).
A fenilalanina usa as mesmas canles de transporte activo ca o triptófano para atravesar a barreira hemato-encefálica, e, en grandes cantidades, interfire coa produción de serotonina.
Nas plantas[editar | editar a fonte]
A fenilalanina é o composto inicial usado polas plantas na síntese de flavonoides. O lignano deriva da fenilalanina a partir da tirosina. A fenilalanina convértese en ácido cinámico (presente na canela) pola acción do encima fenilalanina amoníaco-liase.[3]
Fenilcetonuria[editar | editar a fonte]
O trastorno xenético fenilcetonuria consiste na incapacidade de metabolizar fenilalanina. Os individuos que padecen este trastorno deben regular a súa inxesta de fenilalanina. Unha (rara) "forma variante" da fenilcetonuria chamada hiperfenilalaninemia está causada pola incapacidade de sintetizar o coencima biopterina. As mulleres preñadas que padecen hiperfenilalaninemia poden presentar síntomas moi parecidos aos da fenilcetonuria (altos niveis de fenilalanina en sangue) pero estes síntomas xeralmente desaparecen ao final da xestación. Os individuos que non poden metabolizar fenilalanina deben controlar a súa inxesta de proteínas para controlar a acumulación de fenilalanina cando os seus corpos converten as proteínas en aminoácidos.
Outra fonte de fenilalanina é o edulcorante artificial aspartamo (E951), que o corpo metaboliza orixinando varios produtos entre eles a fenilalanina. Na Unión Europea [4], así como noutros países (Australia, Estados Unidos e o Canadá[5]) os produtos que conteñen este edulcorante, ou o sal de aspartamo-acesulfamo, deben conter na súa etiquetaxe unha advertencia aos fenilcetonúricos: "contiene una fuente de fenilalanina".
D-fenilalanina e DL-fenilalanina[editar | editar a fonte]
O estereoisómero D-fenilalanina pode producirse por síntese orgánica, tanto como enantiómero puro coma en mestura racémica. O que forma parte normal das proteínas é a L-fenilalanina, pero a D pode atoparse en pequenas cantidades nas proteínas, especialmente en proteínas sintetizadas hai bastante tempo ou en proteínas dos alimentos que foron procesadas. A D-fenilalanina pode ter actividade farmacolóxica.
A DL-fenilalanina é unha mestura dos isómeros D e L e comercialízase como complemento nutricional, ao que se lle atribúen propiedades analxésicas e antidepresivas. As actividades analxésicas atribuídas a este produto poden explicarse polo posible bloqueo que fai a D-fenilalanina da degradación das encefalinas (endorfinas) polo encima carboxipeptidase A.[6] O mecanismo que podería explicar as supostas actividades antidepresivas da DL-fenilalanina pode ser que a L-fenilalanina é o precursor da síntese dos neurotransmisores norepinefrina e dopamina, os cales teñen efectos antidepresivos cando os seus niveis cerebrais son elevados. Ademais, a DL-fenilalanina inhibe a degradación das endorfinas, o que inhibe a liberación de GABA no cerebro medio, e aumenta a liberación de dopamina.
Biosíntese[editar | editar a fonte]
Ao ser un aminoácido esencial non a pode sintetizar o organismo humano, pero si bacterias e plantas. Nas bacterias a súa síntese está moi relacionada coa da tirosina e o triptófano. Os pasos chave son os seguintes: a partir de fosfoenolpiruvato e de eritrosa 4-fosfato obtense en varios pasos ácido siquímico, que en dúas reaccións convértese en ácido corísmico; este en tres reaccións encimáticas máis dá lugar a fenilalanina.
Síntese industrial[editar | editar a fonte]
A L-fenilalanina fabrícase para usos médicos, alimentación e aplicacións nutricionais, como a produción de aspartamo, utilizando a bacteria Escherichia coli, que produce de forma natural aminoácidos aromáticos como a fenilalanina. Existen cepas de E. coli modificadas xeneticamente ás que se lles alteraron os promotores dos xenes ou se lles aumentaron o número de xenes que controlan os encimas responsables da síntese de aminoácidos, que se usan na produción industrial.[7]
Degradación[editar | editar a fonte]
Na súa degradación oxidativa a fenilalanina, xunto coa tirosina, poden formar con parte da súa molécula fumarato e co resto acetoacetil-CoA, que orixina acetoacetato, polo que son á vez aminoácidos glicoxénicos e cetoxénicos.
Notas[editar | editar a fonte]
- ↑ Dawson, R. M. C.; et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. "Nomenclature and Symbolism for Amino Acids and Peptides". Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado o 2007-05-17.
- ↑ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ↑ Regulamento (CE) nº 1333/2008 do Parlamento Europeo e do Consello, de 16 de decembro de 2008, sobre aditivos alimentarios (DOUE L 354, de 31.12.2008).
- ↑ Aspartame Arquivado 21 de febreiro de 2012 en Wayback Machine., Food Standards Agency
- ↑ Christianson DW, Mangani S, Shoham G, Lipscomb WN. "Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A." Journal of Biological Chemistry 1989 Aug 5;264(22):12849-53. PMID 2568989.
- ↑ Sprenger George A. (2007). "Aromatic amino acids". Amino acid biosynthesis: pathways, regulation and metabolic engineering (1st ed.). Springer. pp. 106–113. ISBN 978-3540485957.