Ácido oxálico
| Ácido oxálico | |
|---|---|
 | |
|
|
 | |
ácido etanodioico[1] | |
Outros nomes PIN: Ácido oxálico[1] | |
| Identificadores | |
| Número CAS | 144-62-7 (anhidro), 6153-56-6 (dihidrato) |
| PubChem | 971 |
| ChemSpider | 946 |
| UNII | 9E7R5L6H31 |
| Número CE | 205-634-3 |
| Número UN | 3261 |
| DrugBank | DB03902 |
| KEGG | C00209 |
| MeSH | Oxalic+acid |
| ChEBI | CHEBI:16995 |
| ChEMBL | CHEMBL146755 |
| Número RTECS | RO2450000 |
| Referencia Beilstein | 385686 |
| Referencia Gmelin | 2208 |
| 3DMet | B00059 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C2H2O4 |
| Masa molar | 90,03 g mol−1 (anhidro) 126,065 g·mol−1 (dihidrato) |
| Aspecto | cristais brancos |
| Olor | inodoro |
| Densidade | 1,90 g·cm−3 (anhidro, a 17 °C)[2] 1,653 g·cm−3 (dihidrato) |
| Punto de fusión | 189–191 °C; 372–376 °F; 462–464 K |
| Solubilidade en auga | 90-100 g/L (20 °C)[2] |
| Solubilidade | 237 g/L (15 °C) en etanol 14 g/L (15 °C) en dietil éter [3] |
| Presión de vapor | <0.001 mmHg (20 °C)[4] |
| Acidez (pKa) | 1,25, 4,14[5] |
| -60,05·10−6 cm3/mol | |
| Perigosidade | |
| Principais perigos | corrosivo |
| NFPA 704 | |
| Punto de inflamabilidade | 166 °C; 331 °F; 439 K |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
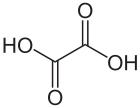
O ácido oxálico é un composto orgánico coa fórmula C2H2O4. É un sólido branco cristalino que forma unha solución incolora en auga. A súa fórmula condensada é HOOCCOOH, que indica a súa clasificación como o ácido dicarboxilico máis simple.
A súa forza como ácido é moita maior que a do ácido acético. O ácido oxálico é un axente redutor[6] e a súa base conxugada, denominada oxalato (C
2O2−
4), é un axente quelante para catións metálicos. Normalmente, o ácido oxálico encóntrase en forma de dihirato coa fórmula C2H2O4·2H2O.
Aparece de forma natural en moitos alimentos, pero a súa inxestión excesiva ou o seu prolongado contacto coa pel poden ser perigosos.
O seu nome procede de que foi illado das plantas do xénero Oxalis.
Historia
[editar | editar a fonte]A preparación de sales de ácido oxálico a partir de plantas coñécese polo menos desde 1745, cando o botánico e médico holandés Herman Boerhaave illou un sal da planta trevo acedo.[7] En 1773, François Pierre Savary de Friburgo, Suíza illara ácido oxálico do seu sal do trevo acedo.[8]
En 1776, os químicos suecos Carl Wilhelm Scheele e Torbern Olof Bergman[9] producían ácido oxálico ao faceren reaccionar o azucre con ácido nítrico concentrado; Scheele chamoulle ao ácido resultante socker-syra ou såcker-syra (ácido de azucre). En 1784, Scheele observou que o "ácido de azucre" e o ácido oxálico de fontes naturais eran idénticos.[10]
En 1824, o químico alemán Friedrich Wöhler obtivo ácido oxálico facendo reaccionar cianóxeno con amoníaco en solución acuosa.[11] Este experimento pode representar a primeira síntese dun produto natural.[12]
Preparación
[editar | editar a fonte]O ácido oxálico fabrícase principalmente por oxidación de glicosa ou outros carbohidratos usando ácido nítrico ou aire en presenza de pentóxido de vanadio. Poden usarse diversos precursores como o ácido glicólico e o etilén glicol.[13] Un novo método supón a carbonilación oxidativa de alcohois para dar os diésteres de ácido oxálico:
- 4 ROH + 4 CO + O2 → 2 (CO2R)2 + 2 H2O
Estes diésteres son seguidamente hidrolizados a ácido oxálico. Prodúcense aproximadamente 120 000 toneladas anualmente.[12]
Historicamente o ácido oxálico obtíñase exclusivamente usando cáusticos, cono o hidróxido de potasio ou de sodio, en serraduras.[14] A pirólise do formiato de sodio (en último extremo preparado a partir de monóxido de carbono), leva á formación de oxalato de sodio, doadamente convertido en ácido oxálico.
Métodos de laboratorio
[editar | editar a fonte]Aínda que pode comprarse facilmente, o ácido oxálico tamén se pode preparar directamente no laboratorio oxidando sacarosa usando ácido nítrico en presenza dunha pequena cantidade de pentóxido de vanadio como catalizador.[15]
O sólido hidratado pode ser deshidratado con calor ou por destilación azeotrópica.[16]
Unha electrocatálise por un complexo de cobre desenvolvida nos Países Baixos permite reducir dióxido de carbono a ácido oxálico;[17] esta conversión usa dióxido de carbono como materia prima para xerar o ácido oxálico.
Estrutura
[editar | editar a fonte]O ácido oxálico anhidro pode existir en forma de dous polimorfos; nun a formación de enlaces de hidróxeno ten como resultado unha estrutura de tipo cadea, mentres que o padrón de enlaces de hidróxeno no outro orixina unha estrutura de tipo laminar.[18] Como o material anhidro é tanto ácido coma hidrófilo, utilízase en esterificacións.
Reaccións
[editar | editar a fonte]O ácido oxálico é un ácido relativamente forte, malia ser un ácido carboxílico:
C2O4H2 ⇌ C2O4H− + H+ pKa = 1.27 C2O4H− ⇌ C
2O2−
4 + H+pKa = 4.27
O ácido oxálico sofre moitas das reaccións características doutros ácidos carboxílicos. Forma ésteres como o oxalato de dimetilo (punto de fusión de 52,5 a 53,5 °C).[19] Forma un cloruro ácido chamado cloruro de oxalilo.
O oxalato, a base conxugada do ácido oxálico, é un excelente ligando para ións metálicos, por exemplo, o fármaco oxaliplatino.
O ácido oxálico e os oxalatos poden ser oxidados por permanganato nunha reacción autocatalitica.[20]
Os valores do pKa do ácido oxálico varían na literatura desde 1,25-1,46 e 3,81-4,40.[21][22][23] A 100ª edición do CRC, que saíu en 2019, dá valores de 1,25 e 3,81.[24]
Presenza natural
[editar | editar a fonte]Biosíntese
[editar | editar a fonte]Existen polo menos dúas vías para a formación mediada por enzimas do oxalato. Nunha das vías, o oxaloacetato, un compoñente do ciclo de Krebs, é hidrolizado a ácido acético polo encima oxaloacetase:[25]
- [O2CC(O)CH2CO2]2− + H2O → C
2O2−
4 + CH
3CO−
2 + H+
Tamén se orixina da deshidroxenación do ácido glicólico, que se produce polo metabolismo do etilén glicol.
Presenza en alimentos e plantas
[editar | editar a fonte]O oxalato de calcio é o compoñente máis común dos cálculos renais. Os primeiros investigadores illaron o ácido oxálico do trevo acedo (Oxalis). Membros da familia das espinacas e as brasicáceas (verza, brócoli, col de Bruxelas) son ricos en oxalatos, como tamén o trevo acedol e umbelíferas como o perexil.[26] As follas de ruibarbo conteñen un 0,5% de ácido oxálico, e a planta Arisaema triphyllum contén cristais de oxalato de calcio. Igualmente, a Parthenocissus quinquefolia, unha planta rubideira decorativa común, produce ácido oxálico nas súas bagas e cristais de oxalato nos seus zumes internos en forma de ráfidos. As bacterias producen oxalatos pola oxidación de carbohidratos.[12]
As plantas do xénero Fenestraria producen unha especie de fibras ópticas feitas de ácido oxálico cristalino para transmitir luz a sitios fotosintéticos subterráneos.[27]
A carambola tamén contén ácido oxálico xunto con caramboxina. Os zumes de cítricos conteñen pequenas cantidades de ácido oxálico. Os froitos cítricos producidos en agricultura orgánica conteñen menos ácido oxálico que os producidos na agricultura convencional.[28]
A formación de pátinas de oxalato de calcio naturais sobre certas estatuas de calcaria e mármore e monumentos propúxose que estaba causada pola reacción química da rocha carbonatada co ácido oxálico segregado por liques ou outros microorganismos.[29][30]
Produción polos fungos
[editar | editar a fonte]Moitas especies de fungos do solo segregan ácido oxálico, o que ten como resultado unha gran solubilidade de catións metálicos, un incremento da dispoñibilidade de certos nutrientes do solo, e a posible formación de cristais de oxalato de calcio.[31][32]
Outros
[editar | editar a fonte]O betume oxidado ou o exposto a raios gamma tamén contén ácido oxálico entre os seus produtos de degradación. O ácido oxálico pode incrementar a lixiviación de radioisótopos acondicionados no betume para a eliminación de residuos radioactivos.[33]
Bioquímica
[editar | editar a fonte]A base conxugada do ácido oxálico é o anión hidroxenoxalato, e a súa base conxugada (oxalato) é un inhibidor competitivo do encima lactato deshidroxenase (LDH).[34] A LDH cataliza a conversión do piruvato a ácido láctico (produto final do proceso anaeróbico da fermentación) oxidando o coencima NADH a NAD+ e H+ ao mesmo tempo. Recuperar os niveis de NAD+ é esencial para a continuación do metabolismo enerxético anaerobio pola glicólise. Como as células cancerosas usan preferentemente o metabolismo anaerobio (efecto Warburg) a inhibición da LDH viuse que inhibe a formación e crecemento de tumores,[35] polo que este podería ser un interesante tratamento para o cancro.
Aplicacións
[editar | editar a fonte]Un 25% do ácido oxálico que se produce utilízase como mordente en procesos de tinguidura. Utilízase en lixivias, especialmente para a polpa de madeira. Tamén se usa nos levedantes químicos[12] e como un terceiro reactivo na análise de instrumentos de sílice.
Limpeza
[editar | editar a fonte]As principais aplicacións do ácido oxálico son a limpeza e nas lixivias, especialmente na limpeza de óxido de ferro (como axente acomplexante do ferro). A súa utilidade nos axentes que eliminan o óxido débese a que forma sales hidrosolubles estables co ferro férrico, que son os ións ferrioxalato.
Metalurxia extractiva
[editar | editar a fonte]O ácido oxálico é un importante reactivo en química lantánida. Os oxalatos de lantánidos hidratados fórmanse doadamente en solucións ácidas moi fortes en forma densamente cristalina facilmente filtrable libre de contaminación de elementos non lantánidos. A descomposición térmica destes oxalatos dá lugar aos óxidos, os cales son a forma máis normal en que se comercializan estes elementos.
Outros usos
[editar | editar a fonte]
O ácido oxálico utilízano algúns apicultores como acaricida contra o ácaro varroa parasito das abella.[36]
Utilízase tamén para limpar minerais.[37][38]
Ás veces utilízase no proceso de anodizar o aluminio con ou sen ácido sulfúrico. Comparado coa anodización con ácido sulfúrico, estes recubrimentos son máis finos e mostran menor rugosidade superficial.
Toxicidade
[editar | editar a fonte]O ácido oxálico en forma concentrada pode ter efectos nocivos por contacto e por inxestión. Non foi identificado como un mutáxeno ou carcinóxeno, aínda que hai un estudo que suxire que podería causar cancro;[39] hai un posible risco de malformacións conxénitas no feto; pode ser daniño se se inhala e é extremadamente destrutivo dos tecidos das mucosas e do tracto respiratorio superior; daniño se se traga; nocivo e destrutivo para outros tecidos e causa queimaduras se se absorbe pola pel ou está en contacto cos ollos. Os seus síntomas e efectos inclúen unha sensación de queimadura, tose, espirro, larinxite, falta de respiración, espasmo, inflamación e edema da larinxe, inflamación e edema dos bronquios, pneumonite e edema pulmonar.[40]
Nos humanos, o ácido oxálico inxerido ten unha LDLo (dose letal menor publicada) oral de 600 mg/kg.[41] Informouse que a dose letal oral é de 15 a 30 gramos.[42]
O oxalato pode entrar nas células, nas que causa disfunción mitocondrial.[43]
A toxicidade do ácido oxálico débese a insuficiencia renal causada por precipitación de oxalato de calcio sólido,[44] o principal compoñente dos cálculos renais. O ácido oxálico pode tamén causar dor articular debido á formación de precipitados similares nas articulacións. A inxestión de etilén glicol orixina como metabolito ácido oxálico, que tamén pode causar insuficiencia renal aguda.
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ↑ 2,0 2,1 Rexistro na GESTIS Substance Database do IFA
- ↑ Radiant Agro Chem. "Oxalic Acid MSDS". Arquivado dende o orixinal o 15 de xullo de 2011. Consultado o 2012-02-02. Arquivado 15 de xullo de 2011 en Wayback Machine.
- ↑ NIOSH Pocket Guide to Chemical Hazards. "#0474". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Bjerrum, J., et al. (1958) Stability Constants, Chemical Society, London.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2005. pp. 17624/28029. ISBN 9783527306732. doi:10.1002/14356007.
- ↑ Ver:
- Herman Boerhaave, Elementa Chemiae (Basil, Switzerland: Johann Rudolph Im-hoff, 1745), volume 2, pp. 35-38. (en letín) From p. 35: "Processus VII. Sal nativum plantarum paratus de succo illarum recens presso. Hic Acetosae." (Procedemento 7. Un sal natural de plantas preparado a partir dos seus zumes expremidos frescos. Este [sal obtido] do trevo acedo.)
- Henry Enfield Roscoe e Carl Schorlemmer, ed.s, A Treatise on Chemistry (New York, New York: D. Appleton and Co., 1890), volume 3, part 2, p. 105..
- ↑ Ver:
- François Pierre Savary, Dissertatio Inauguralis De Sale Essentiali Acetosellæ [Disertación inaugural sobre o sal esencial do trevo acedo] (Jean François Le Roux, 1773). (en latín) Savary sinalou que cando destilaba sal (oxalato de potasio hidróxeno) do trevo acedo, os cristais sublimábanse no recipiente. Na p. 17: "Unum adhuc circa liquorem acidum, quem sal acetosellae tam sincerissimum a nobis paratum quam venale destillatione fundit phoenomenon erit notandum, nimirum quod aliquid ejus sub forma sicca crystallina lateribus excipuli accrescat, ..." (Unha [cousa] máis sinalarei sobre o líquido ácido, que nos proveeu sal de trevo acedo tan puro como o das destilacións comerciais, [este] produce un fenómeno, no que evidentemente algo en forma seca cristalina crece nos laterais do recipiente, ...) Estes eran cristais de ácido oxálico.
- Leopold Gmelin with Henry Watts, trans., Hand-book of Chemistry (London, England: Cavendish Society, 1855), volume 9, p. 111.
- ↑ Ver:
- Torbern Bergman with Johan Afzelius (1776) Dissertatio chemica de acido sacchari [Disertación química sobre o ácido de azucre] (Uppsala, Sweden: Edman, 1776).
- Torbern Bergman, Opuscula Physica et Chemica, (Leipzig (Lipsia), (Germany): I.G. Müller, 1776), volume 1, "VIII. De acido Sacchari," pp. 238-263.
- ↑ Carl Wilhelm Scheele (1784) "Om Rhabarber-jordens bestånds-delar, samt sått at tilreda Acetosell-syran" (Sobre os constituíntes da terra de ruibarbo, e os modos de preparar ácido de trevo acedo), Kungliga Vetenskapsakademiens Nya Handlingar [New Proceedings of the Royal Academy of Science], 2nd series, 5 : 183-187. (en sueco) Na p. 187: "Således finnes just samma syra som vi genom konst af socker med tilhjelp af salpeter-syra tilreda, redan förut af naturen tilredd uti o̊rten Acetosella." (Así conclúese [que] exactamente o mesmo ácido que preparamos artificialmente por medio de azucre coa axuda de ácido nítrico, [estaba] previamente preparado de forma natural na planta acetosella [é dicir, trevo acedo].)
- ↑ Ver:
- F. Wöhler (1824) "Om några föreningar af Cyan" (Sobre algúns compostos do cianuro), Kungliga Vetenskapsakademiens Handlingar [Proceedings of the Royal Academy of Science], pp. 328-333. (en sueco)
- Reimpreso en alemán como: F. Wöhler (1825) "Ueber Cyan-Verbindungen" (Sobre os compostos do cianuro), Annalen der Physik und Chemie, 2nd series, 3 : 177-182.
- ↑ 12,0 12,1 12,2 12,3 Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a18_247 10.1002/14356007.a18_247.
- ↑ Eiichi, Yonemitsu; Tomiya, Isshiki; Tsuyoshi, Suzuki and Yukio, Yashima "Process for the production of oxalic acid", US patent - 3678107, priority date March 15, 1969
- ↑ Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. p. 499.
- ↑ Practical Organic Chemistry by Julius B. Cohen, 1930 ed. preparation #42
- ↑ Clarke H. T.;. Davis, A. W. (1941). "Oxalic acid (anhydrous)". Org. Synth.: 421. CV1P0421.
- ↑ Bouwman, Elisabeth; Angamuthu, Raja; Byers, Philip; Lutz, Martin; Spek, Anthony L. (July 15, 2010). "Electrocatalytic CO2 Conversion to Oxalate by a Copper Complex". Science 327 (5393): 313–315. Bibcode:2010Sci...327..313A. PMID 20075248. doi:10.1126/science.1177981.
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Bowden, E. (1943). "Methyl oxalate". Org. Synth.: 414. CV2P0414.
- ↑ Kovacs K.A.; Grof P.; Burai L.; Riedel M. (2004). "Revising the mechanism of the permanganate/oxalate reaction". J. Phys. Chem. A 108 (50): 11026–11031. Bibcode:2004JPCA..10811026K. doi:10.1021/jp047061u.
- ↑ Bjerrum, J., et al. (1958) Stability Constants, Chemical Society, London.
- ↑ Haynes, W. M. (Ed.). (2014). CRC Handbook of Chemistry and Physics, 95th Edition (95 edition). Boca Raton; London; New York: CRC Press.]
- ↑ Clayton, G. D. and F. E. Clayton (eds.). Patty's Industrial Hygiene and Toxicology: Volume 2A, 2B, 2C: Toxicology. 3rd ed. New York: John Wiley Sons, 1981-1982., p. 4936
- ↑ Rumble, J. (Ed.). (2019). CRC Handbook of Chemistry and Physics, 100th Edition (100 edition). CRC Press.
- ↑ Dutton, M. V.; Evans, C. S. (1996). "Oxalate production by fungi: Its role in pathogenicity and ecology in the soil environment". Canadian Journal of Microbiology 42 (9): 881–895. doi:10.1139/m96-114..
- ↑ Rombauer, Rombauer Becker, and Becker (1931/1997). Joy of Cooking, p.415. ISBN 0-684-81870-1.
- ↑ Attenborough, David. "Surviving." The Private Life of Plants: A Natural History of Plant Behaviour. Princeton, NJ: Princeton UP, 1995. 265+. "OpenLibrary.org: The Private Life of Plants" Print.
- ↑ Duarte, A.; Caixeirinho, D.; Miguel, M.; Sustelo, V.; Nunes, C.; Fernandes, M.; Marreiros, A. (2012). "Organic Acids Concentration in Citrus Juice from Conventional versus Organic Farming". Acta Horticulturae 933: 601-606. doi:10.17660/ActaHortic.2012.933.78.
- ↑ Sabbioni, Cristina; Zappia, Giuseppe (2016). "Oxalate patinas on ancient monuments: The biological hypothesis". Aerobiologia 7: 31–37. doi:10.1007/BF02450015.
- ↑ Frank-Kamemetskaya, Olga; Rusakov, Alexey; Barinova, Ekaterina; Zelenskaya, Marina; Vlasov, Dmitrij (2012). "The Formation of Oxalate Patina on the Surface of Carbonate Rocks Under the Influence of Microorganisms". Proceedings of the 10th International Congress for Applied Mineralogy (ICAM). pp. 213–220. ISBN 978-3-642-27681-1. doi:10.1007/978-3-642-27682-8_27.
- ↑ Dutton, Martin V.; Evans, Christine S. (1 September 1996). "Oxalate production by fungi: its role in pathogenicity and ecology in the soil environment". Canadian Journal of Microbiology 42 (9): 881–895. doi:10.1139/m96-114.
- ↑ Gadd, Geoffrey M. (1 de xaneiro de 1999). "Fungal Production of Citric and Oxalic Acid: Importance in Metal Speciation, Physiology and Biogeochemical Processes". Advances in Microbial Physiology (en inglés) (Academic Press) 41: 47–92. ISBN 9780120277414. PMID 10500844. doi:10.1016/S0065-2911(08)60165-4.
- ↑ EPJ Web of Conferences
- ↑ Novoa, William; Alfred Winer; Andrew Glaid; George Schwert (1958). "Lactic Dehydrogenase V. inhibition by Oxamate and Oxalate". Journal of Biological Chemistry 234 (5): 1143–8. PMID 13654335.
- ↑ Le, Anne; Charles Cooper; Arvin Gouw; Ramani Dinavahi; Anirban Maitra; Lorraine Deck; Robert Royer; David Vander Jagt; Gregg Semenza; Chi Dang (14 December 2009). "Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumor progression". Proceedings of the National Academy of Sciences 107 (5): 2037–2042. PMC 2836706. PMID 20133848. doi:10.1073/pnas.0914433107.
- ↑ Fu, Yu-Lun Lisa (2008). Exploring New Methods for Varroa Mite Control (en inglés). Michigan State University. Department of Entomology.
- ↑ Jackson, Faith. "Quartz Crystal Cleaning" Arquivado 29 de outubro de 2013 en Wayback Machine.. bluemooncrystals.com
- ↑ "Rock Currier – Cleaning Quartz". mindat.org
- ↑ Castellaro, Andrés M.; Tonda, Alfredo; Cejas, Hugo H.; Ferreyra, Héctor; Caputto, Beatriz L.; Pucci, Oscar A.; Gil, German A. (2015-10-22). "Oxalate induces breast cancer". BMC Cancer 15: 761. ISSN 1471-2407. PMC 4618885. PMID 26493452. doi:10.1186/s12885-015-1747-2.
- ↑ Oxalic acid dihydrate. MSDS. sigmaaldrich.com
- ↑ "Oxalic Acid Material Safety Data Sheet" (PDF). Radiant Indus Chem. Arquivado dende o orixinal (PDF) o 20 de maio de 2014. Consultado o 2014-05-20. Arquivado 20 de maio de 2014 en Wayback Machine.
- ↑ "CDC – Immediately Dangerous to Life or Health Concentrations (IDLH): Oxalic acid – NIOSH Publications and Products". cdc.gov
- ↑ Patel, Mikita; Yarlagadda, Vidhush; Adedoyin, Oreoluwa; Saini, Vikram; Assimos, Dean G.; Holmes, Ross P.; Mitchell, Tanecia (May 2018). "Oxalate induces mitochondrial dysfunction and disrupts redox homeostasis in a human monocyte derived cell line". Redox Biology 15: 207–215. PMC 5975227. PMID 29272854. doi:10.1016/j.redox.2017.12.003.
- ↑ EMEA Committee for veterinary medicinal products, oxalic acid summary report, December 2003[Ligazón morta]
Véxase tamén
[editar | editar a fonte]| Commons ten máis contidos multimedia sobre: Oxalic acid |
Ligazóns externas
[editar | editar a fonte]- Oxalic acid MS Spectrum
- International Chemical Safety Card - ICSC - 0529
- NIOSH Guide to Chemical Hazards (CDC)
- Táboa: Contido en ácido oxálico de vexetais seleccionados (USDA)
- Alternative link: Táboa: Contido en ácido oxálico de vexetais seleccionados (USDA)
- Sobre o envelenamento por ruibarbo (The Rhubarb Compendium)
- Oxalosis & Hyperoxaluria Foundation (OHF) Contido en oxalato dos alimentos 2008 (PDF)
- Oxalosis & Hyperoxaluria Foundation (OHF) Información sobre a dieta
- Calculator: Water and solute activities in aqueous oxalic acid

