Ácido pirúvico
| Ácido pirúvico | |
|---|---|

|

|
Ácido 2-oxopropanoico | |
Outros nomes Ácido α-cetopropiónico; ácido acetilfórmico ácido pirorracémico; Pyr | |
| Identificadores | |
| Número CAS | 127-17-3 |
| PubChem | 1060 |
| ChemSpider | 1031 |
| UNII | 8558G7RUTR |
| DrugBank | DB00119 |
| KEGG | C00022 |
| ChEBI | CHEBI:32816 |
| ChEMBL | CHEMBL1162144 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C3H4O3 |
| Masa molecular | 88,06 g/mol |
| Densidade | 1,250 g/cm³ |
| Punto de fusión | 11,8 °C |
| Punto de ebulición | 165 °C |
| Acidez (pKa) | 2,50[1] |
| Compostos relacionados | |
| Outros anións | ión piruvato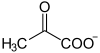 
|
| cetoácidos, ácidos carboxílicos relacionados | ácido acético ácido glioxílico ácido oxálico ácido propiónico ácido acetoacético |
| Compostos relacionados | propionaldehido gliceraldehido metilglioxal piruvato de sodio |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

O ácido pirúvico é un alfa-cetoácido orgánico de tres carbonos moi importante na bioquímica celular. A pH celular está ionizado formando o seu anión carboxilato denominado piruvato.
Pode orixinarse a partir da glicosa por glicólise, convertido de novo en azucres por gliconeoxénese, ou en ácidos graxos a través do acetil-CoA. Pode utilizarse para sintetizar alanina e etanol, ou para producir enerxía na respiración aerobia ou na fermentación homoláctica.
Descubriuse en 1834-35. En 1834, Théophile-Jules Pelouze destilou ácido tartárico e unha mestura de varios ácidos [2]) entre eles un que non foi identificado ata o ano seguinte por Jöns Jacob Berzelius, que o denominou ácido pirúvico.[3]
Características químicas[editar | editar a fonte]
É un ácido de tres carbonos cun grupo carboxilo, un grupo ceto (C=O) no carbono 2 e un grupo CH3. É incoloro, de cheiro similar ao ácido acético, miscible en auga e soluble en etanol e dietiléter. No laboratorio pode ser sintetizado por quentamento dunha mestura de ácido tartárico e bisulfato de potasio; ou pola hidrólise de cianuro de etanoílo, formado pola reacción de cloruro de etanoílo e cianuro de potasio:
É un ácido monoprótico, xa que pode liberar un catión hidróxeno formando o anión piruvato.
- CH3−CO−COOH → CH3−CO−COO− + H+
Importancia biolóxica[editar | editar a fonte]
Produción de enerxía. O piruvato é un composto orgánico chave no metabolismo. É o produto final da glicólise, que se orixina por transformación do fosfoenolpiruvato (unha forma enol fosfatada) en piruvato (unha forma ceto) catalizada polo encima piruvato quinase. A glicólise é unha ruta metabólica central e universal na que a glicosa se escinde en dúas moléculas de piruvato e se orixina enerxía (2 ATP) e poder redutor (2 NADH). O ácido pirúvico pode despois formar moita máis enerxía se entra na respiración celular. En realidade o ácido pirúvico formado na glicólise pode ter dous destinos segundo as condicións da célula:
- Se hai suficiente osíxeno na célula, o ácido pirúvico será descarboxilado na matriz da mitocondria polo complexo encimático piruvato deshidroxenase rendendo CO2, acetil-CoA e NADH. O acetil-CoA entrará no ciclo de Krebs e completará a respiración celular producindo gran cantidade de enerxía. Cada piruvato orixina 15 ATP.
- Se non hai suficiente osíxeno na célula o piruvato é fermentado. A fermentación é un proceso anaeróbico. Nesta vía o piruvato redúcese a lactato permitindo rexenerar o NAD+ consumido na glicólise, aínda que non se produce enerxía (á parte dos 2 ATP da glicólise previa). Os animais realizan a fermentación homoláctica, que ten como produto final o ácido láctico, pero noutros organismos hai outros tipos de fermentación.
Reaccións anapleróticas. O piruvato pode orixinar oxalacetato, que é un metabolito do ciclo de Krebs, polo que esta é unha reacción de "recheo" do ciclo de Krebs ou reacción anaplerótica. O oxalacetato pode ser utilizado na gliconeoxénese para producir nova glicosa.
Metabolito intermediario. O piruvato é un metabolito chave na intersección de varias vías metabólicas. Pode ser convertido en carbohidratos por gliconeoxénese, en ácidos graxos ou en enerxía a través do acetil-CoA, no aminoácido alanina (por transaminación), e en etanol.
Degradación de aminoácidos. Na degradación dos esqueletos carbonados dos aminoácidos, hai cinco deles, a alanina, treonina, glicina, serina e cisteína, que orixinan piruvato. Este despois dá lugar a acetil-CoA.
Derivados. O seu derivado, o ácido bromopirúvico está sendo estudado como posible tratamento do cáncer na Johns Hopkins University en liñas de investigación que apoiarían a hipótese de Warburg sobre a orixe do cáncer.
Notas[editar | editar a fonte]
- ↑ Dawson, R. M. C. et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ Thomson Thomas (1838). "II. Of fixed acids Section". En J. B. Baillière - London. Chemistry of organic bodies, vegetables. p. 65. Consultado o December 1, 2010.[1]
- ↑ Thorpe Sir Thomas Edward (1922). "Glutaric acid". En Longmans, Green, and Co. - London. A dictionary of applied chemistry 3. pp. 426–427. Consultado o December 1, 2010.[2]
Bibliografía[editar | editar a fonte]
- George D. Cody, Nabil Z. Boctor, Timothy R. Filley, Robert M. Hazen, James H. Scott, Anurag Sharma, Hatten S. Yoder Jr., David Master, "Primordial Carbonylated Iron-Sulfur Compounds and the Synthesis of Pyruvate", Science, 289 (5483) (25 de agosto de 2000) pp. 1337 - 1340.
