Dióxido de cloro
| Dióxido de cloro | |
|---|---|

| |
 | |
Dióxido de cloro | |
Outros nomes Óxido de cloro(IV) | |
| Identificadores | |
| Número CAS | 10049-04-4 |
| PubChem | 24870 |
| ChemSpider | 23251 |
| UNII | 8061YMS4RM |
| Número CE | 233-162-8 |
| Número UN | 9191 |
| MeSH | Chlorine+dioxide |
| ChEBI | CHEBI:29415 |
| Número RTECS | FO3000000 |
| Referencia Gmelin | 1265 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | ClO2 |
| Masa molar | 67,45 g mol−1 |
| Aspecto | Gas amarelo a avermellado |
| Olor | Acre |
| Densidade | 2,757 g dm−3[1] |
| Punto de fusión | −59 °C; −74 °F; 214 K |
| Punto de ebulición | 11 °C; 52 °F; 284 K |
| Solubilidade en auga | 8 g/L at 20 °C |
| Solubilidade | Soluble en solucións alcalinas e ácido sulfúrico |
| Presión de vapor | >1 atm[2] |
| kH | 4,01·10-2 atm m3 mol−1 |
| Acidez (pKa) | 3,0(5) |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
104,60 kJ/mol |
| Entropía molar estándar S |
257,22 J K−1 mol−1 |
| Perigosidade | |
| Pictogramas GHS |  
|
| Palabra sinal GHS | Danger (perigo) |
| Principais perigos | Moi tóxico, corrosivo, inestable, poderoso oxidante |
| NFPA 704 | |
| LD50 | 94 mg/kg (oral, rata)[3] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O dióxido de cloro é un composto químico coa fórmula ClO2 que existe en forma de gas verdoso amarelado por riba dos 11 °C, ou como líquido marrón avermellado entre os 11 °C e −59 °C, e como cristais sólidos de cor laranxa intensa por debaixo dos −59 °C. Normalmente manéxase como solución acuosa. Utilízase comunmente como lixivia. Desenvolvementos máis recentes ampliaron as súas aplicacións no procesamento de alimentos e como desinfectante.
O produto milagre pseudomedicinal MMS ("Miracle Mineral Supplement", Suplemento Mineral Milagroso), que está prohibido en España, contén clorito de sodio e cando se prepara de acordo coas instrucións que se dan, produce dióxido de cloro.
Estrutura e enlaces
[editar | editar a fonte]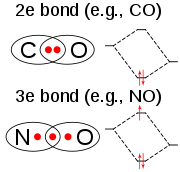


A molécula de ClO2 ten un número impar de electróns de valencia, e, por tanto, é un radical paramagnético. É un exemplo pouco común "dunha molécula con electróns impares que é estable cara á dimerización" (o óxido nítrico é outro exemplo).[4]
En 1933 Lawrence O. Brockway, un estudante graduado de Linus Pauling, propuxo unha estrutura que contén un enlace de tres electróns e dous enlaces simples.[5] Porén, Pauling na súa obra Química xeral mostra un dobre enlace nun oxíxeno e un enlace simple e un enlace de tres electróns no outro. A estrutura de enlaces de valencia representaríase como un híbrido en resonancia ilustrado por Pauling.[6] O enlace de tres electróns represena un enlace que é máis débil que o enlace dobre. Na teoría dos orbitais moleculares esta idea é común se o terceiro electrón está situado nun orbital antienlace. Traballos posteriores confirmaron que o orbital molecular ocupado máis alto é, en efecto, un orbital antienlace non completamente cheo.[7]

A estrutura cristalina do ClO2 é ortorrómbica, e mostra unha simetría do grupo espacial Pbca.[8]
Solubilidade
[editar | editar a fonte]O dióxido de cloro ten propiedades moi diferentes do cloro elemental.[9] Unha das cualidades máis importantes do dióxido de cloro é a súa alta solubilidade, especialmente en auga fría. O dióxido de cloro non reacciona coa auga; permanece como gas en solución. O dióxido de cloro é aproximadamente 10 veces máis soluble en auga que o cloro elemental,[9] pero a súa solubilidade é moi dependente da temperatura.
Preparación
[editar | editar a fonte]O dióxido de cloro preparouno por primeira vez en 1811 Humphry Davy.[10]
É un composto que se pode descompoñer violentamente cando se separaron de substancias diluídas. Como resultado, adoitan preferirse os métodos de preparación que implican producir disolucións de dióxido de cloro sen pasar por un estadio de fase gasosa.
Oxidación do clorito
[editar | editar a fonte]No laboratorio pode prepararse o ClO2 por oxidación do clorito de sodio con cloro:[11]
- NaClO
2 + 1⁄2 Cl
2 → ClO
2 + NaCl
- NaClO
Tradicionalmente, o dióxido de cloro para aplicacións de desinfección facíase a partir de clorito de sodio ou polo método do clorito de sodio–hipoclorito:
- 2 NaClO
2 + 2 HCl + NaOCl → 2 ClO
2 + 3 NaCl + H
2O
- 2 NaClO
ou polo método do clorito de sodio–ácido hidroclórico:
- 5 NaClO
2 + 4 HCl → 5 NaCl + 4 ClO
2 + 2 H
2O
- 5 NaClO
ou polo método do clorito–ácido sulfúrico:
- 4 ClO−
2 + 2 H
2SO
4 → 2 ClO
2 + HClO
3 + 2 SO2−
4 + H
2O + HCl
- 4 ClO−
Os tres métodos poden poden producir dióxido de cloro cun alto rendemento na conversión do clorito. A diferenza doutros procesos, o método do clorito–ácido sulfúrico está completamente libre de cloro, aínda que necesita un 25% máis de clorito para producir unha cantidade equivalente de dióxido de cloro. Alternativamente, pode utilizarse o peróxido de hidróxeno eficientemente en aplicacións a pequena escala.[9]
En xeral, a adición de ácido sulfúrico ou calquera ácido forte a sales de clorato produce dióxido de cloro.[6]
Redución do clorato
[editar | editar a fonte]No laboratorio, o dióxido de cloro pode tamén prepararse por reacción do clorato potásico con ácido oxálico:
- KClO
3 + H
2C
2O
4 → 1⁄2 K
2C
2O
4 + ClO
2 + CO
2 + H
2O
- KClO
ou cos ácidos oxálico e sulfúrico:
- KClO
3 + 1⁄2 H
2C
2O
4 + H
2SO
4 → KHSO
4 + ClO
2 + CO
2 + H
2O
- KClO
Un 95% do dióxido de cloro producido no mundo hoxe faise por redución do clorato de sodio para o seu uso no branqueamento da polpa de madeira para a produción de papel. Prodúcese con alta eficiencia nunha forte solución ácida cun axente redutor axeitado como o metanol, peróxido de hidróxeno, ácido clorhídrico ou dióxido de xofre.[9] As tecnoloxías modernas para a súa produción están baseadas no metanol ou o peróxido de hidróxeno, xa que esas químicas permiten unha mellor economía e non coproducir cloro elemental. A reacción global pode escribirse así:[12]
- clorato + ácido + axente redutor → dióxido de cloro + subprodutos
Como exemplo típico, a reacción do clorato de sodio con ácido hidroclórico nun só reactor crese que procede pola seguinte vía:
- ClO−
3 + Cl− + H+ → ClO−
2 + HOCl - ClO−
3 + ClO−
2 + 2 H+ → 2 ClO
2 + H
2O - HOCl + Cl− + H+ → Cl
2 + H
2O
- ClO−
o cal dá a seguinte reacción global:
- ClO−
3 + Cl− + 2 H+ → ClO
2 + 1⁄2 Cl
2 + H
2O.
- ClO−
A ruta de produción comercialmente máis importante usa metanol como axente redutor e ácido sulfúrico para proporcionar a acidez. Dúas vantaxes de non usar os procesos baseados no cloruro son que non hai formación de cloro elemental e que un subproduto é o sulfto de sodio, un composto químico valioso para o muíño de polpa. Estes procesos baseados no metanol proporcionan unha alta eficiencia e poden realizarse de maneira moi segura.[9]
A variante do proceso que usa clorato de sodio, peróxido de hidróxeno e ácido sulfúrico foise usando cada vez máis desde 1999 para o tratamento da auga e outras aplicacións de desinfección a pequena escala, xa que produce un produto libre de cloro elemental con alta eficiencia, dun 95%.[Cómpre referencia]
Outros procesos
[editar | editar a fonte]Pode producirse dióxido de cloro moi puro por electrólise da solución de clorito:[13]
- NaClO
2 + H
2O → ClO
2 + NaOH + 1⁄2 H
2
- NaClO
O dióxido de cloro gasoso de alta pureza (7,7% en aire ou nitróxeno) pode producirse polo método gas–sólido, que fai reaccionar gas de dióxido de cloro diluído con clorito de sodio sólido:[13]
- NaClO
2 + 1⁄2 Cl
2 → ClO
2 + NaCl
- NaClO
Propiedades de manipulación
[editar | editar a fonte]A presións parciais por riba de 10 kPa (1,5 psi)[9] (ou concentracións de fase de gas maiores do 10% do volume en aire a presión e temperatura normais) de ClO2 pode descompoñerse explosivamente en cloro e oxíxeno. A descomposición pode iniciarse pola luz, puntos quentes, reacción química ou choque de presión. Así, o dióxido de cloro nunca se manipula como gas puro, senón case sempre como solución acuosa en concentracións entre 0,5 e 10 gramos por litro. A súa solubilidade increméntase a temperturas máis baixas, así qie é común usar auga fría (5 °C) cando se almacena en concentracións por riba de 3 gramos por litro. En moitos países, como os Estados Unidos, o dióxido de cloro non pode ser transportado a calquera concentración e case sempre se produce in situ.[9] Nalgúns países, as solucións de dióxido de cloro en concentracións por debaixo de 3 gramos por litro poden ser transportadas por terra, pero son relativamente inestables e deterióranse rapidamente.
Usos
[editar | editar a fonte]O dióxido de cloro utilízase para o branqueamento da polpa de madeira e para a desinfección da auga potable municipal (o que se chama cloración da auga),[14][15]:4-1[16] tratamento da auga en aplicacións de aceite e gas, desinfeccións na industria alimentaria, control biolóxico en torres de refrixeración, e branqueamento de téxtiles.[17] Como desinfectante é efectivo mesmo a concentracións baixas debido ás súas especiais propiedades.[9][15][17]
Branqueamento
[editar | editar a fonte]O dióxido de cloro utilízase ás veces para o branqueamento da polpa de madeira en combinación co cloro, pero utilízase só en secuencias de branquemento libres de cloro elemental (ECF). Utilízase a un pH moderadamente ácido (3,5 a 6). O uso de dióxido de cloro minimiza a cantidade de compostos organoclorados producidos.[18] O uso do dióxido de cloro (tecnoloxía libre de cloro) é actualmente o método máis importante de branqueamento en todo o mundo. Aproximadamente o 95% de toda a polpa kraft branqueada faise usando dióxido de cloro en secuencias de branqueamento libres de cloro.[19]
O dióxido de cloro utilizouse tamén para branquear fariña.[20]
Tratamento de augas
[editar | editar a fonte]O dióxido de cloro utilizouse para potabilizar auga por primeira vez na e planta de Niagara Falls, Nova York fen 1944 para destruír os "compostos fenólicos que producen sabor e olor".[15]:4-17[16] Foi introducido como desinfectante a longa escala en 1956, cando en Bruxelas, Bélxica, cambiaron o uso do cloro polo do dióxido de cloro.[16] É de uso común no tratamento da auga como preoxidante antes da cloración da auga potable para destruír as impurezas da auga natural que doutro modo produciría trihalometanos despois da exposición ao cloro libre.[21][22][23] Os trihalometanos son sunprodutos da desinfección sospeitosos de ser canceríxenos[24] asociados coa cloración de compostos orgánicos que aparecen naturalmente na auga natural.[23] O dióxido de cloro tamén produce un 70% menos de halometanos en presenza de materia orgánica natural comparado co producido cando se usa cloro ou lixivia.[25]
O dióxido de cloro é tamén superior ao cloro cando se funciona por riba do pH 7,[15]:4-33 en presenza de amoníaco e aminas,[26] e para o control de biofilmes nos sistemas de distribución de auga.[23] O dióxido de cloro utilízase en moitas aplicacións de tratamento de auga industrial como biocida, incluíndo torres de refrixeración, auga procesada e procesamento de alimentos.[27]
O dióxido de cloro é menos corrosivo que o cloro e mellor para o control da bacteria Legionella.[16][28] É superior a algúns outros métodos secundarios de desinfección da auga porque non o afecta negativamente o pH, non perde eficacia co tempo porque a bacteria non adquire resistencia a el), e non está afectado negtivamente polo silicio e os fosfatos, que son usados comunmente como inhibidores da corrosión pola auga potable.
É máis efectivo como desinfectante ca o cloro na maioría das circunstancias contra axentes patóxenos transportados pola auga, como os virus,[29] bacterias e protozoos, incluíndo os quistes de Giardia e os ooquistes de Cryptosporidium.[15]:4-20–4-21
O uso de dióxido de cloro no tratamento da auga causa a formación do subproduto clorito, que a Organización Mundial da Saúde aconsella estea limitado a un máximo de 1 parte por millón na auga potable,[25] que é o límite que hai en países como EUA.[15]:4-33[30]
Outros usos de desinfección
[editar | editar a fonte]O dióxido de cloro pode utilizarse como tratamento fumigante para "hixienizar" froitas como os arandos, framboesas e amorodos que desenvolven mofos e lévedos.[31]
O dióxido de cloro pode utilizarse para desinfectar carne de aves asperxéndoa ou mergullándoa despois do sacrificio do animal.[32]
O dióxido de cloro pode utilizarse para a desinfección de endoscopios.[33] Tamén está dispoñible nun trío consistente nunha previa pre-limpeza con surfactante e un exaugado posterior con auga desionizada e unha baixa concentración de antioxidante.[34]
Pode usarse para o control do mexillón cebra e mexillón quagga en tomas de auga.[15]:4-34
O dióxido de cloro é efectivo para a erradicación de chinches.[35]
Para a purificación da auga en campings, as tabletas de desinfección que conteñen dióxido de cloro son máis efectivas contra patóxenos que as que usan lixivia doméstica, pero adoitan ser máis caras.[36][37]
O dióxido de cloro ten moitas aplicacións como un oxidante e desinfectante,[9] para a desinfección do aire, edificios contra bacterias, mofos e en casos de desinfeccións en emerxencias e desastres.[38][39][40]
Durante a pandemia de COVID-19 nos Estados Unidos a EPA sacou unha lista de desinfectantes ambientais para superficies contra o coronavirus SARS-CoV-2,[41][42] algúns baseados no clorito de sodio que se activa xerando dióxido de cloro, e outros que conteñen hipoclorito de sodio, que teñen diferentes modos de acción química.
Utilízase tamén como oxidante para destruír fenois en correntes de auga residual e para o control de olores nos limpadores de aire de plantas de produtos animais.[15]:4-34 Tamén se usa como desodorizante para coches e barcos, en paquetes xeradores de dióxido de cloro que son activados pola auga e deixados no barco ou coche toda a noite.
Seguridade en auga e suplementos
[editar | editar a fonte]Perigos potenciais do dióxido de cloro son o envelenamento e o risco de ignición espontánea ou explosión en contacto con materiais inflamables.[43][44]
O dióxido de cloro é tóxico e son necesarios límites na exposición humana para asegurarse dun uso seguro. A EPA establecu un nivel máximo de 0,8 mg/L de dióxido de cloro en auga potable.[45] Estableceuse un límite de exposición permisible en 8 horas de 0,1 ppm no aire (0,3 mg/m3) para as persoas que traballan con dióxido de cloro.[46]
Pseudomedicina (MMS)
[editar | editar a fonte]- Artigo principal: Suplemento mineral milagroso.
O dióxido de cloro foi comercializado de forma fraudulenta e ilegal como unha cura inxerible dunha ampla variedade de enfermidades, incluíndo o autismo[47] e o coronavirus.[48][49][50] Os nenos que recibiron enemas de dióxido de cloro como suposta cura do autismo sufriron trastornos que puxeron en risco a súa vida.[47] A FDA afirmou que a inxestión ou outros usos internos do dióxido de cloro, que non sexan o uso como enxaugue a concentración diluída, non teñen beneficios para a saúde de ningún tipo e non se deberían utilizar internamente por ningunha razón.[51][52]
O 30 de xullo e o 1 de outubro de 2010 a FDA advertiu contra o uso do produto milagre pseudomedicinal MMS ("Miracle Mineral Supplement", Suplemento Mineral Milagroso), que contén clorito de sodio e que cando se prepara de acordo coas instrucións que se dan produce dióxido de cloro. O MMS foi comercializado como tratamento para unha gran variedade de condicións, incluíndo o VIH/SIDA, cancro, autismo, acne e, máis recentemente, a COVID-19. A FDA recibiu moitas queixas de persoas que informaron de reaccións que puxeron en risco a súa vida,[53] e houbo casos de mortes.[54] A FDA advertiu aos consumidores que o MMS pode causar serios problemas de saúde e que debido ao seu uso se rexistraron numerosos casos de náuseas, diarrea, graves vómitos e baixadas de presión arterial porencialmente mortais causados por deshidratación.[55][56] Esta advertencia foi repetida en 2019 e 2020, afirmando que a inxestión de MMS é tan perigosa como inxerir lixivia e urxindo aos consumidores a non utilizalo nin darllo aos seus fillos por ningunha razón, xa que non hai probas científicas que mostren que o dióxido de cloro teña ningunha propiedade medicamente beneficiosa.[57][52] En España o MMS está prohibido pola Axencia Española de Medicamentos e Produtos Sanitarios (AEMPS).
Notas
[editar | editar a fonte]- ↑ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 4–58. ISBN 978-1-43982077-3.
- ↑ "NIOSH Pocket Guide to Chemical Hazards #0116". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Dobson, Stuart; Cary, Richard; International Programme on Chemical Safety (2002). Chlorine dioxide (gas). World Health Organization. p. 4. hdl:10665/42421. Consultado o 17 de agosto de 2020.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 845. ISBN 978-0-08-037941-8.
- ↑ Brockway, L. O. (marzo de 1933). "The Three-Electron Bond in Chlorine Dioxide" (PDF). Proceedings of the National Academy of Sciences 19 (3): 303–307. Bibcode:1933PNAS...19..303B. PMC 1085967. PMID 16577512. doi:10.1073/pnas.19.3.303.
- ↑ 6,0 6,1 Linus Pauling (1988). General chemistry. Mineola, Nova York: Dover Publications. p. 264. ISBN 0-486-65622-5.
- ↑ Flesch, R.; Plenge, J.; Rühl, E. (2006). "Core-level excitation and fragmentation of chlorine dioxide". International Journal of Mass Spectrometry. 249-250: 68–76. Bibcode:2006IJMSp.249...68F. doi:10.1016/j.ijms.2005.12.046.
- ↑ "mp-23207: ClO2 (Orthorhombic, Pbca, 61)". Materials Project. Consultado o 2022-11-03.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 9,7 9,8 Vogt, H.; Balej, J.; Bennett, J. E.; Wintzer, P.; Sheikh, S. A.; Gallone, P.; Vasudevan, S.; Pelin, K. "Chlorine Oxides and Chlorine Oxygen Acids". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ↑ Aieta, E. Marco, and James D. Berg. "A Review of Chlorine Dioxide in Drinking Water Treatment." Journal (American Water Works Association) 78, no. 6 (1986): 62-72. Consultado o 24 de abril de 2021. http://www.jstor.org/stable/41273622
- ↑ Derby, R. I.; Hutchinson, W. S. (1953). Chlorine(IV) Oxide. Inorganic Syntheses 4. pp. 152–158. ISBN 978-0-470-13235-7. doi:10.1002/9780470132357.ch51.
- ↑ Ni, Y.; Wang, X. (1996). "Mechanism of the Methanol Based ClO2 Generation Process". International Pulp Bleaching Conference. TAPPI. pp. 454–462.
- ↑ 13,0 13,1 White, George W.; White, Geo Clifford (1999). The handbook of chlorination and alternative disinfectants (4ª ed.). Nova York: John Wiley. ISBN 0-471-29207-9.
- ↑ Swaddle, Thomas Wilson (1997). Inorganic Chemistry: An Industrial and Environmental Perspective. Academic Press. pp. 198–199. ISBN 0-12-678550-3.
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 15,6 15,7 Alternative Disinfectants and Oxidants Manual, chapter 4: Chlorine Dioxide (PDF). US Environmental Protection Agency: Office of Water. abril de 1999. Arquivado dende o orixinal (PDF) o 2015-09-05. Consultado o 2009-11-27.
- ↑ 16,0 16,1 16,2 16,3 Block, Seymour Stanton (2001). Disinfection, Sterilization, and Preservation (5th ed.). Lippincott, Williams & Wilkins. p. 215. ISBN 0-683-30740-1.
- ↑ 17,0 17,1 Simpson, Gregory Deward (2005). Practical Chlorine Dioxide (Volume 1 ed.). Colleyville, Texas: Greg D. Simpson & Associates. ISBN 0-9771985-0-2.
- ↑ Sjöström, E. (1993). Wood Chemistry: Fundamentals and Applications. Academic Press. ISBN 0-12-647480-X. OCLC 58509724.
- ↑ "AET – Reports – Science – Trends in World Bleached Chemical Pulp Production: 1990–2005". Arquivado dende o orixinal o 2017-07-30. Consultado o 2016-02-26.
- ↑ Harrel, C. G. (1952). "Maturing and Bleaching Agents in Producing Flour". Industrial & Engineering Chemistry 44 (1): 95–100. doi:10.1021/ie50505a030.
- ↑ Sorlini, S.; Collivignarelli, C. (2005). "Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters". Desalination 176 (1–3): 103–111. doi:10.1016/j.desal.2004.10.022.
- ↑ Li, J.; Yu, Z.; Gao, M. (1996). "A pilot study on trihalomethane formation in water treated by chlorine dioxide". Zhonghua Yufang Yixue Zazhi (Chinese Journal of Preventive Medicine) 30 (1): 10–13. PMID 8758861.
- ↑ 23,0 23,1 23,2 Volk, C. J.; Hofmann, R.; Chauret, C.; Gagnon, G. A.; Ranger, G.; Andrews, R. C. (2002). "Implementation of chlorine dioxide disinfection: Effects of the treatment change on drinking water quality in a full-scale distribution system". Journal of Environmental Engineering and Science 1 (5): 323–330. doi:10.1139/s02-026.
- ↑ Pereira, M. A.; Lin, L. H.; Lippitt, J. M.; Herren, S. L. (1982). "Trihalomethanes as initiators and promoters of carcinogenesis". Environmental Health Perspectives 46: 151–156. JSTOR 3429432. PMC 1569022. PMID 7151756. doi:10.2307/3429432.
- ↑ 25,0 25,1 "Guidelines for drinking-water quality, 4th edition, incorporating the 1st addendum" (en inglés). World Health Organization. Consultado o 2021-11-29.
- ↑ "Chlorine dioxide as a disinfectant". Lenntech. Consultado o 2021-11-25.
- ↑ Andrews, L.; Key, A.; Martin, R.; Grodner, R.; Park, D. (2002). "Chlorine dioxide wash of shrimp and crawfish an alternative to aqueous chlorine". Food Microbiology 19 (4): 261–267. doi:10.1006/fmic.2002.0493.
- ↑ Zhang, Zhe; McCann, Carole; Stout, Janet E.; Piesczynski, Steve; Hawks, Robert; Vidic, Radisav; Yu, Victor L. (2007). "Safety and Efficacy of Chlorine Dioxide for Legionella control in a Hospital Water System" (PDF). Infection Control and Hospital Epidemiology 28 (8): 1009–1012. PMID 17620253. doi:10.1086/518847. Arquivado dende o orixinal (PDF) o 2011-07-19. Consultado o 2009-11-27.
- ↑ Ogata, N.; Shibata, T. (xaneiro de 2008). "Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection". Journal of General Virology 89 (pt 1): 60–67. PMID 18089729. doi:10.1099/vir.0.83393-0.
- ↑ "Chlorine Dioxide & Chlorite | Public Health Statement | ATSDR". United States: Centers for Disease Control and Prevention. Consultado o 2021-11-25.
- ↑ O'Brian, D. (2017). "Chlorine Dioxide Pouches Can Make Produce Safer and Reduce Spoilage". AgResearch Magazine (USDA Agricultural Research Service) (xullo). Consultado o 2018-06-21.
- ↑ "The truth behind the chlorinated chicken panic". The Big Issue (en inglés). 2019-05-29. Consultado o 2020-02-05.
- ↑ Coates, D. (2001). "An evaluation of the use of chlorine dioxide (Tristel One-Shot) in an automated washer/disinfector (Medivator) fitted with a chlorine dioxide generator for decontamination of flexible endoscopes". Journal of Hospital Infection 48 (1): 55–65. PMID 11358471. doi:10.1053/jhin.2001.0956.
- ↑ "Tristel Wipes System Product Information" (PDF). Ethical Agents. Arquivado dende o orixinal (PDF) o 2016-04-15. Consultado o 2012-11-01.
- ↑ Gibbs, S. G.; Lowe, J. J.; Smith, P. W.; Hewlett, A. L. (2012). "Gaseous chlorine dioxide as an alternative for bedbug control". Infection Control & Hospital Epidemiology 33 (5): 495–9. PMID 22476276. doi:10.1086/665320.
- ↑ Langlois, Krista (March 13, 2018). "How to Treat Backcountry Water on the Cheap". Sierra. Sierra Club. Consultado o 2021-02-10.
- ↑ "A Guide to Drinking Water Treatment and Sanitation for Backcountry & Travel Use". United States: Centers for Disease Control and Prevention. 10 de abril de 2009. Consultado o 2021-02-10.
- ↑ Zhang, Y.-L.; Zheng, S.-Y.; Zhi, Q. (2007). "Air Disinfection with Chlorine Dioxide in Saps". Journal of Environment and Health 24 (4): 245–246.
- ↑ "Anthrax spore decontamination using chlorine dioxide". United States: Environmental Protection Agency. 2007. Consultado o 2009-11-27.
- ↑ Sy, Kaye V.; McWatters, Kay H.; Beuchat, Larry R. (2005). "Efficacy of Gaseous Chlorine Dioxide as a Sanitizer for Killing Salmonella, Yeasts, and Molds on Blueberries, Strawberries, and Raspberries". Journal of Food Protection (International Association for Food Protection) 68 (6): 1165–1175. PMID 15954703. doi:10.4315/0362-028x-68.6.1165.
- ↑ "How we know disinfectants should kill the COVID-19 coronavirus". Chemical & Engineering News (en inglés). Consultado o 2020-03-28.
- ↑ "List N: Disinfectants for Use Against SARS-CoV-2". Environmental Protection Agency (en inglés). United States. 2020-03-13. Consultado o 2020-03-28.
- ↑ "Toxicological Profile for Chlorine Dioxide and Chlorite" (PDF). Agency for Toxic Substances and Disease Registry, US HHS. Arquivado dende o orixinal (PDF) o 2019-06-14.
- ↑ López, María I.; Croce, Adela E.; Sicre, Juan E. (1994). "Explosive decomposition of gaseous chlorine dioxide". J. Chem. Soc., Faraday Trans. (en inglés) 90 (22): 3391–3396. ISSN 0956-5000. doi:10.1039/FT9949003391.
- ↑ "ATSDR: ToxFAQs™ for Chlorine Dioxide and Chlorite".
- ↑ "Occupational Safety and Health Guideline for Chlorine Dioxide". Arquivado dende o orixinal o 2012-12-04. Consultado o 2012-12-08.
- ↑ 47,0 47,1 "Parents are poisoning their children with bleach to 'cure' autism. These moms are trying to stop it.". NBC News (en inglés). Consultado o 2019-05-21.
- ↑ "Fake news: Chlorine dioxide won't stop coronavirus". Detroit News (en inglés). Consultado o 2020-04-03.
- ↑ Friedman, Lisa (2020-04-03). "E.P.A. Threatens Legal Action Against Sellers of Fake Coronavirus Cleaners". The New York Times (en inglés). ISSN 0362-4331. Consultado o 2020-04-03.
- ↑ Spencer, Sarnac Hale. "Those coronavirus 'cures' you're hearing about? They're fake. Don't drink chlorine dioxide.". USA TODAY (en inglés). Consultado o 2020-04-03.
- ↑ "Drinking bleach will not cure cancer or autism, FDA warns". NBC News (en inglés). Consultado o 2019-08-13.
- ↑ 52,0 52,1 "FDA warns consumers about the dangerous and potentially life threatening side effects of Miracle Mineral Solution" (en inglés). United States: Food and Drug Administration. 2019-08-12. Arquivado dende o orixinal o 2019-08-14. Consultado o 2019-08-16.
- ↑ Bartley, Lisa (2016-10-29). "Group of SoCal parents secretly try to cure kids with autism using bleach". ABC 7 News. ABC. Consultado o 2019-03-24.
- ↑ Ryan, Frances (2016-07-13). "The fake cures for autism that can prove deadly". The Guardian. Consultado o 2019-03-24.
- ↑ "Press Announcements – FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)". Food and Drug Administration. Arquivado dende o orixinal o 2017-01-12.
- ↑ "'Miracle' Treatment Turns into Potent Bleach". U.S. Food and Drug Administration. 2015-11-20. Arquivado dende o orixinal o 2017-11-01. Consultado o 2017-12-06.
- ↑ "FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)". United States: Food and Drug Administration. 2011-02-03. Arquivado dende o orixinal o 2011-02-03. Consultado o 2018-04-05.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Dióxido de cloro |


