Bicapa lipídica

Unha bicapa lipídica é unha membrana delgada feita de dúas capas de lípidos. Estas membranas son láminas planas que forman unha barreira continua e delimitan as células. A membrana plasmática de todos os organismos vivos e a membrana da envoltura de moitos virus está composta dunha bicapa lipídica, e tamén as membranas que rodean o núcleo celular e outras estruturas subcelulares, aínda que todas estas membranas conteñen tamén proteínas de membrana, que son fundamentais na súa función. A bicapa lipídica é a barreira que mantén a ións, proteínas e outras moléculas compartimentadas e lles impide a libre difusión. As bicapas lipídicas son ideais para este papel porque, aínda que son só duns poucos nm de espesor, son impermeables á maioría das moléculas solubles en auga (moléculas hidrófilas). As bicapas son especialmente impermeables aos ións, o que permite que as células regulen as concentracións de electrólitos e pH por medio do bombeo de ións a través das súas membranas usando proteínas chamadas bombas de ións.
Características[editar | editar a fonte]
As bicapas naturais están compostas na súa maioría de fosfolípidos, que teñen unha cabeza hidrófila e dúas colas hidrófobas. As substancias con esa característica chámanse anfipáticas. Cando os fosfolípidos entran en contacto coa auga, organízanse en dúas capas de moléculas (unha bicapa) con todas as colas orientadas cara ao interior da bicapa. O centro desta bicapa case non contén auga e tamén exclúe moléculas como os azucres ou os sales, que se disolven en auga pero non en solventes apolares. Esta organización é similar á coalescencia de pingas de aceite na auga e réxese pola mesma forza, chamada efecto hidrófobo. Debido a que as bicapas lipídicas son moi fráxiles e tan delgadas que son invisibles con microscopio óptico tradicional, son moi difíciles de estudar. Os experimentos con bicapas a miúdo requiren o uso de técnicas avanzadas, como a microscopía electrónica e a microscopía de forza atómica.
Fosfolípidos con determinados grupos de cabeza poden alterar a química da superficie dunha bicapa e poden, por exemplo, marcar unha célula para a súa destrución polo sistema inmune. As colas dos lípidos tamén poden afectar ás propiedades da membrana, como por exemplo a determinación da fase da bicapa. A bicapa pode adoptar unha fase sólida de xel a temperaturas máis baixas, sufrindo unha transición de fase ao estado líquido a unha temperatura máis alta. O empaquetamento dos lípidos dentro da bicapa tamén afecta ás súas propiedades mecánicas, incluíndo a súa resistencia ao estiramiento e flexión. Moitas destas propiedades foron estudadas co uso dun "modelo" artificial de bicapas producido en laboratorio. Modelos de vesículas formadas por bicapas (liposomas) tamén se teñen utilizado clinicamente para administrar drogas.
As bicapas adoitan incluír varios tipos de lípidos distintos dos fosfolípidos. Un exemplo particularmente importante é o colesterol, que axuda a fortalecer a bicapa e diminuír a súa permeabilidade. O colesterol tamén axuda a regular a actividade de certas proteínas integrais de membrana. As proteínas integrais de membrana son un tipo de proteínas que están activas cando se incorporan a unha bicapa lipídica. Debido a que as bicapas definen os límites da célula e os seus compoñentes, as proteínas de membrana participan nos procesos de comunicación e sinalización celular. Certos tipos de proteínas de membrana participan no proceso de fusión de dúas bicapas. Esta fusión permite a unión de dúas estruturas distintas, como na fecundación da célula ovo polos espermatozoides ou a entrada dun virus nunha célula.
A estrutura de bicapa lipídica da membrana celular axústase ao modelo de mosaico fluído de Singer e Nicolson (1972).
Nos lípidos presentes nas membranas biolóxicas, a cabeza hidrófila procede dun destes tres grupos:
- Glicolípidos, cuxas cabezas conteñen un oligosacárido que consta de 1 a 15 monosacáridos.
- Fosfolípidos, cuxas cabezas conteñen un grupo cargado positivamente que se enlaza á cola por un grupo fosfato cargado negativamente.
- Esteroides, cuxas cabezas conteñen un anel esteroide planar, por exemplo, o colesterol, exclusivo dos animais.

A bicapa lipídica pode formar:
- Dobres capas planas que non teñen límite en extensión.
- Membranas negras, unha bicapa lipídica sintética.
- Túbulos ou esferas ocas.
Estrutura e organización[editar | editar a fonte]
Unha bicapa lipídica é unha estrutura laminar lipídica de dúas moléculas lipídicas de grosor, dispostas de tal xeito que as súas cabezas fosfato hidrófilas queden orientadas cara ao exterior, onde está a solución acuosa que rodea a membrana por ambas as caras, e as colas hidrófobas dos lípidos queden orientadas cara ao interior da membrana, fóra do contacto coa auga. Esta disposición orixina dúas capas cada unha dunha soa molécula de grosor. Os lípidos autoensámblanse dentro desta estrutura debido ao efecto hidrófobo, que crea unha interacción enerxeticamente desfavorable entre as colas hidrófobas dos lípidos e a auga que os rodea. Así, pode dicirse que unha bicapa lipídica mantense unida só por forzas non covalentes que non implican a formación de enlaces químicos entre as moléculas individuais.
Hai algunhas semellanzas entre esta estrutura e unha burbulla de xabón corrente, pero tamén importantes diferenzas. Ambas as estruturas implican a dúas capas dunha soa molécula de grosor dunha substancia anfipática. No caso da burbulla de xabón, as dúas monocapas de xabón cobren unha capa de auga intercalada. As cabezas hidrófilas están orientadas cara a auga intercalada, entanto que as colas hidrófobas apuntan ao aire de dentro e de fóra da burbulla, é dicir, partes hidrófobas por fóra da bicapa e hidrófilas por dentro da mesma. No caso dunha bicapa lipídica, esta estrutura está invertida coas cabezas por fóra da bicapa e as colas hidrófobas no centro e non hai auga interclada dentro da bicapa. Outra importante diferenza entre ambas as dúas é o seu tamaño relativo. As burbullas de xabón teñen normalmente centos de nanómetros de grosor, que é a mesma orde de tamaño ca a lonxitude de onda da luz, o cal explica por que os efectos de interferencia lumínica causan a aparición das cores do arco da vella na superficie da burbulla. Unha bicapa lipídica, polo contrario, ten arredor de cinco nanómetros de grosor, moito menor ca a lonxitude de onda da luz e, xa que logo, é invisible a simple vista, e mesmo cun microscopio óptico normal.

Análise dunha sección de bicapa[editar | editar a fonte]
A bicapa lipídica é moi fina comparada coas súas dimensións lonxitudinais. Se ampliásemos unha célula típica de mamífero (cun diámetro celular de ~10 micrometros) ata o tamaño dunha sandía (30 cm), a bicapa lipídica que constitúe a súa membrana plasmática tería o grosor dunha folla de papel. Malia os seus poucos nanómetros de grosor, a bicapa lipídica consta de varias rexións quimicamente distintas vista en sección. Estas rexión foron caracterizadas usando reflectometría de raios X,[1] dispersión de neutróns[2] e resonancia magnética nuclear.
A primeira rexión a cada lado da bicapa é a zona das cabezas con grupos hidrófilos. Esta porción da membrana está completamente hidratada e adoita ter un grosor de arredor de 0,8-0,9 nm. Nas bicapas de fosfolípidos o grupo fosfato localízase nesta rexión hidratada, separada aproximadamente 0,5 nm da rexión central hidrófoba.[3] Nalgúns casos, a rexión hidratada pode estenderse moito máis, por exemplo en lípidos con longas cadeas proteicas ou de azucres unidas á súa cabeza. Un exemplo común de tal modificación é a cuberta de lipopolisacárido da membrana externa das bacterias,[4] que axuda a reter unha capa de auga arredor da bacteria, impediando a súa deshidratación.

A continuación da rexión hidratada hai unha zona intermedia que está só parcialmente hidratada. Esta capa límite ten aproximadamente 0.3 nm de grosor. Nesta pequena rexión a concentración de auga baixa progresivamente de 2M (que era a que había na rexión das cabezas hidrófilas) a practicamente cero na zona central das colas hidrófobas.[5][6] A rexión central hidrófoba da bicapa ten uns 3-4 nm de grosor, pero este valor varía dependendo da lonxitude e propiedades químicas das cadeas das colas.[1][7] O grosor desta rexión central tamén varía significativamente coa temperatura, particularmente preto da transición de fase (fusión).[8]
Asimetría[editar | editar a fonte]
En moitas membranas naturais a composición das capas externa e interna da bicapa son diferentes. Nos eritrocitos humanos a capa interna (citoplasmática) está composta en grande medida de fosfatidiletanolamina, fosfatidilserina e fosfatidilinositol e os seus fosfolípidos derivados. Polo contrario, a capa externa (extracelular) ten unha composición baseada na fosfatidilcolina, esfingomielina e unha variedade de glicolípidos,[9][10] Nalgúns casos esta asimetría depende do lugar onde se forman os distintos lípidos na célula e reflicte a súa orientación inicial.[11] As funcións biolóxicas desta asimetría dos lípidos non se coñecen ben, mais está claro que son importantes en varias situacións. Por exemplo, cando a célula sofre apoptose, a fosfatidilserina (normalmente situada na capa citoplasmática) transfírese á capa externa: alí é recoñecida polos macrófagos, que fagocitan activamente a célula moribunda.
Esta asimetría dos lípidos orixínase, polo menos en parte, no feito de que a maioría dos fosfolípidos son sintetizados e inicialmente inseridos na monocapa interna. Os que formarán a monocapa externa son despois transportados alí por unha tipo de encimas chamados flipases.[12][13] Outros lípidos, como as esfingomielinas, parecen sintetizarse na capa externa. As flipases son membros dunha ampla familia de moléculas transportadoras de lípidos que tamén inclúe as flopases, que transfiren lípidos na dirección oposta, e scramblases (~"mesturases"), que mesturan e fan aleatoria a distribución de lípidos a través das dúas capas (como sucede en células apoptóticas). En calquera caso, unha vez que queda establecida a asimetría dos lípidos esta non se disipa rapidamente porque o movemento espontáneo de cambio de capa ou flip-flop dos lípidos é extremadamente lento.[14]
É posible imitar esta asimetría das membranas naturais no laboratorio en sistemas de bicapas modelo. Certos tipos de vesículas artificiais moi pequenas fanse automaticamente elas mesmas un pouco asimétricas, aínda que o mecanismo polo cal se xera esta asimetría é moi diferente ao observado nas células.[15] Utilizando dúas monocapas diferentes na técnica de deposición Langmuir-Blodgett[16] ou unha combinación de deposición Langmuir-Blodgett e rotura de vesículas[17] é tamén posible sintetizar unha bicapa planar asimétrica. Esta asimetría pode perderse co tempo a medida que os lípidos destas bicapas tenden a realizar movementos flip-flop.[18]
Fases e transicións de fase[editar | editar a fonte]
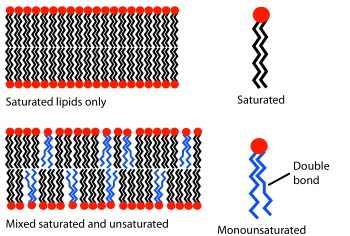
A unha temperatura dada unha bicapa lipídica pode atoparse tanto en estado líquido coma en forma de xel (fase sólida). Todos os lípidos teñen unha temperatura característica á cal fan a transición (funden) de xel á fase líquida. En ambas as fases as moléculas lipídicas teñen un impedimento para facer movementos de flip-flop (cambio de capa) a través da membrana, pero na fase líquida unha molécula de lípido da bicapa pode cambiar a súa posición coa súa veciña (dentro da mesma capa) millóns de veces por segundo. Este movemento aleatorio permite aos lípidos difundir e vagar a través da superficie da membrana.[19] A diferenza das bicapas en fase líquida, os lípidos na fase de xel están localizados nun sitio fixo.
O comportamento de fase das bicapas lipídicas está en grande medida determinado pola forza das interaccións de Van der Waals entre moléculas de lípidos adxacentes. Os lípidos de cadeas hidrocarbonadas máis longas teñen máis área na cal interaccionar, incrementando a forza da interacción e en consecuencia diminuíndo a mobilidade dos lípidos. Así, a unha temperatura dada, un lípido de cola curta será máis fluído ca outro idéntico pero de cola máis longa.[7] A temperatura de transición (ou fusión) pode tamén verse afectada polo grao de insaturación das colas dos lípidos. A insaturación por un dobre enlace pode producir un dobramento na cadea hidrocarbonada, que distorsiona o empaquetamento dos lípidos. Esta distorsión crea un espazo libre extra entre os lípidos que permite ás colas unha flexibilidade adicional.[7] Un exemplo deste efecto pode ser a manteiga, que ten unha grande porcentaxe de graxas saturadas, e é sólida a temperaturas moderadas, entanto que o aceite vexetal, que é principalmente insaturado, a esa mesma temperatura é líquido.
A maioría das membranas naturais son unha complexa mestura de diferentes lípidos (e de proteínas). Se a unha determinada temperatura algún dos compoñentes está líquido e outros están en fase de xel, as dúas fases poden coexistir en rexións espacialmente separadas, como icebergs flotando no océano. Esta separación de fases xoga un papel crítico nos fenómenos bioquímicos porque compoñentes da membrana como as proteínas poden particionarse nunha fase ou na outra,[20] e así poden ser concentradas localmente ou activadas. Un compoñente particularmente importante de moitos sistemas de fases mesturadas é o colesterol, que modula a permeabilidade da bicapa, a súa forza mecánica e as interaccións bioquímicas.
A química de superficie[editar | editar a fonte]
Se as colas dos lípidos son as que principalmente modulan o comportamento de fase da bicapa, son as cabezas hidrófilas as que determinan a química da superficie da bicapa. A maioría das bicapas naturais están compostas principalmente de fosfolípidos con glicerina, aínda que son tamén compoñentes importantes os esfingolípidos como as esfingomielinas e os esterois como o colesterol. Nos fosfolípidos, o grupo de cabeza máis común é a colina, polo que o fosfolípido fosfatidilcolina chega a supoñer arredor da metade de todos os fosfolípidos na maioría das células de mamíferos.[21] A fosfatidilcolina compórtase como un composto zwitteriónico, xa que ten unha carga negativa no grupo fosfato e positiva no grupo amino da colina, pero, malia estas cargas locais, o balance global é que non ten unha carga neta.
Tamén están presentes lípidos con outras cabezas polares en diversas proporcións, entre eles a fosfatidilserina, fosfatidiletanolamina e fosftidilglicerol. Estas moléculas danlle a miúdo funcionalidade biolóxica especial ás bicapas, que depende moito do contexto. Por exemplo, a presenza de fosfatidilserina na cara extracelular da membrana dos eritrocitos e un sinal para a apoptose da célula,[22] e a fosfatilserina en vesículas nas placas epifisarias de crecemento é necesaria para a nucleación de cristais de hidroxiapatito durante a mineralización dos ósos.[23][24] A diferenza da fosfatidilcolina, outros lípidos teñen unha carga neta, o que pode alterar as interaccións electrostáticas de pequenas moléculas coa bicapa.[25]
Funcións biolóxicas[editar | editar a fonte]
Contención e separación[editar | editar a fonte]
A principal función biolóxica da bicapa lipídica é separar determinados compartimentos de contido acuoso do que os rodea. Se non existise algunha forma de barreira que delimitase o que é unha célula e o que é o exterior, sería mesmo difícil definir o concepto de organismo vivo. Esta barreira é a bicapa lipídica en todas as formas de vida coñecidas agás nunhas poucas especies de arqueas, que utilizan unha monocapa lipídica especialmente adaptada.[4] Mesmo se ten proposto que as primeiras formas de vida puideron ser unha simple vesícula lipídica con inicialmente unha soa capacidade biosintética: a produción de máis fosfolípidos para a bicapa.[26] A capacidade de separar da bicapa lipídica está baseada no feito de que as moléculas hidrófilas non poden cruzar facilmente o centro hidrófobo da bicapa, como se discute máis abaixo no apartado "Transporte a través da bicapa".
Os procariotas teñen só unha bicapa lipídica, a membrana plasmática. Moitos procariotas teñen tamén unha parede celular, pero a parede celular está composta de longas cadeas de carbohidratos ou de proteínas, non de lípidos. Polo contrario, os eucariotas teñen un conxunto de orgánulos rodeados de bicapas lipídicas, como o núcleo celular, mitocondrias, lisosomas aparato de Golgi, retículo endoplasmático, peroxisomas e outras vesículas. Todos estes compartimentos subcelulares están rodeados por unha ou máis bicapas lipídicas e, xuntos, suman a maior parte da superficie das bicapas lipídicas da célula. Nos hepatocitos do fígado por exemplo, a membrana plasmática supón só o 2% do total da superficie de bicapas da célula, mentres que o seu retículo endoplasmático contén máis do 50% e as mitocondrias un 30%.[27]

Sinalización[editar | editar a fonte]
Probablemente a forma máis coñecida de sinalización ou comunicación celular é a transmisión sináptica, por medio da cal un impulso nervioso que acadase o extremo do axón dunha neurona transmítese á neurona adxacente por medio da liberación de neurotransmisores. Esta transmisión faise posible pola acción de vesículas sinápticas cargadas con neurotransmisores que serán liberados. Estas vesículas fusiónanse coa membrana celular no terminal presináptico da primeira neurona e ceiban o seu contido no exterior da célula. O contido difunde a través do espazo sináptico e chega ao terminal postsináptico da seguinte neurona.
As bicapas lipídicas están tamén implicadas na transdución de sinais xa que son o lugar onde están inseridas as proteínas integrais de membrana. Estas proteínas constitúen unha clase de moléculas moi variada e importante. Estímase que ata un terzo do proteoma humano pode estar formado por proteínas de membrana.[28] Algunhas destas proteínas están ligadas ao exterior da membrana celular. Un exemplo é a proteína CD59, que identifica as células “propias” e inhibe a súa destrución polo sistema inmune. O virus VIH evita a acción do sistema inmunitario en parte ao inserir estas proteínas da membrana da célula hóspede na súa propia membrana superficial.[27] Outras proteínas están situadas na bicapa atravesando todo o seu grosor (proteínas transmembrana) e serven para retransmitir certos sinais desde o exterior ao interior da célula. O tipo máis común destas proteínas é o receptor acoplado á proteína G (GPCR). Os GPCRs son responsables da maior parte da capacidade celular de percibir o seu medio externo e, debido á súa importante función, aproximadamente o 40% de todos os medicamentos modernos están dirixidos aos GPCRs.[29]
Ademais de procesos mediados por proteínas e disolucións, as bicapas lipídicas poden tamén participar directamente na sinalización celular. Un clásico exemplo disto é a fagocitose activada por fosfatidilserina. Normalmente, a fosfatidilserina está distribuída asimetricamente na membrana da célula e está presente só na cara citoplasmática. Durante a morte celular programada unha proteína chamada scramblase equilibra esta distribución, dispoñendo fosfatidilserina na cara extracelular da bicapa. A presenza de fosfatidilserina desencadea entón a fagocitose que eliminará as células mortas ou moribundas.
Métodos de caracterización[editar | editar a fonte]

A bicapa lipídica é unha estrutura bastante complicada de estudar porque é moi delgada e fráxil. Malia estas limitacións nos últimos setenta anos téñense desenvolvido ducias de técnicas que permitiron investigar a súa estrutura e función.
As medicións eléctricas son unha forma directa de caracterizar unha importante función da membrana: a súa capacidade de separar e impedir o fluxo de ións en disolución. Aplicando unha voltaxe a través da bicapa e medindo a corrente resultante, pode determnarse a resistencia eléctrica da bicapa, que é relativamente alta (108ohm*cm2 de resistencia en bicapas lipídicas puras[30]), xa que a parte central hidrófoba é impermeable a substancias cargadas. A presenza de furados na bicapa de só uns poucos nanómetros causa un importante incremento da corrente eléctrica.[31] A sensibilidade do sistema é tal que mesmo se pode determinar a actividade dunha soa canle iónica.[32]
As medidas eléctricas non nos proporcionan unha imaxe real do que pasa na membrana como o faría unha imaxe de microscopía. As bicapas lipídicas non poden verse nun microscopio convencional porque son moi finas, e hai que utilizar o microscopio de fluorescencia. Nestas técnicas a mostra é excitada cunha luz dunha lonxitude de onda determinada, que causa fluorescencia na mostra (luz de maior lonxitude de onda), que é observada co microscopio despois de pasar por unha serie de filtros. As bicapas lipídicas naturais non son fluorescentes, de modo que hai que usar unha tinguidura que se una ás moléculas que se desexe da bicapa. A resolución está normalmente limitada a uns poucos centos de nanómetros, que é moito menos ca o tamaño dunha célula pero moito maior ca o grosor da bicapa.


O microscopio electrónico proporciona imaxes de maior resolución. No microscopio electrónico, en lugar de fotóns (luz) focalízase sobre a mostra un feixe de electróns. Ás imaxes clásicas obtidas con tinguidura de tetróxido de osmio, que mostraban tres bandas nas membranas, dúas escuras e no medio unha clara, que se correspondían coas zonas hidrófilas e hidrófobas da membrana, seguironlles outras probas máis sofisticadas. Usando o microscopio electrónico xunto con técnicas de conxelación (criofractura), poden estudarse os mecanismsmos do transporte inter- e intracelular, por exemplo para demostrar que as vesículas de exocitose son o modo en que se liberan os neurotransmisores nas sinapses.[34]
Tamén se usa moito a espectroscopía 31P-NMR (resonancia magnética nuclear) en estudos das bicapas de fosfolípidos preparadas e das membranas biolóxicas en condicións naturais. A análise[35] do espectro 31P-NMR dos lípidos pode dar moita información sobre o empaquetamento da bicapa lipídica, as transicións de fase, a orientación e dinámica dos grupos de cabeza polar dos lípidos, e as propiedades elásticas de bicapas lipídicas puras ou o seu comportamento como resultado da unión de proteínas e outras biomoléculas.
Ademais, un experimento específico H-N...(O)-P (transición por axuste escalar 3JH-P~5 Hz) pode fornecer información directa sobre a formación de pontes de hidróxeno entre os protóns dos grupos amido proteicos e o fosfato das partes polares dos lipidos, o que é moi útil en estudos das interaccións proteína/membrana.
Un novo método de estudo das bicapas lipídicas é a microscopía de forza atómica. Nesta técnica non se usa luz nin electróns senón unha sonda de silicio cunha agulla moi pequena e afiada que varre a superficie facendo contacto físico coa bicapa e movéndose sobre ela, de modo semellante ao que que faría unha agulla dun tocadiscos. A microscopía de forza atómica é unha técnica moi prometedora porque ten a potencialidade de obter imaxes cunha resolución de nanómetros a temperaturas ambientais moderadas e mesmo baixo a auga ou tampón fisiolóxico, condicións necesarias para estudar o comportamento natural das bicapas. Utilizando esta capacidade, a microscopía de forza atómica tense usado para examinar o comportamento dinámico das membranas incluíndo a formación de poros transmembrana[33] e transicións de fase en bicapas de laboratorio.[36] Outra vantaxe é que esta técnica non require a marcaxe fluorescente ou isotópica dos lípidos, xa que a punta da sonda interacciona mecanicamente coa superficie da bicapa. Grazas a iso, o mesmo varrido pode obter imaxes tanto dos lípidos coma das proteínas asociadas a eles, ás veces mesmo cunha resolución dunha soa molécula.[33][37] Esta microscopía pode tamén explorar a natureza mecánica das bicapas lipídicas.[38]
As bicapas lipídicas mostran unha alta birrefrinxencia, xa que o índice de refracción no plano da bicapa difire do que presenta o plano perpendicular en 0,1 unidades de índice de refracción. Isto usouse para caracterizar o grao de orde e distorsión nas bicapas usando interferometría de polarización dual para comprender así os mecanismos das interaccións das proteínas.
Transporte a través da bicapa[editar | editar a fonte]
Difusión pasiva[editar | editar a fonte]
A maioría das moléculas polares teñen unha solubilidade baixa na zona central hidrocarbonada da bicapa lipídica e en consecuencia teñen baixos coeficientes de permeabilidade a través da bicapa. Este efecto é particularmente pronunciado no caso das moléculas cargadas, que teñen coeficientes de permeabilidade aínda máis baixos ca as polares neutras.[39] Os anións normalmente teñen un grao de difusión a través das bicapas moito maior cós catións.[40][41] Comparados coas moléculas iónicas, as moléculas de auga en realidade teñen unha permeabilidade a través da membrana relativamente grande, o que se pon en evidencia no fenómeno do inchamento da célula por osmose. Cando unha célula ou unha vesícula cunha concentración de sales alta no seu interior se encontra no seo dunha disolución con concentracións baixas de sales, a auga penetrará na célula por osmose e a célula incha e mesmo pode chegar a rebentar. Este resultado non se daría se a auga non puidese pasar a través da bicapa lipídica con relativa facilidade. A anómala alta permeabilidade relativa da auga a través da bicapa aínda non se comprende por completo e continúa sendo obxecto de activo debate.[42] As moléculas non cargadas apolares difunden a través das bicapas lipídicas considerablemente máis rápido ca as moléculas de auga. Isto pode aplicarse tanto a graxas coma a disolventes orgánicos como o cloroformo e éter. Sen termos en conta o seu carácter polar, o tamaño da molécula tamén inflúe, xa que as moléculas grandes difunden a través da bicapa máis lentamente ca as pequenas.[43]
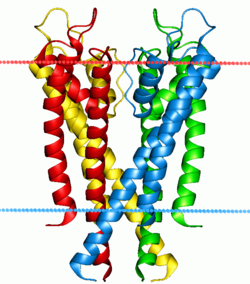
Bombas iónicas e canles[editar | editar a fonte]
Existen dúas clases de proteínas que controlan os gradientes iónicos observados a través das membranas celulares e subcelulares naturais, que son: canles iónicas e bombas iónicas. Tanto as bombas coma as canles son proteínas integrais de membrana que atravesan todo o grosor da bicapa, pero as súas funcións son bastante diferentes. As bombas iónicas son proteínas que crean e manteñen os gradientes químicos utilizando unha fonte de enerxía externa para mover os ións en contra dos gradientes de concentración pasándoos a unha zona con potencial químico máis alto. A fonte de enerxía pode ser ATP, como é o caso da ATPase de Na+-K+ ou bomba de Na+-K+. Alternativamente, a fonte de exerxía pode ser outro gradiente químico xa existente, como sucede no caso do antitransportador de Ca2+/Na+ , que intercambia eses dous ións. Grazas á acción das bombas de ións a célula pode regular o pH por medio do bombeo de protóns.
A diferenza das bombas de ións, as canles iónicas non crean gradientes químicos senón que máis ben os disipan para realizar un traballo ou enviar un sinal. Probablemente o exemplo máis coñecido e estudado é a canle de Na+ regulada por voltaxe, que permite a condución dun potencial de acción ao longo das neuronas. Todas as canles de ións teñen algún tipo de disparador ou mecanismo de “apertura”. No exemplo anterior era unha voltaxe de polarización, pero outras canles poden activarse pola unión de ligandos ou por medio dun cambio conformacional doutra proteína próxima.[44]

Endocitose e exocitose[editar | editar a fonte]
- Artigos principais: Endocitose e Exocitose.
Algunhas moléculas ou partículas son demasiado grandes ou demasiado hidrófilas para conseguiren pasar a través da bicapa lipídica. Outras moléculas poden pasar a través da bicapa pero deben facelo rapidamente e en tan gran cantidade que o seu transporte por canles é inviable. En ambos os casos este tipo de moléculas poden ser transportadas a través da membrana celular por medio da fusión ou evaxinación de vesículas. Cando se orixina unha vesícula no interior da célula e fusiónase coa membrana plasmática para liberar o seu contido no espazo extracelular, falamos de exocitose. O proceso inverso chámase endocitose e consiste en que unha rexión da membrana plasmática se invaxina e finalmente despréndese cara ao interior da célula, levando no seu interior unha porción do fluído extracelular para transportalo ao interior da célula. A endocitose e a exocitose dependen para o seu funcionamento de maquinarias celulares moi diferentes, pero os dous procesos están intimamente ligados e non poderían funcionar un sen o outro. O mecanismo primario desta interdependencia e o volume total de material lipídico implicado.[45] Nunha célula típica intervén no ciclo de endocitose/exocitose unha área de bicapa equivalente ao total da membrana plasmática en só media hora.[46] Se estes dous procesos non están equilibrados a célula ou incharía ata un incrible tamaño ou perdería completamente a súa membrana plasmática en cuestión de minutos.
Electroporación[editar | editar a fonte]
A electroporación é o rápido incremento da permeabilidade da bicapa inducido pola aplicación dun forte campo eléctrico artificial a través da membrana. Experimentalmente, úsase a electroporación para introducir nas células moléculas hidrófilas. É unha técnica especialmente útil para introducir na célula moléculas grandes e moi cargadas como o ADN, que nunca podería difundir pasivamente a través da zona central hidrófoba da bicapa lipídica.[47] Por esta razón, a electroporación é un dos métodos básicos para a transfección (introdución artificial de ADN na célula) e para a transformación bacteriana. Propúxose tamén que a electroporación resultante das tormentas de lóstregos podería ser un mecanismo natural para a transferencia de xenes dunha especie a outra (ou transferencia horizontal de xenes).[48]
Este incremento de permeabilidade afecta principalmente ao transporte de ións e doutras especies químicas hidratadas, o que indica que o seu mecanismo de acción é a creación na membrana de orificios cheos de auga de escala nanométrica. Aínda que tanto a electroporación coma a rotura dieléctrica (perda de resistencia do material illante) orixínanse ambas pola aplicación de campos eléctricos, os mecanismos implicados son moi diferentes. Na rotura dieléctrica o material que fai de barreira é inonizado, creando unha vía condutiva. A alteración do material é neste caso de natureza química. Polo contrario, durante a electroporación as moléculas lipídicas non son alteradas quimicamente senón que simplemente cambian de posición, abrindo un poro que actúa como a vía de condución a través da bicapa a medida que se vai enchendo de auga.
Mecánica das bicapas[editar | editar a fonte]

As bicapas lipídicas son estruturas grandes dabondo como para mostrar algunhas das propiedades mecánicas dos líquidos e os sólidos. O módulo de compresión de área Ka, o módulo de flexión Kb, e a enerxía de bordo , poden usarse para describilas. As bicapas lipídicas sólidas tamén teñen un módulo de cizalladura ou rixidez, pero como para calquera líquido, este módulo é cero para bicapas líquidas. Estas propiedades mecánicas afectan ao funcionamento das membranas. Ka e Kb afectan á capacidade das proteínas e das pequenas moléculas de inserirse na bicapa,[49][50] e sábese que as propiedades mecánicas da bicapa alteran o funcionamento das canles iónicas activadas mecanicamente.[51] As propiedades mecánicas das bicapas tamén determinan que tipos de estrés pode soportar a célula sen rachar. Aínda que as bicapas poden dobrarse facilmente, a maioría non se poden estirar máis dunha pequena porcentaxe sen romperen.[52]
Como se comentou no apartado de "estrutura e organización", a forza principal que mantén cohesionadas as bicapas é a repulsión hidrófoba entre as colas hidrocarbonadas dos lípidos e a auga. Así, o módulo elástico da bicapa está determinado esencialmente pola área extra que queda exposta á auga cando estiramos e separamos os lípidos.[53] Non debe estrañar tendo en conta as forzas implicadas que os estudos realizados mostrasen que Ka varía moito segundo as condicións da disolución[54] pero só un pouco ao variaren a lonxitude e insaturación das colas lipídicas.[7] Como as forzas implicadas son tan pequenas, é difícil determinar experimentalmente Ka. A maioría das probas requiren usar sofisticadas técnicas de microscopía e un equipamento de medición moi sensible.[38][55]
A diferenza do Ka, que é unha medida de canta enerxía se necesita para estirar a bicapa, Kb mide canta enerxía se precisa para dobrala ou flexionala. Formalmente, o módulo de flexión defínese como a enerxía requirida para deformar unha membrana desde a súa curvatura intrínseca a outra curvatura. A curvatura intrínseca defínese pola razón do diámetro do grupo de cabeza do lípido con respecto do grupo de cola. Para un lípido con dúas colas hidrocarbonadas como a fosfatidilcolina, esta razón é de case 1, polo que a curvatura intrínseca é case 0. Se un determinado lípido ten na súa curvatura intrínseca unha desviación grande de cero, non formará unha bicapa, e en lugar diso formará outras fases como micelas ou micelas invertidas. Tipicamente, Kb non se mide experimentalmente senón que se calcula a partir de medicións de Ka e do grosor da bicapa, xa que os tres parámetros están relacionados.
é unha medida da enerxía necesaria para expoñer o bordo da bicapa á auga ao rachar a bicapa ou crearlle un buraco. A orixe desta enerxía é o feito de que ao crear ese tipo de interface quedan expostas á auga algunhas das colas lipídicas, pero a orientación exacta dos lípidos deste límite non se coñece. Hai algunhas evidencias de que poden coexistir tanto poros hidrófobos (colas rectas) coma hidrófilos (cabezas curvadas).[56]
Fusión[editar | editar a fonte]

A fusión de bicapas lipídicas é o proceso polo cal dúas bicapas se unen formando unha estrutura única conectada. Se esta fusión ten lugar de forma completa entre as dúas capas da bicapa, fórmase unha ponte chea de auga e mestúranse as solucións contidas nos dous compartimentos das bicapas. Outra posible alternativa dáse se só intervén na fusión unha das capas de cada bicapa; nese caso fálase de hemifusión. A fusión está implicada en moitos procesos celulares, especialmente en eucariotas, xa que as células eucariotas están moi subdivididas en compartimentos por membranas de bicapas. A exocitose, a fertilización dos ovos polo espermatozoide e o transporte de produtos residuais ao lisosoma son só algúns dos moitos procesos eucarióticos que dependen desta fusión. Mesmo a entrada de patóxenos pode estar determinada pola fusión, pois moitos virus con cubertas membranosas de bicapa especializaron certas proteínas de fusión situadas na súa superficie para conseguir entrar na célula hóspede.
No proceso de fusión hai catro pasos fundamentais.[21] Primeiro, as membranas implicadas no proceso deben achegarse, aproximarse unha a outra ata só uns poucos nanómetros. Segundo, as dúas bicapas deben poñerse en estreito contacto (a só uns poucos ángstroms). Para conseguir este contacto, as dúas superficies deben deshidratarse polo menos parcialmente, xa que a auga unida á superficie que normalmente presentan as bicapas fai que as bicapas se repelan enerxicamente. A presenza de ións, especialmente de catións divalentes como os ións magnesio e calcio, afecta moito a esta fase do proceso.[57][58] Unha das funcións básicas do calcio no organismo é regular a fusión das membranas. Terceiro, debe orixinarse unha desestabilización nalgún punto entre as dúas bicapas en fusión, que distorsione localmente as súas estruturas. A natureza exacta desta distorsión non se coñece. Unha teoría é que se deben formar unha especie de protrusións (stalks) moi curvadas entre as dúas bicapas.[59] Os partidarios desta teoría pensan que isto explicaría por que a fosfatidiletanolamina, un lípido moi curvado, facilita a fusión.[60] Finalmente, na última fase da fusión, este punto distorsionado crece e os compoñentes das dúas bicapas mestúranse e difunden desde o sitio de contacto.
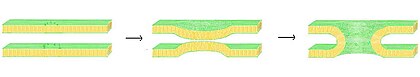

A situación é máis complicada na fusión in vivo porque a fusión biolóxica está case sempre regulada pola acción de proteínas asociadas á membrana. As primeiras destas proteínas en seren estudadas foron as proteínas virais de fusión, que permiten aos virus con envoltura inserir o seu material xenético na célula hóspede (os virus con envoltura están rodeados por unha bicapa lipídica; outros só teñen unha cuberta proteica). As células eucarióticas tamén presentan proteínas de fusión, as mellor estudadas das cales son as proteínas SNARE. As proteínas SNARE úsanse para dirixir todo o tráfico intracelular de vesículas. A pesar dos anos que se levan estudando, aínda se descoñece moito sobre as funcións desta clase de proteínas. De feito, hai aínda un activo debate sobre se as SNARE están relacionadas coa fixación inicial da vesícula á membrana ou participan máis tarde no proceso de fusión facilitando a hemifusión.[61]
Nos estudos de bioloxía molecular e cellular é a miúdo preferible inducir artificialmente a fusión. A adición de polietilenglicol causa a fusión sen que se produza unha agregación significativa ou distorsión bioquímica. Este procedemento úsase hoxe continuamente, por exemplo para fusionar linfocitos B con células de melanoma.[62] O “hibridoma” resultante desta combinación expresa un anticorpo desexado determinado pola célula B, pero este queda "inmortalizado" pola célula de melanoma fusionada. A fusión tamén se pode inducir artificialmente por electroporación nun proceso chamado electrofusión. Crese que este fenómeno débese aos bordos enerxeticamente activos formados na membrana durante a electroporación, que poden actuar como os puntos locais de distorsión para nuclear o crecemento da protrusión entre as dúas bicapas.[63]
Sistemas modelo[editar | editar a fonte]
- Artigo principal: Bicapas lipídicas modelo.
As membranas lipídicas poden crearse artificialmente no laboratorio para facilitar aos investigadores a realización de experimentos que non son factibles con bicapas naturais. Estes sistemas sintéticos chámanse bicapas lipídicas modelo. Hai moitos tipos deferentes de bicapas modelo, e cada unha ten as súas vantaxes e desvantaxes experimentais. Poden elaborarse tanto con lípidos sintéticos coma naturais. Entre os sistemas modelo máis comúns están:
- Membranas negras. Son membranas creadas en orificios practicados nunha superficie de teflón, que cando se observan son escuras á luz reflectida.
- Membranas lipídicas apoiadas en soportes. Apoian sobre un substrato ríxido e só teñen unha cara exposta ao medio.
- Membranas de bicapa fixadas. Nestas membranas os lípidos (tiolípidos) son fixados quimicamente a un soporte sólido de ouro.
- Vesículas.
Aplicacións comerciais[editar | editar a fonte]
Ata hoxe, a aplicación comercial máis exitosa das bicapas lipídicas foi o uso de liposomas para a administración de medicamentos, especialmente no tratamento do cáncer. Os liposomas son unha especie de vesículas artificiais. A idea básica do uso de liposomas para a administración de fármacos é que o fármaco vai encapsulado en disolución no interior do liposoma, o cal é despois inxectado no paciente. Estes liposomas cargados con fármacos viaxan a través dos sistemas corporais ata que se unen aos destinos diana e alí rompen, liberando o fármaco. En teoría os liposomas deberían ser un método ideal de administración de fármacos, xa que dentro deles se pode illar case calquera fármaco liposoluble, pódenselle inserir moléculas que se unan a determinados tecidos diana e son relativamente pouco tóxicos porque o noso corpo posúe vías metabólicas para degradar os lípidos que os compoñen.[64]
A primeira xeración de liposomas usados para a administración de fármacos tiña unha composición lipídica sinxela e o seu uso presentaba varias limitacóns. A súa circulación pola corrente sanguínea era moi limitada debido á súa eliminación polos riles e á fagocitose. Un maior refinamento da súa composición lipídica para mellorar a súa fluidez, densidade de carga superficial e hidratación superficial serviu para elaborar vesículas que adsorbían menos proteínas do plasma sanguíneo, o que dificultaba o seu recoñecemento polo sistema inmunitario.[65] O avance máis significativo neste eido foi a inserción de polietilenglicol na superficie do liposoma para producir vesículas “silandeiras”, que pasan desapercibidas e circulan polo corpo durante longo tempo sen que o sistema inmune ou os riles os eliminen.[66]
Os primeiros liposomas deste novo tipo foron dirixidos pasivamente a tecidos tumorais. Pero como os tumores inducen unha rápida e incontrolada anxioxénese son especialmente “permeables” e permiten aos liposomas saír da circulación sanguínea con moita maior rapidez do que o farían en tecidos non tumorais.[67] Posteriores traballos seguiron a estratexia de inserir anticorpos ou outros marcadores moleculares na superficie do liposoma coa esperanza de que estes se unisen activamente a células ou tecidos específicos.[68] Algúns exemplos desta estratexia están xa na fase de probas clínicas.[69]
Outra potencial aplicación das bicapas lipídicas é no campo dos biosensores. Como a bicapa lipídica é a barreira que hai entre o interior e o exterior da célula, tamén é un sitio de intensa transdución de sinais. Durante anos os investigadores trataron de aproveitar este potencial para preparar un dispositivo baseado nas bicapas para usalo na detección de substancias con uso clínico ou no bioterrorismo. Pero os progresos foron lentos e, aínda que algunhas compañías desenvolveron sistemas de detección automáticos baseados en bicapas lipídicas, só se usan para fins de investigación. Un exemplo é o chip desbotable ofrecido por Biacore Life Sciences, que utiliza bicapas lipídicas,[70] ou os de Nanion Inc que desenvolveu un sistema para estudos electrofisiolóxicos (planar patch clamp).[71] Tamén se está a investigar noutras aplicacións máis exóticas como o uso de poros de membranas de bicapa lipídica para a secuenciación do ADN en Oxford Nanolabs, que aínda non é comercialmente viable.
As bicapas lipídicas apoiadas en substrato sólido tiveron éxito comercial como técnicas de cribado ou selección para medir a permeabilidade de fármacos, como a técnica denominada PAMPA (parallel artificial membrane permeability assay).[72][73][74][75][76]
Historia[editar | editar a fonte]
A principios do século XX os científicos xa pensaban que as células estaban rodeadas por unha delgada barreira de características aceitosas,[77] pero a natureza estrutural desta membrana non se coñecía. Dous experimentos de 1925 puxeron as bases para acabar con este descoñecemento. Hugo Ficke, medindo a capacitancia de solucións de eritrocitos , determinou que a membrana celular tiña un grosor de 3,3 nm.[78]
Aínda que os resultados deste experimento eran precisos, Fricke malinterpretou os datos e pensou que a membrana celular constaba dunha soa capa de moléculas. Evert Gorter[79] (1881–1954) e F. Grendel da Universidade de Leiden abordaron o problema desde outra perspectiva, estendendo os lípidos dos eritrocitos formando unha monocapa nun dispositivo Langmuir-Blodgett. Cando compararon a área da monocapa coa a área superficial das células observaron que a relación era de 2 a 1.[80] Posteriores análises puxeron en evidencia varios erros e asuncións incorrectas nese experimento, pero, por pura sorte, estes erros se cancelaban e con eses datos defectuosos Gorter e Grendel chegaron á conclusión correcta: a membrana celular era unha bicapa lipídica.[21]
Esta teoría foi confirmada co uso do microscopio electrónico na década de 1950. Aínda que non publicou o primeiro estudo de microscopía electrónica de bicapas lipídicas,[81] foi J. David Robertson o primeiro en afirmar que as dúas bandas escuras electrodensas que se observaban na membrana eran os grupos de cabeza hidrófilos dos lípidos e as proteínas asociadas de cada unha das capas superpostas da bicapa.[82][83] Con eses traballos Robertson presentou o concepto de “unidade de membrana.” Esta foi a primeira vez que a estrutura en bicapa era universalmente asignada a todas as membranas celulares e dos orgánulos.
Máis ou menos ao mesmo tempo o desenvolvemento de membranas modelo confirmou que a bicapa lipídica é unha estrutura estable que pode existir independentemente das proteínas. “Pintando” unha disolución de lípidos en disolvente orgánico sobre un orificio (é dicir, construíndo unha membrana "negra"), Mueller e Rudin puideron crear unha bicapa artificial e determinar que esta mostraba fluidez lateral, alta resistencia eléctrica e autorrexeneración en resposta a unha perforación,[84] e todas estas eran propiedades dunha membrana celular natural. Uns poucos anos despois, Alec Bangham demostrou que as bicapas, en forma de vesículas lipídicas, podían tamén formarse simplemente poñendo unha mostra seca de lípidos en auga.[85] Este foi un importante avance, porque demostraba que as bicapas lipídicas se formaban espontaneamente por autoensamblaxe e non requirían unha estrutura de soporte.
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Lewis BA, Engelman DM (1983). "Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles". J. Mol. Biol. 166 (2): 211–7. PMID 6854644. doi:10.1016/S0022-2836(83)80007-2.
- ↑ Zaccai G, Blasie JK, Schoenborn BP (1975). "Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes". Proc. Natl. Acad. Sci. U.S.A. 72 (1): 376–380. PMC 432308. PMID 16592215. doi:10.1073/pnas.72.1.376.
- ↑ Nagle JF, Tristram-Nagle S (2000). "Structure of lipid bilayers". Biochim. Biophys. Acta 1469 (3): 159–95. PMC 2747654. PMID 11063882. doi:10.1016/S0304-4157(00)00016-2.
- ↑ 4,0 4,1 Parker J, Madigan MT, Brock TD, Martinko JM (2003). Brock biology of microorganisms (10th ed.). Englewood Cliffs, N.J: Prentice Hall. ISBN 0-13-049147-0.
- ↑ Marsh D (2001). "Polarity and permeation profiles in lipid membranes". Proc. Natl. Acad. Sci. U.S.A. 98 (14): 7777–82. PMC 35418. PMID 11438731. doi:10.1073/pnas.131023798.
- ↑ Marsh D (2002). "Membrane water-penetration profiles from spin labels". Eur. Biophys. J. 31 (7): 559–62. PMID 12602343. doi:10.1007/s00249-002-0245-z.
- ↑ 7,0 7,1 7,2 7,3 Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E (2000). "Effect of chain length and unsaturation on elasticity of lipid bilayers". Biophys. J. 79 (1): 328–39. Bibcode:2000BpJ....79..328R. PMC 1300937. PMID 10866959. doi:10.1016/S0006-3495(00)76295-3.
- ↑ Trauble H, Haynes DH (1971). "The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition". Chem. Phys. Lipids. 7 (4): 324–35. doi:10.1016/0009-3084(71)90010-7.
- ↑ Bretscher MS, (1972). "Asymmetrical lipid bilayer structure for biological membranes". Nature 236 (61): 11–12. PMID 4502419. doi:10.1038/236011a0.
- ↑ Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL (1973). "The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy". Biochim. Biophys. Acta 323 (2): 178–93. PMID 4356540. doi:10.1016/0005-2736(73)90143-0.
- ↑ Bell RM, Ballas LM, Coleman RA (1 March 1981). "Lipid topogenesis". J. Lipid Res. 22 (3): 391–403. PMID 7017050. Arquivado dende o orixinal o 17 de outubro de 2019. Consultado o 29 de xuño de 2011.
- ↑ Bretscher MS (1973). "Membrane structure: some general principles". Science 181 (4100): 622–629. PMID 4724478. doi:10.1126/science.181.4100.622.
- ↑ Rothman JE, Kennedy EP (1977). "Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly". Proc. Natl. Acad. Sci. U.S.A. 74 (5): 1821–5. PMC 431015. PMID 405668. doi:10.1073/pnas.74.5.1821.
- ↑ Kornberg RD, McConnell HM (1971). "Inside-outside transitions of phospholipids in vesicle membranes". Biochemistry 10 (7): 1111–20. PMID 4324203. doi:10.1021/bi00783a003.
- ↑ Litman BJ (1974). "Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles". Biochemistry 13 (14): 2844–8. PMID 4407872. doi:10.1021/bi00711a010.
- ↑ Crane JM, Kiessling V, Tamm LK (2005). "Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy". Langmuir 21 (4): 1377–88. PMID 15697284. doi:10.1021/la047654w.
- ↑ Kalb E, Frey S, Tamm LK (1992). "Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers". Biochim. Biophys. Acta 1103 (2): 307–16. PMID 1311950. doi:10.1016/0005-2736(92)90101-Q.
- ↑ Lin WC, Blanchette CD, Ratto TV, Longo ML (2006). "Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study". Biophys. J. 90 (1): 228–37. PMC 1367021. PMID 16214871. doi:10.1529/biophysj.105.067066.
- ↑ Berg, Howard C. (1993). Random walks in biology (Extended Paperback ed.). Princeton, N.J: Princeton University Press. ISBN 0-691-00064-6.
- ↑ Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K (2001). "Partitioning of Thy-1, GM1, and cross-linked phospholipid analogs into lipid rafts reconstituted in supported model membrane monolayers". Proc. Natl. Acad. Sci. U.S.A. 98 (19): 10642–7. PMC 58519. PMID 11535814. doi:10.1073/pnas.191168698.
- ↑ 21,0 21,1 21,2 Yeagle, Philip (1993). The membranes of cells (2nd ed.). Boston: Academic Press. ISBN 0-12-769041-7.
- ↑ Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM (1998). "The role of phosphatidylserine in recognition of apoptotic cells by phagocytes". Cell Death Differ. 5 (7): 551–62. PMID 10200509. doi:10.1038/sj.cdd.4400404.
- ↑ Anderson HC, Garimella R, Tague SE (2005). "The role of matrix vesicles in growth plate development and biomineralization". Front. Biosci. 10 (1-3): 822–37. PMID 15569622. doi:10.2741/1576.
- ↑ Eanes ED, Hailer AW (1987). "Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes". Calcif. Tissue Int. 40 (1): 43–8. PMID 3103899. doi:10.1007/BF02555727.
- ↑ Kim J, Mosior M, Chung LA, Wu H, McLaughlin S (1991). "Binding of peptides with basic residues to membranes containing acidic phospholipids". Biophys. J. 60 (1): 135–48. Bibcode:1991BpJ....60..135K. PMC 1260045. PMID 1883932. doi:10.1016/S0006-3495(91)82037-9.
- ↑ Koch AL (1984). "Primeval cells: possible energy-generating and cell-division mechanisms". J. Mol. Evol. 21 (3): 270–7. PMID 6242168. doi:10.1007/BF02102359.
- ↑ 27,0 27,1 Alberts, Bruce (2002). Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 0-8153-4072-9.
- ↑ Martelli PL, Fariselli P, Casadio R (2003). "An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins". Bioinformatics 19 (Suppl 1): i205–11. PMID 12855459. doi:10.1093/bioinformatics/btg1027.
- ↑ Filmore D (2004). "It's A GPCR World". Modern Drug Discovery 11: 24–9.
- ↑ Montal M, Mueller P (December 1972). "Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties". Proc. Natl. Acad. Sci. 69 (12): 3561–6. Bibcode:1972PNAS...69.3561M. PMC 389821. PMID 4509315. doi:10.1073/pnas.69.12.3561.
- ↑ Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV (2001). "Voltage-induced nonconductive pre-pores and metastable single pores in unmodified planar lipid bilayer". Biophys. J. 80 (4): 1829–36. Bibcode:2001BpJ....80.1829M. PMC 1301372. PMID 11259296. doi:10.1016/S0006-3495(01)76153-X.
- ↑ Neher E, Sakmann B (1976). "Single-channel currents recorded from membrane of denervated frog muscle fibres". Nature 260 (5554): 799–802. Bibcode:1976Natur.260..799N. PMID 1083489. doi:10.1038/260799a0.
- ↑ 33,0 33,1 33,2 Y. Roiter, M. Ornatska, A. R. Rammohan, J. Balakrishnan, D. R. Heine, and S. Minko, Interaction of Nanoparticles with Lipid Membrane, Nano Letters, vol. 8, iss. 3, pp. 941–944 (2008).
- ↑ Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L (1979). "Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release". J. Cell Biol. 81 (2): 275–300. PMC 2110310. PMID 38256. doi:10.1083/jcb.81.2.275.
- ↑ Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS (2006). "Modeling of 31P-NMR spectra of magnetically oriented phospholipid liposomes: A new analytical solution". Solid State Nucl Magn Reson. 29 (4): 305–311. PMID 16298110. doi:10.1016/j.ssnmr.2005.10.009.
- ↑ Tokumasu F, Jin AJ, Dvorak JA (2002). "Lipid membrane phase behavior elucidated in real time by controlled environment atomic force microscopy". J. Electron Micros. 51 (1): 1–9. PMID 12003236. doi:10.1093/jmicro/51.1.1.
- ↑ Richter RP, Brisson A (2003). "Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy". Langmuir 19 (5): 1632–40. doi:10.1021/la026427w.
- ↑ 38,0 38,1 Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (2006). "Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy". Biophys. J. 91 (1): 217–26. PMC 1479081. PMID 16617084. doi:10.1529/biophysj.106.081398.
- ↑ Chakrabarti AC (1994). "Permeability of membranes to amino acids and modified amino acids: mechanisms involved in translocation". Amino Acids 6 (3): 213–29. PMID 11543596. doi:10.1007/BF00813743.
- ↑ Hauser H, Phillips MC, Stubbs M (1972). "Ion permeability of phospholipid bilayers". Nature 239 (5371): 342–4. PMID 12635233. doi:10.1038/239342a0.
- ↑ Papahadjopoulos D, Watkins JC (1967). "Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals". Biochim. Biophys. Acta 135 (4): 639–52. PMID 6048247. doi:10.1016/0005-2736(67)90095-8.
- ↑ Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW (1996). "Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness". Biophys. J. 70 (1): 339–48. Bibcode:1996BpJ....70..339P. PMC 1224932. PMID 8770210. doi:10.1016/S0006-3495(96)79575-9.
- ↑ Xiang TX, Anderson BD (1994). "The relationship between permeant size and permeability in lipid bilayer membranes". J. Membr. Biol. 140 (2): 111–22. PMID 7932645.
- ↑ Gouaux E, Mackinnon R (2005). "Principles of selective ion transport in channels and pumps". Science 310 (5753): 1461–5. PMID 16322449. doi:10.1126/science.1113666.
- ↑ Gundelfinger ED, Kessels MM, Qualmann B (2003). "Temporal and spatial coordination of exocytosis and endocytosis". Nat. Rev. Mol. Cell Biol. 4 (2): 127–39. PMID 12563290. doi:10.1038/nrm1016.
- ↑ Steinman RM, Brodie SE, Cohn ZA (1976). "Membrane flow during pinocytosis. A stereologic analysis". J. Cell Biol. 68 (3): 665–87. PMC 2109655. PMID 1030706. doi:10.1083/jcb.68.3.665.
- ↑ Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH (1982). "Gene transfer into mouse lyoma cells by electroporation in high electric fields". EMBO J. 1 (7): 841–5. PMC 553119. PMID 6329708.
- ↑ Demanèche S, Bertolla F, Buret F; et al. (2001). "Laboratory-scale evidence for lightning-mediated gene transfer in soil". Appl. Environ. Microbiol. 67 (8): 3440–4. PMC 93040. PMID 11472916. doi:10.1128/AEM.67.8.3440-3444.2001.
- ↑ Garcia ML (2004). "Ion channels: gate expectations". Nature 430 (6996): 153–5. PMID 15241399. doi:10.1038/430153a.
- ↑ McIntosh TJ, Simon SA (2006). "Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins". Annu. Rev. Biophys. Biomol. Struct. 35 (1): 177–98. PMID 16689633. doi:10.1146/annurev.biophys.35.040405.102022.
- ↑ Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA (2004). "Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers". Nature 430 (6996): 235–40. PMID 15241420. doi:10.1038/nature02743.
- ↑ Hallett FR, Marsh J, Nickel BG, Wood JM (1993). "Mechanical properties of vesicles. II. A model for osmotic swelling and lysis". Biophys. J. 64 (2): 435–42. Bibcode:1993BpJ....64..435H. PMC 1262346. PMID 8457669. doi:10.1016/S0006-3495(93)81384-5.
- ↑ Boal, David H. (2001). Mechanics of the cell. Cambridge, UK: Cambridge University Press. ISBN 0-521-79681-4.
- ↑ Rutkowski CA, Williams LM, Haines TH, Cummins HZ (1991). "The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy". Biochemistry 30 (23): 5688–96. PMID 2043611. doi:10.1021/bi00237a008.
- ↑ Evans E, Heinrich V, Ludwig F, Rawicz W (2003). "Dynamic tension spectroscopy and strength of biomembranes". Biophys. J. 85 (4): 2342–50. Bibcode:2003BpJ....85.2342E. PMC 1303459. PMID 14507698. doi:10.1016/S0006-3495(03)74658-X.
- ↑ Weaver JC, Chizmadzhev YA (1996). "Theory of electroporation: A review". Biochemistry and Bioenergetics 41 (2): 135–60. doi:10.1016/S0302-4598(96)05062-3.
- ↑ Papahadjopoulos D, Nir S, Düzgünes N (1990). "Molecular mechanisms of calcium-induced membrane fusion". J. Bioenerg. Biomembr. 22 (2): 157–79. PMID 2139437. doi:10.1007/BF00762944.
- ↑ Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR (1986). "Divalent cation induced fusion and lipid lateral segregation in phosphatidylcholine-phosphatidic acid vesicles". Biochemistry 25 (22): 6978–87. PMID 3801406. doi:10.1021/bi00370a600.
- ↑ Markin VS, Kozlov MM, Borovjagin VL (1984). "On the theory of membrane fusion. The stalk mechanism". Gen. Physiol. Biophys. 3 (5): 361–77. PMID 6510702.
- ↑ Chernomordik LV, Kozlov MM (2003). "Protein-lipid interplay in fusion and fission of biological membranes". Annu. Rev. Biochem. 72 (1): 175–207. PMID 14527322. doi:10.1146/annurev.biochem.72.121801.161504.
- ↑ Chen YA, Scheller RH (2001). "SNARE-mediated membrane fusion". Nat. Rev. Mol. Cell Biol. 2 (2): 98–106. PMID 11252968. doi:10.1038/35052017.
- ↑ Köhler G, Milstein C (1975). "Continuous cultures of fused cells secreting antibody of predefined specificity". Nature 256 (5517): 495–7. Bibcode:1975Natur.256..495K. PMID 1172191. doi:10.1038/256495a0.
- ↑ Jordan, Carol A.; Neumann, Eberhard; Sowers, Arthur E. (1989). Electroporation and electrofusion in cell biology. New York: Plenum Press. ISBN 0-306-43043-6.
- ↑ Immordino ML, Dosio F, Cattel L (2006). "Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential". Int J Nanomedicine 1 (3): 297–315. PMC 2426795. PMID 17717971. doi:10.2217/17435889.1.3.297.
- ↑ Chonn A, Semple SC, Cullis PR (15 September 1992). "Association of blood proteins with large unilamellar liposomes in vivo. Relation to circulation lifetimes". J. Biol. Chem. 267 (26): 18759–65. PMID 1527006. Arquivado dende o orixinal o 17 de outubro de 2019. Consultado o 05 de xullo de 2011.
- ↑ Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD (1997). "Stealth liposomes: from theory to product". Advanced Drug Delivery Reviews 24 (2-3): 165–77. doi:10.1016/S0169-409X(96)00456-5.
- ↑ Maeda H, Sawa T, Konno T (2001). "Mechanism of tumor-targeted delivery of macromolecular drugs, including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS". J Control Release 74 (1-3): 47–61. PMID 11489482. doi:10.1016/S0168-3659(01)00309-1.
- ↑ Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF (1999). "Cellular trafficking and cytotoxicity of anti-CD19-targeted liposomal doxorubicin in B lymphoma cells". Journal of Liposome Research 9 (2): 199–228. doi:10.3109/08982109909024786.
- ↑ Matsumura Y, Gotoh M, Muro K; et al. (2004). "Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer". Ann. Oncol. 15 (3): 517–25. PMID 14998859. doi:10.1093/annonc/mdh092.
- ↑ Biacore A100 System Information Arquivado 24 de marzo de 2010 en Wayback Machine.. Biacore Inc. Retrieved Feb 12, 2009.
- ↑ Nanion Technologies. Automated Patch Clamp Arquivado 31 de marzo de 2010 en Wayback Machine.. Retrieved Feb 28, 2010. (PDF)
- ↑ Bermejo, M. et al. (2004). PAMPA – a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. Pharm. Sci., 21: 429-441.
- ↑ Avdeef, A. et al. (2005). Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA pKaflux method. Pharm. Sci., 24: 333-349.
- ↑ Avdeef, A. et al. (2004). PAMPA – a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates. Pharm. Sci., 22: 365-374.
- ↑ Dagenais, C. et al. (2009). P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model. Eur. J. Phar. Sci., 38(2): 121-137.
- ↑ Sinkó, B. et al. (2009). A PAMPA Study of the Permeability-Enhancing Effect of New Ceramide Analogues. Chemistry & Biodiversity, 6: 1867-1874.
- ↑ Loeb J (1904). "The recent development of Biology". Science 20 (519): 777–786. PMID 17730464. doi:10.1126/science.20.519.777.
- ↑ Fricke H (1925). "The electrical capacity of suspensions with special reference to blood". Journal of General Physiology 9 (2): 137–52. PMC 2140799. PMID 19872238. doi:10.1085/jgp.9.2.137.
- ↑ Dooren L J, Wiedemann L R (1986). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of European Journal of Pediatrics 145 (5): 329. doi:10.1007/BF00439232.
- ↑ Gorter E, Grendel F (1925). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of Experimental Medicine 41 (4): 439–43. PMC 2130960. PMID 19868999. doi:10.1084/jem.41.4.439.
- ↑ Sjöstrand FS, Andersson-Cedergren E, Dewey MM (1958). "The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle". J. Ultrastruct. Res. 1 (3): 271–87. PMID 13550367. doi:10.1016/S0022-5320(58)80008-8.
- ↑ Robertson JD (1960). "The molecular structure and contact relationships of cell membranes". Prog. Biophys. Mol. Biol. 10: 343–418. PMID 13742209.
- ↑ Robertson JD (1959). "The ultrastructure of cell membranes and their derivatives". Biochem. Soc. Symp. 16: 3–43. PMID 13651159.
- ↑ Mueller P, Rudin DO, Tien HT, Wescott WC (1962). "Reconstitution of cell membrane structure in vitro and its transformation into an excitable system". Nature 194 (4832): 979–80. PMID 14476933. doi:10.1038/194979a0.
- ↑ A D Bangham and R W Horne. "Negative staining of phospholipids and their structural modification by surface active agents as observed in the electron microscope." Journal of Molecular Biology. 8. (1964) 660-668.

