Yersinia pestis
| Yersinia pestis | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
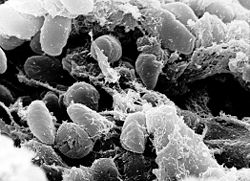 Micrografía electrónica de varrido dunha masa de bacterias Yersinia pestis no intestino anteiror dunha pulga infectada. | |||||||||||||||||
| Clasificación científica | |||||||||||||||||
| |||||||||||||||||
| Nome binomial | |||||||||||||||||
| Yersinia pestis (Lehmann & Neumann, 1896) van Loghem 1944 | |||||||||||||||||
| subespecies | |||||||||||||||||
| |||||||||||||||||
Yersinia pestis (antes chamada Pasteurella pestis) é unha especie de bacterias gramnegativas con forma de bacilo ou cocobacilo, anaerobia facultativa, que pode infectar a humanos e outros animais, e é a causante das pragas de peste dos últimos 1300 anos.[1]
A infección por Y. pestis en humanos pode presentarse de tres formas principais: peste pneumónica, peste septicémica, e peste bubónica.[1] Todas as formas foron responsables de epidemias de grande mortalidade na historia humana, como a Peste de Xustiniano no século VI e a Peste negra que matou a 1/3 da poboación europea no século XIV.[2][3] Pénsase que esas pragas se orixinaron en poboacións de roedores da China.[4][5]
Y. pestis foi descuberta en 1894 por Alexandre Yersin,un médico e bacteriólogo francosuízo do Instituto Pasteur, durante unha peste epidémica en Hong Kong.[6] Yersin era membro da escola de pensamento de Pasteur. Por outra parte, Kitasato Shibasaburō, un bacteriólogo xaponés formado en Alemaña na metodoloxía de Robert Koch, tamén se ocupou naquela época da procura do axente causante da peste.[7] Porén, foi Yersin quen realmente asociou a peste con Yersinia pestis. Orixinalmente a bacteria recibiu o nome de Pasteurella pestis, pero o organismo foi renomeado en 1967 co seu nome actual.
A Organización Mundial da Saúde informa todos os anos de miles de casos de peste, aínda que hoxe cun adecuado e rápido tratamento, o prognóstico das vítimas mellorou moito. Durante a guerra do Vietnam os casos en Asia multiplicáronse por 5 ou por 6, posiblemente debido á destrución dos ecosistemas e a unha maior proximidade entre os homes e os animais. A peste tamén afecta moi prexudicialmente a outros mamíferos (furóns, cans das praderías etc.)
Características xerais
[editar | editar a fonte]Y. pestis é un bacilo anaerobio facultativo cunha tinguidura bipolar (que lle dá ao aspecto dun imperdible).[8] Similar a outros membros do xénero Yersinia dá negativo na proba de urease, e nas da fermentación da lactosa, e do indol.[9] A especie máis próxima é o patóxeno gastrointestinal Yersinia pseudotuberculosis, e máis afastada está Yersinia enterocolitica.
Xenoma
[editar | editar a fonte]A secuencia xenómica completa de Y. pestis está dispoñible para dúas das tres subespecies de Y. pestis: cepa KIM (do biovar Medievalis),[10] e cepa CO92 (do biovar Orientalis, obtido dun illado clínico nos Estados Unidos).[11] En 2006, acabouse de completar a secuencia xenómica da cepa do biovar Antiqua.[12] Igual que outras capas patóxenas, hai signos de mutacións de perda de funcións. O cromosoma da capa KIM ten 4.600.755 pares de bases; o cromosoma da cepa CO92 ten 4.653.728 pares de bases. Igual que os seus parentes próximos Y. pseudotuberculosis e Y. enterocolitica, Y. pestis contén o plásmido pCD1. Ademais, contén outros dous plásmidos, o pPCP1 (tamén chamado pPla ou pPst) e o pMT1 (tamén chamado pFra), que non están presentes noutras especies de Yersinia. O plásmido pFra codifica a fosfolipase D que é importante pola capacidade de Y. pestis de ser transmitida por pulgas.[13] O pPla codifica unha protease, Pla, que activa o plasminóxeno nos hóspedes humanos e é un factor de virulencia moi importante na peste pneumónica.[14] Xunto con estes plásmidos e unha illa de patoxenicidade chamada HPI, o xenoma codifica tamén varias proteínas que causan a patoxénese, que son moi características de Y. pestis. Entre outras cousas, estes factores de virulencia son necesarios para a adhesión da bacteria e a inxección de proteínas na célula hóspede, a invasión da bacteria na célula hóspede (por medio do sistema de secreción de tipo III), e para a captación e ligazón do ferro que procede dos glóbulos vermellos (por medio de sideróforos).
Y. pestis pénsase que descende de Y. pseudotuberculosis, da que difire só na presenza de plásmidos de virulencia específicos.
En 2006 fíxose unha análise proteómica exhaustiva e comparativa da cepa KIM de Y. pestis.[15] A análise centrouse no momento da transición ao crecemento similar ao crecemento nas células hóspedes.
Patoxenia e inmunidade
[editar | editar a fonte]
Nos ciclos urbanos e forestais (selváicos) de Y. pestis, a maioría das transmisións ocorren entre os roedores e as pulgas. No ciclo selvático, son roedores salvaxes, pero, no ciclo urbano, os roedores son domésticos (viven nas casas). Ademais de polas pulgas, os animais infectados poden transmitir a infección aos humanos a través de contactos co tecido epitelial. Os humanos tamén poden transmitirse entre eles a bacteia por medio de espirros, toses, ou contacto directo co tecido infectado.
Nos hóspedes reservorio
[editar | editar a fonte]Os reservorios de Y. pestis son varias especies de roedores. Nas estepas, as especies reservorio crese que son principalmente as marmotas. En Norteamérica crese que varias especies de roedores son reservorios de Y. pestis. Porén, a dinámica da enfermidade esperada non se observou en ningunha especie de roedor, e sábese que esas poboacións de roedores teñen unha resistencia variable á bacteria, que fai que algúns individuos sexan susceptibles e outros sexan portadores asintomáticos.[16] Hai probas de que as pulgas doutros mamíferos tamén teñen un papel nas epidemias de peste humanas.[17]
Esta falta de coñecementos sobre a dinámica da praga nas especies de mamíferos dáse tamén entre os roedores susceptibles como os cans das praderías de rabo negro (Cynomys ludovicianus), nos cales a praga pode causar o colapso de toda a colonia, causando un efecto masivo na rede trófica da que forman parte.[18] Porén, a dinámica de transmisión nos cans das praderías parece non depender de pulgas co tubo dixestivo obstruído, senón talvez dos cadáveres, pulgas non obstruídas ou outros vectores.[19]
Noutras rexións do mundo, o reservorio da infección non está claramente identificado, o cal complica a prevención e os programas de alerta temperá. Un exemplo é a epidemia de 2003 en Alxeria.[20]
Vector
[editar | editar a fonte]A transmisión de Y. pestis polas pulgas está ben caracterizada.[21] A transmisión inicial de Y. pestis polo vector ocorre durante a súa alimentación. Varias proteínas contribúen ao mantemento da bacteria no tracto dixestivo da pulga, entre elas o sistema de almacenamento de hemina (Hms) e a toxina murina de Yersinia (Ymt).
Aínda que a toxina murina de Yersinia é moi tóxica para os roedores e antes se pensaba que se producía para asegurar a reinfección dos novos hóspedes, o que está demostrado é que a Ymt é importante para a supervivencia de Y. pestis nas pulgas.[13]
O sistema Hms xoga un importante papel na transmisión de Y. pestis ao hóspede mamífero.[22] Mentres que no vector insecto, as proteínas codficadas polos loci xenéticos do Hms inducen a formación de biofilmes no proventriculo, unha válvula que conecta o intestino medio co esófago do insecto.[23] A agregación no biofilme impide a alimentación, xa que se forma unha masa de sangue coagulado inxerido e de bacterias (denominado "bloque de Bacot".[24]) A transmisión de Y. pestis ten lugar durante os inútiles intentos da pulga por alimentarse dun sangue que non poderá tragar. O sangue inxerido é bombeado ao esófago, onde remove algunhas das bacterias que forman o tapón do proventrículo, e o sangue coas bacterias é regurxitado na ferida da picadura do hóspede, e as bacterias pasan ao seu sistema circulatorio. Como as pulgas non se poden alimentar, teñen fame e pican máis frecuentemente.
En humanos e outros hóspedes susceptibles
[editar | editar a fonte]A patoxénese debida á infección por Y. pestis dos hóspedes mamíferos é producida por varios factores como a capacidade da bacteria de suprimir e evitar as respostas normais do sistema inmunitario, como a fagocitose e a produción de anticorpos. A picada das pulgas permite que a bacteria sobrepase a barreira da pel. Y. pestis expresa o produto do xene yadBC, que é similar ás adhesinas doutras especies de Yersinia, o que facilita a adherencia e invasión das células epiteliais.[25] Y. pestis expresa un activador do plasminóxeno que é un importante factor de virulencia para a peste pneumónica e que podería degradar os coágulos e sangue para facilitar a invasión sistémica.[14] Moitos dos factores de virulencia da bacteria son antifagocíticos. Dous impotantes antíxenos antifagocíticos, chamados F1 (Fracción 1) e V ou LcrV, son importantes para a virulencia.[8] Estes antíxenos prodúceos a bacteria á temperatura corporal humana normal. Ademais, Y. pestis sobrevive e produce os antíxenos F1 e V mentres está no interior de células brancas do sangue como os monocitos, pero non en neutrófilos. A inmunidade natural ou inducida conséguese pola produción de anticorpos opsonizantes específicos contra os antíxenos F1 e V; os anticorpos contra F1 e V inducen a fagocitose por parte dos neutrófilos.[26]
Ademais, o sistema de secreción de tipo III (T3SS) permite que Y. pestis inxecte proteínas nos macrófagos e outras células inmunes. Estas proteínas inxectadas polo T3SS denomínanse Yops (Yersinia Outer Proteins, Proteína Externas de Yersinia) e entre elas está Yop B/D, que forma poros na membrana plasmática do hóspede e foi asociada coa citólise. Inxéctanse no citoplasma da célula hóspede por medio do T3SS as YopO, YopH, YopM, YopT, YopJ, e YopE por poros creados en parte por YopB e YopD.[27] As proteínas Yop inxectadas limitan a fagocitose e as vías de sinalización celular importantes para o sistema inmunitario innato. Ademais, algunhas cepas de Y. pestis son capaces de interferir coa sinalización inmune (por exemplo, ao impediren a liberación dalgunhas citocinas).
Yersinia pestis prolifera no interior dos ganglios linfáticos, onde pode evitar a súa destrución por células inmunitarias como os macrófagos. A capacidade de Y. pestis de inhibir a fagocitose permítelle crecer nos ganglios linfáticos e causar linfadenopatías. YopH é unha proteína tirosina fosfatase que contribúe a esa capacidade de Y. pestis de evadirse da acción das células inmunitarias.[28] Nos macrófagos, YopH desfosforila a p130Cas, Fyb (proteína de unión a Fyn) SKAP-HOM e Pyk, unha tirosina quinase homóloga de FAK. YopH tamén se une á subunidade p85 da fosfoinosítido 3-quinase, a Gab1, ás proteínas adaptadoras Gab2, e ao factor de intercambio do nucleótido guanina Vav.
YopE funciona como proteína activadora da GTPase para membros da familia Rho de GTPases como RAC1. YopT é unha cisteína protease que inhibe RhoA ao eliminar o grupo isoprenilo, que é importante para a localización da proteína na membrana plasmática. Propúxose que YopE e YopT poderían funcionar limitando a citólise inducida por YopB/D.[29] Isto podería limitar o función de YopB/D de crear os poros usados para a inserción de Yop nas células hóspedes e impedir a rotura inducida por YopB/D das células hóspede e que se libere o contido celular, o cal atraería e estimularía as respostas inmunitarias.
YopJ é unha acetiltransferase que se une a unha hélice alfa conservada das quinases MAPK.[30] YopJ acetila as quinases MAPK en residuos de serinas e treoninas que normalmente se fosforilan durante a activación da cascada das quinases MAP.[31][32] YopJ actívase nas células eucariotas pola interacción co ácido fítico (IP6) da célula diana.[33] Esta distorsión da actividade das proteína quinases da célula hóspede causa a apoptose dos macrófagos, e propúxose que é importante para o establecemento da infección e para a evasión da acción do sistema inmunitario. YopO é unha proteína quinase tamén coñecida como proteína quinase A de Yersinia (YpkA). YopO é un potente indutor da apoptose dos macrófagos humanos.[34]
Inmunidade
[editar | editar a fonte]Non hai vacinas efectivas contra a doenza. Téñense utilizado algunhas vacinas de escasa efectividade e que podían causar graves inflamacións, como a vacina inactivada con formol, que xa non se usa. Estanse facendo experimentos con técnicas de enxeñaria xenética de vacinas baseadas nos antíxenos F1 e V e parecen prometedores. Porén, as bacterias que carecen do antíxeno F1 seguen sendo virulentas, e os antíxenos V son suficientemente variables como para que unha vacina composta deles non sexa totalmente protectora.[35][36][37]
Aspectos clínicos
[editar | editar a fonte]Síntomas e progresión da enfermidade
[editar | editar a fonte]- Peste bubónica
- Período de incubación de 2–6 días, cando a bacteria se está replicando activamente.
- Malestar xeral
- Febre
- Dor de cabeza e calafríos que aparecen de repente ao final do período de incubación
- Inchamento dos ganglios linfáticos que orixinan bubóns, especialmente nas inguas, que é o síntoma clásico da peste bubónica.
- Peste septicémica
- Hipotensión
- Hepatoesplenomegalia
- Delirio
- Convulsións en nenos
- Shock
- Malestar xeral
- Febre
- Os síntomas das pestes bubónica e pneumónica non sempre están presentes
- Nota: O paciente pode morrer antes de que apareza ningún síntoma
- Peste pneumónica (transmítese de persoa a persoa)
A peste pneumónica pode producirse por inhalación de aerosois coa bacteria (primaria) ou esta pode chegar aos pulmóns desde o sangue (secundaria). Como a bacteria se transporta polo sangue, poden verse afectados varios órganos, como o bazo e o cerebro. A infección difusa pode causar unha cascada inmunolóxica que dea lugar a unha coagulación intravascular diseminada, que á súa vez produce hemorraxias e necrose na pel e tecidos. Unha infección diseminada dese tipo incrementa a mortalidade ao 22%. A pneumonía progresa en de 2 a 4 días e se non se iniciou un tratamento temperán os pacientes poden morrer en só 36 horas.
Coa excepción dos bubóns, os síntomas iniciais da peste son moi similares ao de moitas outras enfermidades, o que fai difícil o diagnóstico.[39]
Códigos ICD-9 da OMS para as enfermidades causadas por Y. pestis:
- 020.0 Peste bubónica
- 020.2 Peste septicémica
- 020.5 Peste pneumónica inespecífica
- 020.3 Peste pneumónica primaria
- 020.4 Peste pneumónica secundaria.
Determinación clínica
[editar | editar a fonte]A tinguidura de Gram pode confirmar a presenza de bacilos gramnegativos, e nalgúns casos a identificación de formas de dobre curvatura. Unha proba serolóxica anti-F1 pode diferenciar as diferentes especies de Yersinia, e a reacción en cadea da polimerase (PCR) pode utilizarse para identificar a Y. pestis.
A proteína H da fibra da cola do bacteriófago fago de Yersinia L-413C permite a diferenciación entre Y. pestis e Y. pseudotuberculosis.[40]
Tratamento
[editar | editar a fonte]O tratamento tradicional de primeira liña contra Y. pestis son os antibióticos estreptomicina,[41][42] cloranfenicol, tetraciclina,[43] e as fluoroquinolonas. Hai tamén boas evidencias que apoian o uso de doxiciclina ou xentamicina.[44] Illáronse cepas resistentes, polo que o tratamento debe guiarse polas sensibilidades aos antibióticos sempre que sexa posible. O tratamento antibiótico só é insuficiente para algúns pacientes, que poden tamén requirir apoio circulatorio, respiratorio ou renal.[45]
Epidemias históricas
[editar | editar a fonte]A Peste de Xustiniano
[editar | editar a fonte]- Artigo principal: Peste de Xustiniano.
A mediados do século VI produciuse unha pandemia coñecida como Peste de Xustiniano, que matou a unha terceira parte dos habitantes do Imperio Bizantino, que se cre foi debida á peste bubónica. Houbo epidemias recorrentes e non desapareceu de todo ata o ano 750.[46] Un estudo xenético suxire que esta praga se orixinou de cepas hoxe extintas de Y. pestis, xeneticamente distintas das cepas que orixinaron a Peste negra no século XIV, ou talvez de patóxenos non relacionados coa peste bubónica.[47][48] En 2012 investigadores alemáns recolleron mostras de Y. pestis de tumbas da época de Xustiniano para reconstruíren o ADN da bacteria.[49]
A Peste negra
[editar | editar a fonte]- Artigo principal: Peste negra.
En 2000, Didier Raoult e outros informaron do descubrimento de ADN de Y. pestis en tecido de polpa dental de mostras dun cemiterio do século XIV de Montpellier.[50] Outro estudo de 2010, que estudou restos de vítimas da peste enterradas en Inglaterra, Francia e Países Baixos, confirmou que Y. pestis foi a causa da Peste negra e as sucesivas epidemias de peste posteriores.[51] Neste estudo atoparon dúas cepas previamente descoñecidas, que eran cepas antigas de Y. pestis.[52]
Inicialmente pensouse que os tres biovares de Y. pestis correspondían a cada unha das pandemias históricas da peste bubónica.[53] O biovar Antiqua pénsase que corresponde á Peste de Xustiniano; non se sabe se este biovar tamén corresponde ás epidemias temperás ou menores de peste bubónica, ou se estas eran verdadeiramente peste bubónica e non outra doenza.[54] Antes pensábase que o biovar Mediaevalis correspondía á pandemia da Peste negra,e o biovar Orientalis correspondía á Terceira pandemia e á maioría dos estalidos modernos da praga. Porén, os cálculos da idade evolutiva de Y pestis, obtidos usando o número de substitucións sinónimas de polimorfismos dun só nucleótido (SNP) en conxunción coas taxas dos reloxos moleculares, datan a emerxencia destes biovares nun momento anterior ao de calquera das epidemias históricas debido á cantidade de tempo que cómpre para acumular esas mutacións.[55] Evidencias adicionais en contra desa hipótese son o feito de que Mediaevalis é probablemente demasiado nova para ter producido a Peste negra debido á súa recente diverxencia de Orientalis.[56]
Uso na guerra biolóxica
[editar | editar a fonte]A utilización con fins bélicos de Y. pestis é un dos primeiros exemplos de guerra biolóxica na historia. En 1347 os mongois catapultaron a vítimas da peste sobre as murallas da cidade de Caffa, que hoxe se chama Feodosiya, en Ucraína. É posible que os habitantes desta cidade, algúns infectados, fuxisen a Italia, e así espallasen a Peste negra por Europa, aínda que esta é só unha das varias rutas polas que puido ter chegado a peste desde o leste.[57]
Y. pestis foi utilizada como arma biolóxica na segunda guerra mundial. Os xaponeses o 4 de outubro de 1940 lanzaron desde un avión que sobrevoaba a cidade chinesa de Chushien (na provincia de Chekiang), arroz e trigo con pulgas de rata que estaban infectadas de Y. pestis. Un segundo avión fixo o mesmo 3 semanas máis tarde. Estas accións orixinaron unha praga local que matou a 121 persoas.[58][58]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Ryan KJ, Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. pp. 484–488. ISBN 0-8385-8529-9.
- ↑ Austin Alchon, Suzanne (2003). A pest in the land: new world epidemics in a global perspective. University of New Mexico Press. p. 21. ISBN 0-8263-2871-7.
- ↑ http://www.sciencedaily.com/releases/2013/05/130510075449.htm
- ↑ G. Morelli; Y. Song; C.J. Mazzoni; M. Eppinger; P. Roumagnac; D.M. Wagner; et al. (2010). "Phylogenetic diversity and historical patterns of pandemic spread of Yersinia pestis". Nature Genetics 42 (12): 1140–3. PMC 2999892. PMID 21037571. doi:10.1038/ng.705.
- ↑ Nicholas Wade (31 de outubro de 2010). "Europe’s Plagues Came From China, Study Finds". New York Times. Consultado o 2010-11-01.
As grandes ondadas da praga que devastou por dúas veces Europa e cambiou o curso da historia tiveron a súa orixe en China, segundo informou un equipo de xenetistas o domingo, como tamén unha terceira praga que golpeou con menos virulencia no século XIX.
- ↑ Bockemühl J (1994). "100 years after the discovery of the plague-causing agent--importance and veneration of Alexandre Yersin in Vietnam today". Immun Infekt 22 (2): 72–5. PMID 7959865.
- ↑ Howard-Jones N (1973). "Was Kitasato Shibasaburō the discoverer of the plague bacillus?". Perspect Biol Med 16 (2): 292–307. PMID 4570035.
- ↑ 8,0 8,1 Collins FM (1996). Pasteurella, Yersinia, and Francisella. In: Baron's Medical Microbiology (Baron S et al, eds.) (4th ed.). Univ. of Texas Medical Branch. ISBN 0-9631172-1-1.
- ↑ Stackebrandt, Erko; Dworkin, Martin; Falkow, Stanley; Rosenberg, Eugene; Karl-Heinz Schleifer (2005). The Prokaryotes: A Handbook on the Biology of Bacteria:Volume 6: Proteobacteria: Gamma Subclass. Berlin: Springer. ISBN 0-387-25499-4.
- ↑ Deng W; et al. (2002). "Genome Sequence of Yersinia pestis KIM". Journal of Bacteriology 184 (16): 4601–4611. PMC 135232. PMID 12142430. doi:10.1128/JB.184.16.4601-4611.2002.
- ↑ Parkhill J; et al. (2001). "Genome sequence of Yersinia pestis, the causative agent of plague". Nature 413 (6855): 523–527. PMID 11586360. doi:10.1038/35097083.
- ↑ Chain PS; Hu P; Malfatti SA; et al. (2006). "Complete Genome Sequence of Yersinia pestis Strains Antiqua and Nepal516: Evidence of Gene Reduction in an Emerging Pathogen". J. Bacteriol. 188 (12): 4453–63. PMC 1482938. PMID 16740952. doi:10.1128/JB.00124-06.
- ↑ 13,0 13,1 Hinnebusch BJ, Rudolph AE, Cherepanov P, Dixon JE, Schwan TG, Forsberg A (2002). "Role of Yersinia murine toxin in survival of Yersinia pestis in the midgut of the flea vector". Science 296 (5568): 733–5. PMID 11976454. doi:10.1126/science.1069972.
- ↑ 14,0 14,1 Lathem WW, Price PA, Miller VL, Goldman WE (2007). "A plasminogen-activating protease specifically controls the development of primary pneumonic plague". Science 315 (5811): 509–13. PMID 17255510. doi:10.1126/science.1137195.
- ↑ Hixson K; et al. (2006). "Biomarker candidate identification in Yersinia pestis using organism-wide semiquantitative proteomics". Journal of Proteome Research 5 (11): 3008–3017. PMID 16684765. doi:10.1021/pr060179y.
- ↑ MEYER KF (1957). "The natural history of plague and psittacosis: The R. E. Dyer Lecture". Public Health Rep 72 (8): 705–19. PMC 2031327. PMID 13453634. doi:10.2307/4589874.
- ↑ von Reyn CF; Weber NS; Tempest B; et al. (1977). "Epidemiologic and clinical features of an outbreak of bubonic plague in New Mexico". J. Infect. Dis. 136 (4): 489–94. PMID 908848. doi:10.1093/infdis/136.4.489.
- ↑ Pauli JN, Buskirk SW, Williams ES, Edwards WH (2006). "A plague epizootic in the black-tailed prairie dog (Cynomys ludovicianus)". J. Wildl. Dis. 42 (1): 74–80. PMID 16699150.
- ↑ Webb CT, Brooks CP, Gage KL, Antolin MF (2006). "Classic flea-borne transmission does not drive plague epizootics in prairie dogs". Proc. Natl. Acad. Sci. U.S.A. 103 (16): 6236–41. PMC 1434514. PMID 16603630. doi:10.1073/pnas.0510090103.
- ↑ Bertherat E; Bekhoucha S; Chougrani S; et al. (2007). "Plague Reappearance in Algeria after 50 Years, 2003". Emerging Infect. Dis. 13 (10): 1459–1462. PMC 2851531. PMID 18257987.
- ↑ Zhou D, Han Y, Yang R (2006). "Molecular and physiological insights into plague transmission, virulence and etiology". Microbes Infect. 8 (1): 273–84. PMID 16182593. doi:10.1016/j.micinf.2005.06.006.
- ↑ B.J. Hinnebusch, R.D. Perry and T.G. Schwan (1996). "Role of the Yersinia pestis hemin storage (hms) locus in the transmission of plague by fleas". Science. 273 (5237): 367–70. PMID 8662526. doi:10.1126/science.273.5273.367.
- ↑ Erickson, D. L., N. R. Waterfield, V. Vadyvaloo, D. Long, E. R. Fischer, R. ffrench-Constant, and B. J. Hinnebusch (2007). "Acute oral toxicity of yersinia pseudotuberculosis to fleas: Implications for the evolution of vector-borne transmission of plague". Cellular Microbiology 9 (11): 2658–2666. PMID 17587333. doi:10.1111/j.1462-5822.2007.00986.x.
- ↑ Pepper, C., M. Nascarella, E. Marsland, J. Montford, L. Wood, S. Cox, C. Bradford, T. Burns, and S. Presley. 2004. Threatened or endangered? Keystone species or public health threat? The black-tailed prairie dog, the Endangered Species Act, and the imminent threat of bubonic plague. Journal of Land, Resources, and Environmental Law 24: 355-391.
- ↑ Forman S, Wulff CR, Myers-Morales T, Cowan C, Perry RD, Straley SC (2008). "yadBC of Yersinia pestis, a New Virulence Determinant for Bubonic Plague". Infect. Immun. 76 (2): 578–87. PMC 2223446. PMID 18025093. doi:10.1128/IAI.00219-07.
- ↑ Salyers AA, Whitt DD (2002). Bacterial Pathogenesis: A Molecular Approach (2nd ed.). ASM Press. pp. 207-12.
- ↑ Viboud GI, Bliska JB (2005). "Yersinia outer proteins: role in modulation of host cell signaling responses and pathogenesis". Annu. Rev. Microbiol. 59: 69–89. PMID 15847602. doi:10.1146/annurev.micro.59.030804.121320.
- ↑ de la Puerta ML, Trinidad AG, del Carmen Rodríguez M, Bogetz J, Sánchez Crespo M, Mustelin T, Alonso A, Bayón Y (2009). Bozza, Patricia, ed. "Characterization of New Substrates Targeted By Yersinia Tyrosine Phosphatase YopH". PLoS ONE 4 (2): e4431. PMC 2637541. PMID 19221593. doi:10.1371/journal.pone.0004431.
- ↑ Mejía E, Bliska JB, Viboud GI (2009). "Yersinia Controls Type III Effector Delivery into Host Cells by Modulating Rho Activity". PLoS ONE 4 (2): e4431. PMC 2186360. PMID 18193942. doi:10.1371/journal.ppat.0040003.
- ↑ Hao YH, Wang Y, Burdette D, Mukherjee S, Keitany G, Goldsmith E, Orth K (2008). Kobe, Bostjan, ed. "Structural Requirements for Yersinia YopJ Inhibition of MAP Kinase Pathways". PLoS ONE 2 (3): e1375. PMC 2147050. PMID 18167536. doi:10.1371/journal.pone.0001375.
- ↑ Mukherjee S, Keitany G, Li Y, Wang Y, Ball HL, Goldsmith EJ, Orth K (2006). "Yersinia YopJ acetylates and inhibits kinase activation by blocking phosphorylation". Science 312 (5777): 1211–1214. PMID 16728640. doi:10.1126/science.1126867.
- ↑ Mittal R, Peak-Chew S-Y, McMahon HT (2006). "Acetylation of MEK2 and IκB kinase (IKK) activation loop residues by YopJ inhibits signaling". Proc. Natl. Acad. Sci. USA 103 (49): 18574–18579. PMC 1654131. PMID 17116858. doi:10.1073/pnas.0608995103.
- ↑ Mittal R, Peak-Chew SY, Sade RS, Vallis Y, McMahon HT (2010). "The Acetyltransferase Activity of the Bacterial Toxin YopJ of Yersinia Is Activated by Eukaryotic Host Cell Inositol Hexakisphosphate". J Biol Chem 285 (26): 19927–34. PMC 2888404. PMID 20430892. doi:10.1074/jbc.M110.126581. Arquivado dende o orixinal o 06 de novembro de 2018. Consultado o 26 de xullo de 2013. Arquivado 06 de novembro de 2018 en Wayback Machine.
- ↑ Park H, Teja K, O'Shea JJ, Siegel RM (2007). "The Yersinia effector protein YpkA induces apoptosis independently of actin depolymerization". J Immunol. 178 (10): 6426–6434. PMID 17475872.
- ↑ Welkos S; et al. (2002). "Determination of the virulence of the pigmentation-deficient and pigmentation-/plasminogen activator-deficient strains of Yersinia pestis in non-human primate and mouse models of pneumonic plague". Vaccine 20 (17–18): 2206–2214. PMID 12009274. doi:10.1016/S0264-410X(02)00119-6.
- ↑ Pitt ML (13-14 de outubro). "Non-human primates as a model for pneumonic plague. In: Animals Models and Correlates of Protection for Plague Vaccines Workshop" (PDF). Arquivado dende o orixinal (PDF) o 21 de febreiro de 2006. Consultado o 26 de xullo de 2013.
- ↑ Jefferson T, Demicheli V, Pratt M (2000). "Vaccines for preventing plague". Cochrane Database Syst Rev (2): CD000976. PMID 10796565. doi:10.1002/14651858.CD000976.
- ↑ Info taken from "Harrison's Principles of Internal Medicine 16th Edition"
- ↑ Prentice MB, Rahalison L (2007). "Plague". Lancet 369 (9568): 1196–207. PMID 17416264. doi:10.1016/S0140-6736(07)60566-2.
- ↑ Garcia, E; Chain, P; Elliott, JM; Bobrov, AG; Motin, VL; Kirillina, O; Lao, V; Calendar, R; Filippov, AA (2008). "Molecular characterization of L-413C, a P2-related plague diagnostic bacteriophage". Virology 372 (1): 85–96. PMID 18045639. doi:10.1016/j.virol.2007.10.032.
- ↑ Wagle PM. (1948). "Recent advances in the treatment of bubonic plague". Indian J Med Sci 2: 489–94.
- ↑ Meyer KF. (1950). "Modern therapy of plague". JAMA 144 (12): 982–5. PMID 14774219.
- ↑ Kilonzo BS, Makundi RH, Mbise TJ. (1992). "A decade of plague epidemiology and control in the Western Usambara mountains, north-east Tanzania". Acta Tropica 50 (4): 323–9. PMID 1356303. doi:10.1016/0001-706X(92)90067-8.
- ↑ Mwengee W; Butler T; Mgema S; et al. (2006). "Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania". Clin Infect Dis 42 (5): 614–21. PMID 16447105. doi:10.1086/500137.
- ↑ Jameson, J. N. St C.; Dennis L. Kasper; Harrison, Tinsley Randolph; Braunwald, Eugene; Fauci, Anthony S.; Hauser, Stephen L; Longo, Dan L. (2005). Harrison's principles of internal medicine. New York: McGraw-Hill Medical Publishing Division. ISBN 0-07-140235-7.
- ↑ "Europe’s Plagues Came From China, Study Finds". The New York Times. 31 de outubro de 2010. Consultado o 2010-11-01.
- ↑ McGrath, Matt (12 de outubro de 2011). "Black Death Genetic Code 'Built'". BBC World Service. Consultado o 12 de outubro de 2011.
- ↑ Bos, Kirsten (12 de outubro de 2011). "A draft genome of Yersinia pestis from victims of the Black Death". Nature 478 (7370): 506–510. Bibcode:2011Natur.478..506B. doi:10.1038/nature10549.
- ↑ multiple (2013-05-02). "Yersinia pestis DNA from Skeletal Remains from the 6th Century AD Reveals Insights into Justinianic Plague". PLOS Pathogens. Consultado o 2013-05-16.
- ↑ Drancourt M, Aboudharam G, Signolidagger M, Dutourdagger O, Raoult D. (2002). "Detection of 400-year-old Yersinia pestis DNA in human dental pulp: An ory of plague". Microbes Infect. 4 (1): 105–9. PMID 11825781. doi:10.1016/S1286-4579(01)01515-5.
- ↑ Haensch, Stephanie; Bianucci, Raffaella; Signoli, Michel; Rajerison, Minoarisoa; Schultz, Michael; Kacki, Sacha; Vermunt, Marco; Weston, Darlene A.; Hurst, Derek (2010). Besansky, Nora J., ed. "Distinct Clones of Yersinia pestis Caused the Black Death". PLoS Pathogens (PLoS Pathogens) 6 (10): e1001134. PMC 2951374. PMID 20949072. doi:10.1371/journal.ppat.1001134.
- ↑ "Black Death Blamed on Bacteria". Associated Free Press (Discovery). 8 de outubro de 2010. Arquivado dende o orixinal o 11 de outubro de 2010. Consultado o 11 de outubro de 2010.
- ↑ Zhou D, Tong Z, Song Y, Han Y, Pei D, Pang X, Zhai J, Li M, Cui B, Qi Z, Jin L, Dai R, Du Z, Wang J, Guo Z, Wang J, Huang P, Yang R (2004). "Genetics of Metabolic Variations between Yersinia pestis Biovars and the Proposal of a New Biovar, microtus". J Bacteriol 186 (15): 5147–52. PMC 451627. PMID 15262951. doi:10.1128/JB.186.15.5147-5152.2004.
- ↑ Guiyoule A, Grimont F, Iteman I, Grimont P, Lefèvre M, Carniel E (1994). "Plague pandemics investigated by ribotyping of Yersinia pestis strains". J Clin Microbiol 32 (3): 634–41. PMC 263099. PMID 8195371.
- ↑ Parkhill; J.; B. W. Wren; N. R. Thomson; R. W. Titball; M. T. G. Holden; M. B. Prentice; M. Sebaihia; et al. (2001). "Genome sequence of Yersinia pestis, the causative agent of plague". Nature 413 (6855): 523–527. PMID 11586360. doi:10.1038/35097083.
- ↑ Achtman M, Morelli G, Zhu P, Wirth T, Diehl I, Kusecek B; et al. (2004). "Microevolution and history of the plague bacillus, Yersinia pestis". Proc Natl Acad Sci U S A 101 (51): 17837–42. PMC 535704. PMID 15598742. doi:10.1073/pnas.0408026101.
- ↑ Wheelis, Mark (2002). "Biological Warfare at the 1346 Siege of Caffa". Emerging Infectious Diseseases 8 (9): 971–75.
- ↑ 58,0 58,1 Drisdelle R. Parasites. Tales of Humanity's Most Unwelcome Guests. Univ. of California Publishers, 2010. p. 162f. ISBN 978-0-520-25938-6.
Véxase tamén
[editar | editar a fonte]| Wikispecies posúe unha páxina sobre: Yersinia pestis |
| Commons ten máis contidos multimedia sobre: Yersinia pestis |
Ligazóns externas
[editar | editar a fonte]- Yersinia pestisArquivado 29 de xuño de 2006 en Wayback Machine.. Virtual Museum of Bacteria.
- Lista de cepas variantes e información sobre sinónimos (e moito máis) en NCBI taxonomy browser.
- Páxina do CDC sobre a peste [1]
- Páxina da IDSA con recursos sobre a Peste: patoxénese, microbioloxía, epidemioloxía, diagnose, e tratamento [2]
