Serpina
| Serpina (inhibidor da serina protease) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Unha serpina (en branco) co seu 'bucle do centro reactivo' (azul) unido a unha protease (gris). Unha vez que a protease intenta a catálise será inhibida irreversiblemente. (PDB 1K9O) | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Serpin, SERPIN (símbolo raíz de familia) | ||||||||||
| Pfam | PF00079 | ||||||||||
| InterPro | IPR000215 | ||||||||||
| PROSITE | PDOC00256 | ||||||||||
| SCOPe | 1hle / SUPFAM | ||||||||||
| CDD | cd00172 | ||||||||||
| |||||||||||
As serpinas son unha superfamilia de proteínas con estruturas similares que foron inicialmente identificadas pola súa actividade de inhibición de proteases e poden atoparse en todos os reinos de seres vivos.[1][2] Serpina é un acrónimo que se acuñou orixinalmente así porque as primeiras serpinas descubertas actuaban sobre as serina proteses similares á quimotripsina (que en inglés serían serine protease inhibitors = serpin).[3][4][5] Son notables polo seu mecanismo de acción infrecuente, no cal inhiben irreversiblemente as súas proteases diana ao sufriren un gran cambio conformacional para distorsionar o sitio activo da súa molécula diana.[6][7] Isto contrasta co mecanismo máis común de inhibición competitiva para inhibidores da protease que se unen e bloquea o acceso ao sitio activo da protease.[8][9]
A inhibición de proteases feita polas serpinas controla un conxunto de procesos biolóxicos, como a coagulación e a inflamación, e consecuentemente estas proteínas son o obxectivo dunha intensa investigación médica.[10] O seu cambio conformacional peculiar tamén espertou o interese no eido da bioloxía estrutural e pregamento de proteínas.[7][8] Os mecanismos de cambio conformacional danlles certas vantaxes, pero tamén teñen inconvenientes: as serpinas son vulnerables a mutacións que poden resultar en serpinopatías como o pregamento incorrecto de proteínas e a formación de polímeros de cadea longa inactivos.[11][12] A polimerización das serpinas non só reduce a cantidade de inhibidor activo, senón que tamén causa a acumulación dos polímeros, orixinando morte celular e insuficiencia orgánica.[10]
Aínda que a maioría das serpinas controlan cadoiros proteolíticos, algunhas proteínas con estrutura de serpina non son inhibidores encimáticos, senón que realizan diversas funcións como o almacenamento (como faría a ovoalbumina na clara de ovo), transporte, como en proteínas transportadoras de hormonas (globulina fixadora de tiroxina, globulina fixadora de cortisol), e chaperonización molecular (HSP47).[9] O termo serpina utilízase para describir estes membros tamén, malia non teren función inhibitoria, xa que están evolutivamente relacionados.[1]
Historia
[editar | editar a fonte]Informouse por primeira vez da actividade inhibitoria da protease no plasma sanguíneo a finais do século XIX,[13] pero ata a década de 1950 non se illaron as serpinas antitrombina e alfa1 antitripsina,[14] co recoñecemento posterior da súa estreita homoloxía en 1979.[15][16] Quedou claro que pertencían a unha nova familia proteica cando se comprobou o seu aliñamento coa proteína non inhibitoria da clara do ovo ovoalbumina, dando lugar á chamada superfamilia proteica alfa1-antitripsina-antitrombina III-ovalbumina de inhibidores da serina protease,[17] pero foi despois renomeada de forma máis breve como superfamilia das Serpinas.[18] A caracterización inicial da nova familia centrouse na alfa1-antitripsina, unha serpina presente nunha alta concentración no plasma sangíneo, cuxa mutación pode orixinar un trastorno xenético común que se considera a causa da predisposición á enfermidade pulmonar enfisema[19] e á cirrose hepática.[20] A identificación das mutacións S e Z[21][22] responsables da deficiencia xenética e os posteriores aliñamentos de secuencias da alfa1-antitripsina e a antitrombina en 1982 levaron ao recoñecemento das estreitas homoloxías dos sitios activos das dúas proteínas,[23][24] centrados nunha metionina[25] na alfa1-antitripsina como inhibidor da elastase tisular, e na arxinina na antitrombina[26] como inhibidor da trombina.[27]
O papel fundamental do residuo do centro activo para determinar a especificidade da inhibición das serpinas foi confirmado inequivocamente polo descubrimento de que unha mutación natural que afectaba a metionina do centro activo na alfa1-antitripsina, que se cambiaba por arxinina (como na antitrombina), tiña como resultado un grave trastorno hemorráxico.[28] Esta especificidade de centro activo da inhibición era tamén evidente nas moitas familias de inhibidores da protease[7] pero as serpinas diferían delas en que eran proteínas moito máis grandes e tamén en que posuían o que se descubriu pouco despois como unha capacidade inherente para experimentar cambios de forma. A natureza deste cambio conformacional revelouse coa determinación en 1984 da primeira estrutura cristalina dunha serpina, a da alfa1-antitripsina post-clivaxe.[29] Isto xunto coa posterior resolución da estrutura da ovoalbumina nativa (non clivada)[30] indicou que o mecanismo inhibitorio das serpinas implicaba un notable cambio conformacional, no cal se producía o movemento do bucle peptídico exposto que contén o sitio reactivo e a súa incorporación como unha febra que quedaba en posición intermedia na folla beta-pregada principal que caracteriza a molécula de serpina.[31][32] As primeiras evidencias do papel esencial do movemento deste bucle no mecanismo inhibitorio procederon do descubrimento de que incluso aberracións menores nos residuos de aminoácidos que forman a bisagra por onde se move na antitrombina tiñan como resultado unha enfermidade trombótica.[31][33] A confirmación final do desprazamento ligado da protease diana por causa deste mvemento do bucle proporcionouna en 2000 ocoñecemento da estrutura do complexo post-inhibitorio da alfa1-antitripsina con tripsina,[6] mostrando como o desprazamento resulta na deformación e inactivación da protease unida. Estudos estruturais posteriores revelaron unha vantaxe adicional do mecanismo conformacional[34] para permitir a modulación sutil da actividade inhibitoria, como se viu en particular a nivel tisular[35] coas serpinas funcionalmene diversas do plasma humano.
Ata agora identificáronse unhas 1000 serpinas, incluíndo 36 proteínas humanas, así como moléculas en todos os reinos da vida (animais, plantas, fungos, bacterias e arqueas) e nalgúns virus (Poxviridae).[36][37][38] A característica central de todos é unha armazón estreitamente conservada, que permite o aliñamento preciso dos seus compoñentes estruturais e funcionais baseados na estrutura molde da alfa1-antitripsina.[39] Na década de 2000, presentouse unha nomenclatura sistemática para categorizar os membros da superfamilia da serpina baseada nas súas relacións evolutivas.[1] As serpinas son, polo tanto, a superfamilia máis grande e diversa de inhibidores de proteases.[40]
Actividade
[editar | editar a fonte]
A maioría das serpinas son inhibidores da protease, que afectan a serina proteases similares á quimotripsina extracelulares. Estas proteases posúen un resido de serina nucleófilo nunha tríade catalítica no seu sitio activo. Exemplos son a trombina, tripsina e a elastase do neutrófilo humana.[41] As serpinas actúan como inhibidores suicidas irreversibles ao atraparen un intermediario do mecanismo catalítico da protease.[6]
Algunhas serpinas inhiben outras clases de proteases, tipicamente cisteína proteases, e denomínanse "inhibidores de clase cruzada". Estes encimas difiren das serina proteases en que usan un residuo nucleófilo de cisteína, en vez dunha serina, no seu sitio activo.[42] Non obstante, a química encimática é similar, e o mecanismo de inhibición polas serpinas é o mesmo en ambas as clases de proteases.[43] Exemplos de serpinas inhibitorias de clase cruzada son a serpina B3 (antíxeno 1 de carcinoma de célula escamosa ou SCCA1),[44] e a serpina aviaria proteína específica do estado de terminación nuclear mieloide e eritroide (MENT), as cales inhiben ambas as cisteína proteases similares á papaína.[45][46][47]
Localización e función biolóxica
[editar | editar a fonte]Inhibición da protease
[editar | editar a fonte]Aproximadamente dous terzos das serpinas humanas realizan funcións extracelulares, inhibindo as proteases na circulación sanguínea para modular as súas actividades. Por exemplo, as serpinas extracelulares regulan os cadoiros proteolíticos esenciais para a coagulación do sangue (antitrombina), as respostas inflamatorias e inmunes (antitripsina, antiquimotripsina e o inhibidor de C1) e remodelación de tecidos (PAI-1).[9] Ao inhibiren as proteases de cadoiros de sinalización, poden tamén afectar o desenvolvemento.[48][49] A táboa das serpinas humanas (abaixo) proporciona exemplos do rango de funcións realizadas polas serpinas humanas, así como algunhas das enfermidades que resultan da deficiencia de serpinas.
As proteases que son diana das serpinas inhibitorias intracelulares foron difíciles de identificar, xa que moitas destas moléculas parecen realizar funcións solapadas. Ademais, moitas serpinas humanas carecen de equivalentes funcionais precisos en organismos modelos como o rato. Non obstante, unha función importante das serpinas intracelulares pode ser protexer contra a actividade inapropiada das proteases dentro da célula.[50] Por exemplo, unha das serpinas humanas mellor caracterizadas é Serpina B9, que inhibe a protease grancima B dos gránulos citotóxicos. Facendo isto, a Serpina B9 pode protexer contra a liberación inadvertida de grancima B e a activación prematura ou non desexada das vías de morte celular.[51]
Algúns virus usan as serpinas para interferir coas funcións das proteases do seu hóspede. A serpina viral da varíola das vacas CrmA (modificador da resposta de citocinas A) utilízase para evitar as respostas inflamatorias e apoptóticas de células hóspede infectadas. A CrmA incrementa a infectividade ao suprimir a resposta inflamatoria do hóspede por medio da inhibición do procesamento da IL-1 e IL-18 pola cisteína protease caspase-1.[52] En eucariotas, unha serpina de plantas inhibe ambas as metacaspases[53] e unha cisteína protease similar á papaína.[54]
Funcións non inhibitorias
[editar | editar a fonte]As serpinas extracelulares non inhibitorias tamén realizan unha ampla variedade de funcións importantes. A globulina fixadora da tiroxina e a transcortina transportan as hormonas tiroxina e cortisol, respectivamente.[55][56] A serpina non inhibitoria ovoalbumina é a proteína máis abundante da xema de ovo. A súa función exacta é descoñecida, pero pénsase que é unha proteína de almacenamento para o desenvolvemento do embrión.[57] A serpina de choque térmico 47 é unha chaperona, esencial para o correcto pregamento do coláxeno. Actúa estabilizando a tripla hélice do coláxeno mentres está sendo procesado no retículo endoplasmático.[58]
Algunhas serpinas son á vez inhibidores da protease e realizan funcións adicionais. Por exemplo, o inhibidor da cisteína protease nuclear MENT, en aves tamén actúa como molécula remodeladora da cromatina nos eritrocitos de aves.[46][59]
Estrutura
[editar | editar a fonte]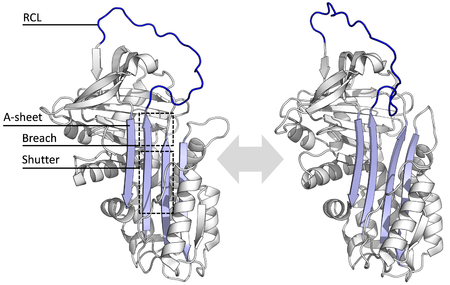
Todas as serpinas comparten unha estrutura (ou pregamento) común, malia as variadas funcións que teñen. Todas teñen caracteristicamente tres follas β (denominadas A, B e C) e oito ou nove hélices α (denominadas hA–hI).[29][30] As rexións máis significativas para a función das serpinas son a folla A e o bucle do centro reactivo (RCL). A folla A inclúe dúas febras β que están nunha orientación paralela cunha rexión entre elas chamada a "persiana" (shutter), e unha rexión superior chamada a "fisura" (breach). O RCL forma a interacción inicial coa protease diana en moléculas inhibitorias. Resolvéronse algunhas estruturas que mostraban o RCL completamente exposto ou parcialmente inserido na folla A, e pénsase que as serpinas están en equilibrio dinámico entre estes dous estados.[8] O RCL só establece interaccións temporais co resto da estrutura, e é, polo tanto, moi flexible e está exposto ao solvente.[8]
As estruturas que se determinaron das serpinas son de varias conformacións diferentes, o cal foi necesario para o coñecemento do seu mecanismo de acción de varios pasos. A Bioloxía estrutural exerceu un papel fundamental no coñecemento da función e bioloxía das serpinas.[8]
Cambio conformacional e mecanismo inhibitorio
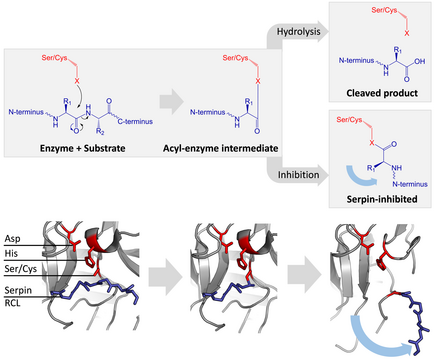
[editar | editar a fonte]As serpinas inhibitorias non inhiben as súas proteases diana polo típico mecanismo de inhibición competitiva (pechadura e chave) usado pola maioría dos inhibidores de proteases pequenos (por exemplo, inhibidores de tipo Kunitz). En vez diso, as serpinas usan un cambio conformacional pouco común, que distorsiona a estrutura da protease e impide que complete a súa catálise. O cambio conformacional implica que o RCL se mova ao extremo oposto da proteína e se insira na folla β A, formando unha fibra β extra antiparalela. Isto cambia a serpina desde o estado estresado ao estado relaxado de baixa enerxía (transición de S a R).[7][8][62]
As serina proteases e cisteína proteases catalizan a rotura do enlace peptídico nun proceso en dúas etapas. Inicialmente, o residuo catalítico da tríade do sitio activo realiza un ataque nucleófilo no enlace peptídico do substrato. Isto libera o novo N-terminal e forma un enlace éster covalente entre o encima e o substrato.[7] Este complexo covalente entre encima e substrato chámase intermediario acil-encima. Para substratos estándar, o enlace éster é hidrolizado e o novo C-terminal libérase para completar a catálise. Porén, cando unha serpina é cortada por unha protease, rapidamente sofre a transición de S a R antes de que o intermediario acil-encima se hidrolice.[7] A eficiencia da inhibición depende de que a velocidade cinética relativa do cambio conformacional é varias ordes de magnitude máis rápida que a hidrólise pola protease.
Como o RCL aínda está ligado covalentemente á protease polo enlace éster, a transición de S a R empurra a protease desde a parte superior á inferior da serpina e distorsiona a tríade catalítica. A protease distorsionada só pode hidrolizar o intermediario acil-encima de maneira extremadamente lenta e así a protease permanece ligada covalentemente por días ou semanas.[6] As serpinas clasifícanse como inhibidores irreversibles e como inhibidores suicidas, xa que cada proteína serpina inactiva permanentemente unha soa protease e só pode funcionar unha vez.[7]
Activación alostérica
[editar | editar a fonte]
A mobilidade conformacional das serpinas proporciona unha vantaxe clave sobre os inhibidores da protease de pechadura e chave estáticos.[34] En concreto, a función das serpinas inhibitorias pode ser regulada por interaccións alostéricas con cofactores específicos. As estruturas cristalinas de raios X da antitrombina, cofactor II da heparina, MENT e a antiquimotripsina murina revelan que estas serpinas adoptan unha conformación na que os primeiros dous aminoácidos do RCL se insiren na parte superior da folla β A. A conformación parcialmente inserida é importante porque algúns cofactores poden cambiar conformacionalmente certas serpinas parcialmente inseridas a unha forma completamente expulsada.[63][64] Este rearranxo conformacional fai que as serpinas sexan uns inhibidores máis efectivos.
O exemplo arquetípico desta situación é a antitrombina, que circula no plasma nun estado relativamente inactivo inserido parcialmente. A especificidade primaria que determina o residuo (a arxinina P1) apunta cara ao corpo da serpina e non queda dispoñible para a protease. Despois de unirse a unha secuencia pentasacárida de alta afinidade da heparina de cadea longa, a antitrombina sofre un cambio conformacional, a expulsión do RCL e a exposición da arxinina P1. A forma unida ao pentasacárido da heparina da antitrombina é, así, un inhibidor máis efectivo da trombina e o factor Xa.[65][66] Ademais, ambas as proteases da coagulación mencionadas conteñen tamén sitios de unión (chamados exositios) para a heparina. Polo tanto, a heparina tamén actúa como molde que se une tanto á protease coma á serpina, o que acelera drasticamente a interacción entre as dúas partes. Despois da interacción inicial, o complexo da serpina final está formado e o residuo de heparina é liberado. Esta interacción é fisioloxicamente importante. Por exemplo, despois dunha lesión nas paredes dos vasos sanguíneos, a heparina queda exposta e a antitrombina é activada para controlar a resposta coagulatoria. A comprensión das bases moleculares desta interacción permitiu o desenvolvemento do Fondaparinux, unha forma sintética do pentasacárido da heparina usada como fármaco anticoagulante.[67][68]
Conformación latente
[editar | editar a fonte]
Certas serpinas sofren espontaneamente a transición de S a R sen que fosen previamente cortadas por unha protease, para formar unha conformación denominada estado latente. As serpinas latentes non poden interaccionar con proteases, polo que xa non son inhibidores da protease. O cambio conformacional á latencia non é exacteamente o mesmo que a transcición de S a R dunha serpina clivada. Como o RCL aínda está intacto, a primeira febra da folla C ten que "pelarse" ou separarse para permitir a inserción completa do RCL.[69]
A regulación da transición á latencia poden actuar como un mecanismo de control nalgunhas serpinas, como a PAI-1. Aínda que a PAI-1 se produce na conformación S inhibitoria, "autoinactívase" polo cambio ao estado latente a menos que se una ao cofactor vitronectina.[69] De xeito similar, a antitrombina pode tamén converterse espontaneamente ao estado latente, como un mecanismo de modulación adicional para a súa activación alostérica pola heparina.[70] Finalmente, cómpre o N-terminal da tengpina, unha serpina de Thermoanaerobacter tengcongensis, para bloquear a molécula no estado inhibitorio nativo. A distorsión das interaccións feitas pola rexión N-terminal ten como resultado un cambio conformacional espontáneo desta serpina á conformación latente.[71][72]
Cambio conformacional en funcións non inhibitorias
[editar | editar a fonte]Certas serpinas non inhibitorias tamén usan o cambio conformacional como parte do seu funcionamento. Por exemplo, a forma nativa (S) da globulina fixadora da tiroxina ten unha alta afinidade pola tiroxina, mentres que a forma clivada (R) ten baixa afinidade. De xeito similar, a transcortina ten unha maior afinidade polo cortisol cando está no seu estao nativo (S) que cando está no estado clivado (R). Deste modo, nestas serpinas, a clivaxe do RCL e a transición de S a R foron utilizadas para permitir a liberación do ligando en lugar de para a inhibición da protease.[55][56][73]
Nalgunhas serpinas, a transición de S a R pode activar eventos de sinalización celular. Nestes casos, unha serpina que formou un complexo coa súa protease diana, é despois recoñecida por un receptor. O evento de unión despois acaba orixinando a sinalización augas abaixo polo receptor.[74] A transición de S a R é, polo tanto, usada para alertar as células da presenza da actividade de protase.[74] Isto difire do mecanismo usual no que as serpinas afectan a sinalización simplemente por inhibiren as proteases implicadas no cadoiro de sinalización.[48][49]
Degradación
[editar | editar a fonte]Cando unha serpina inhibe unha protease diana, forma un complexo permanente que debe ser eliminado. Para as serpinas extracelulares, os complexos finais serpina-encima son retirados rapidamente da circulación. Un mecanismo polo cal isto ocorre en mamíferos é por medio da proteína relacionada co receptor da lipoproteína de baixa densidade (LRP), que se une a complexos inhibitorios creados pola antitrombina, a PA1-1 e a neuroserpina, causando a súa captación celular.[74][75] De maneira semellante, a serpina necrótica de Drosophila degrádase no lisosoma despois de ser transportada á célula polo receptor de lipoforina-1 (homólogo da familia do receptor de LDL de mamíferos).[76]
Enfermidades e serpinopatías
[editar | editar a fonte]As serpinas están envolvidas nunha ampla variedade de funcións fisiolóxicas, e por iso as mutacións nos xenes que os codifican poden causar diversas doenzas. As mutacións que cambian a actividade, especificidade ou propiedades de agregación das serpinas afectan como estas funcionan. A maioría das doenzas relacionadas coas serpinas son o resultado da polimerización das serpinas en agregados, aínda que tamén ocorren outros tipos de mutacións ligadas a enfermidades.[8][77] O trastorno deficiencia de alfa1 antitripsina é unha das enfermidades hereditarias máis comúns.[11][78]
Inactividade ou ausencia
[editar | editar a fonte]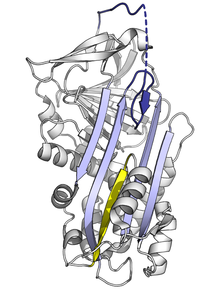
Como o pregamento de serpina estresado é de alta enerxía, as mutacións poden causar que cambien incorrectamente ás súas conformacións de baixa enerxía (por exemplo, a relaxada ou latente) antes de que realizasen debidamente o seu papel inhibitorio.[10]
As mutacións que afectan a taxa ou extensión da inserción do RCL na folla A poden causar que a serpina experimente o seu cambio conformacional de S a R antes de interaccionar cunha protease. Como unha serpina só pode facer este cambio conformacional unha vez, a serpina errada resultante é inactiva e incapaz de controlar axeitadamente á súa protease diana.[10][79] Igualmente, as mutacións que promoven unha transición inapropiada ao estado latente monómero causan enfermidades ao reduciren a cantidade de serpina inhibitoria activa. Por exemplo, as variantes das antitrombina ligadas a enfermidades Wibble e Wobble,[80] promoven ambas a formación do estado latente.
A estrutura do mutante ligado a enfermidades da antiquimotripsina (L55P) revelou outra "conformación δ" inactiva. Na conformación δ, catro residuos do RCL están inseridos na parte superior da folla β A. A metade inferior da folla está chea como resultado de que unha das hélices α (a hélice F) pasou parcialmente a unha conformación de febra β, completando os enlaces de hidróxeno da folla β.[81] Non está claro se outras serpinas poden adoptar este confórmero e se esta conformación ten un papel funcional, mais especúlase que a globulina fixadora da tiroxina pode adoptar a conformación δ durante a liberación da tiroxina.[56] As proteínas non inhibitorias relacionadas coas serpinas poden tamén causar doenzas cando están mutadas. Por exemplo, as mutación na SERPINF1 causan osteoxénese imperfecta tipo VI en humanos.[82]
En ausencia da serpina necesaria, a protease que normalmente regularía está sobreactiva, o que orixina patoloxías.[10] En consecuencia, unha simple deficiencia nunha serpina (por exemplo, unha mutación nula) pode ter como resultado unha enfermidade.[83] Utilízanse knockouts de xenes, especialmente os de ratos, para determinar experimentalmente as funcións normais das serpinas polos efectos observados na súa ausencia.[84]
Cambio de especificidade
[editar | editar a fonte]Nalgúns raros casos, un só cambio de aminoácido nun RCL de serpina altera a súa especificidade de modo que toma como diana unha protease errada. Por exemplo, a mutación Antitripsina-Pittsburgh (M358R) causa que a serpina α1-antitripsina inhiba a trombina, causando un trastorno hemorráxico.[28]
Polimerización e agregación
[editar | editar a fonte]A maioría das enfermidades debidas a serpinas prodúcense por agregación de proteínas e denomínanse "serpinopatías".[12][81] As serpinas son vulnerables a mutacións que causan enfermidades que promoven a formación de polímeros mal pregados debido ás súas estruturas inherentemente inestables.[81] Entre as serpinopatías ben caracterizadas están a deficiencia de α1-antitripsina (alfa1), que pode causar o enfisema familiar, e ás veces cirrose hepática, certas formas familiares de trombose relacionadas coa deficiencia de antitrombina, anxioedema hereditario tipos 1 e 2 relacionados coa deficiencia do inhibidor de C1, e a encefalopatía familiar con corpos de inclusión de neuroserpina (FENIB; un tipo raro de demencia causada pola polimerización da neuroserpina).[11][12][85]
Cada monómero do agregado de serpina encóntrase na conformación relaxada inactiva (co RCL inserido na folla A). Os polímeros son, pois, hiperestables á temperatura e incapaces de inhibir proteases. Polo tanto, as serpinopatías causan patoloxías de xeito similar a outras proteopatías (por edxemplo, enfermidades de prións) por medio de dous mecanismos.[11][12] Primeiro, a falta de serpina activa ten como resultado unha actividade de protease incontrolada e destrución dos tecidos. Segundo, os propios polímeros hiperestables entupen o retículo endoplasmático de células que sintetizan serpinas, resultando finalmente na morte celular e danos nos tecidos. No caso da deficiencia da antitripsina, os polímeros de antitripsina causan a morte de células hepáticas, ás veces dando lugar a danos hepáticos e cirrose. Dentro da célula, os polímeros de serpina son retirados lentamente por degradación no retículo endoplasmático.[86] Porén, os detalles e como os polímeros de serpina causan a morte celular aínda non se comprenden completamente.[11]
Pénsase que os polímeros de serpina fisiolóxicos se forman por eventos de intercambio de dominios, onde un segmento dunha proteína serpina se insire noutro.[87] Os intercambios de dominios ocorren cando as mutacións ou factores ambientais interfiren cos estados finais do pregamento das serpinas ao estado nativo, causando que os intermediarios de alta enerxía se preguen mal.[88] Resolvéronse tanto as estruturas de intercambio de dominios dímeras coma trímeras. No dímero (da antitrombina), o RCL e parte da folla A incorpórase na folla A doutra molécula de serpina.[87] O trímero con intercambio de dominios (da antitripsina) fórmase polo intercambio dunha rexión totalmente diferente da estrutura, a folla B (co RCL de cada molécula inserido na súa propia folla A).[89] Tamén se propuxo que as serpinas poden formar intercambios de dominios inserindo o RCL dunha proteína na folla A doutra (polimerización de folla A).[85][90] Estas estruturas dímeras e trímeras de intercambio de dominios pénsase que son os bloques de construción dos agregados de polímeros que causan enfermidades, pero o mecanismo exacto aínda non está claro.[87][88][89][91]
Estratexias terapéuticas
[editar | editar a fonte]Están utilizándose ou investigándose varias estratexias terapéuticas para tratar a serpinopatía máis común: a deficiencia de antitripsina.[11] A terapia de aumento da antitripsina está aprobada para o enfisema relacionado coa deficiencia de antitripsina grave.[92] Nesta terapia, a antitripsina é purificada do plasma sanguíneo de doantes de sangue e administrada por vía intravenosa (comercializada inicialmente como Prolastin).[11][93] O transplante de pulmón e fígado demostrou ser efectivo para tratar a enfermidade relacionada coa deficiencia de antitripsina grave.[11][94] En modelos animais, o gene targeting en células nais pluripotentes inducidas foi utilizado con éxito para corrixir un defecto de polimerización de antitripsina e para restaurar a capacidade do fígado dos mamíferos de segregar antitripsina activa.[95] Tamén se desenvolveron pequenas moléculas que bloquean a polimerización da antitripsina in vitro.[96][97]
Evolución
[editar | editar a fonte]As serpinas son a superfamilia de inhibidores de proteases máis grande e máis amplamente distribuída.[1][40] Pensouse inicialmente que estaban restrinxidas a organismos eucariotas, pero despois atopáronse en bacterias, arqueas e algúns virus.[36][37][98] Segue sen estar claro se os xenes procariotas son os descendentes dunha serpina procariota ancestral ou son o produto da transferencia horizontal de xenes desde os eucariotas. A maioría das serpinas intracelulares pertencen a un só clado filoxenético, tanto se proceden de plantas coma de animais, o que indica que as serpinas intra e extracelulares puideron diverxer antes de que o fixesen as plantas e os animais.[99] Excepcións son a serpina de choque térmico intracelular HSP47, que é unha chaperona esencial para conseguir o correcto pregamento do coláxeno, e cicla entre o cis-Golgi e o retículo endoplasmático.[58]
Pénsase que a inhibición de proteases é a súa función ancestral, e os membros non inhibitorios resultarían da neofuncionalización evolutiva da estrutura. O cambio conformacional de S a R tamén foi adaptado por algunhas serpinas ligadoras para regular a afinidade polas súas dianas.[56]
Distribución
[editar | editar a fonte]Animal
[editar | editar a fonte]Humanos
[editar | editar a fonte]O xenoma humano codifica 16 clados de serpinas, denominadas por orde alfabética desde serpinA a serpinP, incluíndo 29 proteínas serpina inhibitorias e 7 non inhibitorias.[9][84] O sistema de nomenclatura das serpinas humanas está baseado nunha análise filoxenética de aproximadamente 500 serpinas feito desde 2001, con proteínas chamadas serpinXY, onde X é o clado da proteína e Y é o número da proteína dentro do clado.[1][36][84] As funcións das serpinas humanas foron determinadas por unha combinación de estudos bioquímicos, trastornos xenéticos humanos, e modelos de ratos knockout.[84]
| Nome do xene | Nome común | Localización | Función / Actividade[9][84] | Efecto da deficiencia[9][84] | Enfermidade humana | Localización cromosómica | Estrutura da proteína |
|---|---|---|---|---|---|---|---|
| SERPINA1 | α1-antitripsina | Extracelular | Inhibidor da elastase de neutrófilo humana.[100] O fragmento C-terminal da SERPINA1 clivada pode inhibir a infección polo VIH-1.[101] | A deficiencia ten como resultado enfisema, a polimerización causa cirrose (serpinopatía).[11][102] | 14q32.1 | 1QLP, 7API, 1D5S | |
| SERPINA2 | Proteína relacionada coa antitripsina | Extracelular | Posible pseudoxene.[103] | 14q32.1 | |||
| SERPINA3 | α1-antiquimotripsina | Extracelular | Inhibidor da catepsina G.[104] Funcións adicionais na condensación da cromatina en células hepáticas.[105] | A mala regulación ten como resultado a enfermidade de Alzheimer (serpinopatía).[106] | 14q32.1 | 1YXA, 2ACH | |
| SERPINA4 | Calistatina | Extracelular | Inhibidor da calicreína, regulador da función vascular.[107][108] | A depleción en ratas hipertensivas exacerba as lesións renais e cardiovasculares.[109] | 14q32.1 | ||
| SERPINA5 | Inhibidor da proteína C | Extracelular | Inhibidor da proteína C activa.[110] Papel intracelular de impedir a fagocitose das bacterias.[111] | O knockout en ratos macho causa infertilidade.[112] A acumulación ocorre en placas activas crónicas na esclerose múltiple.[113] | 14q32.1 | 2OL2, 3B9F | |
| SERPINA6 | Transcortina | Extracelular | Non inhibitoria. Únese ao cortisol.[55] | Deficiencia asociada coa fatiga crónica.[114] | 14q32.1 | 2V6D, 2VDX, 2VDY | |
| SERPINA7 | Globulina fixadora da tiroxina | Extracelular | Non inhibitoria. Únese á tiroxina.[56] | A deficiencia causa hipotiroidismo.[115][116] | Xq22.2 | 2CEO, 2RIV, 2RIW | |
| SERPINA8 | Anxiotensinóxeno | Extracelular | Non inhibitoria, a clivaxe pola renina causa a liberación da anxiotensina I.[117] | O knockout en ratos causa hipotensión.[118] | Variantes ligadas coa hipertensión.[119][120][121] | 1q42-q43 | 2X0B, 2WXW, 2WXX, 2WXY, 2WXZ, 2WY0, 2WY1 |
| SERPINA9 | Centerina / GCET1 | Extracelular | Inhibitoria, mantemento de células B virxes.[122][123] | Fortemente expresada na maioría dos linfomas de células B.[124][125] | 14q32.1 | ||
| SERPINA10 | Inhibidor da protease relacionado con proteína Z | Extracelular | Únese á proteína Z e inactiva o factor Xa e o factor XIa.[126] | 14q32.1 | 3F1S, 3H5C | ||
| SERPINA11 | – | Probablemente extracelular | Descoñecida | 14q32.13 | |||
| SERPINA12 | Vaspina | Extracelular | Inhibidor da calicreína-7. Adipocitocina sensibilizante á insulina.[127] | Os altos niveis plasmáticos están asociados coa diabetes tipo II.[128] | 14q32.1 | 4IF8 | |
| SERPINA13 | – | Probablemente extracelular | Descoñecido | 14q32 | |||
| SERPINB1 | Inhibidor da elastase do neutrófilo monocito | Intracelular | Inhibidor da elastase do neutrófilo.[129] | O knockout en ratos causa o defecto de supervivencia de neutrófilos e deficiencia inmune.[130] | 6p25 | 1HLE | |
| SERPINB2 | Inhibidor do activador do plasminóxeno 2 | Intracelular/extracelular | Inhibidor do uPA extracelular. A función intracelular non está clara, pero pode protexer contra a infección viral.[131] | A deficiencia en ratos reduce a resposta inmune á infección por nematodos.[132] O knockout en ratos non causa un fenotipo obvio.[133] | 18q21.3 | 1BY7 | |
| SERPINB3 | Antíxeno 1 de carcinoma de célula escamosa (SCCA1) | Intracelular | Inhibidor de cisteína proteases similares á papaína[45] e as catepsinas K, L e S.[134][135] | O knockout en ratos da Serpinb3a (o homólogo murino das SERPINB3 e SERPINB4 humanas) reduce a produción de moco nun modelo murino de asma.[136] | 18q21.3 | 2ZV6 | |
| SERPINB4 | Antíxeno 2 de carcinoma de célula escamosa (SCCA2) | Intracelular | Inhibidor de serina proteases similares á quimotripsina, catepsina G e quimase.[135][137] | O knockout en ratos da Serpinb3a (o homólogo murino das SERPINB3 e SERPINB4 humanas) reduce a produción de moco nun modelo murino de asma.[136] | 18q21.3 | ||
| SERPINB5 | Maspina | Intracelular | Non inhibitoria, función pouco clara[138][139][140] (ver tamén maspina) | O knockout en ratos indicou orixinalmente que era letal,[141] pero posteriomente mostrou non ter un fenotipo obvio.[140] A expresión pode ser un indicador prognóstico que reflicte a expresión dun xene supresor de tumores veciño (a fosfatase PHLPP1).[140] | 18q21.3 | 1WZ9 | |
| SERPINB6 | PI-6 | Intracelular | Inhibidor da catepsina G.[142] | O knockout en ratos causa perda de audición[143] e unha suave neutropenia.[144] | A deficiencia está asociada coa perda de audición.[145] | 6p25 | |
| SERPINB7 | Megsina | Intracelular | Implicado na maduración dos megacariocitos.[146] | A sobreexpresión en ratos causa enfermidade renal.[147] O knockout en ratos non causa anormalidades histolóxicas.[147] | As mutacións asociadas coa queratose palmoplantar tipo Nagashima.[148] | 18q21.3 | |
| SERPINB8 | PI-8 | Intracelular | Possible inhibidor da furina.[149] | 18q21.3 | |||
| SERPINB9 | PI-9 | Intracelular | Inhibidor do gránulo citotóxico da protease grancima B.[150] | O knockout en ratos causa disfunción immune.[151][152] | 6p25 | ||
| SERPINB10 | Bomapina | Intracelular | Descoñecido[153] | O knockout en ratos non causa e fenotipo obvio (C57/BL6; cepa de laboratorio BC069938). | 18q21.3 | ||
| SERPINB11 | Intracelular | Descoñecido[154] | A Serpinb11 murina é un inhibidor activo, mentres que o ortólogo humano é inactivo.[154] A deficiencia en ponis está asociada coa enfermidade da separación da parede do casco.[155] | 18q21.3 | |||
| SERPINB12 | Yukopina | Intracelular | Descoñecido[156] | 18q21.3 | |||
| SERPINB13 | Hurpina/Headpina | Intracelular | Inhibidor de cisteína proteases similar a papaína.[157] | 18q21.3 | |||
| SERPINC1 | Antitrombina | Extracelular | Inhibidor da coagulación, especificamente do factor X, factor IX e trombina.[34] | Os knockouts en ratos son letais.[158] | A deficiencia ten como resultado a trombose e outros trastornos de coagulación (serpinopatía).[159][160] | 1q23-q21 | 2ANT, 2ZNH, 1AZX, 1TB6, 2GD4, 1T1F |
| SERPIND1 | Cofactor II da heparina | Extracelular | Inhibidor da trombina.[161] | Os knockouts en ratos son letais.[162] | 22q11 | 1JMJ, 1JMO | |
| SERPINE1 | Inhibidor do activador do plasminóxeno 1 | Extracelular | Inhibidor da trombina, uPA e TPa.[163] | 7q21.3-q22 | 1DVN, 1OC0 | ||
| SERPINE2 | Nexina derivada da glía / Protease nexina I | Extracelular | Inhibidor de uPA e tPA.[164] | A expresión anormal leva á infertilidade do macho en ratos.[165] O knockout en ratos causa epilepsia.[166] | 2q33-q35 | 4DY0 | |
| SERPINF1 | Factor derivado do epitelio pigmentado | Extracelular | Potente molécula antianxioxénica non inhibidora.[167] A PEDF únese ao glicosaminoglicano hialurona.[168] | O knockout en ratos afecta aos vasos sanguíneos e a masa do páncreas e próstata.[167] Promove a renovación dependente de Notch das células nais neurais periventriculares adultas.[169] As mutacións en humanos causan osteoxénese imperfecta tipo VI.[82] | 17p13.3 | 1IMV | |
| SERPINF2 | α2-antiplasmina | Extracelular | Inhibidor da plasmina, inhibidor da fibrinólise.[170] | Os knockouts en ratos mostran en ratos un incremento da fibrinólise pero non trastornos hemorráxicos.[171] | A deficiencia causa un raro trastorno hemorráxico.[172][173] | 17pter-p12 | 2R9Y |
| SERPING1 | Inhibidor do Complemento 1 | Extracelular | Inhibidor da esterase C1.[174] | Varios polimorfismos asociados coa dexeneración macular[175] e o anxioedema hereditario.[176] | 11q11-q13.1 | 2OAY | |
| SERPINH1 | Proteína de choque térmico de 47 kDa (HSP47) | Intracelular | Non inhibidora, chaperona molecular no pregamento do coláxeno.[58] | Os knockouts en ratos son letais.[177] | A mutación en humanos causa osteoxénese imperfecta grave.[178][179] | 11p15 | 4AXY |
| SERPINI1 | Neuroserpina | Extracelular | Inhibidor do tPA, uPA e plasmina.[180] | A mutación causa a demencia FENIB (serpinopatía).[181][182] | 3q26 | 1JJO, 3FGQ, 3F5N, 3F02 | |
| SERPINI2 | Pancpina | Extracelular | Descoñecida[183] | A deficiencia en ratos causa insuficiencia pancreática pola perda de células acinares.[184] | 3q26 |
Serpinas de mamíferos especializadas
[editar | editar a fonte]Identificáronse moitas serpinas de mamíferos que non comparten unha ortoloxía obvia coas serpinas correspondentes humanas. Son exemplos as numerosas serpinas de roedores (especialmente algunhas das serpinas intracelulares murinas) así como as serpinas uterinas. O termo serpina uterina aplícase a membros do clado da serpina A que están codificados polo xene SERPINA14. As serpinas uterinas prodúcense no endometrio dun grupo restrinxido de mamíferos do clado Laurasiatheria baixo a influencia da proxesterona ou estróxeno.[185] Probablemente non son inhibidores das proteases funcionais e poderían funcionar durante o embarazo para inhibiren as respostas inmunes maternas contra o concepto ou participaren no transporte transplacentario.[186]
Insectos
[editar | editar a fonte]O xenoma de Drosophila melanogaster contén 29 xenes que codifican serpinas. A análise das secuencias de aminoácidos serviu para situar 14 destas serpinas no clado Q das serpinas e 3 no clado K, mentres que as 12 restantes se clasifican como serpinas orfas que non pertencen a ningún clado.[187] O sistema de clasificación de clados é difícil de usar para as serpinas de Drosophila e no seu lugar adoptouse un sistema de nomenclatura baseado na posición dos xenes das serpinas nos cromosomas de Drosophila. Trece das serpinas de Drosophila aparecen como xenes illados no xenoma (incluíndo a Serpina-27A, ver máis abaixo), e as 16 restantes están organizadas en cinco agrupacións de xenes que se encontran nas posicións cromosómicas 28D (2 serpinas), 42D (5 serpinas), 43A (4 serpinas), 77B (3 serpinas) e 88E (2 serpinas).[187][188][189]
Estudos das serpinas de Drosophila revelan que a Serpina-27A inhibe a proteasee Easter (a protease final no cadoiro proteolítico de Nudel, Gastrulation Defective, Snake e Easter) e así controla os padróns dorsoventrais. Easter funciona clivando Spätzle (un ligando de tipo quimoquina), o que ten como resultado a sinalización mediada por Toll. Ademais do seu papel central no establecemento dos padróns embrionarios, a sinalización de Toll é tamén importante para a resposta inmunitaria innata en insectos. Por conseguinte, a serpina-27A tamén funciona controlando a resposta inmune dos insectos.[49][190][191] No coleóptero Tenebrio molitor unha proteína (SPN93) que comprende dous dominios de serpina dispostos en tándem funciona regulando o cadoiro proteolítico de Toll.[192]
Nematodos
[editar | editar a fonte]O xenoma do verme nematodo Caenorhabditis elegans contén 9 serpinas, todas as cales carecen de secuencia sinal e, polo tanto, son probablemente intracelulares.[193] Porén, só 5 destas serpinas parecen funcionar como inhibidores das proteases.[193] Unha, a SRP-6, realiza unha función protectora contra a distorsión lisosómica asociada á calpaína inducida polo estrés. Ademais, a SRP-6 inhibe as cisteína proteases lisosómicas liberadas despois da rotura do lisosoma. En consecuencia, os vermes que carecen de SRP-6 son sensible ao estrés. Hai que salientar que os vermes knockout para SRP-6 morren cando se meten en auga (o fenotipo de estrés hipoosmótico letal ou Osl). Suxeriuse, polo tanto, que os lisosomas xogan un papel xeral e controlable na determinación do destino celular.[194]
Plantas
[editar | editar a fonte]As serpinas de plantas estaban entre os primeiros membros da superfamilia que se identificaron.[195] A serpina proteína Z da cebada é moi abundante no gran de cebada e é un dos compoñentes proteicos principais na cervexa. O xenoma da planta modelo Arabidopsis thaliana contén 18 xenes similares aos das serpinas, aínda que só 8 deles teñen secuencias de serpina de lonxitude completa.
As serpinas de plantas son potentes inhibidores das serina proteases similares á quimotripsina de mamíferos in vitro, o exemplo mellor estudado é a serpina ZX da cebada (BSZx), que pode inhibir a tripsina e quimotripsina, así como varios factores de coagulación do sangue.[196] Porén, as plantas carecen de parentes próximos das serina proteases similares á quimotripsina. O RCL de varias serpinas do trigo e centeo conteñen secuencias repetidas poli-Q similares ás presentes nas proteínas de almacenamento prolaminas do endosperma.[197][198] Polo tanto, suxeriuse que as serpinas de plantas poden funcionar inhibindo proteases de insectos ou microbios que doutro modo dixerirían as proteínas de almacenamento dos grans de cereais. Un apoio para esta hipótese é que se identificaron serpinas específicas de plantas no zume do floema da cabaza (CmPS-1)[199] e do cogombro.[200][201] Aínda que se observou unha corelación inversa entre a regulación á alza da expresión de CmPS-1 e a supervivencia de áfidos, os experimentos de alimentación in vitro revelaron que a CmPS-1 recombinante non parecía afectar a supervivencia dos insectos.[199]
Propuxéronse funcións alternativas e dianas de proteases para as serpinas de plantas. A serpina de Arabidopsis, AtSerpin1 (At1g47710; 3LE2), é mediadora dun axuste do control sobre a morte celular programada ao afectar a cisteína protease similar á papaína chamada 'Responsive to Desiccation-21' (RD21).[54][202] A AtSerpin1 tamén inhibe as proteases similares á metacaspase in vitro.[53] Outras dúas serpinas de Arabidopsis, AtSRP2 (At2g14540) e AtSRP3 (At1g64030) parecen estar implicadas en respostas a danos no ADN.[203]
Fúnxicas
[editar | editar a fonte]Caracterizouse unha soa serpina fúnxica ata agora: a celpina do fungo Piromyces spp. cepa E2. Piromyces é un xénero de fungos anaerobios que se atopan no rume de ruminantes e é importante para dixerir material vexetal. Predise que a celpina é inhibitoria e contén dous dominios de dockerina N-terminais ademais do seu dominio de serpina. As dockerinas atópanse comunmente en proteínas que se localizan no celulosoma fúnxico, un gran complexo multiproteico extracelular que degrada a celulosa.[38] En consecuencia, suxeriuse que a celpina pode protexer o celulosoma contra as proteases das plantas. Certas serpinas bacterianas localízanse igualmente no celulosoma.[204]
Procariotas
[editar | editar a fonte]Os xenes de serpinas preditos están distribuídos esporadicamente en procariotas. Os estudos in vitro sobre algunhas destas moléculas revelaron que poden inhibir as proteases, e sinalouse que funcionan como inhibidores in vivo. Varias serpinas procariotas atópanse en extremófilos. Polo tanto, e a diferenza das serpinas de mamíferos, estas moléculas posúen unha elevada resistencia á desnaturalización por calor.[205][206] O papel preciso da maioría das serpinas bacterianas segue sen estar claro, aínda que a serpina de Clostridium thermocellum localízase no celulosoma. Suxeriuse que o papel das serpinas asociadas ao celulosoma pode ser impedir a actividade de proteases non desexada contra o celulosoma.[204]
Virais
[editar | editar a fonte]Os virus tamén expresan serpinas como unha maneira de evadirse da defensa inmunitaria do hóspede.[207] As serpinas expresadas por Poxviridae, como o o virus da varíola das vacas (vaccinia) e da varíola do coello (mixoma), son interesantes debido ao seu potencial uso como novas terapéuticas para os trastornos inmunes e inflamatorios e na terapia de transplantes.[208][209] A Serp1 suprime a resposta inmune innata mediada por TLR e permite unha supervivencia indefinida de aloenxertos en ratas.[208][210] a Crma e a Serp2 son inhibidores de clase cruzada e a súa diana son serina proteases (grancima B; aínda que feblemente) e cisteína proteases (caspase 1 e caspase 8).[211][212] En comparación cos seus equivalentes en mamíferos, as serpinas virais conteñen delecións significativas de elementos de estrutura secundaria. Especificamente, o crmA carece de hélice D así como de porcións significativas das hélices A e E.[213]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 1,3 1,4 Silverman GA, Bird PI, Carrell RW, Church FC, Coughlin PB, Gettins PG, Irving JA, Lomas DA, Luke CJ, Moyer RW, Pemberton PA, Remold-O'Donnell E, Salvesen GS, Travis J, Whisstock JC (setembro de 2001). "The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature". The Journal of Biological Chemistry 276 (36): 33293–33296. PMID 11435447. doi:10.1074/jbc.R100016200.
- ↑ Spence MA, Mortimer MD, Buckle AM, Minh BQ, Jackson CJ (xuño de 2021). Echave J, ed. "A Comprehensive Phylogenetic Analysis of the Serpin Superfamily". Molecular Biology and Evolution 38 (7): 2915–2929. PMC 8233489. PMID 33744972. doi:10.1093/molbev/msab081.
- ↑ Carrell RW, Boswell DR (1986). Barrett AJ, Salvesen G, eds. Serpins: the superfamily of plasma serine proteinase inhibitors. Proteinase Inhibitors (en English) (Amsterdam: Elsevier Science Publishers BV). pp. 403–420. ISBN 0-444-80763-2.
- ↑ Silverman GA, Whisstock JC, Bottomley SP, Huntington JA, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Bird PI (agosto de 2010). "Serpins flex their muscle: I. Putting the clamps on proteolysis in diverse biological systems". The Journal of Biological Chemistry 285 (32): 24299–24305. PMC 2915665. PMID 20498369. doi:10.1074/jbc.R110.112771.
- ↑ Whisstock JC, Silverman GA, Bird PI, Bottomley SP, Kaiserman D, Luke CJ, Pak SC, Reichhart JM, Huntington JA (agosto de 2010). "Serpins flex their muscle: II. Structural insights into target peptidase recognition, polymerization, and transport functions". The Journal of Biological Chemistry 285 (32): 24307–24312. PMC 2915666. PMID 20498368. doi:10.1074/jbc.R110.141408.
- ↑ 6,0 6,1 6,2 6,3 Huntington JA, Read RJ, Carrell RW (outubro de 2000). "Structure of a serpin-protease complex shows inhibition by deformation". Nature 407 (6806): 923–926. Bibcode:2000Natur.407..923H. PMID 11057674. doi:10.1038/35038119.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 Gettins PG (decembro de 2002). "Serpin structure, mechanism, and function". Chemical Reviews 102 (12): 4751–4804. PMID 12475206. doi:10.1021/cr010170.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 Whisstock JC, Bottomley SP (decembro de 2006). "Molecular gymnastics: serpin structure, folding and misfolding". Current Opinion in Structural Biology 16 (6): 761–768. PMID 17079131. doi:10.1016/j.sbi.2006.10.005.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 Law RH, Zhang Q, McGowan S, Buckle AM, Silverman GA, Wong W, Rosado CJ, Langendorf CG, Pike RN, Bird PI, Whisstock JC (2006). "An overview of the serpin superfamily". Genome Biology 7 (5): 216. PMC 1779521. PMID 16737556. doi:10.1186/gb-2006-7-5-216.
- ↑ 10,0 10,1 10,2 10,3 10,4 Stein PE, Carrell RW (febreiro de 1995). "What do dysfunctional serpins tell us about molecular mobility and disease?". Nature Structural Biology 2 (2): 96–113. PMID 7749926. doi:10.1038/nsb0295-96.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 11,8 Janciauskiene SM, Bals R, Koczulla R, Vogelmeier C, Köhnlein T, Welte T (agosto de 2011). "The discovery of α1-antitrypsin and its role in health and disease". Respiratory Medicine 105 (8): 1129–1139. PMID 21367592. doi:10.1016/j.rmed.2011.02.002.
- ↑ 12,0 12,1 12,2 12,3 Carrell RW, Lomas DA (xullo de 1997). "Conformational disease". Lancet 350 (9071): 134–138. PMID 9228977. doi:10.1016/S0140-6736(97)02073-4.
- ↑ Fermi C, Pernossi L (decembro de 1894). "Untersuchungen uber die enzyme, Vergleichende Studie" [Studies on the enzyme, Comparative study] (PDF). Zeitschrift für Hygiene und Infektionskrankheiten (en alemán) (18): 83–89. doi:10.1007/BF02216836.
- ↑ Schultze HU, Göllner I, Heide K, Schönenberger M, Schwick G (agosto de 1955). "Zur Kenntnis der alpha-globulin des menschlichen normal serums" [For knowledge of the alpha - globulin of human normal serums]. Zeitschrift für Naturforschung B (en alemán) 10 (8): 463. doi:10.1515/znb-1955-0810.
- ↑ Petersen TE, Dudeck-Wojciechowska G, Sottrup-Jensen L, Magnusson S (1979). "Primary structure of antithrombin III (heparin cofactor): partial homology between alpha-1-antitrypsin and antithrombin III". En Collen D, Wiman B, Verstraete M. The Physiological Inhibitors of Coagulation and Fibrinolysis. Amsterdam: Elsevier. pp. 43–54.
- ↑ Carrell R, Owen M, Brennan S, Vaughan L (decembo de 1979). "Carboxy terminal fragment of human alpha-1-antitrypsin from hydroxylamine cleavage: homology with antithrombin III". Biochemical and Biophysical Research Communications 91 (3): 1032–1037. PMID 316698. doi:10.1016/0006-291X(79)91983-1.
- ↑ Hunt LT, Dayhoff MO (xullo de 1980). "A surprising new protein superfamily containing ovalbumin, antithrombin-III, and alpha 1-proteinase inhibitor". Biochemical and Biophysical Research Communications 95 (2): 864–871. PMID 6968211. doi:10.1016/0006-291X(80)90867-0.
- ↑ Carrell RW, Jeppsson JO, Laurell CB, Brennan SO, Owen MC, Vaughan L, Boswell DR (xullo de 1982). "Structure and variation of human alpha 1-antitrypsin". Nature 298 (5872): 329–334. PMC 7172600. PMID 7045697. doi:10.1016/0968-0004(85)90011-8.
- ↑ Laurell CB, Eriksson S (marzo de 2013). "The electrophoretic α1-globulin pattern of serum in α1-antitrypsin deficiency. 1963". Copd 10 (Suppl 1): 3–8. PMID 23527532. doi:10.3109/15412555.2013.771956.
- ↑ Sharp HL, Bridges RA, Krivit W, Freier EF (xuño de 1969). "Cirrhosis associated with alpha-1-antitrypsin deficiency: a previously unrecognized inherited disorder". The Journal of Laboratory and Clinical Medicine 73 (6): 934–939. PMID 4182334.
- ↑ "Alpha-1-antitrypsin: molecular abnormality of S variant". British Medical Journal 1 (6002): 130–131. xaneiro de 1976. PMC 1638590. PMID 1082356. doi:10.1136/bmj.1.6002.130-a.
- ↑ Jeppsson JO (xuño de 1976). "Amino acid substitution Glu leads to Lys alpha1-antitrypsin PiZ". FEBS Letters 65 (2): 195–197. PMID 1084290. doi:10.1016/0014-5793(76)80478-4.
- ↑ Carrell RW, Jeppsson JO, Laurell CB, Brennan SO, Owen MC, Vaughan L, Boswell DR (xullo de 1982). "Structure and variation of human alpha 1-antitrypsin". Nature 298 (5872): 329–334. Bibcode:1982Natur.298..329C. PMID 7045697. doi:10.1038/298329a0.
- ↑ Carrell RW, Boswell DR, Brennan SO, Owen MC (marzo de 1980). "Active site of alpha 1-antitrypsin: homologous site in antithrombin-III". Biochemical and Biophysical Research Communications 93 (2): 399–402. PMID 6966929. doi:10.1016/0006-291X(80)91090-6.
- ↑ Johnson D, Travis J (outubro de 1978). "Structural evidence for methionine at the reactive site of human alpha-1-proteinase inhibitor". The Journal of Biological Chemistry 253 (20): 7142–7144. PMID 701239. doi:10.1016/S0021-9258(17)34475-7.
- ↑ Jörnvall H, Fish WW, Björk I (outubro de 1979). "The thrombin cleavage site in bovine antithrombin". FEBS Letters 106 (2): 358–362. PMID 499520. doi:10.1016/0014-5793(79)80532-3.
- ↑ Egeberg O (xuño de 1965). "Inherited antithrombin deficiency causing thrombophilia". Thrombosis et Diathesis Haemorrhagica 13 (2): 516–530. PMID 14347873. doi:10.1055/s-0038-1656297.
- ↑ 28,0 28,1 Owen MC, Brennan SO, Lewis JH, Carrell RW (setembro de 1983). "Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder". The New England Journal of Medicine 309 (12): 694–698. PMID 6604220. doi:10.1056/NEJM198309223091203.
- ↑ 29,0 29,1 Loebermann H, Tokuoka R, Deisenhofer J, Huber R (agosto de 1984). "Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function". Journal of Molecular Biology 177 (3): 531–557. PMID 6332197. doi:10.1016/0022-2836(84)90298-5.
- ↑ 30,0 30,1 Stein PE, Leslie AG, Finch JT, Turnell WG, McLaughlin PJ, Carrell RW (setembro de 1990). "Crystal structure of ovalbumin as a model for the reactive centre of serpins". Nature 347 (6288): 99–102. Bibcode:1990Natur.347...99S. PMID 2395463. doi:10.1038/347099a0.
- ↑ 31,0 31,1 Carrell RW, Evans DL, Stein PE (outubro de 1991). "Mobile reactive centre of serpins and the control of thrombosis". Nature 353 (6344): 576–578. Bibcode:1991Natur.353..576C. PMID 1922367. doi:10.1038/353576a0.
- ↑ Mottonen J, Strand A, Symersky J, Sweet RM, Danley DE, Geoghegan KF, Gerard RD, Goldsmith EJ (xaneiro de 1992). "Structural basis of latency in plasminogen activator inhibitor-1". Nature 355 (6357): 270–273. Bibcode:1992Natur.355..270M. PMID 1731226. doi:10.1038/355270a0.
- ↑ Austin RC, Rachubinski RA, Ofosu FA, Blajchman MA (maio de 1991). "Antithrombin-III-Hamilton, Ala 382 to Thr: an antithrombin-III variant that acts as a substrate but not an inhibitor of alpha-thrombin and factor Xa". Blood 77 (10): 2185–2189. PMID 2029579. doi:10.1182/blood.V77.10.2185.2185.
- ↑ 34,0 34,1 34,2 Huntington JA (agosto de 2006). "Shape-shifting serpins--advantages of a mobile mechanism". Trends in Biochemical Sciences 31 (8): 427–435. PMID 16820297. doi:10.1016/j.tibs.2006.06.005.
- ↑ Carrell RW, Read RJ (febreiro de 2017). "How serpins transport hormones and regulate their release". Seminars in Cell & Developmental Biology 62: 133–141. PMID 28027946. doi:10.1016/j.semcdb.2016.12.007.
- ↑ 36,0 36,1 36,2 Irving JA, Pike RN, Lesk AM, Whisstock JC (decembro de 2000). "Phylogeny of the serpin superfamily: implications of patterns of amino acid conservation for structure and function". Genome Research 10 (12): 1845–1864. PMID 11116082. doi:10.1101/gr.GR-1478R.
- ↑ 37,0 37,1 Irving JA, Steenbakkers PJ, Lesk AM, Op den Camp HJ, Pike RN, Whisstock JC (novembro de 2002). "Serpins in prokaryotes". Molecular Biology and Evolution 19 (11): 1881–1890. PMID 12411597. doi:10.1093/oxfordjournals.molbev.a004012.
- ↑ 38,0 38,1 Steenbakkers PJ, Irving JA, Harhangi HR, Swinkels WJ, Akhmanova A, Dijkerman R, Jetten MS, van der Drift C, Whisstock JC, Op den Camp HJ (agosto de 2008). "A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2". Mycological Research 112 (Pt 8): 999–1006. PMID 18539447. doi:10.1016/j.mycres.2008.01.021. hdl:2066/72679.
- ↑ Huber R, Carrell RW (novembro de 1989). "Implications of the three-dimensional structure of alpha 1-antitrypsin for structure and function of serpins". Biochemistry 28 (23): 8951–8966. PMID 2690952. doi:10.1021/bi00449a001.
- ↑ 40,0 40,1 Rawlings ND, Tolle DP, Barrett AJ (marzo de 2004). "Evolutionary families of peptidase inhibitors". The Biochemical Journal 378 (Pt 3): 705–716. PMC 1224039. PMID 14705960. doi:10.1042/BJ20031825.
- ↑ Barrett AJ, Rawlings ND (abril de 1995). "Families and clans of serine peptidases". Archives of Biochemistry and Biophysics 318 (2): 247–250. PMID 7733651. doi:10.1006/abbi.1995.1227.
- ↑ Barrett AJ, Rawlings ND (maio de 2001). "Evolutionary lines of cysteine peptidases". Biological Chemistry 382 (5): 727–733. PMID 11517925. doi:10.1515/BC.2001.088.
- ↑ Irving JA, Pike RN, Dai W, Brömme D, Worrall DM, Silverman GA, Coetzer TH, Dennison C, Bottomley SP, Whisstock JC (abril de 2002). "Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases". Biochemistry 41 (15): 4998–5004. PMID 11939796. doi:10.1021/bi0159985.
- ↑ Izuhara K, Yamaguchi Y, Ohta S, Nunomura S, Nanri Y, Azuma Y, Nomura N, Noguchi Y, Aihara M. Squamous Cell Carcinoma Antigen 2 (SCCA2, SERPINB4): An Emerging Biomarker for Skin Inflammatory Diseases. Int J Mol Sci. 6 de abril de 2018;19(4):1102. doi: 10.3390/ijms19041102. PMID 29642409 ; PMCID: PMC5979376. Cita:"Os antíxenos 1 e 2 do carcinoma de células escamosas (SCCA1 e 2, SERPIN B3 e B4), membros da familia das serpinas serpina da ovoalbumina (ov-serpina)/clado B..."
- ↑ 45,0 45,1 Schick C, Brömme D, Bartuski AJ, Uemura Y, Schechter NM, Silverman GA (novembro de 1998). "The reactive site loop of the serpin SCCA1 is essential for cysteine proteinase inhibition". Proceedings of the National Academy of Sciences of the United States of America 95 (23): 13465–13470. Bibcode:1998PNAS...9513465S. PMC 24842. PMID 9811823. doi:10.1073/pnas.95.23.13465.
- ↑ 46,0 46,1 McGowan S, Buckle AM, Irving JA, Ong PC, Bashtannyk-Puhalovich TA, Kan WT, Henderson KN, Bulynko YA, Popova EY, Smith AI, Bottomley SP, Rossjohn J, Grigoryev SA, Pike RN, Whisstock JC (xullo de 2006). "X-ray crystal structure of MENT: evidence for functional loop-sheet polymers in chromatin condensation". The EMBO Journal 25 (13): 3144–3155. PMC 1500978. PMID 16810322. doi:10.1038/sj.emboj.7601201.
- ↑ Ong PC, McGowan S, Pearce MC, Irving JA, Kan WT, Grigoryev SA, Turk B, Silverman GA, Brix K, Bottomley SP, Whisstock JC, Pike RN (decembro de 2007). "DNA accelerates the inhibition of human cathepsin V by serpins". The Journal of Biological Chemistry 282 (51): 36980–36986. PMID 17923478. doi:10.1074/jbc.M706991200.
- ↑ 48,0 48,1 Acosta H, Iliev D, Grahn TH, Gouignard N, Maccarana M, Griesbach J, Herzmann S, Sagha M, Climent M, Pera EM (marzo de 2015). "The serpin PN1 is a feedback regulator of FGF signaling in germ layer and primary axis formation". Development 142 (6): 1146–1158. PMID 25758225. doi:10.1242/dev.113886.
- ↑ 49,0 49,1 49,2 Hashimoto C, Kim DR, Weiss LA, Miller JW, Morisato D (decembro de 2003). "Spatial regulation of developmental signaling by a serpin". Developmental Cell 5 (6): 945–950. PMID 14667416. doi:10.1016/S1534-5807(03)00338-1.
- ↑ Bird PI (febreiro de 1999). "Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins". Immunology and Cell Biology 77 (1): 47–57. PMID 10101686. doi:10.1046/j.1440-1711.1999.00787.x.
- ↑ Bird CH, Sutton VR, Sun J, Hirst CE, Novak A, Kumar S, Trapani JA, Bird PI (novembro de 1998). "Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway". Molecular and Cellular Biology 18 (11): 6387–6398. PMC 109224. PMID 9774654. doi:10.1128/mcb.18.11.6387.
- ↑ Ray CA, Black RA, Kronheim SR, Greenstreet TA, Sleath PR, Salvesen GS, Pickup DJ (maio de 1992). "Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme". Cell 69 (4): 597–604. PMID 1339309. doi:10.1016/0092-8674(92)90223-Y.
- ↑ 53,0 53,1 Vercammen D, Belenghi B, van de Cotte B, Beunens T, Gavigan JA, De Rycke R, Brackenier A, Inzé D, Harris JL, Van Breusegem F (decembro de 2006). "Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9". Journal of Molecular Biology 364 (4): 625–636. PMID 17028019. doi:10.1016/j.jmb.2006.09.010.
- ↑ 54,0 54,1 Lampl N, Budai-Hadrian O, Davydov O, Joss TV, Harrop SJ, Curmi PM, Roberts TH, Fluhr R (abril de 2010). "Arabidopsis AtSerpin1, crystal structure and in vivo interaction with its target protease RESPONSIVE TO DESICCATION-21 (RD21)". The Journal of Biological Chemistry 285 (18): 13550–13560. PMC 2859516. PMID 20181955. doi:10.1074/jbc.M109.095075.
- ↑ 55,0 55,1 55,2 Klieber MA, Underhill C, Hammond GL, Muller YA (outubro de 2007). "Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release". The Journal of Biological Chemistry 282 (40): 29594–29603. PMID 17644521. doi:10.1074/jbc.M705014200.
- ↑ 56,0 56,1 56,2 56,3 56,4 Zhou A, Wei Z, Read RJ, Carrell RW (setembro de 2006). "Structural mechanism for the carriage and release of thyroxine in the blood". Proceedings of the National Academy of Sciences of the United States of America 103 (36): 13321–13326. Bibcode:2006PNAS..10313321Z. PMC 1557382. PMID 16938877. doi:10.1073/pnas.0604080103.
- ↑ Huntington JA, Stein PE (maio de 2001). "Structure and properties of ovalbumin". Journal of Chromatography. B, Biomedical Sciences and Applications 756 (1–2): 189–198. PMID 11419711. doi:10.1016/S0378-4347(01)00108-6.
- ↑ 58,0 58,1 58,2 Mala JG, Rose C (novembro de 2010). "Interactions of heat shock protein 47 with collagen and the stress response: an unconventional chaperone model?". Life Sciences 87 (19–22): 579–586. PMID 20888348. doi:10.1016/j.lfs.2010.09.024.
- ↑ Grigoryev SA, Bednar J, Woodcock CL (febreiro de 1999). "MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member". The Journal of Biological Chemistry 274 (9): 5626–5636. PMID 10026180. doi:10.1074/jbc.274.9.5626.
- ↑ Elliott PR, Lomas DA, Carrell RW, Abrahams JP (agosto de 1996). "Inhibitory conformation of the reactive loop of alpha 1-antitrypsin". Nature Structural Biology 3 (8): 676–681. PMID 8756325. doi:10.1038/nsb0896-676.
- ↑ Horvath AJ, Irving JA, Rossjohn J, Law RH, Bottomley SP, Quinsey NS, Pike RN, Coughlin PB, Whisstock JC (decembro de 2005). "The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins". The Journal of Biological Chemistry 280 (52): 43168–43178. PMID 16141197. doi:10.1074/jbc.M505598200.
- ↑ Whisstock JC, Skinner R, Carrell RW, Lesk AM (febreiro de 2000). "Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin". Journal of Molecular Biology 296 (2): 685–699. PMID 10669617. doi:10.1006/jmbi.1999.3520.
- ↑ Jin L, Abrahams JP, Skinner R, Petitou M, Pike RN, Carrell RW (decembro de 1997). "The anticoagulant activation of antithrombin by heparin". Proceedings of the National Academy of Sciences of the United States of America 94 (26): 14683–14688. Bibcode:1997PNAS...9414683J. PMC 25092. PMID 9405673. doi:10.1073/pnas.94.26.14683.
- ↑ Whisstock JC, Pike RN, Jin L, Skinner R, Pei XY, Carrell RW, Lesk AM (setembro de 2000). "Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin". Journal of Molecular Biology 301 (5): 1287–1305. PMID 10966821. doi:10.1006/jmbi.2000.3982.
- ↑ Li W, Johnson DJ, Esmon CT, Huntington JA (setembro de 2004). "Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin". Nature Structural & Molecular Biology 11 (9): 857–862. PMID 15311269. doi:10.1038/nsmb811.
- ↑ Johnson DJ, Li W, Adams TE, Huntington JA (mqaio de 2006). "Antithrombin-S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation". The EMBO Journal 25 (9): 2029–2037. PMC 1456925. PMID 16619025. doi:10.1038/sj.emboj.7601089.
- ↑ Walenga JM, Jeske WP, Samama MM, Frapaise FX, Bick RL, Fareed J (marzo de 2002). "Fondaparinux: a synthetic heparin pentasaccharide as a new antithrombotic agent". Expert Opinion on Investigational Drugs 11 (3): 397–407. PMID 11866668. doi:10.1517/13543784.11.3.397.
- ↑ Petitou M, van Boeckel CA (xuño de 2004). "A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next?". Angewandte Chemie 43 (24): 3118–3133. PMID 15199558. doi:10.1002/anie.200300640.
- ↑ 69,0 69,1 Lindahl TL, Sigurdardottir O, Wiman B (setembro de 1989). "Stability of plasminogen activator inhibitor 1 (PAI-1)". Thrombosis and Haemostasis 62 (2): 748–751. PMID 2479113. doi:10.1055/s-0038-1646895.
- ↑ Mushunje A, Evans G, Brennan SO, Carrell RW, Zhou A (decembro de 2004). "Latent antithrombin and its detection, formation and turnover in the circulation". Journal of Thrombosis and Haemostasis 2 (12): 2170–2177. PMID 15613023. doi:10.1111/j.1538-7836.2004.01047.x.
- ↑ Zhang Q, Buckle AM, Law RH, Pearce MC, Cabrita LD, Lloyd GJ, Irving JA, Smith AI, Ruzyla K, Rossjohn J, Bottomley SP, Whisstock JC (xullo de 2007). "The N terminus of the serpin, tengpin, functions to trap the metastable native state". EMBO Reports 8 (7): 658–663. PMC 1905895. PMID 17557112. doi:10.1038/sj.embor.7400986.
- ↑ Zhang Q, Law RH, Bottomley SP, Whisstock JC, Buckle AM (marzo de 2008). "A structural basis for loop C-sheet polymerization in serpins". Journal of Molecular Biology 376 (5): 1348–1359. PMID 18234218. doi:10.1016/j.jmb.2007.12.050.
- ↑ Pemberton PA, Stein PE, Pepys MB, Potter JM, Carrell RW (novembro de 1988). "Hormone binding globulins undergo serpin conformational change in inflammation". Nature 336 (6196): 257–258. Bibcode:1988Natur.336..257P. PMID 3143075. doi:10.1038/336257a0.
- ↑ 74,0 74,1 74,2 Cao C, Lawrence DA, Li Y, Von Arnim CA, Herz J, Su EJ, Makarova A, Hyman BT, Strickland DK, Zhang L (maio de 2006). "Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration". The EMBO Journal 25 (9): 1860–1870. PMC 1456942. PMID 16601674. doi:10.1038/sj.emboj.7601082.
- ↑ Jensen JK, Dolmer K, Gettins PG (xullo de 2009). "Specificity of binding of the low density lipoprotein receptor-related protein to different conformational states of the clade E serpins plasminogen activator inhibitor-1 and proteinase nexin-1". The Journal of Biological Chemistry 284 (27): 17989–17997. PMC 2709341. PMID 19439404. doi:10.1074/jbc.M109.009530.
- ↑ Soukup SF, Culi J, Gubb D (xuño de 2009). Rulifson E, ed. "Uptake of the necrotic serpin in Drosophila melanogaster via the lipophorin receptor-1". PLOS Genetics 5 (6): e1000532. PMC 2694266. PMID 19557185. doi:10.1371/journal.pgen.1000532.
- ↑ Kaiserman D, Whisstock JC, Bird PI (decembro de 2006). "Mechanisms of serpin dysfunction in disease". Expert Reviews in Molecular Medicine 8 (31): 1–19. PMID 17156576. doi:10.1017/S1462399406000184.
- ↑ de Serres FJ (novembro de 2002). "Worldwide racial and ethnic distribution of alpha1-antitrypsin deficiency: summary of an analysis of published genetic epidemiologic surveys". Chest 122 (5): 1818–1829. PMID 12426287. doi:10.1378/chest.122.5.1818.
- ↑ Hopkins PC, Carrell RW, Stone SR (agosto de 1993). "Effects of mutations in the hinge region of serpins". Biochemistry 32 (30): 7650–7657. PMID 8347575. doi:10.1021/bi00081a008.
- ↑ Beauchamp NJ, Pike RN, Daly M, Butler L, Makris M, Dafforn TR, Zhou A, Fitton HL, Preston FE, Peake IR, Carrell RW (outubro de 1998). "Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation". Blood 92 (8): 2696–2706. PMID 9763552. doi:10.1182/blood.V92.8.2696.
- ↑ 81,0 81,1 81,2 Gooptu B, Hazes B, Chang WS, Dafforn TR, Carrell RW, Read RJ, Lomas DA (xaneiro de 2000). "Inactive conformation of the serpin alpha(1)-antichymotrypsin indicates two-stage insertion of the reactive loop: implications for inhibitory function and conformational disease". Proceedings of the National Academy of Sciences of the United States of America 97 (1): 67–72. Bibcode:2000PNAS...97...67G. PMC 26617. PMID 10618372. doi:10.1073/pnas.97.1.67.
- ↑ 82,0 82,1 Homan EP, Rauch F, Grafe I, Lietman C, Doll JA, Dawson B, Bertin T, Napierala D, Morello R, Gibbs R, White L, Miki R, Cohn DH, Crawford S, Travers R, Glorieux FH, Lee B (decembro de 2011). "Mutations in SERPINF1 cause osteogenesis imperfecta type VI". Journal of Bone and Mineral Research 26 (12): 2798–2803. PMC 3214246. PMID 21826736. doi:10.1002/jbmr.487.
- ↑ Fay WP, Parker AC, Condrey LR, Shapiro AD (xullo de 1997). "Human plasminogen activator inhibitor-1 (PAI-1) deficiency: characterization of a large kindred with a null mutation in the PAI-1 gene". Blood 90 (1): 204–208. PMID 9207454. doi:10.1182/blood.V90.1.204.
- ↑ 84,0 84,1 84,2 84,3 84,4 84,5 Heit C, Jackson BC, McAndrews M, Wright MW, Thompson DC, Silverman GA, Nebert DW, Vasiliou V (outubro de 2013). "Update of the human and mouse SERPIN gene superfamily". Human Genomics 7 (1): 22. PMC 3880077. PMID 24172014. doi:10.1186/1479-7364-7-22.
- ↑ 85,0 85,1 Lomas DA, Evans DL, Finch JT, Carrell RW (xuño de 1992). "The mechanism of Z alpha 1-antitrypsin accumulation in the liver". Nature 357 (6379): 605–607. Bibcode:1992Natur.357..605L. PMID 1608473. doi:10.1038/357605a0.
- ↑ Kroeger H, Miranda E, MacLeod I, Pérez J, Crowther DC, Marciniak SJ, Lomas DA (agosto de 2009). "Endoplasmic reticulum-associated degradation (ERAD) and autophagy cooperate to degrade polymerogenic mutant serpins". The Journal of Biological Chemistry 284 (34): 22793–22802. PMC 2755687. PMID 19549782. doi:10.1074/jbc.M109.027102.
- ↑ 87,0 87,1 87,2 Yamasaki M, Li W, Johnson DJ, Huntington JA (outubro de 2008). "Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization". Nature 455 (7217): 1255–1258. Bibcode:2008Natur.455.1255Y. PMID 18923394. doi:10.1038/nature07394.
- ↑ 88,0 88,1 Bottomley SP (setembro de 2011). "The structural diversity in α1-antitrypsin misfolding". EMBO Reports 12 (10): 983–984. PMC 3185355. PMID 21921939. doi:10.1038/embor.2011.187.
- ↑ 89,0 89,1 Yamasaki M, Sendall TJ, Pearce MC, Whisstock JC, Huntington JA (setembro de 2011). "Molecular basis of α1-antitrypsin deficiency revealed by the structure of a domain-swapped trimer". EMBO Reports 12 (10): 1011–1017. PMC 3185345. PMID 21909074. doi:10.1038/embor.2011.171.
- ↑ Chang WS, Whisstock J, Hopkins PC, Lesk AM, Carrell RW, Wardell MR (xaneiro de 1997). "Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins". Protein Science 6 (1): 89–98. PMC 2143506. PMID 9007980. doi:10.1002/pro.5560060110.
- ↑ Miranda E, Pérez J, Ekeowa UI, Hadzic N, Kalsheker N, Gooptu B, Portmann B, Belorgey D, Hill M, Chambers S, Teckman J, Alexander GJ, Marciniak SJ, Lomas DA (setembro de 2010). "A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency". Hepatology 52 (3): 1078–1088. PMID 20583215. doi:10.1002/hep.23760.
- ↑ Sandhaus RA (outubro de 2004). "alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency". Thorax 59 (10): 904–909. PMC 1746849. PMID 15454659. doi:10.1136/thx.2003.006551.
- ↑ Lewis EC (setembro de 2012). "Expanding the clinical indications for α(1)-antitrypsin therapy". Molecular Medicine 18 (6): 957–970. PMC 3459478. PMID 22634722. doi:10.2119/molmed.2011.00196.
- ↑ Fregonese L, Stolk J (xuño de 2008). "Hereditary alpha-1-antitrypsin deficiency and its clinical consequences". Orphanet Journal of Rare Diseases 3: 16. PMC 2441617. PMID 18565211. doi:10.1186/1750-1172-3-16.
- ↑ Yusa K, Rashid ST, Strick-Marchand H, Varela I, Liu PQ, Paschon DE, Miranda E, Ordóñez A, Hannan NR, Rouhani FJ, Darche S, Alexander G, Marciniak SJ, Fusaki N, Hasegawa M, Holmes MC, Di Santo JP, Lomas DA, Bradley A, Vallier L (outubro de 2011). "Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells". Nature 478 (7369): 391–394. Bibcode:2011Natur.478..391Y. PMC 3198846. PMID 21993621. doi:10.1038/nature10424.
- ↑ Mallya M, Phillips RL, Saldanha SA, Gooptu B, Brown SC, Termine DJ, Shirvani AM, Wu Y, Sifers RN, Abagyan R, Lomas DA (novembro de 2007). "Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates". Journal of Medicinal Chemistry 50 (22): 5357–5363. PMC 2631427. PMID 17918823. doi:10.1021/jm070687z.
- ↑ Gosai SJ, Kwak JH, Luke CJ, Long OS, King DE, Kovatch KJ, Johnston PA, Shun TY, Lazo JS, Perlmutter DH, Silverman GA, Pak SC (novembro de 2010). "Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z". PLOS ONE 5 (11): e15460. Bibcode:2010PLoSO...515460G. PMC 2980495. PMID 21103396. doi:10.1371/journal.pone.0015460.
- ↑ Cabrita LD, Irving JA, Pearce MC, Whisstock JC, Bottomley SP (setembro de 2007). "Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap". The Journal of Biological Chemistry 282 (37): 26802–26809. PMID 17635906. doi:10.1074/jbc.M705020200.
- ↑ Fluhr R, Lampl N, Roberts TH (maio de 2012). "Serpin protease inhibitors in plant biology". Physiologia Plantarum 145 (1): 95–102. PMID 22085334. doi:10.1111/j.1399-3054.2011.01540.x.
- ↑ Stoller JK, Aboussouan LS (2005). "Alpha1-antitrypsin deficiency". Lancet 365 (9478): 2225–2236. PMID 15978931. doi:10.1016/S0140-6736(05)66781-5.
- ↑ Münch J, Ständker L, Adermann K, Schulz A, Schindler M, Chinnadurai R, Pöhlmann S, Chaipan C, Biet T, Peters T, Meyer B, Wilhelm D, Lu H, Jing W, Jiang S, Forssmann WG, Kirchhoff F (abril de 2007). "Discovery and optimization of a natural HIV-1 entry inhibitor targeting the gp41 fusion peptide". Cell 129 (2): 263–275. PMID 17448989. doi:10.1016/j.cell.2007.02.042.
- ↑ Gooptu B, Dickens JA, Lomas DA (febreiro de 2014). "The molecular and cellular pathology of α₁-antitrypsin deficiency". Trends in Molecular Medicine 20 (2): 116–127. PMID 24374162. doi:10.1016/j.molmed.2013.10.007.
- ↑ Seixas S, Suriano G, Carvalho F, Seruca R, Rocha J, Di Rienzo A (febreiro de 2007). "Sequence diversity at the proximal 14q32.1 SERPIN subcluster: evidence for natural selection favoring the pseudogenization of SERPINA2". Molecular Biology and Evolution 24 (2): 587–598. PMID 17135331. doi:10.1093/molbev/msl187.
- ↑ Kalsheker NA (setembro de 1996). "Alpha 1-antichymotrypsin". The International Journal of Biochemistry & Cell Biology 28 (9): 961–964. PMID 8930118. doi:10.1016/1357-2725(96)00032-5.
- ↑ Santamaria M, Pardo-Saganta A, Alvarez-Asiain L, Di Scala M, Qian C, Prieto J, Avila MA (abril de 2013). "Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells". Gastroenterology 144 (4): 818–828.e4. PMID 23295442. doi:10.1053/j.gastro.2012.12.029.
- ↑ Zhang S, Janciauskiene S (abril de 2002). "Multi-functional capability of proteins: alpha1-antichymotrypsin and the correlation with Alzheimer's disease". Journal of Alzheimer's Disease 4 (2): 115–122. PMID 12214135. doi:10.3233/JAD-2002-4206.
- ↑ Chao J, Stallone JN, Liang YM, Chen LM, Wang DZ, Chao L (xullo de 1997). "Kallistatin is a potent new vasodilator". The Journal of Clinical Investigation 100 (1): 11–17. PMC 508159. PMID 9202051. doi:10.1172/JCI119502.
- ↑ Miao RQ, Agata J, Chao L, Chao J (novembro de 2002). "Kallistatin is a new inhibitor of angiogenesis and tumor growth". Blood 100 (9): 3245–3252. PMID 12384424. doi:10.1182/blood-2002-01-0185.
- ↑ Liu Y, Bledsoe G, Hagiwara M, Shen B, Chao L, Chao J (outubro de 2012). "Depletion of endogenous kallistatin exacerbates renal and cardiovascular oxidative stress, inflammation, and organ remodeling". American Journal of Physiology. Renal Physiology 303 (8): F1230–F1238. PMC 3469672. PMID 22811485. doi:10.1152/ajprenal.00257.2012.
- ↑ Geiger M (marzo de 2007). "Protein C inhibitor, a serpin with functions in- and outside vascular biology". Thrombosis and Haemostasis 97 (3): 343–347. PMID 17334499. doi:10.1160/th06-09-0488.
- ↑ Baumgärtner P, Geiger M, Zieseniss S, Malleier J, Huntington JA, Hochrainer K, Bielek E, Stoeckelhuber M, Lauber K, Scherfeld D, Schwille P, Wäldele K, Beyer K, Engelmann B (novembro de 2007). "Phosphatidylethanolamine critically supports internalization of cell-penetrating protein C inhibitor". The Journal of Cell Biology 179 (4): 793–804. PMC 2080921. PMID 18025309. doi:10.1083/jcb.200707165.
- ↑ Uhrin P, Dewerchin M, Hilpert M, Chrenek P, Schöfer C, Zechmeister-Machhart M, Krönke G, Vales A, Carmeliet P, Binder BR, Geiger M (decembro de 2000). "Disruption of the protein C inhibitor gene results in impaired spermatogenesis and male infertility". The Journal of Clinical Investigation 106 (12): 1531–1539. PMC 381472. PMID 11120760. doi:10.1172/JCI10768.
- ↑ Han MH, Hwang SI, Roy DB, Lundgren DH, Price JV, Ousman SS, Fernald GH, Gerlitz B, Robinson WH, Baranzini SE, Grinnell BW, Raine CS, Sobel RA, Han DK, Steinman L (febreiro de 2008). "Proteomic analysis of active multiple sclerosis lesions reveals therapeutic targets". Nature 451 (7182): 1076–1081. Bibcode:2008Natur.451.1076H. PMID 18278032. doi:10.1038/nature06559.
- ↑ Torpy DJ, Ho JT (agosto de 2007). "Corticosteroid-binding globulin gene polymorphisms: clinical implications and links to idiopathic chronic fatigue disorders". Clinical Endocrinology 67 (2): 161–167. PMID 17547679. doi:10.1111/j.1365-2265.2007.02890.x.
- ↑ Bartalena L, Robbins J (1992). "Variations in thyroid hormone transport proteins and their clinical implications". Thyroid 2 (3): 237–245. PMID 1422238. doi:10.1089/thy.1992.2.237.
- ↑ Persani L (setembro de 2012). "Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges". The Journal of Clinical Endocrinology and Metabolism 97 (9): 3068–3078. PMID 22851492. doi:10.1210/jc.2012-1616.
- ↑ Kumar R, Singh VP, Baker KM (xullo de 2007). "The intracellular renin-angiotensin system: a new paradigm". Trends in Endocrinology and Metabolism 18 (5): 208–214. PMID 17509892. doi:10.1016/j.tem.2007.05.001.
- ↑ Tanimoto K, Sugiyama F, Goto Y, Ishida J, Takimoto E, Yagami K, Fukamizu A, Murakami K (decembro de 1994). "Angiotensinogen-deficient mice with hypotension". The Journal of Biological Chemistry 269 (50): 31334–31337. PMID 7989296. doi:10.1016/S0021-9258(18)31697-1.
- ↑ Jeunemaitre X, Gimenez-Roqueplo AP, Célérier J, Corvol P (1999). "Angiotensinogen variants and human hypertension". Current Hypertension Reports 1 (1): 31–41. PMID 10981040. doi:10.1007/s11906-999-0071-0.
- ↑ Sethi AA, Nordestgaard BG, Tybjaerg-Hansen A (xullo de 2003). "Angiotensinogen gene polymorphism, plasma angiotensinogen, and risk of hypertension and ischemic heart disease: a meta-analysis". Arteriosclerosis, Thrombosis, and Vascular Biology 23 (7): 1269–1275. PMID 12805070. doi:10.1161/01.ATV.0000079007.40884.5C.
- ↑ Dickson ME, Sigmund CD (xullo de 2006). "Genetic basis of hypertension: revisiting angiotensinogen". Hypertension 48 (1): 14–20. PMID 16754793. doi:10.1161/01.HYP.0000227932.13687.60.
- ↑ Frazer JK, Jackson DG, Gaillard JP, Lutter M, Liu YJ, Banchereau J, Capra JD, Pascual V (outubro de 2000). "Identification of centerin: a novel human germinal center B cell-restricted serpin". European Journal of Immunology 30 (10): 3039–3048. PMID 11069088. doi:10.1002/1521-4141(200010)30:10<3039::AID-IMMU3039>3.0.CO;2-H.
- ↑ Paterson MA, Horvath AJ, Pike RN, Coughlin PB (agosto de 2007). "Molecular characterization of centerin, a germinal centre cell serpin". The Biochemical Journal 405 (3): 489–494. PMC 2267310. PMID 17447896. doi:10.1042/BJ20070174.
- ↑ Paterson MA, Hosking PS, Coughlin PB (xullo de 2008). "Expression of the serpin centerin defines a germinal center phenotype in B-cell lymphomas". American Journal of Clinical Pathology 130 (1): 117–126. PMID 18550480. doi:10.1309/9QKE68QU7B825A3U.
- ↑ Ashton-Rickardt PG (abril de 2013). "An emerging role for Serine Protease Inhibitors in T lymphocyte immunity and beyond". Immunology Letters 152 (1): 65–76. PMID 23624075. doi:10.1016/j.imlet.2013.04.004.
- ↑ Han X, Fiehler R, Broze GJ (novembro de 2000). "Characterization of the protein Z-dependent protease inhibitor". Blood 96 (9): 3049–3055. PMID 11049983. doi:10.1182/blood.V96.9.3049.
- ↑ Hida K, Wada J, Eguchi J, Zhang H, Baba M, Seida A, Hashimoto I, Okada T, Yasuhara A, Nakatsuka A, Shikata K, Hourai S, Futami J, Watanabe E, Matsuki Y, Hiramatsu R, Akagi S, Makino H, Kanwar YS (xullo de 2005). "Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity". Proceedings of the National Academy of Sciences of the United States of America 102 (30): 10610–10615. Bibcode:2005PNAS..10210610H. PMC 1180799. PMID 16030142. doi:10.1073/pnas.0504703102.
- ↑ Feng R, Li Y, Wang C, Luo C, Liu L, Chuo F, Li Q, Sun C (outubro de 2014). "Higher vaspin levels in subjects with obesity and type 2 diabetes mellitus: a meta-analysis". Diabetes Research and Clinical Practice 106 (1): 88–94. PMID 25151227. doi:10.1016/j.diabres.2014.07.026.
- ↑ Remold-O'Donnell E, Chin J, Alberts M (xuño de 1992). "Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor". Proceedings of the National Academy of Sciences of the United States of America 89 (12): 5635–5639. Bibcode:1992PNAS...89.5635R. PMC 49347. PMID 1376927. doi:10.1073/pnas.89.12.5635.
- ↑ Benarafa C, Priebe GP, Remold-O'Donnell E (agosto de 2007). "The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection". The Journal of Experimental Medicine 204 (8): 1901–1909. PMC 2118684. PMID 17664292. doi:10.1084/jem.20070494.
- ↑ Antalis TM, La Linn M, Donnan K, Mateo L, Gardner J, Dickinson JL, Buttigieg K, Suhrbier A (xuño de 1998). "The serine proteinase inhibitor (serpin) plasminogen activation inhibitor type 2 protects against viral cytopathic effects by constitutive interferon alpha/beta priming". The Journal of Experimental Medicine 187 (11): 1799–1811. PMC 2212304. PMID 9607921. doi:10.1084/jem.187.11.1799.
- ↑ Zhao A, Yang Z, Sun R, Grinchuk V, Netzel-Arnett S, Anglin IE, Driesbaugh KH, Notari L, Bohl JA, Madden KB, Urban JF, Antalis TM, Shea-Donohue T (xuño de 2013). "SerpinB2 is critical to Th2 immunity against enteric nematode infection". Journal of Immunology 190 (11): 5779–5787. PMC 4068334. PMID 23630350. doi:10.4049/jimmunol.1200293.
- ↑ Dougherty KM, Pearson JM, Yang AY, Westrick RJ, Baker MS, Ginsburg D (xaneiro de 1999). "The plasminogen activator inhibitor-2 gene is not required for normal murine development or survival". Proceedings of the National Academy of Sciences of the United States of America 96 (2): 686–691. Bibcode:1999PNAS...96..686D. PMC 15197. PMID 9892694. doi:10.1073/pnas.96.2.686.
- ↑ Takeda A, Yamamoto T, Nakamura Y, Takahashi T, Hibino T (febreiro de 1995). "Squamous cell carcinoma antigen is a potent inhibitor of cysteine proteinase cathepsin L". FEBS Letters 359 (1): 78–80. PMID 7851535. doi:10.1016/0014-5793(94)01456-b.
- ↑ 135,0 135,1 Turato C, Pontisso P (marzo de 2015). "SERPINB3 (serpin peptidase inhibitor, clade B (ovalbumin), member 3)". Atlas of Genetics and Cytogenetics in Oncology and Haematology 19 (3): 202–209. PMC 4430857. PMID 25984243. doi:10.4267/2042/56413.
- ↑ 136,0 136,1 Sivaprasad U, Askew DJ, Ericksen MB, Gibson AM, Stier MT, Brandt EB, Bass SA, Daines MO, Chakir J, Stringer KF, Wert SE, Whitsett JA, Le Cras TD, Wills-Karp M, Silverman GA, Khurana Hershey GK (xaneiro de 2011). "A nonredundant role for mouse Serpinb3a in the induction of mucus production in asthma". The Journal of Allergy and Clinical Immunology 127 (1): 254–61, 261.e1–6. PMC 3058372. PMID 21126757. doi:10.1016/j.jaci.2010.10.009.
- ↑ Schick C, Kamachi Y, Bartuski AJ, Cataltepe S, Schechter NM, Pemberton PA, Silverman GA (xaneiro de 1997). "Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase". The Journal of Biological Chemistry 272 (3): 1849–1855. PMID 8999871. doi:10.1074/jbc.272.3.1849.
- ↑ Teoh SS, Whisstock JC, Bird PI (abril de 2010). "Maspin (SERPINB5) is an obligate intracellular serpin". The Journal of Biological Chemistry 285 (14): 10862–10869. PMC 2856292. PMID 20123984. doi:10.1074/jbc.M109.073171.
- ↑ Zou Z, Anisowicz A, Hendrix MJ, Thor A, Neveu M, Sheng S, Rafidi K, Seftor E, Sager R (xaneiro de 1994). "Maspin, a serpin with tumor-suppressing activity in human mammary epithelial cells". Science 263 (5146): 526–529. Bibcode:1994Sci...263..526Z. PMID 8290962. doi:10.1126/science.8290962.
- ↑ 140,0 140,1 140,2 Teoh SS, Vieusseux J, Prakash M, Berkowicz S, Luu J, Bird CH, Law RH, Rosado C, Price JT, Whisstock JC, Bird PI (2014). "Maspin is not required for embryonic development or tumour suppression". Nature Communications 5: 3164. Bibcode:2014NatCo...5.3164T. PMC 3905777. PMID 24445777. doi:10.1038/ncomms4164.
- ↑ Gao F, Shi HY, Daughty C, Cella N, Zhang M (abril de 2004). "Maspin plays an essential role in early embryonic development". Development 131 (7): 1479–1489. PMID 14985257. doi:10.1242/dev.01048.
- ↑ Scott FL, Hirst CE, Sun J, Bird CH, Bottomley SP, Bird PI (marzo de 1999). "The intracellular serpin proteinase inhibitor 6 is expressed in monocytes and granulocytes and is a potent inhibitor of the azurophilic granule protease, cathepsin G". Blood 93 (6): 2089–2097. PMID 10068683. doi:10.1182/blood.V93.6.2089.406k10_2089_2097.
- ↑ Tan J, Prakash MD, Kaiserman D, Bird PI (xullo de 2013). "Absence of SERPINB6A causes sensorineural hearing loss with multiple histopathologies in the mouse inner ear". The American Journal of Pathology 183 (1): 49–59. PMID 23669344. doi:10.1016/j.ajpath.2013.03.009.
- ↑ Scarff KL, Ung KS, Nandurkar H, Crack PJ, Bird CH, Bird PI (maio de 2004). "Targeted disruption of SPI3/Serpinb6 does not result in developmental or growth defects, leukocyte dysfunction, or susceptibility to stroke". Molecular and Cellular Biology 24 (9): 4075–4082. PMC 387772. PMID 15082799. doi:10.1128/MCB.24.9.4075-4082.2004.
- ↑ Sirmaci A, Erbek S, Price J, Huang M, Duman D, Cengiz FB, Bademci G, Tokgöz-Yilmaz S, Hişmi B, Ozdağ H, Oztürk B, Kulaksizoğlu S, Yildirim E, Kokotas H, Grigoriadou M, Petersen MB, Shahin H, Kanaan M, King MC, Chen ZY, Blanton SH, Liu XZ, Zuchner S, Akar N, Tekin M (maio de 2010). "A truncating mutation in SERPINB6 is associated with autosomal-recessive nonsyndromic sensorineural hearing loss". American Journal of Human Genetics 86 (5): 797–804. PMC 2869020. PMID 20451170. doi:10.1016/j.ajhg.2010.04.004.
- ↑ Miyata T, Inagi R, Nangaku M, Imasawa T, Sato M, Izuhara Y, Suzuki D, Yoshino A, Onogi H, Kimura M, Sugiyama S, Kurokawa K (marzo de 2002). "Overexpression of the serpin megsin induces progressive mesangial cell proliferation and expansion". The Journal of Clinical Investigation 109 (5): 585–593. PMC 150894. PMID 11877466. doi:10.1172/JCI14336.
- ↑ 147,0 147,1 Miyata T, Li M, Yu X, Hirayama N (maio de 2007). "Megsin gene: its genomic analysis, pathobiological functions, and therapeutic perspectives". Current Genomics 8 (3): 203–208. PMC 2435355. PMID 18645605. doi:10.2174/138920207780833856.
- ↑ Kubo A (agosto de 2014). "Nagashima-type palmoplantar keratosis: a common Asian type caused by SERPINB7 protease inhibitor deficiency". The Journal of Investigative Dermatology 134 (8): 2076–2079. PMID 25029323. doi:10.1038/jid.2014.156.
- ↑ Dahlen JR, Jean F, Thomas G, Foster DC, Kisiel W (xaneiro de 1998). "Inhibition of soluble recombinant furin by human proteinase inhibitor 8". The Journal of Biological Chemistry 273 (4): 1851–1854. PMID 9442015. doi:10.1074/jbc.273.4.1851.
- ↑ Sun J, Bird CH, Sutton V, McDonald L, Coughlin PB, De Jong TA, Trapani JA, Bird PI (novembro de 1996). "A cytosolic granzyme B inhibitor related to the viral apoptotic regulator cytokine response modifier A is present in cytotoxic lymphocytes". The Journal of Biological Chemistry 271 (44): 27802–27809. PMID 8910377. doi:10.1074/jbc.271.44.27802.
- ↑ Zhang M, Park SM, Wang Y, Shah R, Liu N, Murmann AE, Wang CR, Peter ME, Ashton-Rickardt PG (abril de 2006). "Serine protease inhibitor 6 protects cytotoxic T cells from self-inflicted injury by ensuring the integrity of cytotoxic granules". Immunity 24 (4): 451–461. PMID 16618603. doi:10.1016/j.immuni.2006.02.002.
- ↑ Rizzitelli A, Meuter S, Vega Ramos J, Bird CH, Mintern JD, Mangan MS, Villadangos J, Bird PI (outubro de 2012). "Serpinb9 (Spi6)-deficient mice are impaired in dendritic cell-mediated antigen cross-presentation". Immunology and Cell Biology 90 (9): 841–851. PMID 22801574. doi:10.1038/icb.2012.29.
- ↑ Riewald M, Chuang T, Neubauer A, Riess H, Schleef RR (febreiro de 1998). "Expression of bomapin, a novel human serpin, in normal/malignant hematopoiesis and in the monocytic cell lines THP-1 and AML-193". Blood 91 (4): 1256–1262. PMID 9454755. doi:10.1182/blood.V91.4.1256.
- ↑ 154,0 154,1 Askew DJ, Cataltepe S, Kumar V, Edwards C, Pace SM, Howarth RN, Pak SC, Askew YS, Brömme D, Luke CJ, Whisstock JC, Silverman GA (agosto de 2007). "SERPINB11 is a new noninhibitory intracellular serpin. Common single nucleotide polymorphisms in the scaffold impair conformational change". The Journal of Biological Chemistry 282 (34): 24948–24960. PMID 17562709. doi:10.1074/jbc.M703182200.
- ↑ Finno CJ, Stevens C, Young A, Affolter V, Joshi NA, Ramsay S, Bannasch DL (abril de 2015). "SERPINB11 frameshift variant associated with novel hoof specific phenotype in Connemara ponies". PLOS Genetics 11 (4): e1005122. PMC 4395385. PMID 25875171. doi:10.1371/journal.pgen.1005122.
- ↑ Askew YS, Pak SC, Luke CJ, Askew DJ, Cataltepe S, Mills DR, Kato H, Lehoczky J, Dewar K, Birren B, Silverman GA (decembro de 2001). "SERPINB12 is a novel member of the human ov-serpin family that is widely expressed and inhibits trypsin-like serine proteinases". The Journal of Biological Chemistry 276 (52): 49320–49330. PMID 11604408. doi:10.1074/jbc.M108879200.
- ↑ Welss T, Sun J, Irving JA, Blum R, Smith AI, Whisstock JC, Pike RN, von Mikecz A, Ruzicka T, Bird PI, Abts HF (xuño de 2003). "Hurpin is a selective inhibitor of lysosomal cathepsin L and protects keratinocytes from ultraviolet-induced apoptosis". Biochemistry 42 (24): 7381–7389. PMID 12809493. doi:10.1021/bi027307q.
- ↑ Ishiguro K, Kojima T, Kadomatsu K, Nakayama Y, Takagi A, Suzuki M, Takeda N, Ito M, Yamamoto K, Matsushita T, Kusugami K, Muramatsu T, Saito H (outubro de 2000). "Complete antithrombin deficiency in mice results in embryonic lethality". The Journal of Clinical Investigation 106 (7): 873–878. PMC 517819. PMID 11018075. doi:10.1172/JCI10489.
- ↑ Patnaik MM, Moll S (novembro de 2008). "Inherited antithrombin deficiency: a review". Haemophilia 14 (6): 1229–1239. PMID 19141163. doi:10.1111/j.1365-2516.2008.01830.x.
- ↑ Huntington JA (xullo de 2011). "Serpin structure, function and dysfunction". Journal of Thrombosis and Haemostasis 9 (Suppl 1): 26–34. PMID 21781239. doi:10.1111/j.1538-7836.2011.04360.x.
- ↑ Vicente CP, He L, Pavão MS, Tollefsen DM (decembro de 2004). "Antithrombotic activity of dermatan sulfate in heparin cofactor II-deficient mice". Blood 104 (13): 3965–3970. PMID 15315969. doi:10.1182/blood-2004-02-0598.
- ↑ Aihara K, Azuma H, Akaike M, Ikeda Y, Sata M, Takamori N, Yagi S, Iwase T, Sumitomo Y, Kawano H, Yamada T, Fukuda T, Matsumoto T, Sekine K, Sato T, Nakamichi Y, Yamamoto Y, Yoshimura K, Watanabe T, Nakamura T, Oomizu A, Tsukada M, Hayashi H, Sudo T, Kato S, Matsumoto T (xuño de 2007). "Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice". The Journal of Clinical Investigation 117 (6): 1514–1526. PMC 1878511. PMID 17549254. doi:10.1172/JCI27095.
- ↑ Cale JM, Lawrence DA (setembro de 2007). "Structure-function relationships of plasminogen activator inhibitor-1 and its potential as a therapeutic agent". Current Drug Targets 8 (9): 971–981. PMID 17896949. doi:10.2174/138945007781662337.
- ↑ Lino MM, Atanasoski S, Kvajo M, Fayard B, Moreno E, Brenner HR, Suter U, Monard D (abril de 2007). "Mice lacking protease nexin-1 show delayed structural and functional recovery after sciatic nerve crush". The Journal of Neuroscience 27 (14): 3677–3685. PMC 6672422. PMID 17409231. doi:10.1523/JNEUROSCI.0277-07.2007.
- ↑ Murer V, Spetz JF, Hengst U, Altrogge LM, de Agostini A, Monard D (marzo de 2001). "Male fertility defects in mice lacking the serine protease inhibitor protease nexin-1". Proceedings of the National Academy of Sciences of the United States of America 98 (6): 3029–3033. Bibcode:2001PNAS...98.3029M. PMC 30601. PMID 11248026. doi:10.1073/pnas.051630698.
- ↑ Lüthi A, Van der Putten H, Botteri FM, Mansuy IM, Meins M, Frey U, Sansig G, Portet C, Schmutz M, Schröder M, Nitsch C, Laurent JP, Monard D (xuño de 1997). "Endogenous serine protease inhibitor modulates epileptic activity and hippocampal long-term potentiation". The Journal of Neuroscience 17 (12): 4688–4699. PMC 6573330. PMID 9169529. doi:10.1523/JNEUROSCI.17-12-04688.1997.
- ↑ 167,0 167,1 Doll JA, Stellmach VM, Bouck NP, Bergh AR, Lee C, Abramson LP, Cornwell ML, Pins MR, Borensztajn J, Crawford SE (xuño de 2003). "Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas". Nature Medicine 9 (6): 774–780. PMID 12740569. doi:10.1038/nm870.
- ↑ Becerra SP, Perez-Mediavilla LA, Weldon JE, Locatelli-Hoops S, Senanayake P, Notari L, Notario V, Hollyfield JG (novembro de 2008). "Pigment epithelium-derived factor binds to hyaluronan. Mapping of a hyaluronan binding site". The Journal of Biological Chemistry 283 (48): 33310–33320. PMC 2586245. PMID 18805795. doi:10.1074/jbc.M801287200.
- ↑ Andreu-Agulló C, Morante-Redolat JM, Delgado AC, Fariñas I (decembro de 2009). "Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone". Nature Neuroscience 12 (12): 1514–1523. PMID 19898467. doi:10.1038/nn.2437.
- ↑ Wiman B, Collen D (setembro de 1979). "On the mechanism of the reaction between human alpha 2-antiplasmin and plasmin". The Journal of Biological Chemistry 254 (18): 9291–9297. PMID 158022. doi:10.1016/S0021-9258(19)86843-6.
- ↑ Lijnen HR, Okada K, Matsuo O, Collen D, Dewerchin M (abril de 1999). "Alpha2-antiplasmin gene deficiency in mice is associated with enhanced fibrinolytic potential without overt bleeding". Blood 93 (7): 2274–2281. PMID 10090937. doi:10.1182/blood.V93.7.2274.
- ↑ Carpenter SL, Mathew P (novembro de 2008). "Alpha2-antiplasmin and its deficiency: fibrinolysis out of balance". Haemophilia 14 (6): 1250–1254. PMID 19141165. doi:10.1111/j.1365-2516.2008.01766.x.
- ↑ Favier R, Aoki N, de Moerloose P (xullo de 2001). "Congenital alpha(2)-plasmin inhibitor deficiencies: a review". British Journal of Haematology 114 (1): 4–10. PMID 11472338. doi:10.1046/j.1365-2141.2001.02845.x.
- ↑ Beinrohr L, Harmat V, Dobó J, Lörincz Z, Gál P, Závodszky P (xullo de 2007). "C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease". The Journal of Biological Chemistry 282 (29): 21100–21109. PMID 17488724. doi:10.1074/jbc.M700841200. hdl:10831/92835.
- ↑ Mollnes TE, Jokiranta TS, Truedsson L, Nilsson B, Rodriguez de Cordoba S, Kirschfink M (setembro de 2007). "Complement analysis in the 21st century". Molecular Immunology 44 (16): 3838–3849. PMID 17768101. doi:10.1016/j.molimm.2007.06.150. hdl:10261/61732.
- ↑ Triggianese P, Chimenti MS, Toubi E, Ballanti E, Guarino MD, Perricone C, Perricone R (agosto de 2015). "The autoimmune side of hereditary angioedema: insights on the pathogenesis". Autoimmunity Reviews 14 (8): 665–669. PMID 25827463. doi:10.1016/j.autrev.2015.03.006.
- ↑ Nagai N, Hosokawa M, Itohara S, Adachi E, Matsushita T, Hosokawa N, Nagata K (setembro de 2000). "Embryonic lethality of molecular chaperone hsp47 knockout mice is associated with defects in collagen biosynthesis". The Journal of Cell Biology 150 (6): 1499–1506. PMC 2150697. PMID 10995453. doi:10.1083/jcb.150.6.1499.
- ↑ Marini JC, Reich A, Smith SM (agosto de 2014). "Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation". Current Opinion in Pediatrics 26 (4): 500–507. PMC 4183132. PMID 25007323. doi:10.1097/MOP.0000000000000117.
- ↑ Byers PH, Pyott SM (1 de xaneiro de 2012). "Recessively inherited forms of osteogenesis imperfecta". Annual Review of Genetics 46: 475–497. PMID 23145505. doi:10.1146/annurev-genet-110711-155608.
- ↑ Osterwalder T, Cinelli P, Baici A, Pennella A, Krueger SR, Schrimpf SP, Meins M, Sonderegger P (xaneiro de 1998). "The axonally secreted serine proteinase inhibitor, neuroserpin, inhibits plasminogen activators and plasmin but not thrombin". The Journal of Biological Chemistry 273 (4): 2312–2321. PMID 9442076. doi:10.1074/jbc.273.4.2312.
- ↑ Crowther DC (xullo de 2002). "Familial conformational diseases and dementias". Human Mutation 20 (1): 1–14. PMID 12112652. doi:10.1002/humu.10100.
- ↑ Belorgey D, Hägglöf P, Karlsson-Li S, Lomas DA (1 de marzo de 2007). "Protein misfolding and the serpinopathies". Prion 1 (1): 15–20. PMC 2633702. PMID 19164889. doi:10.4161/pri.1.1.3974.
- ↑ Ozaki K, Nagata M, Suzuki M, Fujiwara T, Miyoshi Y, Ishikawa O, Ohigashi H, Imaoka S, Takahashi E, Nakamura Y (xullo de 1998). "Isolation and characterization of a novel human pancreas-specific gene, pancpin, that is down-regulated in pancreatic cancer cells". Genes, Chromosomes & Cancer 22 (3): 179–185. PMID 9624529. doi:10.1002/(SICI)1098-2264(199807)22:3<179::AID-GCC3>3.0.CO;2-T.
- ↑ Loftus SK, Cannons JL, Incao A, Pak E, Chen A, Zerfas PM, Bryant MA, Biesecker LG, Schwartzberg PL, Pavan WJ (setembro de 2005). "Acinar cell apoptosis in Serpini2-deficient mice models pancreatic insufficiency". PLOS Genetics 1 (3): e38. PMC 1231717. PMID 16184191. doi:10.1371/journal.pgen.0010038.
- ↑ Padua MB, Kowalski AA, Cañas MY, Hansen PJ (febreiro de 2010). "The molecular phylogeny of uterine serpins and its relationship to evolution of placentation". FASEB Journal 24 (2): 526–537. PMID 19825977. doi:10.1096/fj.09-138453.
- ↑ Padua MB, Hansen PJ (outubro de 2010). "Evolution and function of the uterine serpins (SERPINA14)". American Journal of Reproductive Immunology 64 (4): 265–274. PMID 20678169. doi:10.1111/j.1600-0897.2010.00901.x.
- ↑ 187,0 187,1 Reichhart JM (decembro de 2005). "Tip of another iceberg: Drosophila serpins". Trends in Cell Biology 15 (12): 659–665. PMID 16260136. doi:10.1016/j.tcb.2005.10.001.
- ↑ Tang H, Kambris Z, Lemaitre B, Hashimoto C (outubro de 2008). "A serpin that regulates immune melanization in the respiratory system of Drosophila". Developmental Cell 15 (4): 617–626. PMC 2671232. PMID 18854145. doi:10.1016/j.devcel.2008.08.017.
- ↑ Scherfer C, Tang H, Kambris Z, Lhocine N, Hashimoto C, Lemaitre B (novembro de 2008). "Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation". Developmental Biology 323 (2): 189–196. PMID 18801354. doi:10.1016/j.ydbio.2008.08.030.
- ↑ Rushlow C (xaneiro de 2004). "Dorsoventral patterning: a serpin pinned down at last". Current Biology 14 (1): R16–R18. PMID 14711428. doi:10.1016/j.cub.2003.12.015.
- ↑ Ligoxygakis P, Roth S, Reichhart JM (decembro de 2003). "A serpin regulates dorsal-ventral axis formation in the Drosophila embryo". Current Biology 13 (23): 2097–2102. PMID 14654000. doi:10.1016/j.cub.2003.10.062.
- ↑ Jiang R, Zhang B, Kurokawa K, So YI, Kim EH, Hwang HO, Lee JH, Shiratsuchi A, Zhang J, Nakanishi Y, Lee HS, Lee BL (outubro de 2011). "93-kDa twin-domain serine protease inhibitor (Serpin) has a regulatory function on the beetle Toll proteolytic signaling cascade". The Journal of Biological Chemistry 286 (40): 35087–35095. PMC 3186399. PMID 21862574. doi:10.1074/jbc.M111.277343.
- ↑ 193,0 193,1 Pak SC, Kumar V, Tsu C, Luke CJ, Askew YS, Askew DJ, Mills DR, Brömme D, Silverman GA (abril de 2004). "SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins". The Journal of Biological Chemistry 279 (15): 15448–15459. PMID 14739286. doi:10.1074/jbc.M400261200.
- ↑ Luke CJ, Pak SC, Askew YS, Naviglia TL, Askew DJ, Nobar SM, Vetica AC, Long OS, Watkins SC, Stolz DB, Barstead RJ, Moulder GL, Brömme D, Silverman GA (setembro de 2007). "An intracellular serpin regulates necrosis by inhibiting the induction and sequelae of lysosomal injury". Cell 130 (6): 1108–1119. PMC 2128786. PMID 17889653. doi:10.1016/j.cell.2007.07.013.
- ↑ Hejgaard J, Rasmussen SK, Brandt A, SvendsenI (1985). "Sequence homology between barley endosperm protein Z and protease inhibitors of the alpha-1-antitrypsin family". FEBS Lett. 180 (1): 89–94. doi:10.1016/0014-5793(85)80238-6.
- ↑ Dahl SW, Rasmussen SK, Petersen LC, Hejgaard J (setembro de 1996). "Inhibition of coagulation factors by recombinant barley serpin BSZx". FEBS Letters 394 (2): 165–168. PMID 8843156. doi:10.1016/0014-5793(96)00940-4.
- ↑ Hejgaard J (xaneiro de 2001). "Inhibitory serpins from rye grain with glutamine as P1 and P2 residues in the reactive center". FEBS Letters 488 (3): 149–153. PMID 11163762. doi:10.1016/S0014-5793(00)02425-X.
- ↑ Ostergaard H, Rasmussen SK, Roberts TH, Hejgaard J (outubrode 2000). "Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms". The Journal of Biological Chemistry 275 (43): 33272–33279. PMID 10874043. doi:10.1074/jbc.M004633200.
- ↑ 199,0 199,1 Yoo BC, Aoki K, Xiang Y, Campbell LR, Hull RJ, Xoconostle-Cázares B, Monzer J, Lee JY, Ullman DE, Lucas WJ (novembro de 2000). "Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor". The Journal of Biological Chemistry 275 (45): 35122–35128. PMID 10960478. doi:10.1074/jbc.M006060200.
- ↑ la Cour Petersen M, Hejgaard J, Thompson GA, Schulz A (decembro de 2005). "Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex". Journal of Experimental Botany 56 (422): 3111–3120. PMID 16246856. doi:10.1093/jxb/eri308.
- ↑ Roberts TH, Hejgaard J (febreiro de 2008). "Serpins in plants and green algae". Functional & Integrative Genomics 8 (1): 1–27. PMID 18060440. doi:10.1007/s10142-007-0059-2.
- ↑ Lampl N, Alkan N, Davydov O, Fluhr R (maio de 2013). "Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis". The Plant Journal 74 (3): 498–510. PMID 23398119. doi:10.1111/tpj.12141.
- ↑ Ahn JW, Atwell BJ, Roberts TH (maio de 2009). "Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis". BMC Plant Biology 9: 52. PMC 2689219. PMID 19426562. doi:10.1186/1471-2229-9-52.
- ↑ 204,0 204,1 Kang S, Barak Y, Lamed R, Bayer EA, Morrison M (xuño de 2006). "The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors". Molecular Microbiology 60 (6): 1344–1354. PMID 16796673. doi:10.1111/j.1365-2958.2006.05182.x.
- ↑ Irving JA, Cabrita LD, Rossjohn J, Pike RN, Bottomley SP, Whisstock JC (abril de 2003). "The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment". Structure 11 (4): 387–397. PMID 12679017. doi:10.1016/S0969-2126(03)00057-1.
- ↑ Fulton KF, Buckle AM, Cabrita LD, Irving JA, Butcher RE, Smith I, Reeve S, Lesk AM, Bottomley SP, Rossjohn J, Whisstock JC (marzo de 2005). "The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition". The Journal of Biological Chemistry 280 (9): 8435–8442. PMID 15590653. doi:10.1074/jbc.M410206200.
- ↑ Turner PC, Moyer RW (setembro de 2002). "Poxvirus immune modulators: functional insights from animal models". Virus Research 88 (1–2): 35–53. PMID 12297326. doi:10.1016/S0168-1702(02)00119-3.
- ↑ 208,0 208,1 Richardson J, Viswanathan K, Lucas A (xaneiro de 2006). "Serpins, the vasculature, and viral therapeutics". Frontiers in Bioscience 11: 1042–1056. PMID 16146796. doi:10.2741/1862.
- ↑ Jiang J, Arp J, Kubelik D, Zassoko R, Liu W, Wise Y, Macaulay C, Garcia B, McFadden G, Lucas AR, Wang H (novembro de 2007). "Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment". Transplantation 84 (9): 1158–1167. PMID 17998872. doi:10.1097/01.tp.0000286099.50532.b0.
- ↑ Dai E, Guan H, Liu L, Little S, McFadden G, Vaziri S, Cao H, Ivanova IA, Bocksch L, Lucas A (maio de 2003). "Serp-1, a viral anti-inflammatory serpin, regulates cellular serine proteinase and serpin responses to vascular injury". The Journal of Biological Chemistry 278 (20): 18563–18572. PMID 12637546. doi:10.1074/jbc.M209683200.
- ↑ Turner PC, Sancho MC, Thoennes SR, Caputo A, Bleackley RC, Moyer RW (agosto de 1999). "Myxoma virus Serp2 is a weak inhibitor of granzyme B and interleukin-1beta-converting enzyme in vitro and unlike CrmA cannot block apoptosis in cowpox virus-infected cells". Journal of Virology 73 (8): 6394–6404. PMC 112719. PMID 10400732. doi:10.1128/JVI.73.8.6394-6404.1999.
- ↑ Munuswamy-Ramanujam G, Khan KA, Lucas AR (decembro de 2006). "Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders". Endocrine, Metabolic & Immune Disorders Drug Targets 6 (4): 331–343. PMID 17214579. doi:10.2174/187153006779025720.
- ↑ Renatus M, Zhou Q, Stennicke HR, Snipas SJ, Turk D, Bankston LA, Liddington RC, Salvesen GS (xullo de 2000). "Crystal structure of the apoptotic suppressor CrmA in its cleaved form". Structure 8 (7): 789–797. PMID 10903953. doi:10.1016/S0969-2126(00)00165-9.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Merops protease inhibitor claudication (Family I4) Arquivado 8 de decembro de 2016 en Wayback Machine.
- Serpins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- James Whisstock laboratory na Universidade de Monash
- Jim Huntington laboratory Arquivado 30 de outubro de 2016 en Wayback Machine. na Universidade de Cambridge
- Frank Church laboratory na Universidade de Carolina do Norte en Chapel Hill
- Paul Declerck laboratory na Universidade Católica de Lovaina
- Tom Roberts laboratory na Universidade de Sidnei
- Robert Fluhr laboratory no Weizmann Institute of Science
- Peter Gettins laboratory na Universidade de Illinois en Chicago
- Relación de toda a información estrutural dispoñible en PDB para UniProt: P01009 (Human Alpha-1-antitrypsin) en PDBe-KB.