Mosca do vinagre
| Drosophila melanogaster | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Macho de Drosophila melanogaster | |||||||||||||||||||||||
| Clasificación científica | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Nome binomial | |||||||||||||||||||||||
| Drosophila melanogaster Meigen, 1830[1] | |||||||||||||||||||||||
Drosophila melanogaster é unha especie de díptero (mosca) da familia Drosophilidae. A especie recibe o nome en xeral de mosca da froita ou mosca do vinagre, que tamén reciben outras especies de Drosophila. Desde que Charles W. Woodworth propuxo o uso desta mosca como organismo modelo para realizar estudos científicos, D. melanogaster é amplamente utilizada na investigación biolóxica en estudos de xenética, fisioloxía, patoxénese microbiana e evolución. É un animal moi axeitado para este mester porque é fácil de coidar, ten só catro pares de cromosomas, reprodúcese rapidamente, e pon moitos ovos.[2] O xenoma desta mosca foi totalmente secuenciado e moitos dos seus xenes teñen homólogos no xenoma humano. D. melanogaster é unha praga común nas casas, en restaurantes e outros lugares onde se serve comida.[3]
As moscas que pertencen á familia Tephritidae tamén se poden chamar "moscas da froita", e orixinan pragas na froita de importancia económica (por exemplo, a especie Ceratitis capitata), e non hai que confundilas coas drosófilas.
Aspecto físico
[editar | editar a fonte]
As moscas da froita de tipo silvestre ou salvaxe son amarelo-castañas, teñen ollos vermellos ladrillo e aneis negros transversais no abdome. Presentan dimorfismo sexual: as femias miden 2,5 mm de longo e os machos son algo menores coa parte posterior máis escura. Os machos distínguense doadamente das femias polas súas diferenzas de cor, cunha mancha negra distintiva no abdome, menos evidente en moscas novas (ver figura), e polos peites sexuais (que son unha ringleira de pelos escuros no tarso da primeira pata). Ademais, os machos teñen un grupo de pelos espiñentos (para agarar) que rodean as súas partes xenitais utilizadas para agarrarse ás femias durante o apareamento.[4]
Ciclo de vida e reprodución
[editar | editar a fonte]
A duración da vida de D. melanogaster é duns 30 días a 29 °C, pero rexistráronse duracións de ata 3 meses.
O período de desenvolvemento de D. melanogaster varía coa temperatura, como ocorre con moitas especies ectotérmicas. Os tempos de desenvolvemento máis curtos (de ovo a adulto), de 7 días, teñen lugar a 28 °C.[5][6] Os tempos de desenvolvemento increméntanse a temperaturas máis altas (11 días a 30 °C) debido ao estrés pola calor. En condicións ideais, o tempo de desenvolvemento a 25 °C é de 8,5 días,[5][6][7] mentres que a 18 °C tarda 19 días[5][6] e a 12 °C tarda uns 50 días.[5][6] En condicións de superpoboación no lugar de cría, os tempos de desenvolvemento increméntanse,[8] e as moscas que emerxen dos ovos son máis pequenas.[8][9] As femias poñen uns 400 ovos (embrións), uns cinco de cada vez, en froita podre ou outros materiais axeitados como cogomelos en descomposición e fluxos de zume elaborado. Os ovos, que miden uns 0,5 mm, eclosionan en de 12 a 15 horas (a 25 °C).[5][6] As larvas resultantes crecen durante 4 días (a 25 °C) e fan a muda dúas veces (no 2º e 3º estadio larvario), en aproximadamente de 24 a 48 horas despois de eclosionaren.[5][6] Durante este tempo, aliméntanse dos microorganismos que decompoñen a froita, e dos azucres da froita. Despois as larvas encapsúlanse no pupario e sofren durante catro días unha metamorfose (a 25 °C), despois da cal os adultos emerxen da pupa.[5][6]

As femias son receptivas ao cortexo de 8 a 12 horas despois de emerxeren.[10] As femias presentan uns grupos de neuronas específicos que afectan ao comportamento de copulación e a elección de parella. Un deses grupos situado no cordón nervioso abdominal permite que a femia deteña os movementos do seu corpo para poder copular.[11] A activación destas neuronas induce que a femia cese de moverse e que se oriente cara ao macho para permitirlle que a monte. Se o grupo neuronal é inactivado, a femia permanece en movemento e non copula. Este grupo neuronal pode ser activado por varios sinais químicos, como as feromonas do macho.[11]
A femia da mosca da froita prefire que o sexo teña unha duración curta, pero os machos prefiren unha maior duración.[12] Os machos realizan unha secuencia de cinco patróns de comportamento para cortexaren as femias. Primeiro, os machos oriéntanse mentres producen un son ou "canción" de cortexo estendendo horizontalmente as ás e facéndoas vibrar. Pouco despois, o macho sitúase na parte posterior do abdome da femia nunha postura baixa para dar golpiños e lamber os xenitais da femia. Finalmente, o macho dobra o seu abdome e intenta a copulación. As femias poden rexeitar aos machos apartándose deles, pateándoos e extrudindo o seu ovipositor.[13] A copulación dura de 15 a 20 minutos,[14] durante os cales os machos transfiren á femia uns cantos centos de espermatozoides moi longos (de 1,76 mm) no fluído seminal.[15] As femias almacenan o esperma nun receptáculo tubular e en dúas espermatecas con forma de fungo, onde os espermas de moitos apareamentos compiten por realizar a fertilización. Crese que hai unha precedencia ou prioridade do último macho, pola cal o último macho en aparearse coas femias enxendra aproximadamente o 80% da descendencia da femia. Esta precedencia ocorre polos mecanismos chamados desprazamento e incapacitación.[16] O desprazamento atribúese ao manexo do esperma pola femia a medida que se producen os diversos apareamentos e é máis significativo durante os primeiros 1 ou 2 días despois da copulación. O desprazamento desde o receptáculo seminal é máis significativo que o desprazamento desde a espermateca.[16] A incapacitación do esperma do primeiro macho polo esperma do segundo macho é significativo de 2 a 7 días despois da copulación. Crese que o responsable deste mecanismo de incapacitación é o fluído seminal do segundo macho (sen retirar o esperma do primeiro macho), que se produce antes da fertilización.[16] O atraso na efectividade do mecanismo de incapacitación crese que é un mecanismo protector que impide que o macho incapacite o seu propio esperma en caso de que este se aparee coa mesma femia repetidamente. As neuronas sensoriais no útero da femia de D. melanogaster responden á proteína do macho chamada péptido sexual, que se encontra no esperma.[11] Esta proteína fai que a femia sexa reticente a copular durante 10 días despois da inseminación. Coñécese a vía de sinalización que leva a este cambio de comportamento. O sinal envíase á rexión do cerebro que é homóloga do hipotálamo e o hipotálamo despois controla o comportamento e desexo sexual.[11]
D. melanogaster utilízase con frecuencia en estudos sobre o aumento da duración da vida. Estes iniciáronse en 1980, ano en que Michael R. Rose realizou un estudo revolucionario en evolución experimental orixinando as moscas "Methuselah" (Metuxalén, nome o patriarca bíblico que se di viviu 969 anos) que teñen unha duración da vida o dobre do normal. Máis recentemente, identificáronse certos xenes como o INDY, que se afirma que incrementan a duración da vida cando están mutados.
Comportamento sexual do macho e aprendizaxe
[editar | editar a fonte]Con comportamento referímonos ás accións que un organismo podería realizar en resposta a varios estímulos externos ou internos. Os cambios no comportamento poden indicar unha aprendizaxe, a cal se produce cando un organismo se adapta a unha situación ou fenómeno ao cambiar unha resposta de comportamento determinada. A aprendizaxe está xeralmente asociada co incremento de eficcia biolóxica ou fitness, especialmente cando o comportamento adaptado é un aspecto do comportamento sexual. Os machos de D. melanogaster mostran unha forte curva de aprendizaxe reprodutiva, xa que coa experiencia sexual tenden a modificar o seu futuro comportamento reprodutivo de moitos xeitos. Entre estes cambios están o incremento da selectividade de realizar o cortexo só intraespecificamente (coa súa propia especie), e a diminución do tempo de cortexo. Os machos de D. melanogaster sexualmente virxes sábese que dedican un tempo significativo ao cortexo interespecífico, por exemplo con moscas da especie D. simulans. Os machos de D. melanogaster virxes intentan cortexar femias que aínda non son sexualmente maduras e a outros machos. Os machos de D. melanogaster mostran pouca ou ningunha preferencia polas femias de D. melanogaster en comparación con femias doutras especies ou mesmo con machos. Porén, unha vez que as femias de D. simulans ou outras moscas incapaces de copular con eles rexeitan os intentos dos machos, é moito menos probable que D. melanogaster perda o seu tempo cortexando a outras especies no futuro. Esta aparente modificación do comportamento aprendida parece ser evolutivamente significativa, xa que permite aos machos evitar investir enerxía en encontros sexuais inútiles.[17]
Ademais, os machos con experiencias sexuais previas modifican a súa danza de cortexo cando intentan aparearse con novas femias, e os machos experimentados dedican menos tempo a cortexar, e, polo tanto, teñen menores latencias de apareamento, o que significa que poden reproducirse máis rapidamente. Esta diminución da latencia de apareamento orixina unha maior eficacia de apareamento para os machos experimentados en relación cos machos virxes.[18] Esta modificación tamén parece ter vantaxes evolutivas obvias, xa que o incremento da eficacia do apareamento é moi importante na selección natural.
Historia do seu uso en análises xenéticas
[editar | editar a fonte]
Drosophila melanogaster foi un dos primeiros organismos utilizados para a análise xenética, e hoxe é un dos máis utilizados e mellor coñecidos xeneticamente entre os eucariotas. Todos os organismos utilizan sistemas xenéticos comúns; polo tanto, procesos xerais como a transcrición e a replicación do ADN na mosca da froita axudan a comprender estes procesos noutros eucariotas, incluíndo os humanos.[19]
Considérase que Charles W. Woodworth foi o primeiro en criar as Drosophila en suficientes cantidades como para suxerir a W. E. Castle que poderían utilizarse para a investigación xenética durante o seu período na Universidade Harvard.
Thomas Hunt Morgan empezou a utilizar as moscas da froita de forma xeneralizada en estudos experimentais da herdanza na Universidade de Columbia en 1910. O seu laboratorio empezou a coñecerse como o Cuarto das Moscas, situado nun último piso. Este cuarto estaba ocupado por oito mesas, nas que estaban os estudantes facendo os seus experimentos. No Cuarto das Moscas realizáronse algúns dos experimentos máis importantes da historia da bioloxía. Morgan e os seus estudantes finalmente esclareceron moitos principios básicos da herdanza, como a herdanza ligada ao sexo, a epistase, o alelismo múltiple, o ligamento xenético e o mapado de xenes.[19] Os primeiros mapas dos cromosomas de Drosophila foron completados por Alfred Sturtevant.
Organismo modelo en xenética
[editar | editar a fonte]
Drosophila melanogaster é un dos organismos máis estudados na investigación biolóxica, e especialmente en xenética e bioloxía do desenvolvemento. Hai varias razóns para que sexa así:
- O seu coidado e cultivo require pouco equipamento e utiliza pouco espazo mesmo cando se fan cultivos grandes, e o custo global é baixo.
- É un organismo pequeno e doado de cultivar no laboratorio e a súa morfoloxía é fácil de identificar unha vez que as moscas son anestesiadas (normalmente con éter, dióxido de carbono, arrefriándoas ou con produtos como FlyNap).
- Ten un curto tempo de xeración (uns 10 días a temperatura media) polo que se poden estudar varias xeracións en poucas semanas.
- Ten unha alta fecundidade (as femias poñen ata 100 ovos diarios, e uns 2000 en toda a súa vida).[2]
- Os machos e as femias distínguense facilmente e as femias virxes poden ser illadas facilmente, facilitando o cruzamento xenético.
- As larvas maduras teñen cromosomas xigantes nas glándulas salivares chamados cromosomas politénicos, con expansións ou "puffs" que indican as rexións de transcrición e actividade xénica.
- Teñen só catro pares de cromosomas: tres autosomas, e un cromosoma sexual, que intervén na determinación do sexo.
- Os machos non presentan recombinación xenética, o que facilita os estudos xenéticos.
- Os "cromosomas equilibradores" ou balanceadores letais recesivos que levan marcadores xenéticos visibles poden utilizarse para manter stocks de alelos letais en estado de heterocigose sen recombinación debido ás moitas inversións que ten o cromosoma equilibrador.
- As técnicas de transformación xenética utilízanse desde 1987.
- O seu xenoma completo foi secuenciado e publicouse en 2000.[20]
Marcadores xenéticos
[editar | editar a fonte]Os marcadores xenéticos utilízanse comunmente na investigación en Drosophila, por exemplo en cromosomas balanceadores ou insercións de elementos P, e a maioría dos fenotipos son doadamente identificables a simple vista ou co microscopio. Na lista de exemplos de marcadores comúns de máis abaixo, o símbolo do alelo (en inglés) vai seguido polo nome dos xenes afectados e a descrición do seu fenotipo. (Nota: Os alelos recesivos escríbense en minúscula, mentres que os alelos dominantes van en maiúscula.)
- Cy1: Curly; As ás cúrvanse separándose do corpo, e o voo pode quedar algo alterado.
- e1: ebony; Corpo e ás negras (os heterocigotos son visiblemente máis escuros que o tipo salvaxe).
- Sb1: Stubble; Os pelos son máis curtos e máis grosos có tipo salvaxe.
- w1: white; Ollos sen pigmentación visual de cor branca.
- y1: yellow; Pigmentación do corpo e ás amarela. Este é o análogo nas moscas do albinismo.
Os xenes de Drosophila denomínanse tradicionalmente polo fenotipo que causan cando están mutados. Por exemplo, a ausencia dun determinado xene en Drosophila orixinará un embrión mutante que non desenvolve o corazón. Os científicos chmáronlle tinman (home de folla de lata, polo personaxe do Mago de Oz, que non tiña corazón).[21] Este sistema de nomenclatura comprende un maior número de nomes de xenes que noutros organismos.
Xenoma
[editar | editar a fonte]
O xenoma de D. melanogaster (secuenciado en 2000, e conservado na base de datos FlyBase[20]) contén catro pares de cromosomas: un par X/Y, e tres pares de autosomas numerados 2, 3 e 4. O cuarto cromosoma é tan pequeno (puntiforme) que moitas veces é ignorado, aínda que contén o importante xene eyeless. O xenoma secuenciado de D. melanogaster ten 139,5 millóns de pares de bases, foi anotado[22] e contén aproximadamente 15.682 xenes segundo a edición 73 de Ensembl. Máis do 60% deste xenoma parece ser ADN que non codifica proteínas funcionais[23] implicado no control da expresión xenética. A determinación do sexo en Drosophila ten lugar pola proporción X:A entre os cromosomas X e os autosomas, e non pola presenza dun cromosoma Y como na determinación do sexo en humanos. Aínda que o cromosoma Y de drosófila é enteiramente heterocromático, contén polo menos 16 xenes, moitos dos cales crese que teñen funcións relacionadas co macho.[24]
Semellanza cos humanos
[editar | editar a fonte]Un 75% dos xenes humanos coñecidos relacionados con doenzas teñen un xene correspondente no xenoma da mosca da froita,[25] e o 50% das secuencias das proteínas desta mosca teñen homólogos nos mamíferos. Pódese utilizar a base de datos Homophila para procurar homólogos na mosca de xenes humanos causantes de enfermidades e viceversa.[26] Drosophila utilízase como modelo xenético para varias enfermidades humanas como en trastornos neurodexenerativos como as enfermidades de Parkinson, Huntington, ataxia espiñocerebelosa e enfermidade de Alzheimer. Tamén se utiliza esta mosca para estudar os mecanismos que subxacen no envellecemento e estrés oxidativo, inmunidade, diabetes, e cancro, e o abuso de drogas.
Desenvolvemento
[editar | editar a fonte]A embrioxénese de Drosophila foi exhaustivamente estudada, xa que polo seu pequeno tamaño, curto tempo de xeración, e numerosa descendencia fai que sexa ideal para estudos xenéticos e embriolóxicos. Tamén ten a característica única entre os organismos modelo de que a segmentación do ovo ocorre nun sincitio.
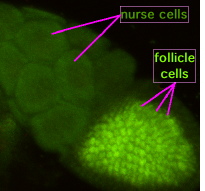
Durante a ovoxénese, unhas pontes citoplasmáticas chamadas "canles de anel" conectan o ovocito en formación a células coidadoras. Os nutrientes e as moléculas que controlan o desenvolvemento móvense desde ditas células ao interior do ovocito. Na figura da esquerda, o ovocito en formación está cuberto de células foliculares de sustentación.
Despois da fertilización do ovocito o embrión temperán (ou embrión sincicial) sofre unha rápida replicación do ADN e prodúcense 13 divisións nucleares ata que se acumulan aproximadamente de 5000 a 6000 núcleos no citoplasma común indiviso do embrión. Ao final da 8ª división a maioría dos núcleos migraron á superficie, rodeando o saco de xema (deixando atrás só uns poucos núcleos, os cales se converterán en núcleos da xema). Despois da 10ª división fórmanse as células polares no extremo posterior do embrión, segregando a liña xerminal do sincitio. Finalmente, despois da 13ª división as membranas celulares invaxínanse lentamente, dividindo o sincitio en células somáticas individualizadas. Unha vez que se completa este proceso comeza a gastrulación.[27]
A división nuclear no embrión temperán de Drosophila ocorre tan rapidamente que non hai verdadeiros puntos de comprobación, polo que poden ocorrer erros na división do ADN. Para solucionar este problema, os núcleos nos que se cometeu algún erro sepáranse dos seus centrosomas e caen ao centro do embrión (o saco da xema), o cal non formará parte da mosca.
A rede de xenes (transcricional e de interacción de proteínas) que dirixe o desenvolvemento temperán do embrión da mosca da froita é unha das mellor coñecidas actualmente, especialmente os patróns ao longo dos eixes anteroposterior (AP) e dorsoventral (DV).[27]
O embrión sofre movementos morfoxenéticos ben caracteriszados durante a gastrulación e o desenvolvemento temperán, como a extensión da banda xerminal, a formación de varios sucos, a invaxinación ventral do mesoderma, invaxinación posterior e anterior do endoderma (tubo dixestivo), e unha segmentación extensa do corpo ata que finalmente eclosiona saíndo da cutícula que o rodea e pasa ao 1º estadio larvario.
Durante o desenvolvemento larvario, os tecidos chamados discos imaxinais crecen dentro da larva. Os discos imaxinais desenvólvense para formar a maioría das estruturas do corpo adulto, como a cabeza, patas, ás, tórax e xenitais. As células dos discos imaxinais quedan aparcadas ou detidas momentaneamente durante a embrioxénese pero continúan crecendo e dividíndose durante os estadios larvarios, a diferenza da maioría das outras células da larva, que se diferenciaron para realizar funcións especializadas e crecen ser experimentar máis divisións celulares. Na metamorfose, a larva forma unha pupa, dentro da cal os tecidos larvarios reabsórbense e os tecidos imaxinais experimentan amplos movementos morfoxenéticos para formar as estruturas adultas.
Determinación do sexo
[editar | editar a fonte]A drosófila ten cromosomas X e Y e autosomas. A diferenza dos humanos, o cromosoma Y non confire masculinidade, senón que codifica xenes necesarios para producir o esperma. O sexo está determinado pola proporción entre autosomas e cromosomas X. Ademais, cada célula "decide" se vai ser masculina ou feminina independentemente do resto do organismo, o que ten como resultado que ocasionalmente se orixinen individuos xinandromorfos.
| Cromosomas X | Autosomas | Proporción X:A | Sexo |
|---|---|---|---|
| XXXX | AAAA | 1 | Femia normal |
| XXX | AAA | 1 | Femia normal |
| XXY | AA | 1 | Femia normal |
| XXYY | AA | 1 | Femina normal |
| XX | AA | 1 | Femia normal |
| X | AA | 0,50 | Macho normal (estéril) |
| XXX | AA | 1,50 | Metafemia |
| XXXX | AAA | 1,33 | Metafemia |
| XX | AAA | 0,66 | Intersexual |
| X | AAA | 0,33 | Metamacho |
Na determinación do sexo de drosófila están implicados tres xenes, chamados sex-lethal, sisterless e deadpan. O xene deadpan é un xene autosómico que inhibe a sex-lethal, mentres que sisterless está situado no cromosoma X e inhibe a acción de deadpan. Unha célula AAX ten dobre dose do xene deadpan ca de sisterless e deste modo sex-lethal queda inhibido e orixínase un macho. Por outra parte, unha célula AAXX terá sisterless dabondo como para inhibir a acción de deadpan, o que permite que o xene sex-lethal se transcriba e orixine unha femia.
Posteriormente, o control por deadpan e sisterless desaparece e o que pasa a ser importante é a forma do xene sex-lethal. A transcrición é causada por un promotor secundario tanto en machos coma en femias. A análise do ADNc mostrou que se expresan diferentes formas en machos e en femias. Sex-lethal afecta ao splicing do seu propio ARNm. Nos machos o 3º exón inclúese no transcrito, o cal codifica un codón de parada que orixina unha forma truncada da proteína. Na versión das femias, a presenza de sex-lethal causa que este exón se perda e prodúcese unha cadea peptídica completa con 7 aminoácidos máis, o que supón unha diferenza entre machos e femias.[28]
A presenza ou ausencia das proteínas funcionais Sex-lethal afectan á transcrición doutra proteína chamada Doublesex. En ausencia de Sex-lethal, Doublesex carecerá do seu 4º exón e será traducida ata incluír o 6º exón (DSX-M[acho]), mentres que en presenza de Sex-lethal o mencionado 4º exón será incluído; este exón codifica un codón de parada e producirá unha versión truncada da proteína (DSX-F[emia]). DSX-F causa a transcrición das proteínas Yolk 1 e 2 nas células somáticas, as cales son bombeadas ao interior do ovocito.
Inmunidade
[editar | editar a fonte]A diferenza dos mamíferos, a drosófila só ten inmunidade innata e carece de resposta inmunitaria adaptativa. O sistema inmunitario de D. melanogaster pode realizar dúas respostas: humoral e mediada por células. A primeira é unha resposta sistémica mediada por medio do xene Toll e a vía imd, que son sistemas paralelos para detectar microbios. A vía Toll en drosófila é homóloga ás vías de tipo Toll dos mamíferos. A proteína Spatzle é un ligando da vía Toll das moscas, que se produce en resposta a bacterias grampositivas, parasitos, e infeccións fúnxicas. Despois da infección, a proteína precursora pro-Spatzle é clivada pola protease SPE (encima procesador de Spatzle) e orixina a Spatzle activa, a cal despois se une ao receptor Toll localizado na superficie celular (no corpo graxo e hemocitos) e dimerízase para activar as vías de sinalización NF-κB de augas abaixo. Por outra parte, a vía imd desencadéase pola presenza de bacterias Gram-negativaa por medio de receptores de superficie (PGRP-LR) e solubles (LC). D. melanogaster ten un "corpo graxo" que se cre que é o homólogo do fígado humano, e é o principal órgano secretor e produce péptidos antimicrobianos. Estes péptidos segréganse á hemolinfa e únense ás bacterias infecciosas, matándoas ao formarlles poros na súa parede celular. Ademais do corpo graxo, os hemocitos, que son as células sanguíneas de drosófila, son os homólogos dos monocitos/macrófagos de mamíferos, e teñen un papel significativo nas respostas inmunes. En resposta aos desafíos inmunitarios, os hemocitos poden segregar citocinas, por exemplo Spatzle, para activar vías de sinalización augas abaixo no corpo graxo. Porén, o mecanismo aínda non está aclarado.
Xenética do comportamento e neurociencia
[editar | editar a fonte]En 1971, Ron Konopka e Seymour Benzer publicou o artigo "Clock mutants of Drosophila melanogaster", no cal describía as primeiras mutacións coñecidas que afectaban ao comportamento dun animal. As moscas de tipo salvaxe mostraban un ritmo de actividade cunha frecuencia de aproximadamente 24 horas. Atoparon que os mutantes con ritmos máis rápidos e máis lentos e tamén as moscas cos seus ritmos alterados que se moven e descansan en arranques repentinos aleatorios. O traballo realizado nos seguintes 30 anos mostra que estas mutacións (e outras) afectan a un grupo de xenes e aos seus produtos que participan nun reloxo biolóxico ou bioquímico. Este reloxo encóntrase nunha ampla gama de células de mosca, pero as células que levan este reloxo que controlan a actividade son varias docenas de neuronas do cerebro central da mosca.
Desde entón, Benzer e outros illaron os xenes implicados na visión, olfacto, audición, aprendizaxe/memoria, cortexo, dor e outros procesos, como a lonxevidade.
Os primeiros mutantes da memoria e aprendizaxe (dunce, rutabaga etc.) foron illados por William Quinn mentres estaba no laboratorio de Benzer, e codificaban compoñentes dunha vía de sinalización celular na que interviña o AMP cíclico, a proteína quinase A e un factor de transcrición chamado CREB. Estas moléculas están tamén implicadas na plasticidade sináptica no molusco Aplysia e en mamíferos.
As moscas macho interpretan unha "canción" para as femias durante o cortexo usando as súas ás para xerar o son, e algunhas características xenéticas do comportamento sexual xa foron caracterizadas. En particular, o xene fruitless ten varias formas de splicing, e as moscas macho que expresan formas de splicing que serían propias das femias teñen un comportamento similar ao das femias e viceversa. As canles TRP nompC, nanchung, e inactive exprésanse en neuronas do órgano de Johnston sensitivo e participan na transdución do son.[29][30]
Ademais, Drosophila foi utilizada en investigacións neurofarmacolóxicas, como estudos sobre o consumo de cocaína e alcohol.
Visión
[editar | editar a fonte]
O ollo composto da mosca da froita contén 760 ollos unitarios ou omatidios, e son uns dos máis avanzados entre os insectos. Cada omatidio contén 8 células fotorreceptoras (R1-8), células de apoio, células pigmentarias, e unha córnea. As moscas de tipo salvaxe teñen células pigmentarias avermelladas, que serven para absorber o exceso de luz azul para que a mosca non quede cegada pola luz ambiental.
Cada célula fotorreceptora consta de dúas seccións principais, o corpo celular e o rabdómero. O corpo celular contén o núcleo celular e o rabdómero, de 100 μm de longo, está feito de membranas amoreadas que semellan un cepillo de dentes chamadas microvilosidades. Cada microvilosidade mide 1 ou 2 μm de longo e ~60 nm de diámetro.[31] A membrana do rabdómero está ateigada de moléculas de rodopsina, uns 100 millóns, que é a proteína visual que absorbe a luz. O resto das proteínas visuais están tamén apertadamente empaquetadas no espazo das microvilosidades, deixando moi pouco espazo para o citoplasma.
Os fotorreceptores de Drosophila expresan varias isoformas da rodopsina. As células fotorreceptoras R1-R6 expresan a rodopsina 1 (Rh1), que absorbe a luz azul (de 480 nm). As células R7 e R8 poden expresar ou ben unha combinación de Rh3 e Rh4, que absorben a luz ultravioleta (de 345 nm e 375 nm), ou ben de Rh5 e Rh6, que absorben a luz azul (de 437 nm) e verde (de 508 nm), respectivamente. Cada molécula de rodopsina consta dunha proteína opsina unida covalentemente a un cromóforo carotenoide chamado 11-cis-3-hidroxirretinal.[32]
Igual ca na visión dos vertebrados, a transdución visual en invertebrados ten lugar por medio dunha vía acoplada á proteína G. Porén, en vertebrados a proteína G empregada é a transducina, mentres que en invertebrados é a Gq (dgq en Drosophila). Cando a rodopsina (Rh) absorbe un fotón de luz, o seu cromóforo, o 11-cis-3-hidroxirretinal, é isomerizado a todo-trans-3-hidroxirretinal. A rodopsina sofre un cambio conformacional pasando á súa forma activa, a metarrodopsina. A metarrodopsina activa a Gq, a cal á súa vez activa unha fosfolipase Cβ (PLCβ) chamada NorpA.[33]
PLCβ hidroliza o fosfatidilinositol (4,5)-bisfosfato (PIP2), que é un fosfolípido que se encontra na membrana plasmática, orixinando inositol trisfosfato (IP3) soluble e diacilglicerol (DAG), que permanece na membrana. O DAG (ou un derivado do DAG) causa que se abra un canle iónica selectiva para o calcio chamado TRP (potencial receptor transitorio) e o calcio e o sodio flúen ao interior da célula. O IP3 crese que se une ao receptores do IP3 nas cisternas subrabdoméricas, que son unha extensión do retículo endoplasmático, e causan a liberación de calcio, pero este proceso non parece ser esencial para unha visión normal.[33]
O calcio únese a proteínas como a calmodulina (CaM) e a unha proteína quinase C (PKC) específica do ollo denominada InaC. Estas proteínas interaccionan con outras proteínas e son necesarias para cortar a resposta á luz. Ademais, unhas proteínas chamadas arrestinas únense á metarrodopsina e impiden que esta active a máis Gq. Un intercambiador sodio-calcio chamado CalX bombea o calcio fóra da célula, utilizando o gradiente de sodio cara ao interior para exportar calcio cunha estequiometría de 3 Na+/ 1 Ca++.[34]
O TRP, a InaC, e a PLC forman un complexo de sinalización ao unirse a unha proteína armazón chamada InaD. A InaD contén cinco dominios de unión (dominios PDZ), que se unen especificamente ao C-terminal das proteínas diana. A alteración deste complexo por mutacións nos dominios PDZ ou nas proteínas diana reduce a eficiencia da sinalización. Por exemplo, a alteración da interacción entre a InaC, a proteína quinase C, e a InaD orixina un atraso na inactivación da resposta á luz.
A diferenza da metarrodopsina de vertebrados, a metarrodopsina de invertebrados pode converterse de novo en rodopsina ao absorber un fotón de luz laranxa (de 580 nm).
Aproximadamente 2/3 do cerebro de Drosophila están dedicados ao procesamento visual.[35] Aínda que a resolución espacial da súa visión é significativamente peor cá humana, a súa resolución temporal é aproximadamente dez veces mellor.
Voo
[editar | editar a fonte]As ás dunha mosca poden bater ata 220 veces por segundo. As moscas voan seguindo secuencias de movemento en liña recta intercaladas con rápidos xiros. Durante estes xiros unha mosca pode rotar 90 graos en menos de 50 milisegundos.
Pensábase antes que as características do voo de drosófila estaban dominadas pola viscosidade do aire, en vez de pola inercia do corpo da mosca. Esta idea foi posta en dúbida polas investigacións realizadas no laboratorio de Michael Dickinson, que indicaban que as moscas realizaban xiros, nos que a mosca acelera, frea mentres xira, e acelera outra vez ao final do xiro, o que suxire que a inercia é a forza dominante, igual que no caso dos animais voadores grandes.[36][37] Porén, os trabllos seguintes indicaron que aínda que os efectos viscosos sobre o corpo do insecto durante o voo poden ser desprezables, as forzas aerodinámicas nas ás son as que en realidade fan que os xiros da mosca da froita sexan diminuídos pola viscosidade do aire.[38]
Como praga
[editar | editar a fonte]Drosophila é xeralmente considerada unha praga ou polo menos unha molestia debido á súa tendencia a infestar casas e establecementos nos que hai froitas; as moscas poden concentrarse en casas, restaurantes, almacéns e outros lugares.[3] A eliminación dunha infestación pode ser difícil, xa que as larvas poden seguir eclosionando nas froitas almacenadas mesmo se a poboación adulta foi xa eliminada.
Notas
[editar | editar a fonte]- ↑ Meigen JW (1830). Systematische Beschreibung der bekannten europäischen zweiflügeligen Insekten. (Volume 6) (PDF) (en alemán). Schulz-Wundermann. Arquivado dende o orixinal (PDF) o 09 de febreiro de 2012. Consultado o 30 de novembro de 2014.
- ↑ 2,0 2,1 James H. Sang (2001-06-23). "Drosophila melanogaster: The Fruit Fly". In Eric C. R. Reeve. Encyclopedia of genetics. USA: Fitzroy Dearborn Publishers, I. p. 157. ISBN 978-1-884964-34-3. Retrieved 2009-07-01. [1]
- ↑ 3,0 3,1 http://ento.psu.edu/extension/factsheets/vinegar-flies
- ↑ "FlyBase: A database of Drosophila genes and genomes". Genetics Society of America. 2009. Arquivado dende o orixinal o 15 de agosto de 2009. Consultado o August 11, 2009.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Ashburner M, Thompson JN (1978). "The laboratory culture of Drosophila". En Ashburner M, Wright TRF. The genetics and biology of Drosophila 2A. Academic Press. 1–81.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 Ashburner M, Golic KG, Hawley RS (2005). Drosophila: A Laboratory Handbook. (2nd ed.). Cold Spring Harbor Laboratory Press. pp. 162–4. ISBN 0-87969-706-7.
- ↑ Bloomington Drosophila Stock Center en Indiana University: Basic Methods of Culturing Drosophila Arquivado 01 de setembro de 2006 en Wayback Machine.
- ↑ 8,0 8,1 Chiang HC, Hodson AC (1950). "An analytical study of population growth in Drosophila melanogaster". Ecological Monographs 20 (3): 173–206. JSTOR 1948580. doi:10.2307/1948580.
- ↑ Bakker K (1961). "An analysis of factors which determine success in competition for food among larvae of Drosophila melanogaster". Archives Neerlandaises de Zoologie 14 (2): 200–281. doi:10.1163/036551661X00061.
- ↑ Pitnick S (1996). "Investment in testes and the cost of making long sperm in Drosophila". American Naturalist 148: 57–80. doi:10.1086/285911.
- ↑ 11,0 11,1 11,2 11,3 "Fruit fly research may reveal what happens in female brains during courtship, mating". Consultado o October 5, 2014.
- ↑ Maggie Koerth-Baker (August 21, 2009). "Female Flies Put Up a Fight to Keep Sex Short". National Geographic News. Consultado o August 21, 2009.
- ↑ Connolly, Kevin; Cook, Robert (1973). "Rejection Responses by Female Drosophila melanogaster: Their Ontogeny, Causality and Effects upon the Behaviour of the Courting Male". Behaviour 44 (1/2): 142–166. doi:10.1163/156853973x00364. Consultado o October 23, 2014.
- ↑ Houot, B.; Svetec, N.; Godoy-Herrera, R.; Ferveur, J. -F. (2010). "Effect of laboratory acclimation on the variation of reproduction-related characters in Drosophila melanogaster". Journal of Experimental Biology 213 (Pt 13): 2322–2331. doi:10.1242/jeb.041566. PMID 20543131.
- ↑ Gilbert SF (2006). "9: Fertilization in Drosophila". En 8th. Developmental Biology. Sinauer Associates. ISBN 978-0-87893-250-4. Arquivado dende o orixinal o 07 de febreiro de 2007. Consultado o 18 de decembro de 2014.
- ↑ 16,0 16,1 16,2 Price C; Catherine S. C.; Kelly A. (1999). "Sperm competition between Drosophila males involves both displacement and incapacitation". Nature 400 (6743): 449–452. Bibcode:1999Natur.400..449P. PMID 10440373. doi:10.1038/22755.
- ↑ Reuven, Dukas (2004). "Male fruit flies learn to avoid interspecific courtship". Behavioral Ecology 15 (4): 695–698.
- ↑ Saleem, S; Ruggles, PH; Abbott, WK; Carney, GE (2014). "Sexual Experience Enhances Drosophila melanogaster Male Mating Behavior and Success". PLoS ONE 9 (5). doi:10.1371/journal.pone.0096639.
- ↑ 19,0 19,1 Pierce, Benjamin A (2004). Genetics: A Conceptual Approach (2nd ed.). W. H. Freeman. ISBN 978-0-7167-8881-2.
- ↑ 20,0 20,1 Adams MD, Celniker SE, Holt RA; et al. (2000). "The genome sequence of Drosophila melanogaster". Science 287 (5461): 2185–95. Bibcode:2000Sci...287.2185.. PMID 10731132. doi:10.1126/science.287.5461.2185. Consultado o 2007-05-25.
- ↑ Azpiazu N, Frasch M (1993). "tinman and bagpipe: two homeo box genes that determine cell fates in the dorsal mesoderm of Drosophila". Genes and Development 7 (7b): 1325–1340. PMID 8101173. doi:10.1101/gad.7.7b.1325.
- ↑ "NCBI (National Center for Biotechnology Information) Genome Database". Consultado o 2011-11-30.
- ↑ Halligan DL, Keightley PD (2006). "Ubiquitous selective constraints in the Drosophila genome revealed by a genome-wide interspecies comparison". Genome Research 16 (7): 875–84. PMC 1484454. PMID 16751341. doi:10.1101/gr.5022906.
- ↑ Carvalho, AB (2002). "Origin and evolution of the Drosophila Y chromosome". Current Opinion in Genetics & Development 12 (6852): 664–668. doi:10.1016/S0959-437X(02)00356-8.
- ↑ Reiter, LT; Potocki, L; Chien, S; Gribskov, M; Bier, E (2001). "A Systematic Analysis of Human Disease-Associated Gene Sequences In Drosophila melanogaster". Genome Research 11 (6): 1114–1125. PMC 311089. PMID 11381037. doi:10.1101/gr.169101.
- ↑ Chien, Samson; Reiter, Lawrence T.; Bier, Ethan; Gribskov, Michael (1 January 2002). "Homophila: human disease gene cognates in Drosophila". Nucleic Acids Research (National Library of Medicine (NLM)) 30 (1): 149–151. PMC 99119. PMID 11752278. doi:10.1093/nar/30.1.149. Consultado o August 24, 2013.
- ↑ 27,0 27,1 Katrin Weigmann, Robert Klapper, Thomas Strasser, Christof Rickert, Gerd Technau, Herbert Jäckle, Wilfried Janning & Christian Klämbt (2003). "FlyMove – a new way to look at development of Drosophila". Trends in Genetics 19 (6): 310–311. PMID 12801722. doi:10.1016/S0168-9525(03)00050-7.
- ↑ Gilbert S.F. (2000). Developmental Biology. 6th edition. Sunderland (MA): Sinauer Associates; 2000.
- ↑ Lehnert, B. P.; Baker, A. E.; Gaudry, Q; Chiang, A. S.; Wilson, R. I. (2013). "Distinct roles of TRP channels in auditory transduction and amplification in Drosophila". Neuron 77 (1): 115–28. doi:10.1016/j.neuron.2012.11.030. PMC 3811118. PMID 23312520.
- ↑ Zhang, W; Yan, Z; Jan, L. Y.; Jan, Y. N. (2013). "Sound response mediated by the TRP channels NOMPC, NANCHUNG, and INACTIVE in chordotonal organs of Drosophila larvae". Proceedings of the National Academy of Sciences 110 (33): 13612–7. doi:10.1073/pnas.1312477110. PMC 3746866. PMID 23898199.
- ↑ Hardie RC, Raghu P (2001). "Visual transduction in Drosophila". Nature 413 (6852): 186–93. PMID 11557987. doi:10.1038/35093002.
- ↑ Nichols R, Pak WL (1985). "Characterization of Drosophila melanogaster rhodopsin". Journal of Biological Chemistry 260 (23): 12670–4. PMID 3930500.
- ↑ 33,0 33,1 Raghu P, Colley NJ, Webel R; et al. (2000). "Normal phototransduction in Drosophila photoreceptors lacking an InsP(3) receptor gene". Molecular and Cellular Neuroscience 15 (5): 429–45. PMID 10833300. doi:10.1006/mcne.2000.0846.
- ↑ Wang T, Xu H, Oberwinkler J, Gu Y, Hardie R, Montell C; et al. (2005). "Light activation, adaptation, and cell survival Functions of the Na+/Ca2+ exchanger CalX". Neuron 45 (3): 367–378. PMID 15694299. doi:10.1016/j.neuron.2004.12.046.
- ↑ Rein, K. and Zockler, M. and Mader, M.T. and Grubel, C. and Heisenberg, M. (2002). "The Drosophila Standard Brain". Current Biology 12 (3): 227–231. PMID 11839276. doi:10.1016/S0960-9822(02)00656-5.
- ↑ "Caltech Press Release 4/17/2003". Arquivado dende o orixinal o 14 de setembro de 2008. Consultado o 18 de decembro de 2014.
- ↑ S. Fry and M. Dickinson (2003). "The aerodynamics of free-flight maneuvers in Drosophila". Science 300 (5618): 495–8. Bibcode:2003Sci...300..495F. PMID 12702878. doi:10.1126/science.1081944.
- ↑ T. Hesselberg and F.-O. Lehmann (2007). "Turning behaviour depends on frictional damping in the fruit fly "Drosophila"". The Journal of Experimental Biology 210 (Pt 24): 4319–34. PMID 18055621. doi:10.1242/jeb.010389.
Véxase tamén
[editar | editar a fonte]| Wikispecies posúe unha páxina sobre: Mosca do vinagre |
| Commons ten máis contidos multimedia sobre: Mosca do vinagre |
Bibliografía
[editar | editar a fonte]- K. Haug-Collet; et al. (1999). "Cloning and Characterization of a Potassium-Dependent Sodium/Calcium Exchanger in Drosophila". J. Cell Biol. 147 (3): 659–70. PMC 2151195. PMID 10545508. doi:10.1083/jcb.147.3.659.
- R. Ranganathan; et al. (1995). "Signal transduction in Drosophila photoreceptors". Annu. Rev. Neurosci. 18: 283–317. PMID 7605064. doi:10.1146/annurev.ne.18.030195.001435.
- Adams MD; et al. (2000). "The genome sequence of Drosophila melanogaster". Science 287 (5461): 2185–95. Bibcode:2000Sci...287.2185.. PMID 10731132. doi:10.1126/science.287.5461.2185.
- Kohler, Robert E. (1994). Lords of the Fly: Drosophila genetics and the experimental life. Chicago: University of Chicago Press. ISBN 0-226-45063-5.
- Gilbert S.F. (2000). Developmental Biology. 6th edition. Sunderland (MA): Sinauer Associates; 2000.
Ligazóns externas
[editar | editar a fonte]- Introdución simple e rápida a Drosophila melanogaster
- FlyBase — Base de datos de xenes e xenoma de Drosophila
- páxina do NCBI sobre Drosophila melanogaster
- The WWW Virtual Library: Drosophila
- The Berkeley Drosophila Genome Project
- FlyMove Arquivado 12 de abril de 2021 en Wayback Machine.
- Annual Drosophila Research Conference
- A mosca interactiva — Unha guía dos xenes de Drosophila e os seus papeis no desenvolvemento
- Nomenclatura de Drosophila — os nomes dos xenes
- Desenvolvemento de Drosophila
- Medida do comportamento de cortexo de Drosophila melanogaster
- Mantemento dun laboratorio de Drosophila: Procedementos xerais
- Transcript In Situ Hybridization of Whole-Mount Embryos for Phenotype Analysis of RNAi-Treated Drosophila
- Injection of dsRNA into Drosophila Embryos for RNA Interference (RNAi)
- Vista do xenoma da mosca da froita en Ensembl
