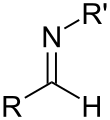
Imina

Unha imina é un grupo funcional ou composto químico que contén un dobre enlace carbono–nitróxeno, no que o nitróxeno está á súa vez unido ou ben a un átomo de hidróxeno (H) ou a un grupo orgánico. Cando dito nitróxeno non está unido a un H o composto denomínase base de Schiff.[1] O carbono ten ademais outros dous enlaces simples.[2][3][4] As iminas son moi comúns na natureza. A vitamina B6 promove a desaminación dos aminoácidos por medio da formación de iminas, por exemplo.
Nomenclatura e clasificación
[editar | editar a fonte]As iminas están relacionadas coas cetonas e aldehidos, nos cales se produce un reemprazamento do osíxeno cun grupo NR. Cando R = H, o composto é unha imina primaria, cando R é un hidrocarbil (grupo hidrocarbonado), o composto é unha imina secundaria.[4] Cando R3 é un OH, a imina denomínase oxima, e cando R3 é NH2 a imina denomínase hidrazona.
Aldiminas e cetiminas
[editar | editar a fonte]Unha imina primaria na que C está unido á vez a un grupo hidrocarbonado e a un H denomínase aldimina primaria; unha imina secundaria que conteña ditos grupos denomínase aldimina secundaria.[5]
Unha imina primaria na que o C está unido a dous grupos hidrocarbonados denomínase cetimina primaria; unha imina secundaria que conteña ditos grupos denomínase cetimina secundaria.[6]
-
Aldimina primaria
-
Aldimina secundaria
-
Cetimina primaria
-
Cetimina secundaria
Síntese de iminas
[editar | editar a fonte]As iminas obtéñense normalmente por condensación de aminas primarias e aldehidos ou menos comunmente cetonas. Ditas reaccións proceden por medio dunha adición nucleofílica da amina sobre o carbonilo electrofílico do aldehido ou cetona, orixinando un intermediato hemiaminal -C(OH)(NHR)-, seguida da eliminación dunha molécula de auga que orixina a imina (ver alquilimino-de-oxo-bisubstitución para máis detalle). O equilibrio nesta reacción xeralmente favorece a formación do composto carbonilo e a amina, de modo que se require unha destilación azeotrópica ou o uso de axentes deshidratantes como peneira molecular para impulsar a reacción cara á formación de iminas.

Existen outros métodos de síntese de iminas, como os seguintes:
- Condensación de carbonos ácidos con compostos nitrosos.
- Rearranxo de tritil N-haloaminas no rearranxo de Stieglitz.
- Deshidratación de hemiaminais.[7]
- Reacción de alquenos con ácido hidrazoico na reacción de Schmidt.
- Reacción dun nitrilo, ácido clorhídrico e un areno na reacción de Hoesch.
- Síntese de multicompoñentes de 3-tiazolinas na reacción de Asinger.
Reaccións das iminas
[editar | editar a fonte]As reaccións máis importantes das iminas son as súas hidrólises para dar as correspondentes aminas e carbonilos. Participan tamén en moitas outras reaccións, moitas das cales son análogas das reaccións de aldehidos e cetonas.
- Unha imina reacciona cunha amina dando un aminal, como ocorre por exemplo na síntese de cucurbituril.
- Unha imina reacciona con dienos na reacción de Aza Diels-Alder para dar tetrahidropiridina.
- Unha imina pode oxidarse con ácido meta-cloroperoxibenzoico (mCPBA) para dar unha oxaziridina.
- Unha imina aromática reacciona cun enol éter para dar unha quinolina na reacción de Povarov.
- Unha tosilimina reacciona cun composto carbonilo α,β-insaturado para dar unha amina alílica na reacción de Aza-Baylis–Hillman.
- As iminas son intermediatos na alquilación de aminas con ácido fórmico na reacción de Eschweiler-Clarke.
- Un rearranxo en química de carbohidratos no que está implicado unha imina é o rearranxo de Amadori.
- Unha reacción de transferencia de metileno dunha imina por unha sulfonio ilida inestabilizada pode orixinar un sistema aziridina.
- Unha imina é un intermediato na aminación redutiva.
Reaccións ácido-base
[editar | editar a fonte]De xeito similar ás aminas correspondentes, as iminas son medianamente básicas e protónanse reversiblemente para daren sales iminio. Os derivados iminio son particularmente susceptibles de redución a aminas utilizando hidroxenación de transferencia ou pola acción estequiométrica do cianoborohidruro de sodio. Como as iminas derivadas de cetonas asimétricas son proquirais, a súa redución é un método útil para a síntese de aminas quirais.
Ligandos
[editar | editar a fonte]As iminas son ligandos comúns en química de coordinación. A condensación do salicilaldehido e acetilacetona dá lugar a familias de axentes quelantes que conteñen iminas, como os salen.
Reducións das iminas
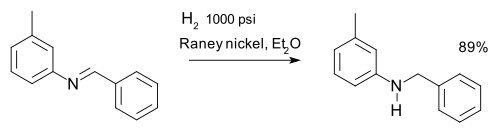
[editar | editar a fonte]Unha imina pode reducirse a amina por medio de hidroxenación, como por exemplo na síntese de m-tolilbenzilamina:[8]
Outros axentes redutores son o hidruro de litio aluminio e o borohidruro de sodio.[9]
A primeira redución dunha imina asimétrica foi publicada en 1973 por Kagan utilizando Ph(Me)C=NBn e PhSiH2 nunha hidrosililación cun ligando quiral DIOP e o rodio como catalizador (RhCl(CH2CH2)2)2.[10] Desde entón foron investigados moitos outros sistemas.[11][12]
Notas
[editar | editar a fonte]- ↑ IUPAC Goldbook base de Schiff
- ↑ IUPAC Goldbook Imina
- ↑ March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ↑ 4,0 4,1 Fletcher, Dermer, Fox, Nomenclature of Organic Compounds (1974) doi:10.1021/ba-1974-0126.ch023 [1]
- ↑ IUPAC Gold Book Aldimines
- ↑ IUPAC Gold Book Ketimines
- ↑ W. J. Middleton and H. D. Carlson (1988), "Hexafluoroacetone imine", Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0664 Arquivado 05 de xuño de 2011 en Wayback Machine. ; Coll. Vol. 6: 664 Hexafluoroacetone imine Arquivado 05 de xuño de 2011 en Wayback Machine..
- ↑ C. F. H. Allen and James VanAllan (1955), "m-Tolylbenzylamine", Org. Synth.: 827, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv3p0827 Arquivado 06 de xuño de 2011 en Wayback Machine. ; Coll. Vol. 3 Tolylbenzylamine Arquivado 06 de xuño de 2011 en Wayback Machine.
- ↑ Por exemplo: For example: Ieva R. Politzer and A. I. Meyers (1988), "Aldehydes from 2-Benzyl-4,4,6-trimethyl-5,6-dihydro-1,3(4H)-oxazine: 1-Phenylcyclopentanecarboxaldehyde", Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0905 Arquivado 05 de outubro de 2012 en Wayback Machine. ; Coll. Vol. 6: 905 Aldehydes from 2-Benzyl-4,4,6-trimethyl-5,6-dihydro-1,3(4H)-oxazine: 1-Phenylcyclopentanecarboxaldehyde Arquivado 05 de outubro de 2012 en Wayback Machine.
- ↑ Langlois, N (1973). "Synthese asymetrique d'amines par hydrosilylation d'imines catalysee par un complexe chiral du rhodium". Tet. Lett. 14 (49): 4865. doi:10.1016/S0040-4039(01)87358-5.
- ↑ Kobayashi, Shū; Ishitani, Haruro (1999). "Catalytic Enantioselective Addition to Imines". Chem. Rev. 99 (5): 1069. doi:10.1021/cr980414z..
- ↑ J. Martens: Reduction of Imino Groups (C=N) in (G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann) Houben-Weyl Stereoselective Synthesis, Workbench Edition E21 Volume 7, S. 4199-4238, Thieme Verlag Stuttgart, 1996, ISBN 3-13-106124-3.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Carboximidato
- Outros grupos funcioanis con dobre enlace C=N: oximas, hidrazonas
- Outros grupos funcionais con triplo enlace C≡N: nitrilos, isonitrilos
- Iminoácido