Sulfóxido

Un sulfóxido é un composto químico que contén un grupo funcional sulfinilo unido a dous átomos de carbono. Os sulfóxidos son tioéteres oxidados. Un exemplo de sulfóxido que se encontra na natureza é a aliína.
Natureza do enlace
[editar | editar a fonte]Os sulfóxidos represéntanse xeralmente coa fórmula estrutural R–S(=O)–R', na que R e R' son grupos orgánicos. O enlace entre os átomos de xofre e oxíxeno é distinto do convencional dobre enlace entre o carbono e o oxíxeno (por exemplo, nas cetonas).[1] A interacción S–O ten unha carácter electrostático, que lle dá ao enlace un carácter dipolar significativo, coa carga negativa centrada no oxíxeno.
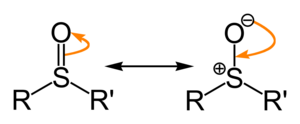
No átomo de xofre hai un par de electróns libres que lle dá unha xeometría molecular tetraédrica. Cando os dous residuos orgánicos son diferentes, o xofre é un centro quiral, por exemplo no metilfenilsulfóxido. Se ambos os grupos son iguais, o composto non sería quiral, senón simétrico: un exemplo é o dimetilsulfóxido (DMSO), CH3-S(=O)-CH3.

A enerxía requirida para inverter este estereocentro é alta dabondo como para que os sulfóxidos sexan opticamente estables, é dicir, o grao de racemización é baixo a temperatura moderada. Os sulfóxidos quirais utilízanse en certos fármacos como o esomeprazole e Armodafinil, e tamén se empregan como auxiliares quirais.[2] Moitos sulfóxidos quirais prepáranse por medio dunha oxidación catalítica asimétrica de sulfoxidos aquirais cun metal de transición e un ligando quiral.
Reaccións
[editar | editar a fonte]Os sulfuros son os materiais de partida usuais para obter sulfóxidos por oxidación orgánica. Por exemplo, o sulfuro de dimetilo cun estado de oxidación de -2 oxídase a dimetilsulfóxido cun estado de oxidación de 0. Unha ulterior oxidación converte o composto en dimetilsulfona no que o xofre ten un estado de oxidación de +2.
- (CH3)-S-(CH3) + O → (CH3)-SO-(CH3)
- (CH3)-SO-(CH3) + O → (CH3)-SO2-(CH3)
Os sulfóxidos como o DMSO, teñen un carácter básico, e son excelentes ligandos e facilmente alquilables. Os alquil sulfóxidos son susceptibles de desprotonarse pola acción de bases fortes, como o hidruro de sodio.[3]
Notas
[editar | editar a fonte]- ↑ Terence P. Cunningham, David L. Cooper, Joseph Gerratt, Peter B. Karadakov and Mario Raimondi (1997). "Chemical bonding in oxofluorides of hypercoordinate sulfur". Journal of the Chemical Society, Faraday Transactions 93 (13): 2247–2254. doi:10.1039/A700708F.
- ↑ Oxidation of sulfides to chiral sulfoxides using Schiff base-vanadium (IV) complexes Ángeles Gama, Lucía Z. Flores-López, Gerardo Aguirre, Miguel Parra-Hake, Lars H. Hellberg, and Ratnasamy Somanathan Arkivoc MX-789E 2003 Online article Arquivado 21 de abril de 2005 en Wayback Machine.
- ↑ Iwai, I.; Ide, J. 2,3-Diphenyl-1,3-Butadiene. OrgSynth 6, 531, ano 1988, prep = cv6p0531 [1] Arquivado 30 de setembro de 2012 en Wayback Machine.
