Composto organofosforado
- Véxase tamén: Organofosfato e organofosfito.
Un composto organofosforado ou composto de organofósforo é un composto orgánico degradable que contén enlaces fósforo-carbono (o cal exclúe aos ésteres de fosfato e de fosfito, que carecen dese enlace), utilizados principalmente no control de pragas como alternativa aos hidrocarburos clorados que persisten no medio ambiente. A química dos organofosforados é a ciencia que estuda as propiedades e a reactividade dos compostos organofosforados. O fósforo comparte o grupo 15 da táboa periódica co nitróxeno e outros elementos. Os compostos de nitróxeno e os compostos de fósforo son similares.[1][2][3]
A definición dos compostos organofosforados é variable, o que pode levar a confusión. Independentemente da definición anterior, en química industrial e ambiental, un composto para ser considerado organofosforado necesita conter soamente un substituínte orgánico, pero non necesita ter un enlace directo P-C. Así a maioría dos herbicidas, como por exemplo o malatión, inclúense a miúdo nesta clase de compostos.
Estado de oxidación, número de coordinación e valencia
[editar | editar a fonte]Para axudar a establecer os enlaces dun átomo de fósforo nun composto organofosforado empréganse tres números.
| NC | Símbolos | Fórmula xeral | Grupo de compostos[4] |
|---|---|---|---|
| 1 | σ11n | R—P | Fosfinidenos |
| 1 | σ1λ3 | R—CP | Fosfoalquinos |
| 2 | σ2λ3 | R2C=P—R | Fosfoalquenos |
| 2 | σ2λ3 | RO—P=O | Oxofosfinos |
| 2 | σ2λ3 | R—P=S | Tioxofosfinos |
| 2 | σ2λ3 | R—N=P | Iminofosfinos |
| 2 | σ2λ3 | R—P=P—R | Difosfenos |
| 2 | σ2λ2 | R2P+ | Catión fosfenio |
| 3 | σ3λ3 | R3P | Fosfinas |
| 3 | σ3λ3 | R—PX2 | Dihaluro alquilfosfonoso |
| 3 | σ3λ3 | R2P—X | Haluro de dialquilfosfino |
| 3 | σ3λ3 | R—P(OR)2 | Dialquilfosfonito |
| 3 | σ3λ3 | (RO)3P | Trialquilfosfito |
| 3 | σ3λ5 | R—PO2 | Dioxofosforanos |
| 3 | σ3λ5 | RO—PO2 | Alquilmetafosfato |
| 3 | σ3λ5 | R—P(O)(=CH2) | Metilenoxofosforano |
| 3 | σ3λ5 | R—P(=CR2)2 | Bis(metilen)fosforano |
| 4 | σ4λ4 | R4P+ | Ión fosfonio |
| 4 | σ4λ5 | R—P(O)(OH)2 | Ácido fosfónico |
| 4 | σ4λ5 | R2—P(O)(OH) | Ácido fosfínico |
| 4 | σ4λ5 | R3—P(O) | Óxido de fosfina |
| 4 | σ4λ5 | RO—P(O)(OH)2 | alquilfosfato |
| 4 | σ4λ5 | (RO)2P(O)(OH) | dialquilfosfato |
| 4 | σ4λ5 | (RO)3P(O) | trialquilfosfato |
| 5 | σ5λ5 | R5P | fosforanos |
| 6 | σ6λ6 | R6P- | Sen nome común |
Estado de oxidación ou número de oxidación: Nun modelo de enlace iónico, é a carga iónica que queda en cada átomo despois de aplicar unhas regras[5] que asignan os pares de electróns compartidos aos átomos máis electronegativos.[6] O fósforo pode adoptar diversos estados de oxidación, e é habitual clasificar os compostos organofosforados segundo sexan derivados do fósforo (V) ou do fósforo (III), que son as clases predominantes de compostos de fósforo.
Na nomenclatura de substitución da IUPAC, unha nomenclatura descritiva que aínda se utiliza pouco, para nomear os compostos de fósforo e outros elementos que non presentan o número de enlace estándar emprégase a convención λ (lambda).[7] Xunto a ela emprégase o número de coordinación.
O número de coordinación, que se representa polas letras gregas sigma σ ou δ cun superíndice, é o número de átomos aos que está directamente enlazado o átomo central, ou o número de enlaces σ que forma o átomo central.[4] O número de coordinación δ do fósforo pode variar entre 1 e 6.
Na convención lambda, o número total de enlaces n entre un elemento e os seus átomos veciños indícase como λn, chamado valencia λ. O símbolo λ5-fosfano indica que o fósforo se enlaza con cinco hidróxenos, é dicir, o símbolo λ utilízase para indicar que o fósforo presenta un estado de valencia non estándar (o estándar é 3) e o superíndice indica cinco enlaces con hidróxeno.
Neste sistema, a fosfina ou fosfano é un composto σ3λ3. Nun composto σmλn, o átomo de fósforo está unido a m átomos por medio dun total de n enlaces.
Unha clasificación dos compostos organofosforados, segundo o número de coordinación
[editar | editar a fonte]Na táboa da dereita móstranse diversos grupos de compostos organofosforados, segundo o seu diferente número de coordinación (NC) e as súas valencias lambda, λ.
Compostos organofosforados de fósforo(V)
[editar | editar a fonte]Ésteres de fosfato e amidas
[editar | editar a fonte]- Artigo principal: Organofosfato.
Os ésteres fosfato teñen a estrutura xeral P(=O)(O)3 na que o fósforo ten estado de oxidación 5+, P (V). Estas especies químicas son de grande importancia tecnolóxica como axentes ignífugos e plastificantes. Debido a que carecen dun enlace P-C, estes compostos non son tecnicamente compostos organofosforados, senón ésteres do ácido fosfórico, pero conteñen parte orgánica, polo que se mencionan aquí. Na natureza atópanse moitos derivados, como a fosfatidilcolina. Os ésteres fosfóricos son sintetizados por alcohólise de oxicloruro de fósforo. Tamén se coñece unha variedade de derivados mixtos amido-alcoxo, por exemplo a ciclofosfamida, que é un medicamento de importancia médica contra o cancro. Tamén están os derivados que conteñen o grupo tiofosforilo (P=S) entre os que se encontra o pesticida malatión. Os organofosforados preparados a maior escala son os ditiofosfatos de cinc, uns aditivos para aceite de motor. Prodúcense anualmente varios millóns de quilogramos deste complexo de coordinación pola reacción de alcohois con pentasulfuro de fósforo.[8]

No medio ambiente, estes compostos degrádanse por hidrólise para producir finalmente o fosfato e o alcohol ou a amina orgánica da que se derivan.
Ácidos fosfónico, fosfínico e os seus ésteres
[editar | editar a fonte]Os fosfonatos son ésteres do ácido fosfórico e teñen a fórmula xeral RP(=O)(O)2. Os fosfonatos teñen moitas aplicacións técnicas, como por exemplo, o glifosato, que é un herbicida. Coa fórmula (HO)2P(O)CH2NHCH2CO2H, este derivado da glicina é un dos herbicidas máis utilizados. Os bifosfonatos (tamén chamados bisfosfonatos, denominación correcta da IUPAC) son unha clase de fármacos para tratar a osteoporose.[9] O gas nervioso axente sarín, que contén os enlaces C-P e F-P, é un fosfonato.
Os fosfinatos con dous enlaces C-P, teñen a fórmula xeral R2P(=O)(O). Un membro comercialmente significativo é o herbicida glufosinato. Similar ao glifosato que se mencionou anteriormente, ten a estrutura CH3P(O)(OH)CH2CH2CH(NH2)CO2H.

A reacción de Michaelis-Arbuzov é o principal método para a síntese destes compostos. Por exemplo, o dimetilmetilfosfonato (ver figura anterior) xorde da reorganización de trimetilfosfito, que é catalizada polo ioduro de metilo. Na reacción de Horner-Wadsworth-Emmons e na homologación de Seyferth-Gilbert, os fosfonatos utilízanse en reaccións con compostos carbonilo. A reacción de Kabachnik-Campos é un método para a preparación de aminofosfonatos. Estes compostos conteñen un enlace moi inerte entre o fósforo e o carbono. En consecuencia, hidrolízanse para dar derivados do ácido fosfónico e fosfínico, pero non fosfato.
Óxidos de fosfina e compostos relacionados con enlace P-N
[editar | editar a fonte]- Artigo principal: óxido de fosfina.
Os óxidos de fosfina (designación δ3λ3) teñen a estrutura xeral R3P=O con estado de oxidación formal 5+, P (V). Os óxidos de fosfina forman enlaces de hidróxeno e algúns, por tanto, son solubles en auga. O enlace P=O é moi polar cun momento dipolar de 4,51 D para o óxido de trifenilfosfina. Compostos relacionados cos óxidos de fosfina son as imidas (R3PNR') e calcoxenuros relacionados (R3PE, onde E= S, Se, Te). Estes compostos son algúns dos compostos organofosforados termicamente máis estables, pero poucos son útiles en cantidades significativas.
Sales de fosfonio e fosforanos
[editar | editar a fonte]Os sales de fosfonio posúen a fórmula [PR4+]X-, xa que inclúen o ión fosfonio, R4P+. Estas especies son compostos tetraédricos de fósforo (V). Desde o punto de vista comercial, o membro máis importante é cloruro de tetraquis(hidroximetil)fosfonio, [P(CH2OH)4]Cl, que se utiliza como retardante do lume na industria téxtil. Prodúcense anualmente aproximadamente 2 millóns de quilogramos deste cloruro e do sulfato dese catión.[8] Obtéñense por reacción de fosfinas con formaldehido en presenza dun ácido mineral:
- PH3 + HX + 4 CH2O → [P(CH2OH)4+]X-
Poden prepararse por alquilación e arilación de organofosfinas unha gran variedade de sales de fosfonio:
- PR3 + R'X → [PR3R'+]X-
A metilación de trifenilfosfina é o primeiro paso na preparación do reactivo de Wittig.

O composto parental fosforano (δ5λ5) teórico é PH5, pero non se coñece. Son bastante comúns outros compostos relacionados que conteñen haloxenuros e outros substituíntes orgánicos de fósforo. Os derivados con cinco substituíntes orgánicos son raros, aínda que é coñecido o P(C6H5)5, que deriva do tetrafenilfosfonio (P(C6H5)4) por reacción con fenillitio.
Os iluros de fósforo son fosforanos insaturados, coñecidos como reactivos de Wittig, por exemplo, CH2P(C6H5)3. Estes compostos derivan do fósforo tetraédrico (V) e considéranse relacionados cos óxidos de fosfina. Tamén se poden facer derivar dos sales de fosfonio, pero por desprotonación, non por alquilación.
Compostos organofosforados de fósforo(III)
[editar | editar a fonte]Fosfitos, fosfonitos e fosfinitos
[editar | editar a fonte]- Artigos principais: éster fosforoso, fosfonito e fosfinito.
Os fosfitos, ás veces chamados ésteres fosforosos ou ésteres de fosfito, teñen a estrutura xeral P(O)3, e presentan o fósforo en estado de oxidación +3, P(III). Estas especies derivan da alcohólise do tricloruro de fósforo:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
A reacción é xeral, polo que se coñecen un gran número de especies. Os fosfitos empréganse na reacción de Perkow e a reacción de Michaelis-Arbuzov. Tamén serven como ligandos na química organometálica.
Tamén existen compostos intermedios entre os fosfitos e as fosfinas: son os fosfonitos, P(O)2R'), e os fosfinitos, P(O)R'2. Estas especies obtéñense a partir de reaccións de alcohólise dos correspondentes cloruros fosfonoso e fosfinoso, PClR'2 e PCl2R', respectivamente).
Fosfinas
[editar | editar a fonte]- Artigo principal: fosfina.
O principal composto da fosfinas é o PH3, chamado fosfina, aínda que o seu nome aconsellado pola IUPAC é fosfano.[10] A substitución dun ou máis átomos de hidróxeno por un substituínte orgánico (alquilo, arilo), forma unha organofosfina, PH3−xRx, xeralmente chamada tamén fosfina.

.
Comparación entre fosfinas e aminas
[editar | editar a fonte]

O átomo de fósforo nas fosfinas ten un estado de oxidación formal de -3 (δ3 λ3; unido a tres átomos por medio de tres enlaces sinxelos), polo que o fósforo é análogo ao nitróxeno nas aminas. Igual que as aminas, as fosfinas teñen unha xeometría molecular piramidal trigonal, aínda que habitualmente con ángulos C-E-C máis pequenos (E = N, P), polo menos en ausencia de efectos estéricos. O ángulo de enlace C-P-C é de 98,6° para a trimetilfosfina, e aumenta ata 109,7° cando os grupos metilo se substitúen por grupos terc-butilo. Cando se utiliza como ligando, o volume estérico das fosfinas terciarias avalíase polo seu ángulo do cono. A barreira á inversión é moito maior que nas aminas para que se produza un proceso como a inversión de nitróxeno, e polo tanto as fosfinas con tres substituíntes diferentes pódense separar en isómeros ópticos termicamente estables. As fosfinas son menos básicas que as aminas correspondentes, por exemplo, o ión fosfonio ten un pKa de -14 en comparación con 9,21 para o ión amonio; o trimetilfosfonio ten un pKa de 8,65 fronte a 9,76 para a trimetilamina. Con todo, a trifenilfosfina (pKa = 2,73) és máis básica que a trifenilamina (pKa = -5), principalmente debido a que o par solitario do nitróxeno en NPh3 está parcialmente deslocalizado nos tres aneis de fenilo. Porén, considerando que o par solitario do nitróxeno está deslocalizado no pirrol, o par solitario no átomo de fósforo no equivalente de fósforo do pirrol (chamado fosfol) non o está. A reactividade das fosfinas coincide coa das aminas en relación coa súa nucleofilicidade na formación de sales de fosfonio coa estrutura xeral PR4 +X -. Esta propiedade utilízase na reacción de Appel para a conversión de alcohois en haloxenuros de alquilo. As fosfinas son oxidadas doadamente ao seu correspondente óxido de fosfina, mentres que os óxidos de amina se xeran menos facilmente. En parte por esta razón, as fosfinas moi rara vez se encontran na natureza.
Formas de obtención
[editar | editar a fonte]Desde o punto de vista comercial, a fosfina máis importante é a trifenilfosfina, da que se producen anualmente varios millóns de quilogramos. Prepárase a partir da reacción do clorobenceno, C6H5-Cl ó Ph-Cl, con magnesio en presenza de PCl3.[8]
PhCl + Mg -> PhMgCl
3 PhMgCl + PCl3 -> PPh3 + 3 MgCl2
As fosfinas de carácter máis especializado prepáranse xeralmente por outras vías. Os haluros de fósforo sofren desprazamento nucleófilo por parte dos reactivos organometálicos como os reactivos de Grignard. Polo contrario, nalgunhas sínteses están envolvidos desprazamentos nucleofílicos de equivalentes do anión fosfuro ("R2P-") por haluros de arilo ou de alquilo.
As fosfinas primarias (RPH2) e secundarias (RR'PH e R2PH) sofren reaccións de adición a alquenos en presenza dunha base forte (por exemplo, KOH en DMSO). Aplícase a regra de Markovnikov. Reaccións similares prodúcense coa participación de alquinos.[11] Para alquenos deficientes de electróns (por exemplo, os derivados de acrilonitrilo) e para alquinos non cómpre que o medio sexa básico.

En condicións libres de radicais, os enlaces P-H das fosfinas primarias e secundarias engádense aos alquenos. Estas reaccións cumpren a regra de antiMarkovnikov. Como iniciadores utilízanse o AIBN ou peróxidos orgánicos. Os óxidos e sulfuros de fosfinas terciarias pódense reducir con clorosilanos e outros reactivos.
Reaccións
[editar | editar a fonte]Os tipos principais de reacción das fosfinas son como nucleófilos e como bases. A súa nucleofilicidade ponse en evidencia polas súas reaccións con haloxenuros de alquilo para dar os sales de fosfonio. As fosfinas son catalizadores nucleofílicos na dimerización de enonas en diversas reaccións de síntese orgánica, por exemplo, a reacción de Rauhut-Currier.
As fosfinas son axentes redutores, como se ilustra na redución de Staudinger que converte as azidas en aminas, e na reacción de Mitsunobu para a conversión de alcohois en ésteres. Nestes procesos a fosfina oxídase dando óxido de fosfina. As fosfinas tamén poden reducir aos grupos carbonilo activados, por exemplo, a redución dun α-cetoéster a un α-hidroxiéster segundo se aprecia no esquema 2.[12] No mecanismo de reacción proposto, o primeiro ión hidróxeno é cedido polo grupo metilo da trifenilfosfina (a trifenilfosfina non reacciona).

Ligandos fosfina
[editar | editar a fonte]| Nome e estrutura molecular dalgúns ligandos fosfina | |||
| sPhos | 
|
SPANphos | 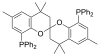
|
| SEGphos | 
|
Triphos | |
| Xantphos | 
|
XPhos | 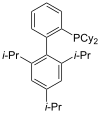
|
| Chiraphos | 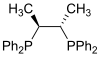
|
duPhos | 
|
As fosfinas como por exemplo a trimetilfosfina son importantes ligandos na química organometálica. Debido principalmente á utilidade da síntese asimétrica, popularizáronse algunhas variedades de difosfina quiral, como BINAP e DIPAMP. Todas elas, incluíndo as difosfinas, reciben o nome de ligandos fosfina (en inglés, phos ligands)
Fosfinas primarias e secundarias
[editar | editar a fonte]
Ademais das outras reaccións asociadas con fosfinas, os grupos que levan P-H presentan reactividade adicional asociada aos enlaces P-H. Son doadamente desprotonados por bases fortes para dar anións fosfuro. As fosfinas primarias e secundarias prepáranse xeralmente por redución de haluros de fósforo ou ésteres relacionados. Por exemplo, os fosfonatos redúcense a fosfinas primarias:[13]
A estabilidade atribúese á conxugación entre o anel aromático e o par solitario do fósforo.
Fosfoalquenos e fosfoalquinos
[editar | editar a fonte]- Artigos principais: Fosfoalqueno e Fosfoalquino.
Os compostos de carbono con fósforo (III) que forman enlaces múltiples (dobres, triplos) chámanse fosfoalquenos, (R2C=P-R), e fosfoalquinos, (RCPR). No composto chamado fosforina, un grupo H-C no benceno substitúese por un átomo de fósforo. As especies deste tipo son relativamente raras pero aínda así son de interese para os investigadores. Un método xeral para a síntese de fosfoalquenos é a reacción de 1,2-eliminación dos precursores axeitados, iniciada termicamente ou por bases como a DBU, DABCO ou a trietilamina:
A termólise de dimetilfosfina, Me2PH, xera o fosfoalqueno de fórmula CH2 = PMe, unha especie inestable na fase condensada.
Compostos organofosforados de fósforo (0), (I) e (II)
[editar | editar a fonte]Os compostos de fósforo, onde o estado de oxidación formal é menor de III son raros, mais coñécense exemplos de cada clase. Uns exemplos de compostos organofosforados de fósforo (0) son os adutos do carbeno, como [P(NHC)]2, onde NHC é un carbeno N-heterocíclico. Os compostos de fósforo (I) e (II) teñen as fórmulas (RP)n (R2P)2, respectivamente, e xéranse por redución dos cloruros organofosforados de fósforo (III) relacionados:
Os difosfenos, coa fórmula xeral R2P2, formalmente conteñen dobres enlaces fósforo=fósforo. Estas especies con fósforo (I) son raras, pero son estables, sempre que os substituíntes orgánicos sexan grandes dabondo como para evitar o encadeamento.
Coñécense tamén moitos compostos de valencia mixta, por exemplo, o composto en forma de gaiola, P7(CH3)3.
Notas
[editar | editar a fonte]- ↑ Dillon, K. B.; Mathey, F.; Nixon, J. F. Phosphorus. The Carbon Copy; John Wiley & Sons, 1997. ISBN 0-471-97360-2
- ↑ Quin, L. D. A Guide to Organophosphorus Chemistry; John Wiley & Sons, 2000. ISBN 0-471-31824-8
- ↑ Racke, K.D., 1992. Degradation of organophosphorus insecticides in environmental matrices. In: Chambers, J.E., Levi, P.E. (Eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego, pp. 47–73.
- ↑ 4,0 4,1 A guide to organophosphorus chemistry. Louis D. Quin. Wiley-IEEE, 2000. ISBN 0471318248. Páx. 8
- ↑ Principios básicos de química. Harry B. Gray, Gilbert P. Haight. Editorial Reverteé, 1981. ISBN 8429172009. Páx. 5.9
- ↑ Química organometálica de los metales de transición. Robert H. Crabtree. Ediciones de la Universitat Jaume I, 1997. ISBN 8480211342. Páx. 55
- ↑ Convenciones kappa, lambda y delta. Arquivado 10 de xuño de 2015 en Wayback Machine. Jesús Marcos Segura. Química e Industria de la Asociación Nacional de Químicos de España. 554, xullo-agosto, 22-28, 2004.
- ↑ 8,0 8,1 8,2 Jürgen Svara, Norbert Weferling, Thomas Hofmann “Phosphorus Compounds, Organic” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi 10.1002/14356007.a19_545.pub2
- ↑ Bifosfonatos y osteoporosis posmenopáusica. Joaquín Calaf Alsina. Scientific Communication Management, 2003. ISBN 8475926673. 144 páxinas
- ↑ Gold Book IUPAC: Link
- ↑ Arbuzova, S. N.; Gusarova, N. K.; Trofimov, B. A. "Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes." Arkivoc 2006, part v, 12–36 (EL-1761AR). Article Arquivado 07 de febreiro de 2008 en Wayback Machine.
- ↑ Zhang, W.; Shi, M. "Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones." Chem. Commun. 2006, 1218–1220. doi 10.1039/b516467b
- ↑ Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes Rachel M. Hiney, Lee J. Higham, Helge Müller-Bunz, Declan G. Gilheany Angewandte Chemie International Edition Volume 45, Issue 43, Pages 7248 - 7251 2006 doi 10.1002/anie.200602143
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Composto organofosforado |
Outros compostos
[editar | editar a fonte]- Proteómica baseada na actividade unha rama da bioquímica que a miúdo depende de sondas de compostos organofosforados para comprobar as actividades dos encimas.
- Grupo funcional
Ligazóns externas
[editar | editar a fonte]- Química dos organofosforados @ users.ox.ac.uk Arquivado 27 de abril de 2006 en Wayback Machine.; @ www.chem.wisc.edu
- Predictor RMN para desprazamentos químicos de compostos organofosforados, de Alan Brisdon's Research Group Enlace


