Nitrilo

Un nitrilo é un composto orgánico que ten un grupo funcional −C≡N.[1] O prefixo ciano- e o termo nitrilo utilízanse de maneira indistinta na literatura industrial. Os grupos nitrilo encóntranse en moitos comopostos útiles, como o metil cianoacrilato, usado nas supercolas e na goma de nitrilo, un polímero que contén nitrilo usado en laboratorios libres de látex e en luvas médicas. A goma de nitrilo utilízase moito tamén na industria da automoción para facer mangueiras e selados, xa que é resistente a aceites e combustibles. Os compostos orgánicos que conteñen múltiples grupos nitrilo coñécense como cianocarburos.
Os compostos inorgánicos que conteñen o grupo −C≡N non se denominan nitrilos senón cianuros.[2] Aínda que tanto os nitrilos coma os cianuros poden derivarse a partir de sales de cianuro, a maioría dos nitrilos son moito menos tóxicos.
Estrutura e propiedades básicas[editar | editar a fonte]
A xeometría do N−C−C é linear nos nitrilos, reflectindo a hibridación sp do carbono con enlace triplo. A distancia C−N é curta, de 1,16 Å, o que concorda cun triplo enlace.[3] Os nitrilos son polares, como indican os seus elevados momentos diplolares. Como líquidos teñen altas permitividades relativas, a miúdo con valores da orde de 30.
Historia[editar | editar a fonte]
O primeiro composto homólogo aos nitrilos, o nitrilo do ácido fórmico, chamado cianuro de hidróxeno, foi sintetizado por Carl Wilhelm Scheele en 1782.[4][5] En 1811 J. L. Gay-Lussac conseguiu preparar o ácido puro, moi tóxico e volátil.[6] Arredor de 1832 Friedrich Wöhler e Justus von Liebig prepararon o benzonitrilo, o nitrilo do ácido benzoico, pero debido ao rendemento mínimo da síntese non determinaron as súas propiedades físicas nin químicas nin suxeriron unha estrutura. En 1834 Théophile-Jules Pelouze sintetizou o propionitrilo, suxerindo que era un éter do alcohol propiónico e o ácido hidrociánico.[7] A síntese de benzonitrilo feita por Hermann Fehling en 1844 ao quentar benzoato amónico foi o primeiro método de obter unha cantidade de substancia suficiente para a investigación química. Fehling determinou a estrutura comparando os seus resultados coa a síntese xa coñecida de cianuro de hidróxeno quentando formiato amónico. Foi el quen acuñou o nome "nitrilo" (benzonitrilo) para a nova substancia, que se convertería no nome de todo este grupo de compostos.[8]
Síntese[editar | editar a fonte]
Industrialmente, os principais métodos de producir nitrilos son a amoxidación e a hidrocianación. Ambas as rutas son de "quimica verde" porque non xeran cantidades estequiométricas de sales.
Amoxidación[editar | editar a fonte]
Na amoxidación, un hidrocarburo é parcialmente oxidado en presenza de amoníaco. Esta conversión é realizada a grande escala para o acrilonitrilo:[9]
- CH3CH=CH2 + 3⁄2 O2 + NH3 → NCCH=CH2 + 3 H2O
Na produción de acrilonitrilo, un produto secundario é o acetonitrilo. A escala industrial prepáranse por amoxidación varios derivados do benzonitrilo, ftalonitrilo e isobutironitrilo. O proceso é cataliado por óxidos metálicos e considérase que se produce por medio da imina.
Hidrocianación[editar | editar a fonte]
A hidrocianación é un método industrial para producir nitrilos a partir de cianuro de hidróxeno e alquenos. O proceso require catalizadores homoxéneos. Un exemplo de hidrocianación é a produción de adiponitrilo, un precursor do nailon-6,6 a partir de 1,3-butadieno:
- CH2=CH−CH=CH2 + 2 HCN → NC(CH2)4CN
A partir de haluros orgánicos e sales de cianuro[editar | editar a fonte]
Dúas reaccións de metátese de sales son comúns como reaccións a escala de laboratorio. Na síntese de nitrilo de Kolbe, os haluros de alquilo sofren unha substitución alifática nucleofílica con cianuros de metal alcalino. Os nitrilos de arilo prepáranse pola síntese de Rosenmund-von Braun.
Cianohidrinas[editar | editar a fonte]

As cianohidrinas son un tipo especial de nitrilos. Clasicamente son o resultado da adición de cianuros de metal alcalino a aldehidos na reacción da cianohidrina. Debido á polaridade do carbonilo orgánico, esta reacción non necesita catalizador, a diferenza da hidrocianación de alquenos. As O-silil cianohidrinas xéranse pola adición de cianuro de trimetilsililo en presenza dun catalizador (sililcianación). As cianohidrinas tamén se preparan por reaccións de transcianohidrina que empezan, por exemplo, con cianohidrina de acetona como fonte de HCN.[10]
Deshidración de amidas e oximas[editar | editar a fonte]
Os nitrilos poden prepararse por deshidración de amidas primarias. En presenza de etil diclorofosfato e DBU a benzamida convértese en benzonitrilo:[11] Outros reactivos usados comunmente para este propósito son o P4O10 e o SOCl2.
Nunha deshidratación relacionada, as amidas secundarias dan nitrilos pola degradación de amidas de von Braun. Neste caso rompe un enlace C-N. A deshidratación de aldoximas (RCH=NOH) tamén proporciona nitrilos. Reactivos típicos para esta transformación son a trietilamina/dióxido de xofre, as ceolitas ou o cloruro de sulfurilo. Aprovéitase esta estratexia na síntese one pot (nun só reactor) de nitrilos a partir de aldehidos con hidroxilamina en presenza de sulfato de sodio.[12]
- A partir de ácidos carboxílicos de arilo (síntese de nitrilo de Letts).
Reacción de Sandmeyer[editar | editar a fonte]
Os nitrilos aromáticos prepáranse con frecuencia no laboratorio a partir da anilina por medio de compostos de diazonio. Esta é a reacción de Sandmeyer, para a cal cómpren cianuros de metal de transición.[13]
- ArN+
2 + CuCN → ArCN + N2 + Cu+
Outros métodos[editar | editar a fonte]
- Unha fonte comercial de grupos cianuro é o cianuro de dietilaluminio Et2AlCN, que pode prepararse a partir de trietilaluminio e HCN.[14] Foi utilizado en adición nucleofílica a cetonas.[15] Un exemplo do seu uso dáse na síntese total de Taxol de Kuwajima
- Os ións cianuro facilitan o acoplamento de dibromuros. A reacción do ácido α,α′-dibromoadípico con cianuro de sodio en etanol rende o ciano ciclobutano:[16]

- Na denominada reacción de Franchimont (que foi desenvolvida polo estudante doutoral belga Antoine Paul Nicolas Franchimont (1844-1919) en 1872) un ácido α-bromocarboxílico é dimerizado despois dunha hidrólise do cianogrupo e descarboxilación.[17]
- Poden prepararse nitrilos aromáticos a partir da hidrólise básica de aril cetiminas de triclorometilo (RC(CCl3)=NH) na síntese de Houben-Fischer.[18]
- Poden obterse nitrilos a partir de aminas primarias por oxidación. Entre os métodos comúns están o uso de persulfato de potasio,[19] ácido tricloroisocianúrico,[20] ou electrosíntese anódica.[21]
- Os α-aminoácidos forman nitrilos e dióxido de carbono por varios medios de descarboxilación oxidtiva.[22][23] Henry Drysdale Dakin descubriu esta oxidación en 1916.[24]
Reaccións[editar | editar a fonte]
Os grupos nitrilo en compostos orgánicos poden sufrir diversas reaccións dependendo dos reactivos ou condicións. Un grupo nitrilo pode ser hidrolizado, reducido ou retirado da molécula como un ión cianuro.
Hidrólise[editar | editar a fonte]
A hidrólise de nitrilos RCN prodúcense nas súas distintas etapas baixo tratamento ácido ou báscio para dar primeiramente carboxamidas RC(=O)NH2 e despois ácidos carboxílicos RCOOH. A hidrólise de nitrilos a áidos carboxílicos é eficaz. En ácidos ou bases, as ecuacións de equilibrio son as seguintes:
- RCN + 2H2O + HCl → RCO2H + NH4Cl
- RCN + H2O + NaOH → RCO2Na + NH3
Nótese que falando estritramente, estas reaccións están mediadas (e non catalizadas) por acidos ou bases, xa que se consome un equivalente do ácido ou base para formar o sal de amonio ou carboxilato, respectivamente.
Os estudos cinéticos mostran que a constante de velocidade de segunda orde para a hidrólise catalizada por ión hidróxido do acetonitrilo a acetamida é de 1,6 × 10−6 M−1 s−1, a cal é máis lenta que a hidrólise da amida a carboxilato (7,4 × 10−5 M−1 s−1). Así, a ruta de hidrólise básica proporcionará carboxilato (ou a amida contaminada con carboxilato). Por outra parte, as reaccións catalizadas por ácido requiren un coidadoso control da temperatura e da proporción de reactivos para evitar a formación de polímeros, o cal é promovido polo carácter exotérmico da hidrólise.[25] O procedemento clásico para converter un nitrilo na correspondente amida primaria esixe engadir o nitrilo a ácido sulfúrico concentrado frío.[26] A subseguinte conversión a ácido carboxílico está desfavorecida pola baixa temperatura e a baixa concentración de auga.
- RCN + H2O → RC(O)NH2 (H2SO4 é un catalizador)
A hidrólise de nitrilos é catalizada por dúas familias de enzimas. As nitrilases hidrolizan os nitrilos a ácidos carboxílicos:
- RCN + 2 H2O → RCO2H + NH3
As nitrilo hidratases son metaloenzimas que hidrolizan os nitrilos a amidas.
- RCN + H2O → RC(O)NH2
Estes enzimas utilízanse comercialmente para producir acrilamida.
Redución[editar | editar a fonte]
Hai varios tipos de redución de nitrilos. Os nitrilos son susceptibles á hidroxenación sobre diversos catalizadores metálicos. A reacción pode producir a amina primaria (RCH2NH2) ou a amina terciaria ((RCH2)3N), dependendo das condicións.[27] Nas reducións orgánicas convencionais, os nitrilos redúcense por tratamento con hidruro de litio aluminio á amina. A redución á imina seguida da hidrólise ao aldehido ten lugar na síntese de aldehidos de Stephen, que utiliza cloruro estanoso en ácido.
Alquilación[editar | editar a fonte]
Os alquil nitrilos son dbondo ácidos como para formar anións nitrilo, que alquilan unha ampla variedade de electrófilos.[28] A pequena demanda estérica da unidade CN combinada coa súa estabilización indutiva son claves para a excepcional nucleofilidade observada. Estas características fan que os nitrilos sexan ideais para crear novos enlaces carbono-carbono en ambientes con máis esixencia estérica para usalos nas sínteses químicas farmacolóxicas. Recentes desenvolvementos mostraron que a natureza do contraión metálico causa unha diferente coordinación tanto ao nitróxeno do nitrilo coma ao carbono nucleofílico adxacente, a miúdo con profundas diferenzas en reactividade e estereoquímica.[29]
Nucleófilos[editar | editar a fonte]
O centro de carbono dun nitrilo é electrófilo, polo que é susceptible a reaccións de adición nucleofílica:
- cun composto organozinc na reacción de Blaise,
- con alcohois na reacción de Pinner,
- con aminas; por exemplo, a reacción da amina sarcosina con cianamida rende creatina.[30]
- Os nitrilos reaccionan na acilación de Friedel–Crafts na reacción de Houben–Hoesch dando cetonas.
Métodos misceláneos e compostos[editar | editar a fonte]
- Na descianación redutiva o grupo nitrilo é substituído por un protón.[31] As descianacións poden realizarse por redución de metal disolvente (por exemplo, HMPA e metal potasio en ter-butanol) ou por fusión dun nitrilo en KOH.[32] De xeito similar, os α-aminonitrilos poden ser descianados con outros axentes redutores como o hidruro de litio aluminio.[31]
- Os nitrilos autoreaccionan en presenza dunha base na reacción de Thorpe nunha adición nucleofílica.
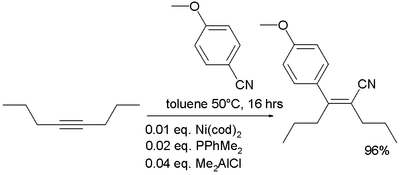
- En química organometálica os nitrilos engádense a alquinos na carbocianctión:[33]
Complexación[editar | editar a fonte]
Os nitrilos son precursores de complexos de nitrilo de metal de transición, que son reactivos e catalizadores. Exemplos son o [Cu(MeCN)4]+ e o PdCl2(PhCN)2).[34]

Derivados do nitrilo[editar | editar a fonte]
Cianamidas orgánicas[editar | editar a fonte]
As cianamidas son compostos N-ciano coa estrutura xeral R1R2N−CN e relacionados coa cianamida parental inorgánica, como se observa, por exemplo, na reacción de von Braun.
Óxidos de nitrilo[editar | editar a fonte]
Os óxidos de nitrilo teñen a estrutura xeral R−CNO.
Presenza e aplicacións[editar | editar a fonte]
Os nitrilos aparecen de forma natural nun conxunto moi diverso de plantas e animais. Illáronse uns 120 nitrilos naturais de fontes mariñas e terrestres. Os nitrilos encóntranse habitualmente en caguñas de certos froitos e especialmente en améndoas e durante a cocción de verduras do xénero Brassica, como verzas, coles de Bruxelas e coliflor, que liberan nitrilos por hidrólise. O mandelonitrilo, unha cianohidrina producida ao inxerir améndoas e froitos con caguña, liberan cianuro de hidróxeno e a ela se debe a toxicidade dos glicósidos cianoxénicos.[35]
Actualmente comercialízanse uns 30 medicamentos que conteñen nitrilos cunha gran variedade de indicacións medicinais e hai máis de 20 compostos adicionais que conteñen nitrilos que están en desenvolvemento clínico. O grupo nitrilo é bastante robusto e difícil de metabolizar. Os tipos de fármacos que conteñen nitrilos son diversos, desde a vildagliptina, un fármaco antidiabético, ao anastrozol, que é o estándar no tratamento do cancro de mama. En moitos casos o nitrilo imita a funcionalidade presente nos substratos de encimas, mentres que noutros casos o nitrilo incrementa a solubilidade na auga ou diminúe a susceptibilidade ao metabolismo oxidativo no fígado.[36] Velaquí algúns exemplos de fármacos que conteñen o grupo funcional nitrilo:
-
Estrutura do citalopram, un fármaco antidepresivo da clase do inhibidor da recaptación da serotonina selectivo (SSRI).
-
Estrutura da ciamemazina, un fármaco antipsicótico.
-
Estrutura do letrozol, un inhibidor da aromatase non esteroide oral para o tratamento de certos tipos de cancro de mama.
Notas[editar | editar a fonte]
- ↑ IUPAC Gold Book nitriles
- ↑ NCBI-MeSH Nitriles
- ↑ Karakida, Ken-ichi; Fukuyama, Tsutomu; Kuchitsu, Kozo (1974). "Molecular Structures of Hydrogen Cyanide and Acetonitrile as Studied by Gas Electron Diffraction". Bulletin of the Chemical Society of Japan 47 (2): 299–304. doi:10.1246/bcsj.47.299.
- ↑ Ver:
- Carl W. Scheele (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Experimento sobre a substancia coloreada de azul Berlín), Kungliga Svenska Vetenskapsakademiens handlingar (Real Academia Sueca de Procedementos Científicos), 3: 264–275 (en sueco).
- Reimpreso en latín como: "De materia tingente caerulei berolinensis" en: Carl Wilhelm Scheele con Ernst Benjamin Gottlieb Hebenstreit (ed.) e Gottfried Heinrich Schäfer (trans.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Alemaña): Johann Godfried Müller, 1789), vol. 2, páxinas 148–174.
- ↑ David T. Mowry (1948). "The Preparation of Nitriles" (– Scholar search). Chemical Reviews 42 (2): 189–283. PMID 18914000. doi:10.1021/cr60132a001.
- ↑ Gay-Lussac produciu cianuro de hidróxeno puro licuado en: Gay-Lussac (1811) "Note sur l'acide prussique" (Nota sobre o ácido prúsico), Annales de chimie, 44: 128 – 133.
- ↑ J. Pelouze (1834). "Notiz über einen neuen Cyanäther" [Note on a new cyano-ether]. Annalen der Pharmacie 10 (3): 249. doi:10.1002/jlac.18340100302.
- ↑ Hermann Fehling (1844). "Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme (Sobre a descomposición do benzoato amónico pol calor)". Annalen der Chemie und Pharmacie 49 (1): 91–97. doi:10.1002/jlac.18440490106. Na páxina 96, Fehling escribiu: "Da Laurent den von ihm entdeckten Körper schon Nitrobenzoyl genannt hat, auch schon ein Azobenzoyl existirt, so könnte man den aus benzoësaurem Ammoniak entstehenden Körper vielleicht Benzonitril nennen." (Como Laurent nomeou a substancia que el descubrira "nitrobenzoíl" – tamén existía xa un "azobenzoíl" – talvez podemos chamar a substancia que se orixina a partir do benzoato de amonio "benzonitrilo".)
- ↑ Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a17_363
- ↑ Gregory, Robert J. H. (1999). "Cyanohydrins in Nature and the Laboratory: Biology, Preparations, and Synthetic Applications". Chemical Reviews 99 (12): 3649–3682. PMID 11849033. doi:10.1021/cr9902906.
- ↑ Chun-Wei Kuo; Jia-Liang Zhu; Jen-Dar Wu; Cheng-Ming Chu; Ching-Fa Yao; Kak-Shan Shia (2007). "A convenient new procedure for converting primary amides into nitriles". Chem. Commun. 2007 (3): 301–303. PMID 17299646. doi:10.1039/b614061k.
- ↑ Sharwan K, Dewan, Ravinder Singh, and Anil Kumar (2006). "One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation". Arkivoc: (ii) 41–44.
- ↑ "o-Tolunitrile and p-Tolunitrile" H. T. Clarke and R. R. Read Org. Synth. 1941, Coll. Vol. 1, 514.
- ↑ W. Nagata and M. Yoshioka (1988). "Diethylaluminum cyanide". Org. Synth. cv6p0436.
- ↑ W. Nagata, M. Yoshioka, and M. Murakami (1988). "Preparation of cyano compounds using alkylaluminum intermediates: 1-cyano-6-methoxy-3,4-dihydronaphthalene". Org. Synth. cv6p0307.
- ↑ Reynold C. Fuson; Oscar R. Kreimeier & Gilbert L. Nimmo (1930). "Ring Closures in the Cyclobutane Series. II. Cyclization Of α,α′-Dibromo-Adipic Esters". J. Am. Chem. Soc. 52 (10): 4074–4076. doi:10.1021/ja01373a046.
- ↑ A. P. N. Franchimont (1872). "Ueber die Dibenzyldicarbonsäure" [On 2,3-diphenylsuccinic acid]. Berichte der Deutschen Chemischen Gesellschaft 5 (2): 1048–1050. doi:10.1002/cber.187200502138.
- ↑ J. Houben, Walter Fischer (1930) "Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.)," Berichte der deutschen chemischen Gesellschaft (A and B Series) 63 (9): 2464 – 2472. doi 10.1002/cber.19300630920
- ↑ Yamazaki, Shigekazu; Yamazaki, Yasuyuki (1990). "Nickel-catalyzed dehydrogenation of amines to nitriles". Bulletin of the Chemical Society of Japan 63 (1): 301–303. doi:10.1246/bcsj.63.301.
- ↑ Chen, Fen-Er; Kuang, Yun-Yan; Hui-Fang, Dai; Lu, Liang (2003). "A Selective and Mild Oxidation of Primary Amines to Nitriles with Trichloroisocyanuric Acid". Synthesis 17 (17): 2629–2631. doi:10.1055/s-2003-42431.
- ↑ Schäfer, H. J.; Feldhues, U. (1982). "Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode". Synthesis 2 (2): 145–146. doi:10.1055/s-1982-29721.
- ↑ Hiegel, Gene; Lewis, Justin; Bae, Jason (2004). "Conversion of α‐Amino Acids into Nitriles by Oxidative Decarboxylation with Trichloroisocyanuric Acid". Synthetic Communications 34 (19): 3449–3453. doi:10.1081/SCC-200030958.
- ↑ Hampson, N; Lee, J; MacDonald, K (1972). "The oxidation of amino compounds at anodic silver". Electrochimica Acta 17 (5): 921–955. doi:10.1016/0013-4686(72)90014-X.
- ↑ Dakin, Henry Drysdale (1916). "The Oxidation of Amino-Acids to Cyanides". Biochemical Journal 10 (2): 319–323. PMC 1258710. PMID 16742643. doi:10.1042/bj0100319.
- ↑ Kukushkin, V. Yu.; Pombeiro, A. J. L. (2005). "Metal-mediated and metal-catalyzed hydrolysis of nitriles". Inorg. Chim. Acta 358: 1–21. doi:10.1016/j.ica.2004.04.029.
- ↑ Abbas, Khamis A. (2008-01-01). "Substituent Effects on the Hydrolysis of p-Substituted Benzonitriles in Sulfuric Acid Solutions at (25.0± 0.1) °C". Zeitschrift für Naturforschung A 63 (9). ISSN 1865-7109. doi:10.1515/zna-2008-0912.
- ↑ Barrault, J.; Pouilloux, Y. (1997). "Catalytic Amination Reactions: Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts". Catalysis Today 1997 (2): 137–153. doi:10.1016/S0920-5861(97)00006-0.
- ↑ Adams, Roger (1957). Organic Reactions, Volume 9. New York: John Wiley & Sons, Inc. ISBN 9780471007265. Consultado o 18 July 2014.
- ↑ Fleming, Fraser F.; Zhang, Zhiyu (24 January 2005). "Cyclic nitriles: tactical advantages in synthesis". Tetrahedron 61 (4): 747–789. doi:10.1016/j.tet.2004.11.012.
- ↑ Smith, Andri L.; Tan, Paula (2006). "Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment". J. Chem. Educ. 83 (11): 1654. Bibcode:2006JChEd..83.1654S. doi:10.1021/ed083p1654.
- ↑ 31,0 31,1 Mattalia, Jean-Marc; Marchi-Delapierre, Caroline; Hazimeh, Hassan & Chanon, Michel (2006-03-15). "The reductive decyanation reaction: chemical methods and synthetic applications". Arkivoc (en inglés) 2006 (4): 90. ISSN 1551-7012. doi:10.3998/ark.5550190.0007.408. AL-1755FR.
- ↑ Berkoff, Charles E.; Rivard, Donald E.; Kirkpatrick, David; Ives, Jeffrey L. (1980). "The Reductive Decyanation of Nitriles by Alkali Fusion". Synthetic Communications 10 (12): 939–945. doi:10.1080/00397918008061855.
- ↑ Yoshiaki Nakao; Akira Yada; Shiro Ebata & Tamejiro Hiyama (2007). "A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes". J. Am. Chem. Soc. (Communication) 129 (9): 2428–2429. PMID 17295484. doi:10.1021/ja067364x.
- ↑ Rach, S. F.; Kühn, F. E. (2009). "Nitrile Ligated Transition Metal Complexes with Weakly Coordinating Counteranions and Their Catalytic Applications". Chemical Reviews 109 (5): 2061–2080. PMID 19326858. doi:10.1021/cr800270h.
- ↑ Natural Product Reports Issue 5, 1999 Nitrile-containing natural products
- ↑ Fleming, Fraser F.; Yao, Lihua; Ravikumar, P. C.; Funk, Lee; Shook, Brian C. (November 2010). "Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore". J Med Chem 53 (22): 7902–17. PMC 2988972. PMID 20804202. doi:10.1021/jm100762r.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Nitrilos protonados: Nitrilio
- Nitrilos desprotonados: Anión nitrilo
- Cianocarburo
- Iluro de nitrilo