Cromosoma Y
| Cromosoma Y humano | |
|---|---|
Cromosoma Y humano con bandeado G. Este cromosoma hérdase do pai. | |
 Cromosoma Y nun cariograma humano masculino | |
| Características | |
| Lonxitude (bp) | 57,227,415 bp (GRCh38)[1] |
| No. de xenes | 63 (CCDS)[2] |
| Tipo | Alosoma |
| Posición do centrómero | Acrocéntrico[3] (10.4 Mbp[4]) |
| Lista completa de xenes | |
| CCDS | Lista de xenes |
| HGNC | Lista de xenes |
| UniProt | Lista de xenes |
| NCBI | Lista de xenes |
| Visores de mapa externos | |
| Ensembl | Cromosoma Y |
| Entrez | Cromosoma Y |
| NCBI | Cromosoma Y |
| UCSC | Cromosoma Y |
| Secuencias de ADN completas | |
| RefSeq | NC_000024 (FASTA) |
| GenBank | CM000686 (FASTA) |
O cromosoma Y é un dos dous cromosomas, xunto co X, que serven para a determinación do sexo nos seres humanos e na maioría dos mamíferos. Ambos os cromosomas forman o par cromosómico 23 humano ou par de cromosomas sexuais. Os individuos XX son femias e os XY machos. Nos mamíferos o cromosoma Y contén o xene SRY, que desencadea o desenvolvemento dos testículos e o desenvolvemento embrionario como macho. Ten tamén outros xenes que se necesitan para a produción normal de esperma. Unha mutación no xene SRY pode facer que un individuo XY sexa fenotipicamente muller. No xenoma humano o Y é o único cromosoma que non teñen as mulleres, xa que é exclusivo dos homes. O cromosoma Y humano está composto por aproximadamente 50 millóns de pares de bases, polo que é un cromosoma pequeno. Un home recibe o seu cromosoma Y do seu pai, e a análise do ADN do cromosoma Y utilízase na investigación das xenealoxías. O cromosoma Y é unha das partes do xenoma humano cunha maior rapidez de evolución.[5]
Orixe e evolución[editar | editar a fonte]
Antes do cromosoma Y[editar | editar a fonte]
Moitos vertebrados ectotérmicos (que non manteñen a súa temperatura corporal constante) non teñen cromosomas sexuais. Se teñen diferentes sexos, o sexo está determinado por factores ambientais e non xeneticamente. Para algúns deles, como os réptiles, o sexo depende da temperatura de incubación dos ovos; outros son hermafroditas (o mesmo individuo pode producir gametos masculinos e femininos).
Orixe[editar | editar a fonte]
Os cromosomas X e Y pénsase que evolucionaron a partir dun par de cromosomas idénticos,[6][7] de tipo autosoma, e que nun mamífero ancestral sufriron unha variación alélica, orixinándose un "locus do sexo", de modo que simplemente a posesión dese alelo causaría que o organismo fose macho.[8] O cromosoma que levaba este alelo converteuse no cromosoma Y, e o outro membro do par orixinou o cromosoma X. Co tempo, os xenes que eran beneficiosos para os machos e daniños ou sen efecto para as femias ou ben se desenvolveron directamente no cromosoma Y ou ben foron adquiridos por dito cromosoma por un proceso de translocación cromosómica.[9]
Ata hai pouco, pensábase que os cromosomas X e Y diverxeran arredor de 300 millóns de anos. Porén, recentes investigacións,[10] especialmente as que se derivaron da secuenciación do xenoma do ornitorrinco,[11] suxeriron que o sistema de determinación sexual XY probablemente non existía aínda hai máis de 166 millóns de anos, momento da diverxencia entre os monotremas e os outros mamíferos.[12] Esta reestimación da idade do sistema XY dos terios está baseado no descubrimento de que secuencias que están nos cromosomas X dos mamíferos marsupiais e euterios (placentarios) están presentes nos autosomas do ornitorrinco e aves.[12] A estimación anterior estaba baseada en datos incorrectos sobre que os cromosomas X do ornitorrinco contiñan estas secuencias.[13][14]
No caso do ornitorrinco a determinación do sexo depende dun sistema XY baseado en cinco pares de cromosomas.[13] Os cromosomas sexuais do ornitorrinco parecen de feito ter unha homoloxía moito máis forte co cromosoma Z das aves (qure teñen unha determinación do sexo ZW),[11] e o xene SRY, que é tan básico para a determinación do sexo na maioría dos mamíferos, non parece estar implicado na determinación de sexos no ornitorrinco.[12]
Inhibición da recombinación[editar | editar a fonte]
A recombinación xenética entre os cromosomas X e Y está probado que é prexudicial, e orixina que os machos queden sen xenes necesarios que orixinalmente estaban no cromosoma Y, e que as femias acaben tendo xenes innecesarios e mesmo daniños no seu cromosoma X, que previamente se atopaban só no Y. Como resultado, os xenes beneficiosos para os machos acumuláronse preto dos xenes para a determinación sexual, e a recombinación nesta rexión foi suprimida para preservar esta rexión específica nos machos.[8] Co tempo, o cromosoma Y cambiou de modo que nas áreas arredor dos xenes que determinan o sexo se inhibise toda recombinación co cromosoma X. Como resultado deste proceso, o 95% do cromosoma Y humano non pode recombinar.
Teoría da contracción ou encollemento[editar | editar a fonte]
Segundo algunhas estimacións, o cromosoma Y humano perdeu 1.393 dos seus 1.438 xenes orixinais no decurso da súa existencia, cunha taxa de perda xenética de 4,6 xenes por cada millón de anos, polo que algúns investigadores consideran que o cromosoma Y podería potencialmente perder a súa función nos próximos 10 millóns de anos.[15] A análise xenómica comparativa, porén, revela que moitas especies de mamíferos están experimentando unha perda similar de función no seu cromosoma sexual Y. A dexeneración pode simplemente ser o destino que lles espera a todos os cromosomas sexuais que non se recombinan debido á acción de tres forzas evolutivas comúns: alta frecuencia de mutación, selección ineficiente e deriva xenética.[8] Por outra parte, non todos os datos concordan con estas estimacións numéricas, e as comparacións recentes entre os cromosomas Y de humanos e chimpancés mostran que o cromosoma Y humano non perdeu ningún xene desde a diverxencia entre os antepasados dos humanos e os dos chimpancés hai entre 6 e 7 millóns de anos,[16] e soamente perdeu un xene desde que os humanos diverxiron do macaco Rhesus hai 25 millóns de anos,[17] o que proporciona unha evidencia directa de que aplicar un modelo de extrapolación liñal non é correcto.
Altas frecuencias de mutación[editar | editar a fonte]
O cromosoma Y humano está particularmente exposto a altas frecuencias de mutación debido ao ambiente no que se atopa. O cromosoma Y pásase de xeración en xeración exclusivamente polo esperma, que é unha liña celular que sofre múltiples divisións celulares durante a gametoxénese. Cada división celular proporciona máis oportunidade de acumular mutacións. Ademais, o esperma almacénase nun ambiente moi oxidativo como é o dos testículos, o cal favorece as mutacións. Estas dúas condicións combinadas fan que o risco de mutación do cromosoma Y sexa 4,8 veces maior ca o do resto do xenoma.[8]
Selección ineficiente[editar | editar a fonte]
Sen a capacidade de recombinarse durante a meiose, o cromosoma Y non pode expoñer individualizadamente os seus alelos á selección natural. Os alelos deletéreos poden nestas condicións "facer autostop" nos seus xenes veciños beneficiosos, e así poden propagarse alelos maladaptados á seguinte xeración. Inversamente, os alelos vantaxosos poden ser seleccionados en contra se están rodeados de alelos nocivos (selección de fondo). Debido a esta incapacidade de discriminar no seu contido xenético, o cromosoma Y está especialmente inclinado a acumular ADN "lixo". Atópanse acumulacións masivas de retrotransposóns espallados por todo o cromosoma Y.[8] A inserción aleatoria de segmentos de ADN con frecuencia interrompe as secuencias de xenes codificantes e convérteos en non funcionais. Porén, o cromosoma Y non ten forma de desfacerse destes "xenes saltareiros" ("jumping genes"). Sen a capacidade de illar os seus alelos a selección non pode actuar con efectividade sobre eles.
Unha indicación cuantitativa clara desta ineficiencia é a taxa de entropía do cromosoma Y. Todos os outros cromosomas humanos teñen unha taxa de entropía de 1,5–1,9 bits por nucleótido (comparado cun máximo teórico de 2 para a non redundancia), pero a taxa de entropía do cromosoma Y é de só 0,84.[18] Isto significa que o cromosoma Y contén moita menos información en relación coa súa lonxitude total; é, pois, máis redundante.
Deriva xenética[editar | editar a fonte]
Mesmo se un cromosoma Y ben adaptado consegue manter a actividade xenética evitando a acumulación de mutacións, non hai garantías de que pase á seguinte xeración. O tamaño de poboación do cromosoma Y está limitado a 1/4 da dos autosomas: os organismos diploides conteñen dúas copias dos cromosomas autosómicos e só a metade da poboación contén un cromosoma Y. Deste modo, a deriva xenética é unha forza excepcionalmente forte que actúa sobre o cromosoma Y. Por pura distribución aleatoria, un macho adulto podería non pasar nunca á descendencia o seu cromosoma Y se só ten fillas. Así, aínda que un macho poida ter un cromosoma Y ben adaptado e libre de excesivas mutacións, pode que nunca pase ao acervo xenético da seguinte xeración.[8] A repetida perda aleatoria de cromosomas Y ben adaptados, combinada con tendencia do cromosoma Y a evolucionar adquirindo máis mutacións deletéreas, contribúe á dexeneración do cromosoma Y nas especies a través do mecanismo chamado trinquete de Muller (acumulación irreversible de mutacións prexudiciais).[19]
Conversión de xenes[editar | editar a fonte]
En 2003 os investigadores do MIT descubriron un proceso que pode facer que vaia máis lento o proceso de degradación. Encontraron que o cromosoma Y humano pode "recombinarse" consigo mesmo, utilizando o apareamento dunha secuencia palindrómica.[20] Unha "recombinación" deste tipo denomínase conversión xénica.
No caso dos cromosomas Y, as secuencias palindrómicas non son de ADN non codificante; estas cadeas de bases conteñen xenes activos importantes para a fertilidade masculina. A maior parte dos pares de bases da secuencia son idénticos en máis do 99,97%. O uso extensivo da conversión xénica pode xogar un papel na capacidade do cromosoma Y de corrixir os erros xenéticos e manter a integridade dos relativamente poucos xenes que leva. Noutras palabras, como só hai un cromosoma Y, este duplicou os seus xenes dentro da súa propia estrutura en lugar de utilizar un segundo cromosoma homólogo onde eses xenes estivesen repetidos. Cando ocorren erros, pode utilizar outras partes de si mesmo (sen erros) como molde para corrixilos.
Estes descubrimentos foron comprobados ao comparar rexións similares do cromosoma Y de humanos, chimpancés, bonobos e gorilas. A comparación demostrou que o mesmo fenómeno de conversión de xenes parecía estar funcionando desde hai 5 millóns de anos, cando os humanos se separaron dos outros primates.
Evolución futura[editar | editar a fonte]
Nas fases finais da dexeneración do cromosoma Y, outros cromosomas tomarán os seus xenes e funcións e, finalmente, o cromosoma Y podería desaparecer por completo, orixinándose un novo sistema de determinación do sexo.[8] Varias especies de roedores das familias dos Muridae e Cricetidae chegaron xa a esa fase,[21][22] dos seguintes xeitos:
- Os ratos Ellobius lutescens e Ellobius tancrei, e os ratos de campo xaponeses Tokudaia osimensis e Tokudaia muenninki, perderon xa por completo o seu cromosoma Y e o xene SRY.[8][23][24] Os Tokudaia spp. recolocaron no cromosoma X algúns xenes que antes estaban no cromosoma Y.[24] Tanto Tokudaia spp. coma Ellobius lutescens teñen un xenotipo X0 en todos os individuos,[24] e Ellobius tancrei posúe un xenotipo XX en todos os individuos.[8] O novo sistema de determinación do sexo nestes roedores aínda non se coñece.
- Os lemmings Myopus schisticolor, Dicrostonyx torquatus, e múltiples especies de ratos do xénero Akodon teñen femias fértiles que posúen o xenotipo XY, que xeralmente é propio dos machos de mamíferos, pero tamén outras femias co xenotipo ancestral XX, debido a unha variedade de modificacións dos cormosomas X e Y.[21][25][26]
- No rato de campo Microtus oregoni, as femias, que só teñen un cromosoma X, producen só gametos X, e os machos XY, producen gametos Y ou gametos sen ningún cromosoma sexual, debido a non disxunción durante a meiose.[27]
Fóra do grupo dos roedores, no cérvido Muntiacus crinifrons evolucionaron novos cromosomas X e Y por medio de fusións dos antigos cromosomas sexuais con autosomas.[28] Os cromosomas Y dos primates, incluíndo os humanos, están bastante dexenerados e poderían evolucionar a un novo sistema de determinación sexual, segundo algunhas estimacións nuns 14 millóns de anos nos humanos.[8][29]
Cromosoma Y humano[editar | editar a fonte]
O cromosoma Y humano ten uns 58 millóns de pares de bases e representa aproximadamente o 2% do total de ADN da célula nos machos.[30] O número de xenes identificados nun cromosoma depende do método utilizado, polo que pode variar dun método a outro. O cromosoma Y humano contén só 86 xenes segundo algunhas estimacións[31], que codifican 23 proteínas distintas. Os caracteres xenéticos que se herdan a través do cromosoma Y denomínanse caracteres holándricos.
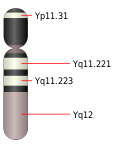
O cromosoma Y humano non pode recombinarse co X case en ningunha parte da súa lonxitude, excepto nunha pequena parte chamada rexión pseudoautosómica preto do telómero; esta rexión comprende aproximadamente o 5% da lonxitude do cromosoma. Estas rexións son restos da antiga homoloxía entre os cromosomas X e Y. A grande área do cromosoma Y que non se recombina denomínase rexión non recombinante ("NRY") do cromosoma Y.[32] Os polimorfismos dun só nucleótido (SNP) desta rexión utilízanse en estudos xenealóxicos por liña paterna.
Xenes[editar | editar a fonte]
Sen incluír xenes pseudoautosómicos, algúns xenes do cromosoma Y son:
- Xenes da rexión non recombinante (NRY) con xenes correspondentes no cromosoma X:
- Outros xenes da NRY:
- AZF1 (factor 1 da azoospermia)
- BPY2 (proteína básica do cromosoma Y)
- DAZ1 (delecionado na azoospermia)
- DAZ2
- PRKY (proteína quinase, ligada ao Y)
- RBMY1A1
- SRY (rexión que determina o sexo masculino)
- TSPY (proteína específica do testículo)
- USP9Y
- UTY (xene TPR transcrito ubicuamente do cromosoma Y)
- ZFY (proteína dedo de cinc)
Enfermidades ligadas ao cromosoma Y[editar | editar a fonte]
Ningún xene vital reside no cromosoma Y, xa que as mulleres carecen del. A única enfermidade humana ben definida como ligada a un defecto no cromosoma Y é o desenvolvemento defectivo testicular, que se debe a unha deleción ou a unha mutación deletérea do xene SRY. Porén, os individuos XXY (síndrome de Klinefelter) sofren efectos siilares. Por outra parte, ter máis dun cromosoma Y (polisomía do Y) ten efectos diferentes aos da masculinización.
Microdeleción do cromosoma Y[editar | editar a fonte]
A microdeleción do cromosoma Y (YCM) é unha familia de trastornos xenéticos causados pola perda de xenes no cromosoma Y. Moitos homes afectados non mostran síntomas e levan unha vida normal. Porén, esta microdeleción tamén produce nun número significativo de homes unha redución da fertilidade ou do reconto de esperma.
Cromosoma Y defectivo[editar | editar a fonte]
Orixina que os individuos XY presenten un fenotipo feminino (nacen con xenitais femininos). A falta do segundo cromosoma X orixina infertilidade.
A causa pode ser explicada como a posesión dun cromosoma Y incompleto: o cariotipo usual nestes casos é 44X e mais un fragmento do Y. Isto xeralmente orixina un desenvolvemento testicular deficiente, de tal maneira que o neno pode ou non ter xenitais masculinos completamente formados internos ou externos. Pode presentarse un abano completo no rango de ambigüidade da estrutura xenital, especialmente se hai mosaicismo xenético (liñas celulares con distintos cariotipos). Cando o fragmento do Y é mínimo e non funcional, o neno é xeralmente unha nena con características propias da síndrome de Turner ou disxénese gonadal mixta.
XYY[editar | editar a fonte]
A síndrome 47,XYY está causada pola presenza dunha copia extra do cromosoma Y en todas as células do home que ten en total 47 cromosomas. Está asociada cun incremento de estatura e problemas de aprendizaxe, pero o efecto é variable e ás veces mínimo. Antes asociouse esta condición coa agresividade, criminalidade e comportamento antisocial (e denominouse o "cariotipo criminal"), pero os estudos posteriores consideraron isto totalmente infundado e o concepto de "cariotipo criminal" foi abandonado.
Maiores graos de polisomía no cromosoma Y son moi raros (XYYY). Están asociados con anormalidades esqueléticas, diminución do coeficiente intelectual (IQ) e atraso no desenvolvemento, pero a gravidade destes efectos é variable.
Síndrome do home XX[editar | editar a fonte]
Nesta doenza non intervén de forma directa o cromosoma Y, pero si o seu xene SRY, polo que é útil para comprender a natureza do cromosoma Y. A síndrome do home XX é un trastorno raro que aparece cando houbo unha recombinación xenética entre os cromosomas X e Y durante a formación dos gametos, que fixo que a porción SRY do cromosoma Y pasase ao cromosoma X. Cando un cromosoma X dun individuo XX leva o xene SRY este contribuirá a formar un fenotipo masculino.
Xenealoxía[editar | editar a fonte]
En xenealoxía xenética humana a utilización da información contida no cromosoma Y é de particular interese, xa que, a diferenza doutros xenes, os do cromosoma Y pasan exclusivamente de pais a fillos. Pódense así estudar as migracións humanas e a evolución xenética das poboacións humanas, e estudar liñas xenealóxicas paternas. De forma análoga pode utilizarse o ADN mitocondrial, que só se herda da nai, para estudar as liñas xenealóxicas maternas.
Cromosomas Y en animais non mamíferos[editar | editar a fonte]
Moitos grupos de organismos ademais dos mamíferos teñen cromosomas Y, pero estes cromosomas Y non comparten un devanceiro común cos dos mamíferos. Ditos grupos inclúen a Drosophila, e outros insectos, algúns peixes, algúns réptiles, e algunhas plantas. En Drosophila melanogaster, o cromosoma Y non desencadea o desenvolvemento como macho, senón que o sexo está determinado polo número de cromosomas X. O cromosoma Y de D. melanogaster non contén xenes necesarios para a fertilidade do macho. Deste modo, unha D. melanogaster XXY é femia, e outra só cun X (é dicir, X0) é un macho, pero estéril. Hai algunhas especies de Drosophila nas que os machos X0 son viables e fértiles.
Cromosomas ZW[editar | editar a fonte]
Outros organismos teñen cromosomas parecidos aos X e Y, que determinan o sexo. Nas aves, serpes e bolboretas eses cromosomas denomínanse Z e W. As femias son ZW (sexo heterogamético) e os machos son ZZ (sexo homogamético).
Notas[editar | editar a fonte]
- ↑ "Human Genome Assembly GRCh38 - Genome Reference Consortium". National Center for Biotechnology Information (en inglés). 2013-12-24. Consultado o 2017-03-04.
- ↑ "Homo sapiens Y chromosome genes". CCDS Release 20 for Homo sapiens. 2016-09-08. Consultado o 2017-05-28.
- ↑ Strachan, Tom; Read, Andrew (2 April 2010). Human Molecular Genetics. Garland Science. p. 45. ISBN 978-1-136-84407-2.
- ↑ Genome Decoration Page, NCBI. Ideogram data for Homo sapiens (850 bphs, Assembly GRCh38.p3). Última actualización 2014-06-03. Consultado o 2017-04-26.
- ↑ Wade, Nicholas (January 13, 2010). "Male Chromosome May Evolve Fastest". New York Times.
- ↑ Muller, HJ (1914). "A gene for the fourth chromosome of Drosophila". Journal of Experimental Zoology 17 (3): 325–336. doi:10.1002/jez.1400170303.
- ↑ Lahn B, Page D (1999). "Four evolutionary strata on the human X chromosome". Science 286 (5441): 964–7. PMID 10542153. doi:10.1126/science.286.5441.964.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 Graves, J. A. M. (2006). "Sex chromosome specialization and degeneration in mammals". Cell 124 (5): 901–914. PMID 16530039. doi:10.1016/j.cell.2006.02.024.
- ↑ Graves J.A.M., Koina E., Sankovic N. (2006). "How the gene content of human sex chromosomes evolved". Curr Opin Genet Dev 16 (3): 219–24. PMID 16650758. doi:10.1016/j.gde.2006.04.007.
- ↑ Hamilton, Jon (January 13, 2010). "Human Male: Still A Work in Progress". NPR.
- ↑ 11,0 11,1 Warren WC, Hillier LDW, Graves JAM; et al. (2008). "Genome analysis of the platypus reveals unique signatures of evolution". Nature 453 (7192): 175–183. PMC 2803040. PMID 18464734. doi:10.1038/nature06936.
- ↑ 12,0 12,1 12,2 Veyrunes F, Waters PD, Miethke P; et al. (2008). "Bird-like sex chromosomes of platypus imply recent origin of mammal sex chromosomes". Genome Research 18 (6): 965–973. PMC 2413164. PMID 18463302. doi:10.1101/gr.7101908.
- ↑ 13,0 13,1 Grützner F, Rens W, Tsend-Ayush E; et al. (2004). "In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes". Nature 432 (7019): 913–917. PMID 15502814. doi:10.1038/nature03021.
- ↑ Watson, Jaclyn M.; Riggs, Arthur; Jennifer A. Marshall (1992). "Gene mapping studies confirm the homology between the platypus X and echidna X1 chromosomes and identify a conserved ancestral monotreme X chromosome". Chromosoma 101 (10): 596–601. doi:10.1007/BF00360536.
- ↑ Graves, J. A. M. (2004). "The degenerate Y chromosome—can conversion save it?". Reproduction Fertility and Development 16 (5): 527–534. PMID 15367368. doi:10.1071/RD03096.
- ↑ Hughes, Jennifer F.; et al. (2005). "Conservation of Y-linked genes during human evolution revealed by comparative sequencing in chimpanzee". Nature 437 (7055): 100–103. PMID 16136134. doi:10.1038/nature04101.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 25 de febreiro de 2012. Consultado o 15 de abril de 2012.
- ↑ Liu, Zhandong; Venkatesh, Santosh S.; Maley, Carlo C. (2008). "Sequence space coverage, entropy of genomes and the potential to detect non-human DNA in human samples". BMC Genomics 9: 509. PMID 18973670. doi:10.1186/1471-2164-9-509. Fig. 6, using the Lempel-Ziv estimators of entropy rate.
- ↑ Charlesworth, B.; Charlesworth, D. (2000). "The degeneration of Y chromosomes". Philosophical Transactions of the Royal Society of London Series B-Biological Sciences 355 (1403): 1563–1572. doi:10.1098/rstb.2000.0717.
- ↑ Rozen S, Skaletsky H, Marszalek J, Minx P, Cordum H, Waterston R, Wilson R, Page D (2003). "Abundant gene conversion between arms of palindromes in human and ape Y chromosomes". Nature 423 (6942): 873–6. PMID 12815433. doi:10.1038/nature01723.
- ↑ 21,0 21,1 Marchal, J. A.; Acosta, M. J.; Bullejos, M.; de la Guardia, R. D.; Sanchez, A. (2003). "Sex chromosomes, sex determination, and sex-linked sequences in Microtidae". Cytogenetic and Genome Research 101 (3–4): 266–273. doi:10.1159/000074347.
- ↑ Wilson, M. A.; Makova, K. D. (2009). "Genomic analyses of sex chromosome evolution". Annual Review of Genomics and Human Genetics 10: 333–354. PMID 19630566. doi:10.1146/annurev-genom-082908-150105.
- ↑ Just, W.; Baumstark, A.; Suss, A.; Graphodatsky, A.; Rens, W.; Schafer, N.; Bakloushinskaya, I.; et al. (2007). "Ellobius lutescens: Sex determination and sex chromosome". Sexual Development 1 (4): 211–221. PMID 18391532. doi:10.1159/000104771.
- ↑ 24,0 24,1 24,2 Arakawa, Y.; Nishida-Umehara, C.; Matsuda, Y.; Sutou, S.; Suzuki, H. (2002). "X-chromosomal localization of mammalian Y-linked genes in two XO species of the Ryukyu spiny rat". Cytogenetic and Genome Research 99 (1–4): 303–309. PMID 12900579. doi:10.1159/000071608.
- ↑ Hoekstra, H. E.; Edwards, S. V. (2000). "Multiple origins of XY female mice (genus Akodon): phylogenetic and chromosomal evidence". Proceedings of the Royal Society B 267 (1455): 1825–1831. PMC 1690748. PMID 11052532. doi:10.1098/rspb.2000.1217.
- ↑ Ortiz, M. I.; Pinna-Senn, E.; Dalmasso, G.; Lisanti, J. A. (2009). "Chromosomal aspects and inheritance of the XY female condition in Akodon azarae (Rodentia, Sigmodontinae)". Mammalian Biology 74 (2): 125–129. doi:10.1016/j.mambio.2008.03.001.
- ↑ Charlesworth, B.; Dempsey, N. D. (2001). "A model of the evolution of the unusual sex chromosome system of Microtus oregoni". Heredity 86 (4): 387–394. PMID 11520338. doi:10.1046/j.1365-2540.2001.00803.x.
- ↑ Zhou, Q.; Wang, J.; Huang, L.; Nie, W. H.; Wang, J. H.; Liu, Y.; Zhao, X. Y.; et al. (2008). "Neo-sex chromosomes in the black muntjac recapitulate incipient evolution of mammalian sex chromosomes". Genome Biology 9 (6): R98. PMID 18554412. doi:10.1186/gb-2008-9-6-r98.
- ↑ Goto, H.; Peng, L.; Makova, K. D. (2009). "Evolution of X-degenerate Y chromosome genes in greater apes: conservation of gene content in human and gorilla, but not chimpanzee". Journal of Molecular Evolution 68 (2): 134–144. PMID 19142680. doi:10.1007/s00239-008-9189-y.
- ↑ "National Library of Medicine's Genetic Home Reference". Arquivado dende o orixinal o 29 de marzo de 2012. Consultado o 15 de abril de 2012.
- ↑ "Ensembl Human MapView release 43". February 2007. Consultado o 2007-04-14.
- ↑ ScienceDaily.com Apr. 3, 2008
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Haplogrupos do cromosoma Y humano
- Polimorfismo dun só nucleótido
- Cromosoma X
- Adán cromosómico Y
- Migracións humanas prehistóricas
- Rexión pseudoautosómica
Ligazóns externas[editar | editar a fonte]
- Genetic Genealogy: About the use of mtDNA and Y chromosome analysis in ancestry testing
- Ensembl genome browser
- http://www.ncbi.nlm.nih.gov/mapview/maps.cgi?taxid=9606&chr=Y
- Human Genome Project Information—Human Chromosome Y Launchpad
- On Topic: Y Chromosome—From the Whitehead Institute for Biomedical Research
- Nature—focus on the Y chromosome
- National Human Genome Research Institute (NHGRI)—Use of Novel Mechanism Preserves Y chromosome Genes
- Ysearch.org – Public Y-DNA databaseArquivado 04 de xaneiro de 2011 en Wayback Machine.
- Y chromosome Consortium (YCC)
- NPR's Human Male: Still A Work In Progress
