Crecemento celular
O crecemento celular é o incremento da masa total dunha célula, incluíndo tanto o volume do citoplasma, coma do núcleo e os orgánulos.[1] O crecemento celular ocorre cando a taxa global de biosíntese (produción de biomoléculas ou anabolismo) é maior que a taxa global de degradación celular (a destrución de biomoléculas por medio do proteosoma, lisosoma ou autofaxia, ou catabolismo).[2][3][4]
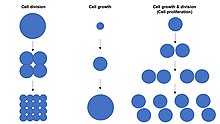
O crecemento celular non se debe confundir coa división celular ou o ciclo celular, que son procesos distintos que poden ocorrer xunto co crecemento celular durante o proceso da proliferación celular, no cal a célula, chamada célula proxenitora, crece e divídese para producir dúas células fillas.[1] Porén, o crecemento celular e a división celular poden tamén ocorrer independentemente un da outra. Durante as fases iniciais do desenvolvemento embrionario (segmentación do cigoto para formar a mórula e o blastoderma), as divisións celulares ocorren repetidamente sen que haxa crecemento celular. Inversamente, algunhas células poden crecer sen división celular ou sen ningún avance no ciclo celular, como no crecemento das neuronas durante o crecemento axonal no desenvolvemento do sistema nervioso.
En organismos multicelulares o crecemento de tecidos raramente ocorre unicamente por crecemento celular sen división celular, senón que o máis habitual é que o faga por medio de proliferación celular.[1] Isto débese a que unha soa célula cunha soa copia do xenoma no núcleo celular pode realizar a biosíntese e así experimentar un crecemento celular a só a metade da velocidade coa que o farían dúas células. Por tanto, dúas células crecen (acumulan masa) ao dobre de velocidade que unha soa célula, e catro células ao cuádruplo. Este principio orixina un incremento exponencial da taxa de crecemento dos tecidos (acumulación de masa) durante a proliferación celular, debido ao aumento exponencial do número de células.
O tamaño celular depende tanto do crecemento celular coma da división celular, e un aumento desproporcionado da taxa de crecemento celular conduce á produción de células máis grandes e un incremento desproporcionado na taxa de división celular leva á produción de moitas células máis pequenas. A proliferación celular implica tipicamente un balance nas taxas de crecemento celular e división celular que mantén un tamaño celular aproximadamente constante nas poboacións de células que crecen exponencialmente.
Algunhas células especiais poden crecer ata tamaños moi grandes por un ciclo celular pouco común de endorreplicación, no cal o xenoma se replica durante a fase S, pero isto non vai seguido dunha mitose (fase M) ou división celular (citocinese). Estas grandes células endorreplicantes teñen moitas copias do xenoma, polo que teñen un alto grao de poliploidía.
Os ovocitos poden ser células especialmente grandes en especies nas cales o desenvolvemento embrionairo ten lugar fóra do corpo materno dentro dun ovo que se pon no exterior. O gran tamaño dalgúns ovos pode alcanzarse bombeando compoñentes citosólicos das células veciñas a través de pontes citoplasmáticas chamadas canles en anel (como en Drosophila) ou por internalización de gránulos de almacenamento de nutrientes (gránulos da xema) por endocitose (como en ras).
Mecanismos de control do crecemento celular[editar | editar a fonte]
As células poden crecer incremenando a súa taxa de biosíntese celular de tal maneira que produción de biomoléculas exceda a taxa global de degradación celular de biomoléculas por medio do proteasoma, lisosoma ou autofaxia.
A biosíntese de biomoléculas iníciase coa expresión de xenes que codifica ARNs e/ou proteínas, incluíndo encimas que catalizan a síntese de lípidos e carbohidratos.
Cada xene xeralmente exprésase por transcrición dun ARN mensaxeiro (ARNm) e a tradución a proteínas, e a expresión de cada xene ocorre a diferentes niveis segundo o tipo celular (en resposta a redes regulatorias de xenes).
Para impulsar o crecemento celular pode incrementarse a taxa global de expresión xénica amplificando a taxa global de transcrición pola ARN polimerase II (para xenes activos) ou a taxa global de tradución do ARNm a proteína ao incrementar a abundancia dos ribosomas e o ARNt, cuxa bioxénese depende da ARN polimerase I e ARN polimerase III. O factor de transcrición Myc é un exemplo dunha proteína regulatoria que pode inducir a actividade global das ARN polimerases I, II e III para impulsar a transcrición e tradución globais e así o crecemento celular.
Ademais, a actividade de ribosomas individuais pode incementarse para aumentar a eficiencia global da tradución de ARNm por medio da regulación de factores de iniciación da tradución, como o complexo do factor de iniciación da elongación traducional 4E (eIF4E), que se une e forma unha caparuza no extremo 5' dos ARNm. A proteína TOR, que forma parte do complexo TORC1, é un importante regulador da iniciación da tradución de augas arriba así como a bioxénese dos ribosomas.[5] TOR é unha serina/treonina quinase que pode fosforilar directamente e inactivar o inhibidor xeral de eIF4E chamado proteína que se une a 4E (4E-BP), para promover a eficiencia da tradución. TOR tamén pode fosforilar directamente e activar a proteína S6-quinase ribosómica (S6K), que promove a bioxénese de ribosomas.
Para inhibir o crecemento celular a taxa global de expresión xénica pode diminuírse ou a taxa global de degradación biomolecular pode incrementarse ao aumentar a taxa de autofaxia. TOR normalmente inhibe directamente a función da quinase que induce a autofaxia Atg1/ULK1. Así, reducir a actividade de TOR tanto reduce a taxa global de tradución coma incrementa a autofaxia para reducir o crecemento celular.
Regulación do crecemento celular en animais[editar | editar a fonte]
Moitas da moléculas de sinalización que controlan o crecemento celular on os chamados factores de crecemento, moitos dos cales inducen un sinal de tradución por medio da vía PI3K/AKT/mTOR, que inclúe a lípido quinase de augas arriba PI3K e a serina/treonina proteína quinase de augas abaixo Akt, que pode activar outra proteína quinase TOR, que promove a tradución e inhibe a autofaxia para impulsar o crecemento celular.
A dispoñibilidade de nutrientes inflúe na produción de factores de crecemento da familia da insulina/IGF-1, que son hormonas circulantes en animals para activar a vía PI3K/AKT/mTOR en células para promover a actividade de TOR para que cando os animais están ben alimentados crecen rapidamente e cando non poden recibir suficientes nutrientes reducen a súa taxa de crecemento. Recentemente, demostrouse que o metabolismo celular do bicarbonato, que é responsable do crecemento celular, pode ser regulado pola sinalización de mTORC1.[6]
Ademais, a dispoñibilidade de aminoácidos en cada célula tamén promove directamente a actividade de TOR, aínda que este modo de regulación é máis importante en organismos unicelulares que en multicelulares, como os animais, que sempre manteñen unha abundancia de aminoácidos en circulación.
Unha discutida teoría propón que moitos tipos de células de mamífero experimentan transicións dependentes do tamaño durante o ciclo celular. Estas transicións están controladas pola quinase dependente de ciclina Cdk1.[7] Aínda que as proteínas que controlan a Cdk1 se coñecen ben, a súa conexión cos mecanismos que monitorizan o tamaño celular segue sen estar clara.
Un modelo postulado para o control do tamaño celular en mamíferos considera a masa como a forza impulsora do ciclo celular. Unha célula pode crecer ata un tamaño anormalmente alto porque a un certo tamaño ou masa celular, iníciase a fase S do ciclo. A fase S empeza a secuencia de eventos que conducen á mitose e citocinese. Unha célula non pode facerse moi pequena porque eventos do ciclo celular, como a fases S, G2 e M, son atrasadas ata que se incrementa a masa dabondo como para que empece a fase S.[8]
Poboacións de células[editar | editar a fonte]
As poboacións celulares pasan por un determinado tipo de crecemento exponencial chamado duplicación ou proliferación celular. Deste xeito, cada xeración de células debería ser dobre en número que a xeración previa. Porén, o número de xeracións só dá unha cifra máxima, xa que non todas as células sobreviven en cada xeración. As células poden reproducirse na etapa de mitose, na que duplican o seu tamaño e se dividen en dúas células xeneticamente iguais.
Tamaño celular[editar | editar a fonte]
O tamño celular é moi variable entre os organismos, e algunhas algas como Caulerpa taxifolia formadas por unha soa célula miden varios metros de lonxitude.[9] As células de plantas son moito máis grandes que as células animais, e protistas como Paramecium poden ser de 330 μm de longo, mentres que unha célula humana típica adoita medir 10 μm. Non está resolto como fan estas células para "decidir" o grandes que deberían ser antes de dividirse. Os gradientes químico son en parte responsables, e hipotetizouse que está implicada a detección do estrés mecánico polos estruturas do citeosqueleto. O traballo sobre este tema require xeralmente un organismo cuxo ciclo celular estea ben cracterizado.
Regulación do tamaño celular en lévedos[editar | editar a fonte]
A relación entre o tamaño celular e a división celular foi amplamente estudada en lévedos. Para algunhas células, hai un mecanismo polo cal a división celular non se inicia ata que a célula acadou certo tamaño. Se a subministración de nutrientes é restrinxida (despois do tempo t = 2 no diagrama de abaixo), e a taxa de incremento do tamaño celular se fai máis lenta, o período de tempo entre as división celulares increméntase.[10] Illáronse lévedos mutantes para o tamaño celular que empezan a división celular antes de acadaren o tamaño normal/regular (mutantes Wee).[11]

A proteína Wee1 é unha tirosina quinase que normalmente fosforila nun residuo de tirosina a proteína regulatoria do ciclo celular Cdc2 (a homóloga da CDK1 humana), unha quinase dependente de ciclina. Cdc2 impulsa a entrda na mitose ao fosforilar un amplo rango de dianas. Esta modificación covalente da estrutura molecular de Cdc2 inhibe a actividade encimática de Cdc2 e impide a división cellar. Wee1 actúa mantendo inactiva Cdc2 durante a G2 temperán cando as células son aínda pequenas. Cando as células acadaron un tamaño suficiente durante G2, a fosfatase Cdc25 elimina a fosforilación inhibitoria e así activa Cdc2 para permitir a entrada na mitose. O balance entre as actividades de Wee1 e Cdc25 con cambios no tamaño celular está coordinado polo sistema de control da entrada na mitose. Observouse que nos mutantes Wee1, con células cunha actividade debilitada de Wee1, a proteína Cdc2 facíase activa cando a célula era máis pequena. Nesas condicións a mitose ocorre antes de que os lévedo acaden o seu tamaño normal. Isto suxire que a división celular pode ser regulada en parte por dilución da proteína Wee1 en células a medida que crecen e son máis grandes.
Ligazón de Cdr2 con Wee1[editar | editar a fonte]
A proteína quinase Cdr2 (que regula negativamente a Wee1) e a quinase relacionada con Cdr2 Cdr1 (que forsforila directamente e inhibe a Wee1 in vitro)[12] están localizadas nunha banda de nodos corticais na parte media das células en interfase. Despois da entrada na mitose, recrútanse factores de citocinese como a miosina II a nodos similares; estes nodos finalmente condensan para formar o anel citocinético.[13] Unha proteína non caracterizada previamente, a Blt1, colocalízase con Cdr2 nos nodos interfásicos mediais. As células con knockout para Blt1 incrementan a súa lonxitude na división, o cal é consistente cun atraso na entrada na mitose. Este descubrimento conecta unha localización física, unha banda de nodos corticais, con factores que regulan directamente a entrada na mitose, concretamente Cdr1, Cdr2 e Blt1.
Outros experimentos con proteínas etiquetadas con proteína fluorescente verde (GFP) e proteinas mutantes indican que os nodos corticais mediais están formados pola ensamblaxe ordenada dependente de Cdr2 de múltiples proteínas interaccionantes durante a interfase. Cdr2 está na parte superior desta xerarquía e funciona augas arriba de Cdr1 e Blt1.[14] Promociónase a mitose pola regulación negativa de Wee1 por Cdr2. Tamén se observou que Cdr2 recruta a Wee1 nos nodos corticais mediais. O mecanismo deste recrutamento aínda non se descubriu. Un mutante para a Cdr2 quinase, que pode localizarse apropiadamente malia unha perda de función na fosforilación, impide o recrutamento de Wee1 no córtex medial e atrasa a entrada na mitose. Así, Wee1 localízase coa súa rede inhibitoria, o cal demostra que a mitose está controlada por regulación negativa dependente de Cdr2 de Wee1 nos nodos corticais mediais.[14]
Factores de polaridade celular[editar | editar a fonte]
Os factores de polaridade celular situados nos extremos da célula proporcionan pistas espaciais para limitar a distribución de Cdr2 no medio da célula. Nos lévedos de fisión como Schizosaccharomyces pombe, que teñen forma bacilar e, por tanto, extremos definidos, as células divídense cando chegan a un tamaño definido reproducible durante a mitose debido á actividade regulada de Cdk1.[15] A proteína quinase da polaridade celular Pom1, membro da familia de quinases da quinase regulada por fosforilación da tirosina de especificidade dual (DYRK), localízase nos extremos da célula. En células con knockut para Pom1, a Cdr2 xa non está restrinxida á parte media da célula, pero obsérvase difusamente por unha das metades da célula. Destes datos despréndese que Pom1 proporciona sinais inhibitorios que confinan Cdr2 na parte media da célula. Atopouse tamén que os sinais dependentes de Pom1 levan á fosforilación de Cdr2. As células knockout para Pom1 tamén se dividen ao chegaren a un tamaño menor que as de tipo silvestre, o cal indica unha entrada prematura na mitose.[14]
Pom1 forma gradientes polares que chegan ao seu máximo nos extremos da célula, o cal mostra unha ligazón directa entre os factores que controlan o tamaño e unha localización física específica na célula.[16] A medida que unha célula aumenta de tamaño, crece o gradiente en Pom1. Cando as células son pequenas, Pom1 espállase difusamente por todo o corpo celular. A medida que a célula aumenta o seu tamaño, a concentración de Pom1 diminúe na parte media e concéntrase nos extremos da célula. As células pequenas a inicio da fase G2 que conteñen suficientes niveis de Pom1 por toda a célula teñen a Cdr2 inactiva e non poden entrar na mitose. Cando a célula crece e chega á G2 tardía e Pom1 está confinada nos extremos da célula, entón a Cdr2 dos nodos corticais mediais actívase e é capaz de empezar a inhibición de Wee1. Este descubrimento mostra como o tamaño celular xoga un papel directo na regulación do comezo da mitose. Neste modelo, Pom1 actúa como unha ligazón molecular entre o crecemento celular e a entrada mitótica a través da vía Cdr2-Cdr1-Wee1-Cdk1.[14] O gradiente polar de Pom1 transmite perfectamente información sobre o tamaño e xeometría celular ao sistema regulatorio de Cdk1. A través deste gradiente, a célula está segura de que acadou un tamaño suficiente definido para entrar na mitose.
Outros sistemas experimentais para o estudo da regulación do tamaño celular[editar | editar a fonte]
Un xeito común de producir células moi longas é por fusión celular para formar sincitios. Por exemplo, as células musculares esqueléticas moi longas (varios centímetros) fórmanse por fusión de moitos miocitos. Os estudos xenéticos na mosca do vinagre Drosophila melanogaster revelaron varios xenes que cómpren para a formación de células musculares multinucleadas por fusión de mioblastos.[17] Algunhas das proteínas clave son importantes para a adhesión celular entre miocitos e algunhas están implicadas na transdución de sinais célula-célula dependente da adhesión que permite un cadoiro de eventos de fusión celular.
Os aumentos de tamaño na células de plantas son complicados porque case todas as células de plantas están dentro dunha parede celular sólida. Baixo a influencia de certas hormonas vexetais pode remodelarse a parede celular, permitindo o aumento do tamaño celular, o que é importante para o crecemento dalgúns tecidos de plantas.
A maioría dos organismos unicelulres son de tamaño microscópico, pero hai algunhas bacterias e protozoos xigantes que son visibles a simple vista. (Ver Táboa de tamaños celulares —Densas poboacións de bacterias do xofre xigantes nos sedimentos da plataforma continental de Namibia[18]—Grandes protistas do xénero Chaos, estreitamente relaciondaos co xénero Amoeba.)
Nas bacterias de forma bacilar Escherichia coli, Caulobacter crescentus e Bacillus subtilis o tamaño celular está controlado por un mecanismo simple no cal a división celular ocorre unha vez que se aumenta un volume constante desde a división previa.[19][20] Ao creceren sempre ata un mesmo tamaño, as células nacen máis pequenas ou máis grandes que como media converxen naturalmente ata un tamaño medio equivalente á cantidade de volume engadido durante cada xeración.
Trastornos[editar | editar a fonte]
Poden producirse unha serie de trastornos do crecemento a nivel celular e estes en consecuencia son a base de gran parte do curso que seguen as células no cancro, no cal un grupo de células mostran un crecemento e división incontrolados alén dos límites normais, e prodúcese a invasión (intrusión e destrución de tecidos adxacentes), e ás veces metástase (espallamento a outras localizacións no corpo por vía linfática ou sanguínea). Varios determinantes clave do crecemento celular, como a ploidía e a regulación do metabolismo celular, están comunmente alterados en tumores.[21] Por tanto, o crecemento celular heteroxéneo e pleomorfismo é unha das primeiras marcas distintivas da progresión do cancro.[22][23] Malia a prevalencia do pleomorfismo na patoloxía humana, o seu papel na progresión da enfermidade non está claro. En tecidos epiteliais, a mala regulación do tamaño celular pode inducir defectos de empaquetado e células aberrantes dispersas.[24] Pero a consecuencia do crecemento celular atípico noutros tecidos animais descoñécese.
Métodos de medida[editar | editar a fonte]
O crecemento celular pode detectarse por diversos métodos. O crecemento da célula pode visualizarse no microscopio, usando cepas adecuadas. Pero o incremento do número de células adoita ser mís significativo. Pode medirse polo reconto manual de células baixo observación microscópica, usando o método de exclusión de tinguidura (é dicir, o azul de tripán) para contar só células viables. Métodos menos esixentes e escalables son o uso de citómetros, mentres que a citometría de fluxo permite combinar a contaxe de células ('eventos') con outros parámetros específicos: sondas fluorescentes para as membranas, citoplasma ou núcleos permiten distinguir as células mortas das viables, tipos celulares, diferenciación celular, ou expresión de biomarcadores como a Ki67.
Ademais de co incremento no número de células, o crecemento pode avaliarse de acordo co aumento da actividade metabólica, é dicir, o CFDA e a calceína-AM miden (fluorimetricamente) non só a funcionalidade da membrana (retención da tinguidura), senón tamén a funcionalidade de encimas citoplasmáticos (esterases). O ensaios MTT (colorimétricos) e o ensaio de resazurina (fluorimétrico) dosifican o potencial redox mitocondrial.
Todos estes ensaios poden correlacionarse ben ou non, dependendo das condicións de crecemento celular e os aspectos desexados (actividade, proliferación). A tarefa é aínda máis complicada con poboacións de diferentes células, e cando se combinan as interferencias co crecemento celular ou toxicidade.
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 1,2 Conlon, Ian; Raff, Martin (1999). "Size Control in Animal Development". Cell 96 (2): 235–244. ISSN 0092-8674. PMID 9988218. doi:10.1016/S0092-8674(00)80563-2.
- ↑ Grewal, Savraj S; Edgar, Bruce A (2003). "Controlling cell division in yeast and animals: does size matter?". Journal of Biology 2 (1): 5. ISSN 1475-4924. PMC 156596. PMID 12733996. doi:10.1186/1475-4924-2-5.
- ↑ Neufeld, Thomas P; de la Cruz, Aida Flor A; Johnston, Laura A; Edgar, Bruce A (1998). "Coordination of Growth and Cell Division in the Drosophila Wing". Cell 93 (7): 1183–1193. ISSN 0092-8674. PMID 9657151. doi:10.1016/S0092-8674(00)81462-2.
- ↑ Thompson, Barry J. (2010). "Developmental control of cell growth and division in Drosophila". Current Opinion in Cell Biology 22 (6): 788–794. PMID 20833011. doi:10.1016/j.ceb.2010.08.018.
- ↑ Hafen, E. (2004). "Interplay Between Growth Factor and Nutrient Signaling: Lessons from Drosophila TOR". TOR. Current Topics in Microbiology and Immunology 279. pp. 153–167. ISBN 978-3-642-62360-8. ISSN 0070-217X. PMID 14560957. doi:10.1007/978-3-642-18930-2_10.
- ↑ Ali E, Liponska A, O'Hara B, Amici D, Torno M, Gao P, Asara J, Yap M-N F, Mendillo M, Ben-Sahra I (xuño de 2022). "The mTORC1-SLC4A7 axis stimulates bicarbonate import to enhance de novo nucleotide synthesis". Molecular Cell 82 (1): 3284–3298.e7. PMC 9444906. PMID 35772404. doi:10.1016/j.molcel.2022.06.008.
- ↑ Mitchison JM (2003). "Growth during the cell cycle". Int. Rev. Cytol. International Review of Cytology 226: 165–258. ISBN 978-0-12-364630-9. PMID 12921238. doi:10.1016/S0074-7696(03)01004-0.
- ↑ Cooper, Stephen (2004). "Control and maintenance of mammalian cell size". BMC Cell Biology 5 (1): 35. PMC 524481. PMID 15456512. doi:10.1186/1471-2121-5-35.
- ↑ Peplow, Mark (23 de maro de 2005). "Algae create glue to repair cell damage". Nature.com. Consultado o 4 de xullo de 2016.
- ↑ Slavov N.; Botstein D. (xuño de 2011). "Coupling among Growth Rate Response, Metabolic Cycle and Cell Division Cycle in Yeast". Molecular Biology of the Cell 22 (12): 1997–2009. PMC 3113766. PMID 21525243. doi:10.1091/mbc.E11-02-0132.
- ↑ Os mutantes Wee1 de Schizosaccharomyces pombe teñen tamaño celular pequeno e as proteínas homólogas dos seres humanos tamén regulan a entrada no ciclo celular na mitose; en Lodish HF, Berk A, Zipursky LS, Matsudaira P, et al., eds. (2000). Molecular cell biology (4ª ed.). Nova York: W.H. Freeman. ISBN 978-0-7167-3136-8.
- ↑ Wu L, Russell P (xuño de 1993). "Nim1 kinase promotes mitosis by inactivating Wee1 tyrosine kinase". Nature 363 (6431): 738–41. Bibcode:1993Natur.363..738W. PMID 8515818. doi:10.1038/363738a0.
- ↑ Wu JQ, Kuhn JR, Kovar DR, Pollard TD (novembro de 2003). "Spatial and temporal pathway for assembly and constriction of the contractile ring in fission yeast cytokinesis". Dev. Cell 5 (5): 723–34. PMID 14602073. doi:10.1016/S1534-5807(03)00324-1.
- ↑ 14,0 14,1 14,2 14,3 Moseley JB, Mayeux A, Paoletti A, Nurse P (xuño de 2009). "A spatial gradient coordinates cell size and mitotic entry in fission yeast". Nature 459 (7248): 857–60. Bibcode:2009Natur.459..857M. PMID 19474789. doi:10.1038/nature08074.
- ↑ Rupes I (setembro de 2002). "Checking cell size in yeast". Trends Genet. 18 (9): 479–85. PMID 12175809. doi:10.1016/S0168-9525(02)02745-2.
- ↑ Padte NN, Martin SG, Howard M, Chang F (decembro de 2006). "The cell-end factor pom1p inhibits mid1p in specification of the cell division plane in fission yeast". Curr. Biol. 16 (24): 2480–7. PMID 17140794. doi:10.1016/j.cub.2006.11.024.
- ↑ Menon SD, Osman Z, Chenchill K, Chia W (xuño de 2005). "A positive feedback loop between Dumbfounded and Rolling pebbles leads to myotube enlargement in Drosophila". J. Cell Biol. 169 (6): 909–20. PMC 2171639. PMID 15955848. doi:10.1083/jcb.200501126.
- ↑ Schulz HN, Brinkhoff T, Ferdelman TG, Mariné MH, Teske A, Jorgensen BB (abril de 1999). "Dense populations of a giant sulfur bacterium in Namibian shelf sediments". Science 284 (5413): 493–5. Bibcode:1999Sci...284..493S. PMID 10205058. doi:10.1126/science.284.5413.493.
- ↑ Taheri-Araghi, S; Bradde, S; Sauls, J. T.; Hill, N. S.; Levin, P. A.; Paulsson, J; Vergassola, M; Jun, S (febreiro de 2015). "Cell-size control and homeostasis in bacteria". Current Biology 25 (3): 385–391. PMC 4323405. PMID 25544609. doi:10.1016/j.cub.2014.12.009.
- ↑ Campos, M; Surovtsev, I. V.; Kato, S; Paintdakhi, A; Beltran, B; Ebmeier, S. E.; Jacobs-Wagner, C (decembro de 2014). "A constant size extension drives bacterial cell size homeostasis". Cell 159 (6): 1433–1446. PMC 4258233. PMID 25480302. doi:10.1016/j.cell.2014.11.022.
- ↑ Schmoller, Kurt M.; Skotheim, Jan M. (decembro de 2015). "The Biosynthetic Basis of Cell Size Control". Trends Cell Biol. 25 (12): 793–802. PMC 6773270. PMID 26573465. doi:10.1016/j.tcb.2015.10.006.
- ↑ Travis, W.D.; Brambilla, B.; Burke, A.P; Marx, A.; Nicholson, A.G. (2015). WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Lyon: International Agency for Research on Cancer. ISBN 978-92-832-2436-5.
- ↑ El-Naggar, A.K.; Chan, J.C.K.; Grandis, J.R.; Takata, T.; Slootweg, P.J. (2017-01-23). WHO Classification of Head and Neck Tumours. Lyon: International Agency for Research on Cancer (also known as Adman). ISBN 978-92-832-2438-9. Arquivado dende o orixinal o 2019-10-31. Consultado o 2019-10-31.
- ↑ Ramanathan, Subramanian P.; Krajnc, Matej; Gibson, Matthew C. (outubro de 2019). "Cell-Size Pleomorphism Drives Aberrant Clone Dispersal in Proliferating Epithelia". Developmental Cell 51 (1): 49–61.e4. PMC 6903429. PMID 31495693. doi:10.1016/j.devcel.2019.08.005.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Morgan, David O. (2007). The cell cycle: principles of control. Londres: Sunderland, Mass. ISBN 978-0-9539181-2-6.
Ligazóns externas[editar | editar a fonte]
- Unha comparación dos modelos xeneracionl e exponencial de crecemento de poboacións celulares
- Local Growth in an Array of Disks Wolfram Demonstrations Project
