Ciclo do ácido cítrico

O ciclo do ácido cítrico, tamén chamado ciclo de Krebs ou ciclo do ácido tricarboxílico,[1][2] é un ciclo de reaccións metabólicas catalizadas encimaticamente, que forma unha parte central da respiración celular, por medio da cal a maioría dos seres vivos oxidan os substratos para obter a enerxía que necesitan para vivir. Nas células eucariotas, o ciclo do ácido cítrico ten lugar na matriz das mitocondrias e nas bacterias no citoplasma. Os compoñentes e reaccións do ciclo do ácido cítrico foron primeiramente estudados polo investigador húngaro[3] e premio Nobel Albert Szent-Györgyi, e posteriormente o premio Nobel Hans Adolf Krebs, un xudeu alemán refuxiado en Gran Bretaña, ampliou eses estudos e postulou por primeira vez o ciclo.[4]
Nos organismos aerobios o ciclo do ácido cítrico é parte dunha vía metabólica implicada na conversión química dos carbohidratos, lípidos e proteínas en dióxido de carbono e auga para xerar unha forma de enerxía utilizable pola célula, chamada respiración aerobia. Outras vías previas ao ciclo do ácido cítrico no caso do metabolismo dos carbohidratos son a glicólise e a descarboxilación do piruvato, que subministran os metabolitos que entran no ciclo. Despois do ciclo do ácido cítrico ten lugar a fosforilación oxidativa, na que se obtén enerxía. Ademais, o ciclo do ácido cítrico proporciona moléculas precursoras que entran noutras vías metabólicas, como a da síntese dalgúns aminoácidos, polo que é funcional mesmo en células que teñen un metabolismo fermentativo. A súa posición central para moitas vías biosintéticas fai pensar que foi un dos primeiros ciclos de reaccións do metabolismo xurdidos na evolución, e puido formarse nas primeiras etapas da orixe da vida abioxeneticamente.[5]
Visión xeral do ciclo[editar | editar a fonte]
- No ciclo de Krebs entan grupos de dous carbonos procedentes dos substratos que se van oxidar, que chegan ao ciclo unidos ao coencima A (ou CoA) en forma de acetil-CoA. O ciclo do ácido cítrico empeza coa transferencia do grupo acetilo de dous carbonos do acetil-CoA a unha molécula de oxalacetato (de 4 carbonos), orixinándose unha molécula de 6 carbonos chamada citrato (ácido cítrico ionizado). O citrato é a primeira molécula formada no ciclo e é un ácido con tres grupos carboxilo ou -COOH, polo que é un ácido tricarboxílico. De aí veñen os nomes de ciclo do ácido cítrico ou ciclo do ácido tricarboxílico.
- O citrato experimenta despois unha serie de transformacións químicas, nas que perde dous dos seus grupos carboxilo en forma de dióxido de carbono (este CO2, xunto co formado na descarboxilación do piruvato previa, é o CO2 que se desprende na respiración e que será expulsado polos pulmóns, branquias, estomas das follas das plantas...). Os carbonos que se desprenden como dúas moléculas de CO2 formaban parte do oxalacetato preexistente, non (directamente) do acetil-CoA. Os carbonos doados polo acetil-CoA pasarán formar parte do oxalacetato que se rexenera ao final da primeira volta do ciclo, e non se perderán como CO2 ata as posteriores voltas do ciclo, a non ser que os intermediarios do ciclo se desvíen a outras vías metabólicas do anabolismo.[6]
- Moitas das reaccións do ciclo supoñen unha perda de electróns e hidróxenos para os metabolitos intermedios, polo que se oxidan. Estes electróns e hidróxenos ricos en enerxía son recollidos polos coencimas NAD+ e FAD, que se converten en NADH e FADH2. Por cada grupo acetilo que entra no ciclo, prodúcense tres moléculas de NADH e unha de FADH2 (o FADH2, que é un grupo prostético que non se pode desprender do seu encima, cede os electróns despois ao coencima Q, formando QH2).
- Nunha das reaccións do ciclo ten lugar unha fosforilación a nivel de substrato, que orixina o nucleótido enerxético GTP, que se pode transformar encimaticamente en ATP, polo que hai unha formación directa de moléculas enerxéticas no ciclo. O resto da enerxía extraída dos substratos vaise producir nas fases posteriores ao ciclo, chamadas transporte de electróns da cadea de transporte electrónico e fosforilación oxidativa, xa que os coencimas producidos no ciclo ceden os seus electróns á cadea de transporte electrónico e iso ten como resultado a produción de grandes cantidades de ATP.
- Ao final do ciclo rexenérase o oxalacetato que comezara o ciclo, que deste modo pode volver a entrar noutra volta do ciclo.
En resumo, en cada volta do ciclo entra un grupo acetilo de dous carbonos e prodúcense dous CO2, un GTP e catro moléculas de coencimas reducidos. O CO2 será expulsado do organismo, o GTP transformado en ATP e utilizado como fonte enerxética, e os coencimas cederán os seus electróns posteriormente á cadea de transporte electrónico para producir ATP.
Reaccións do ciclo[editar | editar a fonte]
A reacción neta xeral de todo o ciclo é:
- acetil-CoA + 3 NAD+ + FAD + ADP + Pi → CoA + 3 NADH + H+ + FADH2 + ATP + 2 CO2
Ao ciclo deben chegar continuamente grupos acetilo de dous carbonos traídos polo CoA en forma de acetil-CoA[7]. No ciclo interveñen 8 encimas. Varios dos encimas do ciclo poden estar feblemente asociados formando complexos multiencimáticos na matriz mitocondrial[8]. Os encimas están no seo da matriz mitocondrial, menos a succinato deshidroxenase, que está unida á cara interna da membrana mitocondrial interna. Os intermediarios son diversas moléculas de ácidos e oxoácidos de 4 a 6 átomos de carbono, que están ionizadas a pH celular, por iso falamos de citrato, malato, fumarato... en vez de ácidos cítrico, málico, fumárico... Deben intervir diversos coencimas, como o CoA, NAD, FAD ou GDP e ións catalizadores. Por cada acetil-CoA que entra no ciclo fórmanse dúas moléculas de CO2. a enerxía desprendida das reaccións "almacénase" por medio da formación dunha molécula de GTP e catro de coencimas reducidos (3 NADH e 1 FADH2). Os coencimas cederán despois esa enerxía transferindo os electróns á cadea de transporte electrónico. Como o coencima FADH2 está unido covalentemente ao seu encima (é un grupo prostético), cede os seus electróns ao coencima Q (pasa a QH2), que é o aceptor final da reacción e o intermediario que pasa os electróns á cadea de transporte electrónico (en realidade o encima está unido á membrana mitocondrial interna e forma parte do complexo II da cadea de transporte electrónico[9]).
A continuación unha táboa resumo coas principais características das reaccións do ciclo, e despois unha análise máis detallada de cada reacción.
| Substratos | Produtos | Encima | Tipo de reacción | Comentario | |
|---|---|---|---|---|---|
| 1 | Oxalacetato + Acetil-CoA + H2O |
Citrato + CoA-SH |
Citrato sintase | condensación | irreversible, a molécula de 4C (oxalacetato) convértese noutra de 6C (citrato) |
| 2 | Citrato | cis-aconitato + H2O |
Aconitase | Deshidratación | isomerización reversible |
| 3 | cis-Aconitato + H2O |
Isocitrato | Hidratación | ||
| 4 | Isocitrato + NAD+ |
Oxalosuccinato + NADH + H + |
Isocitrato deshidroxenase | Oxidación | xera NADH (equivale a 2,5 ATP aproximadamente) |
| 5 | Oxalosuccinato | α-cetoglutarato + CO2 |
Descarboxilación | reacción limitante, paso irreversible, xera unha molécula de 5C | |
| 6 | α-cetoglutarato + NAD+ + CoA-SH |
Succinil-CoA + NADH + H+ + CO2 |
α-cetoglutarato deshidroxenase | descarboxilación oxidativa |
paso irreversible, xera NADH (equivale a uns 2,5 ATP), rexenera a cadea de 4C (excluído o CoA) |
| 7 | Succinil-CoA + GDP + Pi |
Succinato + CoA-SH + GTP |
Succinil-CoA sintetase | fosforilación a nivel de substrato | ou ADP→ATP en vez de GDP→GTP,[9] xera 1 ATP ou equivalente |
| 8 | Succinato + ubiquinona (Q) |
Fumarato + ubiquinol (QH2) |
Succinato deshidroxenase | Oxidación | usa FAD como grupo prostético (FAD→FADH2 no primeiro paso da reacción) no encima,[9]:501 xera o equivalente a uns 1,5 ATP |
| 9 | Fumarato + H2O |
L-Malato | Fumarase | adición de H2O (hidratación) |
|
| 10 | L-Malato + NAD+ |
Oxalacetato + NADH + H+ |
Malato deshidroxenase | Oxidación | reversible (de feito, o equilibrio favorece o malato), xera NADH (equivalente a uns 2,5 ATP) |
As mitocondrias nos animais, incluídos homes, posúen dúas succinil-CoA sintetases: unha que produce GTP a partir de GDP, e outra que produce ATP a partir de ADP[10]. As plantas teñen o tipo que produce ATP[7]. O GTP que forma a succinil-CoA sintetase pode utilizalo a nucleósido-difosfato quinase para formar ATP, catalizando a reacción: GTP + ADP → GDP + ATP.[9]
Reacción 1: citrato sintase[editar | editar a fonte]
 |
A citrato sintase cataliza a condensación do oxalacetato co acetil-CoA na que se obtén citrato e se libera CoA. A estrutura cuaternaria deste encima consta de dúas subunidades, a cada unha das cales se poden unir os dous substratos. O sitio activo do encima activa o acetil-CoA para facelo afín a un centro carbonoso do oxalacetato. A continuación, únense os dous substratos con rotura do enlace tioéster do CoA por hidrólise, formando así o citrato. A reacción é moi exergónica (ΔG'°=-31,4 kJ/mol), polo que é irreversible. O cirato producido polo encima, é un inhibidor competitivo do encima. Deste modo o encima pode ser regulado estritamente, funcionando como a reacción limitante de todo o ciclo. |
 |
Reacción 2: aconitase[editar | editar a fonte]
 |
A aconitase cataliza a isomerización do citrato a isocitrato (por medio da formación do cis-aconitato). O encima cataliza tamén a reacción inversa, pero no ciclo do ácido cítrico esta reacción é unidireccional a causa da lei de acción de masas: as concentracións (en condicións estándar) de citrato (91%), do intermediato cis-aconitato (3%) e de isocitrato (6%), impulsan a reacción claramente cara á produción de isocitrato. No sitio activo do encima está presente un grupo fero-sulfurado que, xunto con algúns residuos de aminoácidos polares, únese ao substrato. No centro activo os residuos de serina, arxinina, histidina e aspartato permiten a unión estereoespecífica do citrato 1R,2S exclusivamente, rexeitando a forma oposta. |
 |
Reacción 3: isocitrato deshidroxenase[editar | editar a fonte]
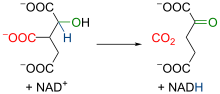 |
A isocitrato deshidroxenase mitocondrial é un encima dependente do NAD+ e de Mn2+ e/ou Mg2+. Inicialmente, o encima cataliza a oxidación do isocitrato a oxalosuccinato, que xera unha molécula de NADH. Despois, a presenza dun ión bivalente que acomplexa os osíxenos do grupo carboxilo en posición alfa aumenta a electronegatividade desa rexión da molécula. Isto xera unha redistribución dos electróns da molécula, coa conseguinte rotura do enlace entre o carbono en posición gamma e o grupo carboxilo adxacente. Deste modo prodúcese unha descarboxilación (é dicir, a liberación dun CO2 procedente do grupo -COOH), que leva á formación de α-cetoglutarato, molécula caracterizada por ter un grupo carboxilo en cada extremo e unha cetona en posición alfa respecto a un dos dous grupos carboxilo. |
 |
Reacción 4: α-cetoglutarato deshidroxenase[editar | editar a fonte]
 |
A conversión do isocitrato en α-cetoglutarato vai seguida dunha segunda reacción de descarboxilación oxidativa, que orixina succinil-CoA. A descarboxilación oxidativa do α-cetoglutarato é moi similar á que sofre o piruvato, outro α-cetoácido, para orixinar o acetil-CoA que entra no ciclo na primeira reacción. Ambas as reaccións inclúen a descarboxilación dun α-cetoácido e a conseguinte produción dun enlace tioéster de alta enerxía co coencima A. Os complexos que catalizan estas reaccións son semellantes. A α-cetoglutarato deshidroxenase (tamén chamada oxoglutarato deshidroxenase) en realidade é un complexo composto por tres encimas diferentes. A subunidade E1, chamada 2-cetoglutarato deshidroxenase, e a E2, chamada transsuccinilase, presentan unha grande homoloxía coa piruvato deshidroxenase. A subunidade E3, a dihidrolipoamida deshidroxenase, polo contrario, é o mesmo polipéptido presente no outro complexo encimático. |
 |
Reacción 5: succinil-CoA sintetase[editar | editar a fonte]
 |
A succinil-CoA é un tioéster de alta enerxía (a súa ΔG°′ de hidrólise é de aproximadamente -33,5 kJ/mol, similar á do ATP, de -30,5 kJ/mol). A citrato sintase utiliza un intermediario que ten ese enlace de alta enerxía para levar a termo a fusión entre unha molécula de dous átomos de carbono (o acetil-CoA) e outra de catro (o oxalacetato). O encima succinil-CoA sintetase utiliza, polo contrario, esta enerxía para catalizar unha fosforilación a nivel de substrato no GDP. A enerxía que provén do tioéster é simplemente convertida en enerxía ligada a un enlace co fosfato. O primeiro paso da reacción xera un novo intermediario de alta enerxía, coñecido como succinil fosfato. Seguidamente, unha histidina presente no sitio catalítico elimina o fosfato da molécula, xerando o produto succinato e unha molécula de fosfohistidina, que cede rapidamente o seu fosfato ao GDP, transformándoo en GTP. Trátase do único paso do ciclo no que hai unha fosforilación a nivel de substrato. O GTP está implicado principalmente nas vías de transdución de sinais, pero o seu papel nun proceso enerxético como o ciclo de Krebs é esencialmente o de ser un medio para trasferir o grupo fosfato ao ATP, nunha reacción catalizada pola nucleósido difosfoquinase, que cataliza a reacción: GTP + ADP → GDP + ATP. |
 |
Reacción 6: succinato deshidroxenase[editar | editar a fonte]
 |
A parte final do ciclo comprende reaccións de redistribución en moléculas de catro átomos de carbono ata a rexeneración do oxalacetato. Para que sexan posibles, o grupo metilo (CH3) presente no succinato debe ser convertido nun carbonilo (C=O). Como acontece noutras vías metabólicas (como por exemplo a beta oxidación dos ácidos graxos), esa conversión ten lugar en tres pasos: unha oxidación inicial, unha hidratación e unha segunda oxidación. Estes tres pasos, ademais de rexeneraren o oxalacetato que iniciou o ciclo, permiten a extracción de máis enerxía por medio da formación dos coencimas reducidos FADH2 e NADH. A primeira reacción de oxidación catalízaa o complexo da succinato deshidroxenase, o único encima do ciclo que ten como aceptor de hidróxeno ao FAD en lugar do NAD+: este FAD está ligado ao encima de modo covalente nun residuo de histidina (é un grupo prostético). O encima utiliza o FAD porque a enerxía asociada á reacción non sería dabondo para reducir o NAD+. O complexo encimático é tamén o único do ciclo que está ancorado á cara interna da membrana mitocondrial interna (os demais están libres na matriz). Tal posición débese a que o encima está implicado na cadea de transporte electrónico (onde se denomina complexo II). Os electróns que recolleu o FAD son introducidos directamente na cadea, grazas ao enlace estable entre o encima e o propio cofactor. A succinato deshidroxenase (ou complexo II) forma un complexo de varias subunidades que ten o coencima FAD mencionado, grupos ferro-xofre, e hemo e asóciase co coencima Q. |
 |
Reacción 7: fumarase[editar | editar a fonte]
 |
A fumarase cataliza a unión en trans dun protón e dun grupo OH- (oxhidrilo) procedentes dunha molécula de auga. Dado que o encima só pode unir o OH por un lado o fumarato só pode converterse no isómero L do ácido málico, o L-malato. |
 |
Reacción 8: malato deshidroxenase[editar | editar a fonte]
 |
A última reacción do ciclo consiste na oxidación do malato a oxalacetato. A reacción, catalizada pola malato deshidroxenase, utiliza outra molécula de NAD+ como aceptor de hidróxeno, producindo NADH. A enerxía libre de Gibbs asociada a esta última reacción é claramente positiva (a diferenza das outras do ciclo). A actividade do encima é impulsada polo consumo di oxalacetato que fai a citrato sintase e pola entrada do NADH na cadea de transporte electrónico. |
 |
Regulación[editar | editar a fonte]
Aínda que a piruvato deshidroxenase non forma parte, estritamente falando, do ciclo do ácido cítrico, inclúense aquí tamén comentarios sobre a súa regulación.
A regulación do ciclo do ácido cítrico está basicamente determinada pola dispoñibilidade de substrato e a inhibición polo produto. O NADH, un produto das deshidroxenases do ciclo, excepto da succinato deshidroxenase, inhibe a piruvato deshidroxenase, a isocitrato deshidroxenase, a alfa-cetoglutarato deshidroxenase, e a citrato sintase. O acetil-CoA inhibe a piruvato deshidroxenase, mentres que o succinil-CoA inhibe a succinil-CoA sintetase e a citrato sintase. Cando se proban in vitro os encimas do ciclo, o ATP inhibe a citrato sintase e a alfa-cetoglutarato deshidroxenase; pero os niveis de ATP in vivo non varían máis dun 10% dunha situación de repouso a unha situación de exercicio intenso, e non se coñece ningún mecanismo alostérico que explique os grandes cambios observados na velocidade da reacción cun cambio na concentración do efector alostérico de só o 10%.[19]
O calcio é tamén un regulador. Activa a piruvato deshidroxenase, a isocitrato deshidroxenase e a alfa-cetoglutarato deshidroxenase.[20] Isto incrementa a velocidade de reacción de moitos pasos do ciclo, e, por tanto, incrementa o fluxo a través da vía.
O citrato úsase como un inhibidor por retroalimentación (feedback), xa que inhibe a fosfofrutoquinase, un encima implicado na glicólise, que cataliza a formación de frutosa 1,6-difosfato, un precursor do piruvato. Isto prevén un fluxo constante alto cando hai acumulación de citrato e unha diminución do substrato do encima.
Traballos recentes demostraron unha clara relación entre os intermediatos do ciclo do ácido cítrico e a regulación dos factores da hipoxia inducible (HIF). O HIF xoga un papel na regulación da homeostase do osíxeno, e é un factor de transcrición para a anxioxénese (formación de vasos sanguíneos), a remodelación vascular, utilización da glicosa, transporte de ferro e apoptose. O HIF sintetízase consititutivamente, e a hidroxilación de polo menos un ou dous residuos de prolina chaves media a súa interacción co complexo Hippel Lindau da E3 ubiquitina ligase, o cal o marca para unha rápida degradación. Esta reacción está catalizada pola prolil hidroxilase. O fumarato e o succinato foron identificados como potentes inhibidores das prolil hidroxilases, o que leva a unha estabilización do HIF.[21]
Principais vías metabólicas que converxen no ciclo do ácido cítrico[editar | editar a fonte]
Varias vías catabólicas converxen no ciclo do ácido cítrico. As reaccións que forman intermediatos do ciclo do ácido cítrico chámanse reaccións de "recheo" ou anapleróticas, que teñen lugar especialmente cando hai escaseza de ditos intermediatos.
O ciclo do ácido cítrico é a terceira fase do catabolismo de carbohidratos. A primeira fase é a glicólise, que ten lugar no citosol e orixina piruvato. Despois o piruvato entra na mitocondria e pasa á segunda fase, a descarboxilación do piruvato, na que se forma o acetil-CoA que entrará no ciclo do ácido cítrico.
No catabolismo dos lípidos os triglicéridos son hidrolizados liberando ácidos graxos e glicerol. No fígado o glicerol pode converterse en glicosa a través da dihidroxiacetona fosfato e gliceraldehido-3-fosfato pola vía da gliconeoxénese. En moitos tecidos, especialmente no corazón, os ácidos graxos son oxidados por medio da beta oxidación, na cal rompen en grupos de dous carbonos (acetilos), que forman acetil-CoA, que pode entrar no ciclo do ácido cítrico. A beta oxidación dos ácidos graxos de número impar de cabonos (moi minoritarios) produce tamén propionil-CoA, que se converte en succinil-CoA, que pode introducir succinato no ciclo do ácido cítrico.[22]
No catabolismo das proteínas estas son atacadas por proteases que liberan os aminoácidos que as forman. O esqueleto carbonado destes aminoácidos en certas situacións pode ser utilizado como fonte de enerxía, xa que se pode converter en acetil-CoA, que entra no ciclo do ácido cítrico.
A enerxía total producida pola degradación total dunha molécula de glicosa na glicólise, ciclo do ácido cítrico, transporte electrónico e fosforilación oxidativa é de 30 moléculas de ATP en eucariotas nas plantas.
O ciclo do ácido cítrico considérase unha vía anfibólica, porque pode participar tanto no catabolismo coma anabolismo.
O ciclo do glioxilato pode considerarse unha variante do ciclo do ácido cítrico que teñen as plantas.
Notas[editar | editar a fonte]
- ↑ Heymans Institute of Pharmacology (1899). H. Engelcke, ed. Archives Internationales de Pharmacodynamie Et de Therapie.
- ↑ Hans-Werner Altmann, Franz Büchner (1962). Springer, ed. Handbuch der allgemeinen Pathologie.
- ↑ http://nobelprize.org/nobel_prizes/medicine/laureates/1937/szent-gyorgyi-bio.html
- ↑ http://www.whonamedit.com/doctor.cfm/1541.html
- ↑ Lane, Nick (2010), "Life Ascending: the 10 great innovations of evolution" (Profile)
- ↑ Wolfe, R. R.; Jahoor, F. (1990). "Recovery of labeled CO2 during the infusion of C-1- vs C-2-labeled acetate: implications for tracer studies of substrate oxidation. Am J Clin Nutr. 51(2):248-52. PMID 2106256" (PDF).
- ↑ 7,0 7,1 Buchanan Gruissem, Jones (2000). American society of plant physiology, ed. Biochemistry & molecular biology of plants (1st ed.). ISBN 0-943088-39-9.
- ↑ Barnes, SJ; Weitzman, PD (1986). "Organization of citric acid cycle enzymes into a multienzyme cluster". FEBS Lett. 201 (2): 267–70. PMID 3086126. doi:10.1016/0014-5793(86)80621-4.
- ↑ 9,0 9,1 9,2 9,3 Berg J. M., J. L. Tymoczko, L. Stryer (2002). WH Freeman and Company, ed. Biochemistry (5th ed.). pp. 465–484, 498–501. ISBN 0-7167-4684-0.
- ↑ Johnson, JD; Mehus, JG; Tews, K; Milavetz, BI; Lambeth, DO (1998). "Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes". J Biol Chem 273 (42): 27580–6. PMID 9765291. doi:10.1074/jbc.273.42.27580.
- ↑ C. Usher, J. Remington, P. Martin, G. Drueckhammer, A very short hydrogen bond provides only moderate stabilization of an enzyme-inhibitor complex of citrate synthase. In: Biochemistry 33, S. 7753-7759, 1994
- ↑ H. Lauble, C. D. Stout: Steric and conformational features of the aconitase mechanism. In: Proteins 22, S. 1-11, 1995
- ↑ Mesecar, A.D., Stoddard, B.L., Koshland Jr., D.E. Orbital steering in the catalytic power of enzymes: small structural changes with large catalytic consequences. Science v277 pp.202-206, 1997
- ↑ Knapp, J.E., Carroll, D., Lawson, J.E., Ernst, S.R., Reed, L.J., Hackert, M.L. Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase. Protein Sci. v9 pp.37-48, 2000
- ↑ Fraser, M.E., James, M.N., Bridger, W.A., Wolodko, W.T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. J.Mol.Biol. v299 pp.1325-1339, 2000
- ↑ V. Yankovskaya, R. Horsefield, S. Tornroth, C. Luna-Chavez, H. Miyoshi, C. Leger, B. Byrne, G. Cecchini, S. Iwata: Architecture of succinate dehydrogenase and reactive oxygen species generation. In: Science 299, S. 700-704, 2003
- ↑ Weaver, T., Lees, M., Zaitsev, V., Zaitseva, I., Duke, E., Lindley, P., McSweeny, S., Svensson, A., Keruchenko, J., Keruchenko, I., Gladilin, K., Banaszak, L. Crystal structures of native and recombinant yeast fumarase. J.Mol.Biol. v280 pp.431-442, 1998
- ↑ Tomita, T., Fushinobu, S., Kuzuyama, T., Nishiyama, M. Structural basis for alteration of cofactor specificity of malate dehydrogenase from Thermus flavus
- ↑ Voet D., Voet J. G. (2004). John Wiley & Sons, Inc. - New York, ed. Biochemistry (3rd ed.). p. 615.
- ↑ Denton Richard M., Randle Philip J., Bridges Barbara J., Cooper Ronald H., Kerbey Alan L., Pask Helen T., Severson David L., Stansbie David, Whitehouse Susan (1975). "Regulation of mammalian pyruvate dehydrogenase". Mol Cell Biochem 9 (1): 27–53. PMID 171557. doi:10.1007/BF01731731.
- ↑ Koivunen, P.; Hirsila, M.; Remes, A. M.; Hassinen, I. E.; Kivirikko, K. I.; Myllyharju, J. (2007). "Inhibition of hypoxia-inducible factor (HIF) hydroxylases by citric acid cycle intermediates: possible links between cell metabolism and stabilization of HIF". J. Biol. Chem. 282 (7): 4524–32. PMID 17182618. doi:10.1074/jbc.M610415200.
- ↑ Halarnkar, P; Blomquist, G (1989). "Comparative aspects of propionate metabolism". Comp. Biochem. Physiol., B 92 (2): 227–31. PMID 2647392. doi:10.1016/0305-0491(89)90270-8.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
- Ciclo do glioxilato
- Ciclo do ácido cítrico inverso
- Ácido cítrico
- Descarboxilación do piruvato
- Fosforilación oxidativa
- Glicólise
- Hans Adolf Krebs
- Respiración aerobia
- Respiración anaerobia
Ligazóns externas[editar | editar a fonte]
- Unha animación do ciclo do ácido cítrico do Smith College
- Notas sobre o ciclo do ácido cítricoArquivado 22 de maio de 2008 en Wayback Machine. de rahulgladwin.com
- Variantes do ciclo do ácido círico de MetaCyc
- Vías metabólicas conectadas co ciclo do ácido cítrico Arquivado 26 de outubro de 2008 en Wayback Machine. de Kyoto Encyclopedia of Genes and Genomes
- Animación detallada Arquivado 25 de xuño de 2005 en Wayback Machine. de johnkyrk.com
- A citric-acid cycle self quiz flash appletArquivado 06 de xullo de 2008 en Wayback Machine. da Universidade de Pittsburgh
