Antocianina


As antocianinas (do grego ἄνθος, anthos, 'flor' e κυάνεος/κυανοῦς, kuáneos/kuanoû, 'azul escuro'), tamén chamadas antocianos ou antocianósidos, son pigmentos vacuolares hidrosolubles que, dependendo do pH, poden ter cor vermella, púrpura, azul ou negra. Son glicósidos formados por un glícido (azucre) unido a un derivado flavonoide (unha aglicona), que durante a súa hidrólise renden agliconas coloreadas chamadas antocianidinas.[1]
En 1835, o farmacéutico alemán Ludwig Clamor Marquart deulle o nome de Anthokyan a un composto químico que lle daba ás flores unha cor azul no seu tratado "Die Farben der Blüthen" e de aí deriva o seu nome. Entre as plantas comestibles ricas en antocianinas están os arandos, framboesa, arroz negro e soia negra, entre moitos outros que son vermellos, azuis, púrpuras ou negros. Algunhas das cores das follas outonais derivan de antocianinas (outras de pigmentos fotosintéticos secundarios).[2][3]
As antocianinas son pigmentos de plantas que pertencen a unha clase maior de compostos chamados flavonoides sintetizados pola vía do fenilpropanoide. Aparecen en todos os tecidos das plantas superiores, incluíndo as follas, talos, raíces, flores e froitos. As antocianinas derivan das antocianidinas ao engadirlles azucres.[4] Son inodoros e moderadamente adstrinxentes.
Aínda que as antocianinas están aprobadas como colorantes extraídos de fontes naturais de alimentos e bebidas na Unión Europea, esta reavaliándose o seu uso como aditivo alimentario (E-163), xa que necesita maior verificación, aínda que o panel de expertos da Autoridade de Seguridade Alimentaria Europea indica que cos datos dos que se dispón "as exposicións estimadas dos usos actuais e niveis de uso destes extractos é improbable que sexan unha preocupación para a seguridade".[5] Non hai probas concluíntes de que as antocianinas teñen efectos sobre a bioloxía (nin malos nin bos) nin tampouco sobre doenzas humanas.[5][6][7]
Plantas ricas en antocianinas[editar | editar a fonte]

Coloración[editar | editar a fonte]
Nas flores a coloración que lle proporciona a acumulación de antocianinas pode atraer unha ampla variedade de polinizadores animais, mentres que en froitos, esa coloración pode axudar a dispersar as sementes ao atraer animais herbívoros a froitos potencialmente comestibles que teñen cores vermellas, azuis ou púrpuras.
Fisioloxía vexetal[editar | editar a fonte]
As antocianinas poden ter un papel protector contra as temperaturas extremas.[8][9] As plantas de tomate protéxense contra o estrés polo frío porque as antocianinas contarrestan as especies reactivas do oxíxeno, orixinando unha baixa taxa de morte celular nas folas.[8]
Absorción de luz[editar | editar a fonte]

O padrón de absorbancia para a cor vermella das antocianinas pode ser complementario do das clorofilas verdes en tecidos fotosinteticamente activos como as follas novas de Quercus coccifera. Pode protexer as follas dos ataques dos herbívoros que poden ser atraídos pola cor verde.[10]
Distribución das antocianinas[editar | editar a fonte]
As antocianinas encóntranse dentro de vacúolos celulares, principalmente en flores e froitos, pero tamén en follas, talos e raíces. Nestas partes atópanse predominantemente en capas celulares externas, como as da epiderme e as célula do mesofilo periférico das follas.
O máis frecuente é que aparezan na natureza como glicósidos de cianidina, delfinidina, malvidina, pelargonidina, peonidina e petunidina. Un 2% de todos os hidrocarburos fixados na fotosíntese son convertidos en flavonoides e os seus derivados, como as antocianinas. Non todas as plantas conteñen antocianinas; nas Caryophyllales (incluíndo cactos, remolachas e amarantos) son substituídos por betalaínas. As antocianinas e betalaínas nunca se atoparon xuntas na mesma planta.[11][12]
Algunhas veces en horticultura fanse cruzamentos procurando un alto contido en antocianina, obtendo variedades de plantas ornamentais e agrícolas como os pementos morróns, que poden ter un atractivo estético e culinario pouco común.[13]
En flores[editar | editar a fonte]
As antocianinas están presentes nas flores de moitas plantas, como as flores azuis dalgunhas especies e cultivares de Meconopsis.[14] As antocianinas tamén se encontran en varios tipos de tulipáns, como Tulipa gesneriana, Tulipa fosteriana e Tulipa eichleri.[15]
En alimentos[editar | editar a fonte]
| Fonte de alimento | Contido en antocianina en mg por 100 g |
|---|---|
| Azaí | 410[16] |
| Grosella negra | 190–270 |
| Aronia | 1.480[17] |
| Amoras Marion | 317[18] |
| Empetrum nigrum | 4.180[19] |
| Rubus leucodermis | 589[20] |
| Framboesa | 365 |
| Arando silvestre | 558[21] |
| Cereixa | 122[22] |
| Ameixa Queen Garnet | 277[23] |
| Grosella vermella | 80–420 |
| Arroz negro | 60 [24] |
| Feixón negro | 213[25] |
| Millo azul (millo) | 71[26] |
| Millo violeta | 1.642[27] |
| Follas de millo violeta | 10× máis que nos grans de millo[28] |
| Tomate púrpura | 2,83 ± 0,46[29] |
| Uva Concord | 326[30] |
| Uva Norton | 888[30] |
| Lombarda (fresca) | c. 150[31] |
| Lombarda (seca) | c. 1442[31] |
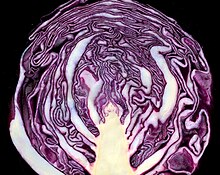

Plantas ricas en antocianinas son as especies de Vaccinium, como a arandeira, arandeira vermella e arandeira silvestre; as especies de Rubus inclúen o Rubus leucodermis, framboeseiro e amoras; tamén abundan na groselleira negra, cerdeira, pel de berenxena, arroz negro, Dioscorea alata, pataca doce, uva Concord, Vitis rotundifolia, lombarda e pétalos de violeta. Os pexegueiros de carne vermella e as mazás Pink Pearl conteñen antocianinas.[32][33][34][35] As antocianinas son menos abundantes en plátanos, espárragos, chícharos, fiúncho, peras e patacas, e poden estar totalmente ausentes en certos cultivares de Ribes verdes.[17]
A cantidade maior rexistrada de antocianinas atopouse na cuberta das sementes de soia negra (Glycine max L. Merr.), que contén aproximadamente 2 g por 100 g de produto,[36] nos grans e cascas de millo e na pel e polpa de Aronia melanocarpa L. (ver táboa). Debido ás diferenzas fundamentais na orixe da mostra, preparación e métodos de extracción para determinar o contido en antocianinas,[37][38] os valores presentados na táboa non son directamente comparables.
A natureza, os métodos da agricultura tradicional e o cruzamento de plantas produciron varias plantas pouco comúns que conteñen antocianinas, como as patacas azuis ou vermellas e o brócoli púrpura ou vermello, cores que tamén se poden dar en certas coles, coliflores, cenoiras e millo. Os tomates de xardín foron sometidos a un programa de cruzamento usando liñas de introgresión de organismos modificados xeneticamente (pero non se incorporan ao tomate púrpura final) para definir a base xenética da coloración púrpura na especie silvestre que orixinalmente era de Chile e as Illas Galápagos.[39] A variedade "Indigo Rose" estivo a disposición da industria agrícola e da xardinaría doméstica desde 2012.[39] Variedades de tomate con alta cantidade de antocianinas duplican a súa duración en bo estado nas tendas e inhiben o crecemento despois de colleitados do mofo patóxeno Botrytis cinerea.[40]
Algúns tomates foron modificados xeneticamente con factores de transcrición procedentes de Antirrhinum para producir altos niveis de antocianinas nos froitos.[41] As antocianinas poden encontrarse tamén en olivas maduradas naturalmente,[42][43] e son en parte responsables das cores vermellas e púrpuras dalgunhas olivas.[42]
Nas follas de plantas comestibles[editar | editar a fonte]
O contido de antocianinas nas follas de plantas moi coloreadas como o millo azul, a arandeira ou a arandeira rubia é unhas dez veces maior que nos grans ou froitos comestibles de ditas plantas.[28][44]
O espectro de cor das follas pode analizarse para avaliarmos a cantidade de antocianinas que contén. A madureza do froito, a calidade e tempo de colleita poden avaliarse baseándose na análise de dito espectro.[45]
Cor das follas no outono[editar | editar a fonte]

As cores das follas outonais vermellas, pírpuras e as súas combinacións mesturadas derivan da presenza de antocianinas. A diferenza dos carotenoides (que tamén lle dan cor ás follas outonais), as antocianinas non están presentes na folla durante a estación de crecemento, senón que se producen activamente contra o final do verán.[3] Desenvólvense ao final do verán no zume interno das follas, orixinándose por complexas interaccións de factores do exterior e interior da planta. A súa formación depende da degradación de azucres en presenza de luz a medida que o nivel de fosfato na folla se reduce.[2] Os niveis de cores laranxa no outono son o resultado dunha combinación de antocianinas e carotenoides.
As antocianinas están presentes aproximadamente nun 10% das especies de árbores en rexións temperadas, aínda que en certas áreas como, por exemplo, Nova Inglaterra nos EUA, ata o 70% das especies de árbores poden producir antocianinas.[3]
Seguridade como colorante[editar | editar a fonte]
As antocianinas están aprobadas para o seu uso como colorante alimentario na Unión Europea, Australia e Nova Zelandia, e aignóuselle o número E163.[46][47] En 2013, un panel de expertos científicos da Autoridade de Seguridade Alimentaria Europea concluíron que as antocianinas de varias froitas e vexetais foran insuficientemente estudadas en canto á súa seguridade e toxicoloxía como para aprobar o seu uso como aditivo alimentario.[5] Porén, atendendo á historia de seguridade mostrada polo uso de extractos de groselleira negra e pel de uva tinta para colorear alimentos producidos en Europa, o panel concluí que estas fontes de extractos eran suficientemente seguras, e outros tipos de extractos debían seguir sendo avaliados.[5]
Os extractos de antocianinas non están especificamente incluídos na lista de aditivos colorantes aprobados nos Estados Unidos; porén, o zume de uva, a pel de uva tinta e moitos froitos e zumes de froitos vexetais, que están aprobados para o seu uso como colorantes, son ricos de forma natural en antocianinas.[48] Ningunha fonte de antocianinas está incluída entre os colorantes aprobados para fármacos ou cosméticos.[49] Cando se esterifican con ácidos graxos, as antocianinas poden usarse como colorantes lipófilos para alimentos.[50]
Efectos en humanos[editar | editar a fonte]
Aínda que as antocianinas mostraron ter propiedades antioxidantes in vitro,[51] non hai probas de efectos antioxidantes en humanos despois do consumo de alimentos ricos en antocianinas.[6][52][53] A diferenza das condicións controladas dos tubos de ensaio, o destino das antocianinas in vivo indica que son pouco conservadas no organismo (menos do 5%), e a maioría das que se absorben están en forma de metabolitos quimicamente modificados que se excretan rapidamente.[54] O incremento da capacidade antioxidante do sangue visto despois do consumo de alimentos ricos en antocianinas pode non ser causado directamente polas antocianinas dos alimentos, senón por un incremento dos niveis de ácido úrico derivado da metabolización de flavonoides (os compostos parentais das antocianinas) dos alimentos.[54] É posible que os metabolitos das antocianinas inxeridas sexan reabsorbidos no tracto gastrointestinal desde onde poden entrar no sangue para a súa distribución sistémica e teñan efectos como moléculas máis pequenas.[54]
Nunha revisión feita en 2010 das probas científicas sobre os posibles beneficios para a saúde de comer alimentos dos que se afirma que teñen "propiedades antioxidantes" debido ás antocianinas, a Autoridade de Seguridade Alimentaria Europea chegou á conclusión de que: 1) non había base para afirmar un efecto antioxidante beneficioso das antocianinas da dieta en humanos, 2) non había evidencia dunha relación causa-efecto entre o consumo de alimentos ricos en antocianinas e a protección do ADN, proteínas, e lípidos causados por danos oxidativos e 3) non había evidencias xerais de que o consumo de alimentos ricos en antocianinas tivese ningún efecto "antioxidante", "anti-cancro", "anti-envellecemento" ou de "envellecemento saudable".[6]
Propiedades químicas das antocianinas[editar | editar a fonte]
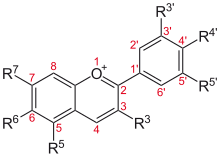

Derivados do catión flavilio[editar | editar a fonte]
- Artigo principal: Antocianidina.
| Estrutura básica | Antocianidina | R3′ | R4′ | R5′ | R3 | R5 | R6 | R7 |
|---|---|---|---|---|---|---|---|---|

|
Aurantinidina | −H | −OH | −H | −OH | −OH | −OH | −OH |
| Cianidina | −OH | −OH | −H | −OH | −OH | −H | −OH | |
| Delfinidina | −OH | −OH | −OH | −OH | −OH | −H | −OH | |
| Europinidina | −OCH 3 |
−OH | −OH | −OH | −OCH 3 |
−H | −OH | |
| Pelargonidina | −H | −OH | −H | −OH | −OH | −H | −OH | |
| Malvidina | −OCH 3 |
−OH | −OCH 3 |
−OH | −OH | −H | −OH | |
| Peonidina | −OCH 3 |
−OH | −H | −OH | −OH | −H | −OH | |
| Petunidina | −OH | −OH | −OCH 3 |
−OH | −OH | −H | −OH | |
| Rosinidina | −OCH 3 |
−OH | −H | −OH | −OH | −H | −OCH 3 |
Glicósidos de antocianidinas[editar | editar a fonte]
As antocianinas son principalmente 3-glicósidos de antocianidinas, pero poden ter outros enlaces. As antocianinas hidrolizadas sepáranse en azucres libres e antocianidinas (a aglicona ou parte non glicídica). En 2003 informárase de máis de 400 antocianinas diferentes,[55] mentres que a literatura posterior a inicios do 2006 elevara ese número a máis de 550 antocianinas. A diferenza en estrutura química que ocorre en resposta a cambios de pH, é a razón pola cal as antocianinas se usan a miúdo como indicadores de pH, xa que cambian da cor vermella en ácidos a azul en bases por un proceso chamado halocromismo.
Estabilidade[editar | editar a fonte]
As antocianinas pénsase que sofren unha degradación fisioquímica in vivo e in vitro. A estrutura, pH, temperatura, luz, oxíxeno, ións metálicos, asociación intramolecular e asociación intermolecular con outros compostos (copigmentos, azucres, proteínas, produtos de degradación, etc.) sábese que afectan á cor e estabilidada das antocianinas.[56] O estado de oxidación do anel B e o pH son os factores que median a degradación das antocianinas aos seus ácidos fenólicos e aldehidos constituíntes.[57] Porcións significativas das antocianinas inxeridas son probablemente degradadas a ácidos fenólicos e aldehidos in vivo despois da súa inxestión. Esta característica confunde o estudo e illamento científico dos mecanismos específicos da antocianinas in vivo.
pH[editar | editar a fonte]

As antocianinas xeralmente degrádanse a pH altos. Porén, algunhas antocianinas, como a petanina (petunidina 3-[6-O-(4-O-(E)-p-coumaroil-O-α-(en samoano)-ramnopiranosil)-β-(en samoano)-glicopiranósido]-5-O-β-(en samoano)-glicopiranósido), son resistentes á degradación a pH 8 e poden utilizarse como colorantes alimentarios.[58]
Uso como indicador ambiental do pH[editar | editar a fonte]

As antocianinas poden utilizarse como indicadores de pH porque as súas cores cambian co pH; son vermellas ou rosas en solucións ácidas (pH < 7), púrpuras en solucións neutras (pH ≈ 7), amarelo-verdosas en solucións alcalinas (pH > 7) e incoloras en solucións moi alcalinas, onde o pigmento está totalmente reducido.[59]
Biosíntese[editar | editar a fonte]

- Os pigmentos antocianinas están ensamblados como todos os outros flavonoides procedentes doutras correntes de materias primas químicas da célula:
- Unha corrente implica a vía shikimate para producir o aminoácido fenilalanina, (ver fenilpropanoides).
- A outra corrente produce tres moléculas de malonil-CoA, unha unidade C3 a partir dunha unidade C2 (acetil-CoA).[60]
- Estas correntes xúntanse e están acopladas polo encima chalcona sintase, que forma un composto intermediario similar á chalcona por medio dun meanismo de dobramento de policétido que é común en plantas.
- A chalcona é seguidamente isomerizada polo encima chalcona isomerase ao pigmento prototipo narinxenina.
- A narinxenina é despois oxidada por encimas como a flavanona hidroxilase, flavonoide 3'-hidroxilase e flavonoide 3',5'-hidroxilase.
- Estes produtos de oxidación son reducidos máis polo encima dihidroflavonol 4-redutase ás correspondentes leucoantocianidinas incoloras.[61]
- As leucoantocianidinas críase antes que eran os precursores inmediatos do seguinte encima, unha dioxixenase denominada antocianidina sintase ou leucoantocianidina dioxixenase. Porén, recentemente se descubriu que os flavan-3-ols son os verdadeiros substratos da leucoantocianidina redutase (LAR).
- As antocianidinas inestables resultantes son despois acopladas a moléculas de azucres por encimas como a UDP-3-O-glicosiltransferase,[62] para render as antocianinas relativamente estables finais.
Deste xeito, cómpren máis de cinco encimas para sintetizar estes pigmentos, que actúan en concerto. Incluso unha alteración menor en calquera dos mecanismos destes encimas por factores xenéticos ou ambientais, pararía a produción de antocianina. Aínda que o custo biolóxico de producir antocianinas é relativamente alto, as plantas benefícianse significativamente da adaptación ambiental e tolerancia a enfermidades e pragas que as antocianinas lles proporcionan.
Na vía da biosíntese das antocianinas, a L-fenilalanina é convertida en narinxenina pola fenilalanina amonioliase (PAL), cinamato 4-hidroxilase (C4H), 4-coumarato CoA ligase (4CL), chalcona sintase (CHS) e chalcona isomerase (CHI). Despois, a seguinte vía cataliza a formación de aglicona complexa e antocianina por composición pola flavanona 3-hidroxilase (F3H), flavonoide 3'-hidroxilase (F3′H), dihidroflavonol 4-redutase (DFR), antocianidina sintase (ANS), UDP-glicósido: flavonoide glicosiltransferase (UFGT) e metil transferase (MT). Entre elas, UFGT é dividida en UF3GT e UF5GT, que son responsables da glicosilación de antocianinas para producir moléculas estables.[63]
En Arabidopsis thaliana dúas glicosiltransferases, UGT79B1 e UGT84A2, interveñen na vía biosintética da antocianinas. A proteína UGT79B1 converte o cianidina 3-O-glicósido en cianidina 3-O-xilosil(1→2)glicósido. A UGT84A2 é a ácido sinápico: UDP-glicosiltransferase.[64]
Análise xenética[editar | editar a fonte]
As vías e encimas do metabolismo fenólico poden estudarse por medio de transxénese de xenes. O xene regulador da planta Arabidopsis que controla a produción do pigmento antocianina 1 (AtPAP1) pode expresarse noutras especies de plantas.[65]
Células solares sensibilizadas por tintura[editar | editar a fonte]
As antocianinas foron utilizadas en células solares orgánicas debido á súa capacidade de converter a enerxía da luz en enerxía eléctrica.[66] Os principais beneficios de usar unha célula solar sensibilizada con tintura ou colorante en vez das tradicionais células de silicio de unión p-n, son ter uns requirimentos de pureza menores e a abundancia de materiais compoñentes, así como que poden producirse sobre substratos flexibles, facéndoos axeitados para un proceso de impresión rolo-rolo.[67]
Marcadores visuais[editar | editar a fonte]
As antocianinas fluorescen, o que as converte nunha ferramenta para a investigación de células vexetais, xa que permiten tomar imaxes de células vivas sen necesidade de usar outros fluoróforos.[68] A produción de antocianinas pode facerse por enxeñaría en materiais modificados xeneticamente, que permiten a súa identificación visual.[69]
Notas[editar | editar a fonte]
- ↑ "Anthocyanins". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ 2,0 2,1 Davies, Kevin M. (2004). Plant pigments and their manipulation. Wiley-Blackwell. p. 6. ISBN 978-1-4051-1737-1.
- ↑ 3,0 3,1 3,2 Archetti, Marco; Döring, Thomas F.; Hagen, Snorre B.; et al. (2011). "Unravelling the evolution of autumn colours: an interdisciplinary approach". Trends in Ecology & Evolution 24 (3): 166–73. PMID 19178979. doi:10.1016/j.tree.2008.10.006.
- ↑ Andersen, Øyvind M (17 de outubro de 2001). "Anthocyanins". Encyclopedia of Life Sciences. John Wiley & Sons. ISBN 978-0470016176. doi:10.1038/npg.els.0001909.
- ↑ 5,0 5,1 5,2 5,3 "Scientific opinion on the re-evaluation of anthocyanins (E 163) as a food additive". EFSA Journal (European Food Safety Authority) 11 (4): 3145. abril de 2013. doi:10.2903/j.efsa.2013.3145.
- ↑ 6,0 6,1 6,2 EFSA Panel on Dietetic Products, Nutrition and Allergies (2010). "Scientific Opinion on the substantiation of health claims related to various food(s)/food constituent(s) and protection of cells from premature aging, antioxidant activity, antioxidant content and antioxidant properties, and protection of DNA, proteins and lipids from oxidative damage pursuant to Article 13(1) of Regulation (EC) No 1924/20061". EFSA Journal 8 (2): 1489. doi:10.2903/j.efsa.2010.1752.
- ↑ "Flavonoids". Micronutrient Information Center. Corvallis, Oregon: Linus Pauling Institute, Oregon State University. 2016. Consultado o 2022-03-27.
- ↑ 8,0 8,1 Qiu, Zhengkun; Wang, Xiaoxuan; Gao, Jianchang; Guo, Yanmei; Huang, Zejun; Du, Yongchen (2016-03-04). "The Tomato Hoffman's Anthocyaninless Gene Encodes a bHLH Transcription Factor Involved in Anthocyanin Biosynthesis That Is Developmentally Regulated and Induced by Low Temperatures". PLOS ONE 11 (3): e0151067. Bibcode:2016PLoSO..1151067Q. ISSN 1932-6203. PMC 4778906. PMID 26943362. doi:10.1371/journal.pone.0151067.
- ↑ Breusegem, Frank Van; Dat, James F. (2006-06-01). "Reactive Oxygen Species in Plant Cell Death". Plant Physiology (en inglés) 141 (2): 384–390. ISSN 1532-2548. PMC 1475453. PMID 16760492. doi:10.1104/pp.106.078295.
- ↑ Karageorgou P; Manetas Y (2006). "The importance of being red when young: anthocyanins and the protection of young leaves of Quercus coccifera from insect herbivory and excess light". Tree Physiol 26 (5): 613–621. PMID 16452075. doi:10.1093/treephys/26.5.613.
- ↑ Francis, F.J. (1999). Colorants. Egan Press. ISBN 978-1-891127-00-7.
- ↑ Stafford, Helen A. (1994). "Anthocyanins and betalains: evolution of the mutually exclusive pathways". Plant Science 101 (2): 91–98. doi:10.1016/0168-9452(94)90244-5.
- ↑ Stommel J, Griesbach RJ (setembro de 2006). "Twice as Nice Breeding Versatile Vegetables". Agricultural Research Magazine, US Department of Agriculture. Consultado o 2 de febreiro de 2016.
- ↑ "Colour range within genus". Meconopsis Group. Arquivado dende o orixinal o 04 de maio de 2020. Consultado o 30 de xuño de 2018.
- ↑ N. Marissen, W. G. van Doorn and U. van Meeteren, International Society for Horticultural Science Proceedings of the Eighth International Symposium on Postharvest Physiology of Ornamental Plants, 2005 en Google Books.
- ↑ Moura, Amália Soares dos Reis Cristiane de; Silva, Vanderlei Aparecido da; Oldoni, Tatiane Luiza Cadorin; et al. (marzo de 2018). "Optimization of phenolic compounds extraction with antioxidant activity from açaí, blueberry and goji berry using response surface methodology". Emirates Journal of Food and Agriculture 30 (3): 180–189. doi:10.9755/ejfa.2018.v30.i3.1639.
- ↑ 17,0 17,1 Wu X; Gu L; Prior RL; et al. (decembro de 2004). "Characterization of anthocyanins and proanthocyanidins in some cultivars of Ribes, Aronia, and Sambucus and their antioxidant capacity". Journal of Agricultural and Food Chemistry 52 (26): 7846–56. PMID 15612766. doi:10.1021/jf0486850.
- ↑ Siriwoharn T; Wrolstad RE; Finn CE; et al. (decembro de 2004). "Influence of cultivar, maturity, and sampling on blackberry (Rubus L. Hybrids) anthocyanins, polyphenolics, and antioxidant properties". Journal of Agricultural and Food Chemistry 52 (26): 8021–30. PMID 15612791. doi:10.1021/jf048619y.
- ↑ Ogawa K; Sakakibara H; Iwata R; et al. (xuño de 2008). "Anthocyanin Composition and Antioxidant Activity of the Crowberry (Empetrum nigrum) and Other Berries". Journal of Agricultural and Food Chemistry 56 (12): 4457–62. PMID 18522397. doi:10.1021/jf800406v.
- ↑ Wada L; Ou B (xuño de 2002). "Antioxidant activity and phenolic content of Oregon caneberries". Journal of Agricultural and Food Chemistry 50 (12): 3495–500. PMID 12033817. doi:10.1021/jf011405l.
- ↑ Hosseinian FS; Beta T (decembro de 2007). "Saskatoon and wild blueberries have higher anthocyanin contents than other Manitoba berries". Journal of Agricultural and Food Chemistry 55 (26): 10832–8. PMID 18052240. doi:10.1021/jf072529m.
- ↑ Wu X; Beecher GR; Holden JM; et al. (novembro de 2006). "Concentrations of anthocyanins in common foods in the United States and estimation of normal consumption". Journal of Agricultural and Food Chemistry 54 (11): 4069–75. PMID 16719536. doi:10.1021/jf060300l.
- ↑ Fanning K; Edwards D; Netzel M; et al. (novembro de 2013). "Increasing anthocyanin content in Queen Garnet plum and correlations with in-field measures". Acta Horticulturae 985 (985): 97–104. doi:10.17660/ActaHortic.2013.985.12.
- ↑ Hiemori M; Koh E; Mitchell A (abril de 2009). "Influence of Cooking on Anthocyanins in Black Rice (Oryza sativa L. japonica var. SBR)". Journal of Agricultural and Food Chemistry 57 (5): 1908–14. PMID 19256557. doi:10.1021/jf803153z.
- ↑ Takeoka G; Dao L; Full G; et al. (setembro de 1997). "Characterization of Black Bean (Phaseolus vulgaris L.) Anthocyanins". Journal of Agricultural and Food Chemistry 45 (9): 3395–3400. doi:10.1021/jf970264d.
- ↑ Herrera-Sotero M; Cruz-Hernández C; Trujillo-Carretero C; Rodríguez-Dorantes M; García-Galindo H; Chávez-Servia J; Oliart-Ros R; Guzmán-Gerónimo R (2017). "Antioxidant and antiproliferative activity of blue corn and tortilla from native maize". Chemistry Central Journal 11 (1): 110. PMC 5662526. PMID 29086902. doi:10.1186/s13065-017-0341-x.
- ↑ Lieberman S (2007). "The antioxidant power of purple corn: a research review". Alternative & Complementary Therapies 13 (2): 107–110. doi:10.1089/act.2007.13210.
- ↑ 28,0 28,1 Li, C. Y.; Kim, H. W.; Won, S. R.; et al. (2008). "Corn husk as a potential source of anthocyanins". Journal of Agricultural and Food Chemistry 56 (23): 11413–6. PMID 19007127. doi:10.1021/jf802201c.
- ↑ Butelli E, Titta L, Giorgio M, et al. (2008). "Enrichment of tomato fruit with health-promoting anthocyanins by expression of select transcription factors". Nat Biotechnol 26 (11): 1301–1308. PMID 18953354. doi:10.1038/nbt.1506.
- ↑ 30,0 30,1 Muñoz-Espada, A. C.; Wood, K. V.; Bordelon, B.; et al. (2004). "Anthocyanin Quantification and Radical Scavenging Capacity of Concord, Norton, and Marechal Foch Grapes and Wines". Journal of Agricultural and Food Chemistry 52 (22): 6779–86. PMID 15506816. doi:10.1021/jf040087y.
- ↑ 31,0 31,1 Ahmadiani, Neda; Robbins, Rebecca J.; Collins, Thomas M.; Giusti, M. Monica (2014). "Anthocyanins Contents, Profiles, and Color Characteristics of Red Cabbage Extracts from Different Cultivars and Maturity Stages". Journal of Agricultural and Food Chemistry 62 (30): 7524–31. PMID 24991694. doi:10.1021/jf501991q.
- ↑ Cevallos-Casals, BA; Byrne, D; Okie, WR; et al. (2006). "Selecting new peach and plum genotypes rich in phenolic compounds and enhanced functional properties". Food Chemistry 96 (2): 273–328. doi:10.1016/j.foodchem.2005.02.032.
- ↑ Sekido, Keiko; et al. (2010). "Efficient breeding system for red-fleshed apple based on linkage with S3-RNase allele in 'Pink Pearl'.". HortScience 45 (4): 534–537. doi:10.21273/HORTSCI.45.4.534.
- ↑ Oki, Tomoyuki; Kano, Mitsuyoshi; Watanabe, Osamu; Goto, Kazuhisa; Boelsma, Esther; Ishikawa, Fumiyasu; Suda, Ikuo (2016). "Effect of consuming a purple-fleshed sweet potato beverage on health-related biomarkers and safety parameters in Caucasian subjects with elevated levels of blood pressure and liver function biomarkers: a 4-week, open-label, non-comparative trial". Bioscience of Microbiota, Food and Health 35 (3): 129–136. PMC 4965517. PMID 27508114. doi:10.12938/bmfh.2015-026.
- ↑ Moriya, Chiemi; Hosoya, Takahiro; Agawa, Sayuri; Sugiyama, Yasumasa; Kozone, Ikuko; Shin-ya, Kazuo; Terahara, Norihiko; Kumazawa, Shigenori (7 de abril de 2015). "New acylated anthocyanins from purple yam and their antioxidant activity". Bioscience, Biotechnology, and Biochemistry 79 (9): 1484–1492. PMID 25848974. doi:10.1080/09168451.2015.1027652.
- ↑ Choung, Myoung-Gun; Baek, In-Youl; Kang, Sung-Taeg; et al. (decembro de 2001). "Isolation and determination of anthocyanins in seed coats of black soybean (Glycine max (L.) Merr.)". J. Agric. Food Chem. 49 (12): 5848–51. PMID 11743773. doi:10.1021/jf010550w.
- ↑ Krenn, L; Steitz, M; Schlicht, C; et al. (novembro de 2007). "Anthocyanin- and proanthocyanidin-rich extracts of berries in food supplements—analysis with problems". Pharmazie 62 (11): 803–12. PMID 18065095.
- ↑ Siriwoharn, T; Wrolstad, RE; Finn, CE; et al. (decembro de 2004). "Influence of cultivar, maturity, and sampling on blackberry (Rubus L. Hybrids) anthocyanins, polyphenolics, and antioxidant properties". J Agric Food Chem 52 (26): 8021–30. PMID 15612791. doi:10.1021/jf048619y.
- ↑ 39,0 39,1 Scott J (27 de xaneiro de 2012). "Purple tomato debuts as 'Indigo Rose'". Oregon State University Extension Service, Corvallis. Consultado o 9 de setembro de 2014.
- ↑ Zhang, Y.; Butelli, E.; De Stefano, R.; et al. (2013). "Anthocyanins Double the Shelf Life of Tomatoes by Delaying Overripening and Reducing Susceptibility to Gray Mold". Current Biology 23 (12): 1094–100. PMC 3688073. PMID 23707429. doi:10.1016/j.cub.2013.04.072.
- ↑ Butelli, Eugenio; Titta, Lucilla; Giorgio, Marco; et al. (novembro de 2008). "Enrichment of tomato fruit with health-promoting anthocyanins by expression of select transcription factors". Nature Biotechnology 26 (11): 1301–8. PMID 18953354. doi:10.1038/nbt.1506.
- ↑ 42,0 42,1 Agati, Giovanni; Pinelli, Patrizia; Cortés Ebner, Solange; et al. (marzo de 2005). "Nondestructive evaluation of anthocyanins in olive (Olea europaea) fruits by in situ chlorophyll fluorescence spectroscopy". Journal of Agricultural and Food Chemistry 53 (5): 1354–63. PMID 15740006. doi:10.1021/jf048381d.
- ↑ Stan Kailis; David Harris (28 de febreiro de 2007). "The olive tree Olea europaea". Producing Table Olives. Landlinks Press. pp. 17–66. ISBN 978-0-643-09203-7.
- ↑ Vyas, P; Kalidindi, S; Chibrikova, L; et al. (2013). "Chemical analysis and effect of blueberry and lingonberry fruits and leaves against glutamate-mediated excitotoxicity". Journal of Agricultural and Food Chemistry 61 (32): 7769–76. PMID 23875756. doi:10.1021/jf401158a.
- ↑ Bramley, R.G.V.; Le Moigne, M.; Evain, S.; et al. (febreiro de 2011). "On-the-go sensing of grape berry anthocyanins during commercial harvest: development and prospects" (PDF). Australian Journal of Grape and Wine Research 17 (3): 316–326. doi:10.1111/j.1755-0238.2011.00158.x. Arquivado dende o orixinal (PDF) o 19 de outubro de 2017. Consultado o 03 de xaneiro de 2023.
- ↑ "Current EU approved additives and their E Numbers". United Kingdom: Food Standards Agency. 2010. Consultado o 12 de agosto de 2017.
- ↑ Australia New Zealand Food Standards Code"Standard 1.2.4 – Labelling of ingredients". Consultado o 27 de outrubro de 2011.
- ↑ "Summary of Color Additives for Use in the United States in Foods, Drugs, Cosmetics, and Medical Devices". US Food and Drug Administration. maio de 2015. Consultado o 29 de xuño de 2017.
- ↑ "Summary of Color Additives for Use in the United States in Foods, Drugs, Cosmetics, and Medical Devices". US Food and Drug Administration. maio de 2015. Consultado o 13 de agosto de 2017.
- ↑ Marathe, Sandesh J.; Shah, Nirali N.; Bajaj, Seema R.; Singhal, Rekha S. (2021-04-01). "Esterification of anthocyanins isolated from floral waste: Characterization of the esters and their application in various food systems". Food Bioscience (en inglés) 40: 100852. ISSN 2212-4292. doi:10.1016/j.fbio.2020.100852.
- ↑ De Rosso, VV; Morán Vieyra, FE; Mercadante, AZ; et al. (outubro de 2008). "Singlet oxygen quenching by anthocyanin's flavylium cations". Free Radical Research 42 (10): 885–91. PMID 18985487. doi:10.1080/10715760802506349.
- ↑ Lotito SB; Frei B (2006). "Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: cause, consequence, or epiphenomenon?". Free Radic. Biol. Med. 41 (12): 1727–46. PMID 17157175. doi:10.1016/j.freeradbiomed.2006.04.033.
- ↑ Williams RJ; Spencer JP; Rice-Evans C (abril de 2004). "Flavonoids: antioxidants or signalling molecules?". Free Radical Biology & Medicine 36 (7): 838–49. PMID 15019969. doi:10.1016/j.freeradbiomed.2004.01.001.
- ↑ 54,0 54,1 54,2 "Studies force new view on biology of flavonoids", by David Stauth, EurekAlert!. Adapted from a news release issued by Oregon State University
- ↑ Kong, JM; Chia, LS; Goh, NK; et al. (novembro de 2003). "Analysis and biological activities of anthocyanins". Phytochemistry 64 (5): 923–33. PMID 14561507. doi:10.1016/S0031-9422(03)00438-2.
- ↑ Andersen, Øyvind M.; Jordheim, Monica (2008). "Anthocyanins- food applications". 5th Pigments in Food congress- for quality and health. University of Helsinki. ISBN 978-952-10-4846-3.
- ↑ Woodward, G; Kroon, P; Cassidy, A; et al. (xuño de 2009). "Anthocyanin stability and recovery: implications for the analysis of clinical and experimental samples". J. Agric. Food Chem. 57 (12): 5271–8. PMID 19435353. doi:10.1021/jf900602b.
- ↑ Fossen T; Cabrita L; Andersen OM (decembro de 1998). "Colour and stability of pure anthocyanins influenced by pH including the alkaline region". Food Chemistry 63 (4): 435–440. doi:10.1016/S0308-8146(98)00065-X. hdl:10198/3206.
- ↑ Michaelis, Leonor; Schubert, M.P.; Smythe, C.V. (1 de decembro de 1936). "Potentiometric Study of the Flavins" (PDF). J. Biol. Chem. 116 (2): 587–607. doi:10.1016/S0021-9258(18)74634-6.
- ↑ Jack Sullivan (1998). "Anthocyanin". Carnivorous Plant Newsletter. Arquivado dende o orixinal o 1 de novembro de 2009. Consultado o 6 de outubro de 2009.
- ↑ Nakajima, J; Tanaka, Y; Yamazaki, M; et al. (xullo de 2001). "Reaction mechanism from leucoanthocyanidin to anthocyanidin 3-glucoside, a key reaction for coloring in anthocyanin biosynthesis". The Journal of Biological Chemistry 276 (28): 25797–803. PMID 11316805. doi:10.1074/jbc.M100744200.
- ↑ Kovinich, N; Saleem, A; Arnason, JT; et al. (agosto de 2010). "Functional characterization of a UDP-glucose:flavonoid 3-O-glucosyltransferase from the seed coat of black soybean (Glycine max (L.) Merr.)". Phytochemistry 71 (11–12): 1253–63. PMID 20621794. doi:10.1016/j.phytochem.2010.05.009.
- ↑ Da Qiu Zhao; Chen Xia Han; Jin Tao Ge; et al. (15 de novembro de 2012). "Isolation of a UDP-glucose: Flavonoid 5-O-glucosyltransferase gene and expression analysis of anthocyanin biosynthetic genes in herbaceous peony (Paeonia lactiflora Pall.)". Electronic Journal of Biotechnology 15 (6). doi:10.2225/vol15-issue6-fulltext-7.
- ↑ Yonekura-Sakakibara K; Fukushima A; Nakabayashi R; et al. (xaneiro de 2012). "Two glycosyltransferases involved in anthocyanin modification delineated by transcriptome independent component analysis in Arabidopsis thaliana". Plant J 69 (1): 154–67. PMC 3507004. PMID 21899608. doi:10.1111/j.1365-313X.2011.04779.x.
- ↑ Li, Xiang; Gao, Ming-Jun; Pan, Hong-Yu; et al. (2010). "Purple canola: Arabidopsis PAP1 increases antioxidants and phenolics in Brassica napus leaves". J. Agric. Food Chem. 58 (3): 1639–1645. PMID 20073469. doi:10.1021/jf903527y.
- ↑ Cherepy, Nerine J.; Smestad, Greg P.; Grätzel, Michael; Zhang, Jin Z. (1997). "Ultrafast Electron Injection: Implications for a Photoelectrochemical Cell Utilizing an Anthocyanin Dye-Sensitized TiO
2 Nanocrystalline Electrode" (PDF). The Journal of Physical Chemistry B 101 (45): 9342–51. doi:10.1021/jp972197w. - ↑ Grätzel, Michael (outubro de 2003). "Dye-sensitized solar cells". Journal of Photochemistry and Photobiology 4 (2): 145–53. doi:10.1016/S1389-5567(03)00026-1.
- ↑ Wiltshire EJ; Collings DA (outubro de 2009). "New dynamics in an old friend: dynamic tubular vacuoles radiate through the cortical cytoplasm of red onion epidermal cells". Plant & Cell Physiology 50 (10): 1826–39. PMID 19762337. doi:10.1093/pcp/pcp124.
- ↑ Kovinich, N; Saleem, A; Rintoul, TL; et al. (agosto de 2012). "Coloring genetically modified soybean grains with anthocyanins by suppression of the proanthocyanidin genes ANR1 and ANR2". Transgenic Res. 21 (4): 757–71. PMID 22083247. doi:10.1007/s11248-011-9566-y.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Andersen, O.M. (2006). Flavonoids: Chemistry, Biochemistry and Applications. Boca Raton FL: CRC Press. ISBN 978-0-8493-2021-7.
- Gould, K.; Davies, K.; Winefield, C., eds. (2008). Anthocyanins: Biosynthesis, Functions, and Applications. Springer. ISBN 978-0-387-77334-6.
Ligazóns externas[editar | editar a fonte]
- Anthocyanins FAQ MadSci Network Arquivado 25 de xullo de 2020 en Wayback Machine.
