Morfoxénese
A morfoxénese (do grego morphê, 'forma' e genesis, 'creación', literalmente "a xeración da forma") é o proco biolóxico que causa que unha célula, tecido ou organismo desenvolva a súa forma. É un dos tres aspectos fundamentais da bioloxía do desenvolvemento xunto co control do crecemento dos tecidos e formación de padróns na diferenciación celular.
O proceso controla a distribución espacial organizada das células durante o desenvolvemento embrionario dun organismo. A morfoxénese pode ter lugar nun organismo maduro, como no mantemento de tecidos normal polas células nais ou na rexeneración de tecidos despois dunha lesión. O cancro é un exemplo de morfoxénese de tecidos patolóxica e moi anormal. A morfoxénese tamén describe o desenvolvemento de formas de vida unicelulares que non teñen unha etapa embrionaria no seu ciclo de vida. A morfoxénese é esencial para a evolución de novas formas.
A morfoxénese é un proceso mecánico no que interveñen forzas que xeran estrés, tensión e movemento de células,[1] e pode inducirse por programas xenéticos segundo o padrón espacial das células dentro dos tecidos. A morfoxénese anormal denomínase dismorfoxénese.
Historia[editar | editar a fonte]
- Véxase tamén: Bioloxía evolutiva do desenvolvemento#Historia e Padrón de Turing.
Algunhas das primeiras ideas e descricións matemáticas sobre como afectan os procesos físicos e as restricións ao crecemento biolóxico, e, por tanto, os padróns naturais como as espirais da filotaxe, publicounas D'Arcy Wentworth Thompson no seu libro de 1917 On Growth and Form (Sobre o crecemento e a forma)[2][3][4] [5] e Alan Turing na súa obra The Chemical Basis of Morphogenesis (A base química da morfoxénese, 1952).[6] Alí onde Thompson explicara as formas do corpo dos animais como xeradas polas diversas velocidades de crecemento en distintas direccións, por exemplo para crear a cuncha espiral dun caracol, Turing predixo correctamente un mecanismo de morfoxénese: a difusión de dous sinais químicos distintos, un activador e outro desactivador do crecemento, para establecer os padróns de desenvolvemento, décadas antes de que se observasen ditos padróns.[7] Unha comprensión máis completa dos mecanismos implicados en organismos reais necesitaron o descubrimento da estrutura do ADN en 1953, e o desenvolvemento da bioloxía molecular e da bioquímica.[Cómpre referencia]
Bases xenéticas e moleculares[editar | editar a fonte]
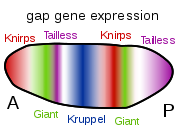
Varios tipos de moléculas son importantes na morfoxénese. Os morfóxenos son moléculas solubles que poden difundir e transportar sinais que controlan a diferenciación celular por medio de gradientes de concentración. Os morfóxenos actúan tipicamente uníndose a receptores de proteínas específicas. Unha importante clase de moléculas implicadas na morfoxénese son factores de transcrición proteicos que determinan o destino das células ao interaccionaren co ADN. Estes poden ser codificados por xenes reguladores mestres, que activan ou desactivan a transcrición doutros xenes; á súa vez, estes produtos xénicos secundarios poden regular a expresión doutros xenes nu cadoiro regularorio das redes regulatorias de xenes. Ao final deste cadoiro están as clases de moléculas que controlan os comportamentos celulares, como a migración celular, ou, máis xeralmente, as súas propiedades, como a adhesión celular ou a contractilidade celular. Por exemplo, durante a gastrulación, grupos de células nais desactivan a adhesión células a célula, convértense en migratorias, e sitúanse en novas posicións dentro dun embrión onde de novo activan proteínas de adhesión celular específicas e forman novos tecidos e órganos. Entre as vías de sinalización do desenvolvemento implicadas na morfoxénese están Wnt, Hedgehog e efrinas.[8]
Bases celulares[editar | editar a fonte]

A nivel de tecidos, ignorando os medios de control, a morfoxénese orixínase pola proliferación e motilidade celular.[9] A morfoxénese tamén implica cambios na estrutura celular[10] ou no modo en como as células interaccionan nos tecidos. Estes cambios poden causar a elongación dos tecidos, o seu adelgazamento, pregamento, invasión ou a separación dun tecido en distintas capas. Este último caso adoita denominarse ordenación celular (cell sorting). A "ordenación" celular consiste no movemento das células para ordenarse ou arranxarse en grupos que maximizan o contacto entre as células do mesmo tipo. Malcolm Steinberg propuxo que a capacidade das células de facer isto se orixina pola adhesión celular diferencial, segundo a súa hipótese da adhesión diferencial. A separación de tecidos pode tamén ocorrer por eventos de diferenciación celular máis drásticos durante os cales as células epiteliais convértense en mesenquimais (ver transición epitelial-mesenquimal). As células mesenquimais abandonan normalmente o tecido epitelial como consecuencia de cambios nas propiedades adhesivas e contráctiles das células. Despois da transición epitelial-mesenquimal, as células poden migrar lonxe do epitelio e despois asociarse con outras células similares nunha nova localización.[11] A morfoxénese celular das plantas está ligada estreitamente coa composición química e as propiedades mecánicas da parede celular.[12][13]
Adhesión célula-célula[editar | editar a fonte]
Durante o desenvolvemento embrionario, as células están restrinxidas a diferentes capas debido a afinidades diferenciais. Un dos xeitos en que isto pode ocorrer é cando as células comparten as mesmas moléculas de adhesión célula-célula. Por exemplo, a adhesión celular homotípica pode manter as fronteiras entre grupos de células que teñen diferentes moléculas de adhesión. Ademais, as células poden ordenarse baseándose nas diferenzas na adhesión entre elas, de maneira que así se poden ordenar ou clasificar mesmo dúas poboacións de células con diferentes niveis da mesma molécula de adhesión. En células en cultivo celular teñen o movemeno de adhesión máis forte cara ao centro dun agregado mixto de células. Ademais, a adhesión célula-célula está a miúdo modulada pola contractilidade, a cal pode exercer forzas sobre os contactos célula-célula para que dúas poboacións de células con igual nivel da mesma molécula de adhesión poidan clasificarse. As moléculas responsables da adhesión chámanse moléculas de adhesión celular (CAMs polas súas siglas en inglés). Coñécense varios tipos destas moléculas e unha das clases principais é a das cadherinas. Existen ducias de cadherinas diferentes que se expresan en distintos tipos celulares. As cadherinas únense a outras cadherinas similares: a E-cadherina (atopada en moitas células epiteliais) únese preferentemente a outras moléculas de E-cadherina. As células mesenquimais xeralmente expresan outros tipos de cadherinas como as N-cadherinas.[14][15]
Matriz extracelular[editar | editar a fonte]
A matriz extracelular ten un papel en manter os tecidos separados, proporcionando soporte estrutural ou proporcionando unha estrutura sobre a que as células poidan migrar. O coláxeno, a laminina e a fibronectina son as principais moléculas da matriz extracelular que se segregan e ensamblan en láminas, fibras e xeles. Os receptores transmembrana multisubunidade chamados integrinas utilízanse para unirse á matriz extracelular. As integrinas únense extracelularmente á fibronectina, laminina, ou outros compoñentes da matriz extracelular, e intracelularmente a proteínas que se unen a microfilamentos como a α-actinina e a talina para ligar o citoesqueleto co exterior. As integrinas tamén serven como receptores para desencadear cadoiros de transdución de sinais cando se unen á matriz extracelular. Un exemplo ben estudado de morfoxénese que implica á matriz extracelular é a ramificación dos condutos da glándula mamaria.[16][17]
Contractilidade celular[editar | editar a fonte]
Os tecidos poden cambiar a súa forma e separarse en distintas capas por mor da contractilidade celular. Igual que nas células musculares, a miosina pode contraer diferentes partes do citoplasma para cambiar a súa forma ou estrutura. Obsérvase a contractilidade producida pola miosina na morfoxénese de tecidos embrionais durante a separación capas xerminais nos organismos modelo Caenorhabditis elegans, Drosophila e peixe cebra. A miúdo hai pulsos periódicos de contracción na morfoxénese embrional. Un modleo chamado o separador do estado celular (cell state splitter) propón unha alternancia de contracción e expansión celular, iniciada por un orgánulo biestable no extremo apical de cada célula. O orgánulo consta de microtúbulos e microfilamentos en oposición mecánica. Responde ás perturbacións mecánicas locais causadas por movementos morfoxenéticos. Estes despois desencadean ondas de diferenciación embrional de contracción ou expansión viaxeiras en posibles tecidos que determinan o tipo celular e van seguidas da diferenciación celular. O modelo do separador do estado celular propúxose inicialmente para explicar a morfoxénese da placa neural durante a gastrulación do anfibio axolote[18] e o modelo foi despois xeneralizado a todas as morfoxéneses.[19][20]
Morfoxénese das ramificacións[editar | editar a fonte]
No desenvolvemento dos pulmóns un bronquio ramifícase en bronquíolos formando a árbore respiratoria.[21] A ramificación é o resultado de que se bifurque o extremo de cada tubo bronquiolar, e o proceso da morfoxénese da ramificación forma os bronquios, bronquíolos e finalmente os alvéolos pulmonares.[22]
A morfoxénese ramificante tamén é evidente na formación dos condutos da glándula mamaria.[23][17] A formación do duto primitivo empeza no desenvolvemento prenatal, pero a formación de ramificacións do sistema de condutos empeza máis tarde en resposta ao estróxeno durante a puberdade e ademais redefínese conforme se desenvolve a glándula mamaria.[17][24][25]
Morfoxénese do cancro[editar | editar a fonte]
O cancro pode ser o resultado das alteración da morfoxénese normal, incluíndo tanto a formación de tumores coma a metástase.[26] A disfunción mitocondrial pode causar un incremento do risco de cancro debido á distorsión da sinalizaon morfóxena.[26]
Morfoxénese de virus[editar | editar a fonte]
Durante a ensamblaxe do virión do bacteriófago T4, as proteínas morfoxenéticas codificadas polos xenes do fago interaccionan entre si nunha secuencia característica. Manter un balance apropiado nas cantidades de cada unha destas proteínas producidas durante a infección viral parece ser crucial para a morfoxénese normal do faago T4.[27] Entre as proteínas codificadas polo fago T4 que determinan a estrutura do virión están os compoñentes estruturais principais, compontes estruturais menores e proteínas non estruturais que catalizan pasos específicos na secuencia da morfoxénese.[28] A morfoxénese do fago T4 dividese en tres vías independentes: a da cabeza, a da cola e a das fibras da cola longas, tal como detallaron Yap e Rossman.[29]
Modelos computacionais[editar | editar a fonte]
Unha aproximación á modelización da morfoxénese en ciencias da computación ou matemáticas pode remontarse ao artigo de Alan Turing de 1952, "The chemical basis of morphogenesis" (A base química da morfoxenese),[30] un modelo coñecido como padrón de Turing.
Outro modelo famoso é o chamado modelo de bandeira francesa, desenvolvido na década de 1960.[31]
As melloras en rendemento de computadores no século XXI permitiu a simulación de modelos de morfoxénese relativamente complexos. En 2020 propúxose un modelo no que o crecemento e diferenciación celulares é o dun autómata celular con regras parametrizadas. Como os parámetros das regras son diferenciables, poden ser adestrados con descenso de gradiente, unha técnica que foi moi optimizada en anos recentes debido ao seu uso en aprendizaxe de máquinas.[32] Este modelo foi limitado á xeración de imaxes e é así bidimensional.
Un modelo similar ao descrito arriba foi despois ampliado para xerar estruturas tridimensionais, e foi demostrado no vídeo xogo Minecraft, cuxa natureza baseada en bloques o facía especialmente conveniente para a simulación de autómatas celulares 3D.[33]
Notas[editar | editar a fonte]
- ↑ Bidhendi, Amir J.; Altartouri, Bara; Gosselin, Frédérick P.; Geitmann, Anja (xullo de 2019). "Mechanical stress initiates and sustains the morphogenesis of wavy leaf epidermal cells". Cell Reports 28 (5): 1237–1250. PMID 31365867. doi:10.1016/j.celrep.2019.07.006.
- ↑ Thompson, D'Arcy Wentworth (1917). On Growth and Form. Cambridge University Press.
- ↑ Montell, Denise J. (5 de decembro de 2008). Morphogenetic Cell Movements: Diversity from Modular Mechanical Properties (PDF). Science 322. pp. 1502–1505. Bibcode:2008Sci...322.1502M. PMID 19056976. doi:10.1126/science.1164073. Arquivado dende o orixinal (PDF) o 28 de novembro de 2014. Consultado o 11 de decembro de 2012.
- ↑ O libro de Thompson cítase a miúdo. Unha versión abreviada de 349 páxinas, segue imprimíndose e pode obterse doadamente. Thompson, D'Arcy Wentworth (2004) [1917, abridged 1961]. Bonner, John Tyler, ed. On Growth and Form. Cambridge, Inglaterra; Nova York, NY: Cambridge University Press. ISBN 978-0-521-43776-9. Consultado o 11 de decembro de 2012.
- ↑ Tamén se publicou unha versión non abreviada de 1116 páxinas. Thompson, D'Arcy Wentworth (1992). On Growth and Form: The Complete Revised Edition. Nova York, NY: Dover. ISBN 978-0-486-67135-2.
- ↑ Turing, A. M. (1952). "The Chemical Basis of Morphogenesis". Philosophical Transactions of the Royal Society B 237 (641): 37–72. Bibcode:1952RSPTB.237...37T. doi:10.1098/rstb.1952.0012.
- ↑ Hiscock, Tom W.; Megason, Sean G. (2015). "Orientation of Turing-like Patterns by Morphogen Gradients and Tissue Anisotropies". Cell Systems 1 (6): 408–416. PMC 4707970. PMID 26771020. doi:10.1016/j.cels.2015.12.001.
- ↑ Kouros-Mehr, H.; Werb, Z. (2006). "Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis". Dev. Dyn. 235 (12): 3404–12. PMC 2730892. PMID 17039550. doi:10.1002/dvdy.20978.
- ↑ Montévil, Maël; Speroni, Lucia; Sonnenschein, Carlos; Soto, Ana M. (2016). "Modeling mammary organogenesis from biological first principles: Cells and their physical constraints". Progress in Biophysics and Molecular Biology. From the Century of the Genome to the Century of the Organism: New Theoretical Approaches 122 (1): 58–69. PMC 5563449. PMID 27544910. arXiv:1702.03337. doi:10.1016/j.pbiomolbio.2016.08.004.
- ↑ Duran-Nebreda, Salva; Pla, Jordi; Vidiella, Blai; Piñero, Jordi; Conde-Pueyo, Nuria; Solé, Ricard (2021-01-15). "Synthetic Lateral Inhibition in Periodic Pattern Forming Microbial Colonies". ACS Synthetic Biology (en inglés) 10 (2): 277–285. ISSN 2161-5063. PMC 8486170. PMID 33449631. doi:10.1021/acssynbio.0c00318.
- ↑ Gilbert, Scott F. (2000). "Morphogenesis and Cell Adhesion". Developmental biology (6ª ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-243-6.
- ↑ Bidhendi, Amir J; Geitmann, Anja (xaneiro de 2016). "Relating the mechanical properties of the primary plant cell wall to morphogenesis." (PDF). Journal of Experimental Botany 67 (2): 449–461. PMID 26689854. doi:10.1093/jxb/erv535.
- ↑ Bidhendi, Amir J; Geitmann, Anja (xaneiro de 2018). "Finite element modeling of shape changes in plant cells". Plant Physiology 176 (1): 41–56. PMC 5761827. PMID 29229695. doi:10.1104/pp.17.01684.
- ↑ Hulpiau, P.; van Roy, F. (febreiro de 2009). "Molecular evolution of the cadherin superfamily". Int. J. Biochem. Cell Biol. 41 (2): 349–69. PMID 18848899. doi:10.1016/j.biocel.2008.09.027.
- ↑ Angst, B.; Marcozzi, C.; Magee, A. (febreiro de 2001). "The cadherin superfamily: diversity in form and function". J Cell Sci 114 (Pt 4): 629–41. PMID 11171368. doi:10.1242/jcs.114.4.629.
- ↑ Fata JE, Werb Z, Bissell MJ (2004). "Regulation of mammary gland branching morphogenesis by the extracellular matrix and its remodeling enzymes". Breast Cancer Res. 6 (1): 1–11. PMC 314442. PMID 14680479. doi:10.1186/bcr634.
- ↑ 17,0 17,1 17,2 Sternlicht MD (2006). "Key stages in mammary gland development: the cues that regulate ductal branching morphogenesis". Breast Cancer Res. 8 (1): 201. PMC 1413974. PMID 16524451. doi:10.1186/bcr1368.
- ↑ Gordon, Richard; Brodland, G. Wayne (1987). "The cytoskeletal mechanics of brain morphogenesis". Cell Biophysics 11: 177–238. PMID 2450659. doi:10.1007/BF02797122.
- ↑ Gordon, Natalie K.; Gordon, Richard (2016). "The organelle of differentiation in embryos: The cell state splitter". Theoretical Biology and Medical Modelling 13: 11. PMC 4785624. PMID 26965444. doi:10.1186/s12976-016-0037-2.
- ↑ Gordon, Natalie K.; Gordon, Richard (2016). Embryogenesis Explained. ISBN 978-981-4350-48-8. doi:10.1142/8152.
- ↑ Wolpert, Lewis (2015). Principles of development (5ª ed.). Oxford University Press. pp. 499–500. ISBN 978-0-19-967814-3.
- ↑ Miura, T (2008). "Modeling Lung Branching Morphogenesis". Multiscale Modeling of Developmental Systems. Current Topics in Developmental Biology 81. pp. 291–310. ISBN 9780123742537. PMID 18023732. doi:10.1016/S0070-2153(07)81010-6.
- ↑ Fata JE, Werb Z, Bissell MJ (2004). "Regulation of mammary gland branching morphogenesis by the extracellular matrix and its remodeling enzymes". Breast Cancer Res. 6 (1): 1–11. PMC 314442. PMID 14680479. doi:10.1186/bcr634.
- ↑ Hynes, N. E.; Watson, C. J. (2010). "Mammary Gland Growth Factors: Roles in Normal Development and in Cancer". Cold Spring Harbor Perspectives in Biology 2 (8): a003186. ISSN 1943-0264. PMC 2908768. PMID 20554705. doi:10.1101/cshperspect.a003186.
- ↑ Jay R. Harris; Marc E. Lippman; C. Kent Osborne; Monica Morrow (28 de marzo de 2012). Diseases of the Breast. Lippincott Williams & Wilkins. pp. 94–. ISBN 978-1-4511-4870-1.
- ↑ 26,0 26,1 Fosslien E (2008). "Cancer morphogenesis: role of mitochondrial failure" (PDF). Annals of Clinical & Laboratory Science 38 (4): 307–329. PMID 18988924. Arquivado dende o orixinal (PDF) o 2017-09-21.
- ↑ Floor, Erik (1970). "Interaction of morphogenetic genes of bacteriophage T4". Journal of Molecular Biology 47 (3): 293–306. PMID 4907266. doi:10.1016/0022-2836(70)90303-7.
- ↑ Snustad, D.Peter (1968). "Dominance interactions in Escherichia coli cells mixedly infected with bacteriophage T4D wild-type and amber mutants and their possible implications as to type of gene-product function: Catalytic vs. Stoichiometric". Virology 35 (4): 550–563. PMID 4878023. doi:10.1016/0042-6822(68)90285-7.
- ↑ Yap, Moh Lan; Rossmann, Michael G. (2014). "Structure and function of bacteriophage T4". Future Microbiology 9 (12): 1319–1327. PMC 4275845. PMID 25517898. doi:10.2217/fmb.14.91.
- ↑ Turing, Alan Mathison (1952). "The chemical basis of morphogenesis". Philosophical Transactions of the Royal Society B 237 (641): 37–72. Bibcode:1952RSPTB.237...37T. doi:10.1098/rstb.1952.0012.
- ↑ Sharpe, James; Green, Jeremy (2015). "Positional information and reaction-diffusion: two big ideas in developmental biology combine". Development 142 (7): 1203–1211. PMID 25804733. doi:10.1242/dev.114991. hdl:10230/25028.
- ↑ Mordvintsev, Alexander; Randazzo, Ettore; Niklasson, Eyvind; Levin, Michael (2020). "Growing Neural Cellular Automata". Distill 5 (2). doi:10.23915/distill.00023.
- ↑ Sudhakaran, Shyam; Grbic, Djordje; Li, Siyan; Katona, Adam; Najarro, Elias; Glanois, Claire; Risi, Sebastian (2021). "Growing 3D Artefacts and Functional Machines with Neural Cellular Automata". arXiv:2103.08737 [cs.LG].
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Bibliografía[editar | editar a fonte]
- Bard, J. B. L. (1990). Morphogenesis: The Cellular and Molecular Processes of Developmental Anatomy. Cambridge, England: Cambridge University Press.
- Slack, J. M. W. (2013). Essential Developmental Biology. Oxford: Wiley-Blackwell.
Ligazóns externas[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Morfoxénese |
