Citoesqueleto
O citoesqueleto é un entramado tridimensional de microtúbulos e microfilamentos que prové o soporte interno para as células, ancora as estruturas internas da mesma e intervén nos fenómenos de movemento celular e na súa división. É unha estrutura dinámica que mantén a forma da célula, facilita a mobilidade celular (usando estruturas como os cilios e os flaxelos), e desempeña un importante papel tanto no transporte intracelular (por exemplo, os movementos de vesículas e orgánulos) coma na división celular.
As células eucariotas teñen tres tipos de filamentos citoesqueléticos:

Microfilamentos (actina e miosina)[editar | editar a fonte]
- Artigo principal: Microfilamento.
Duns 7 - 5 nm (nanómetros) de diámetro. Están formadas por unha proteína globular chamada actina que pode presentarse de dúas formas:
- Actina non polimerizada: A actina atópase asociada á profilina que evita a súa polimerización. Representa a metade da actina da célula e é utilizada para polimerizar microfilamentos cando é necesario.
- Actina polimerizada: É unha dobre hélice dextroxira de dúas fibras de actina non polimerizada. Esta actina pódese atopar asociada a outras proteínas.
- Proteínas estruturais: Que permiten a unión dos filamentos de actina
- Proteínas reguladoras: A máis importante é a miosina que permite a contracción muscular ao permitir que a actina se desprace sobre ela.
As dos microfilamentos de actina son a contracción muscular, a formación de pseudópodos, o mantemento da morfoloxía celular e, na citocinese de células animais, forma un anel contráctil que divide a célula en dúas.
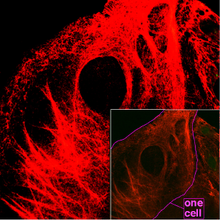
Filamentos intermedios[editar | editar a fonte]
- Artigo principal: Filamento intermedio.
Son filamentos de proteína fibrosa duns 12 nm de diámetro, son os compoñentes do citoesqueleto máis estábeis, dando soporte ós orgánulos (polas súas fortes ligazóns), e heteroxéneos. As proteínas que conforman estes filamentos, a citoqueratina, vimentina, proteína dos neurofilamentos, desmina e a proteína acídica fibrilar glial, dependen do tecido no que se achen. A súa función principal é a organización da estrutura tridimensional interna da célula (por exemplo, forman parte da envoltura nuclear e dos sarcómeros). Tamén participan nalgunhas unións intercelulares (desmosomas).
Microtúbulos[editar | editar a fonte]
- Artigo principal: Microtúbulo.

Os microtúbulos son estruturas tubulares de 25 nm de diámetro que se orixinan nos centros organizadores de microtúbulos e que se estenden ó longo de todo o citoplasma. Pódense polimerizar e despolimerizar segundo as necesidades da célula. Áchanse nas células eucariotas e están formados pola polimerizacion dun dímero de dúas proteínas globulares, a alfa e a beta tubulina. Cada microtúbulo está composto de tres protofilamentos formados polos dímeros de tubilina. Interveñen en diversos procesos celulares que involucran desprazamentos de vesículas de secreción, movemento de orgánulos, transporte intracelular de substancias, así como na división celular (mitose e meiose). Ademais, constitúen a estrutura interna dos cilios e os flaxelos. Os microtúbulos son máis flexíbeis pero máis duros que a actina.
O citoesqueleto procariota[editar | editar a fonte]
- Artigo principal: Citoesqueleto procariota.

No pasado críase que o citoesqueleto era unha característica exclusiva das células eucarióticas, pero desde entón encontráronse homólogos bacterianos das principais proteínas do citoesqueleto eucariota.[2] A pesar de que as relacións evolutivas son tan distantes que non se poden inferir analoxías a partir das secuencias de aminoácidos, a similitude da estrutura tridimendional, as funcións no mantemento da forma e na polaridade das células proporcionan probas sólidas de que os citoesqueletos eucariotas e procariotas son realmente homólogos.[3]
FtsZ[editar | editar a fonte]
A FtsZ foi a primeira proteína do citoesqueleto procariota en ser identificada. Igual que a tubulina, a FtsZ forma filamentos en presenza de GTP, pero estes filamentos non se agrupan en microtúbulos. Durante a división celular, a FtsZ é a primeira proteína que se despraza ao lugar da división e é esencial para organizar as proteínas que sintetizan a nova parede celular nas células en división.
MreB e ParM[editar | editar a fonte]
As proteínas procariotas similares á actina, tales como MreB, están implicadas no mantemento da forma celular. Estas proteínas forman unha rede helicoidal debaixo da membrana celular que guía as proteínas que participan na biosíntese da parede celular. Todas as bacterias non esféricas teñen xenes que codifican este tipo de proteínas.
Algúns plásmidos codifican un sistema de particionado que envolve unha proteína similar á actina, denominada ParM. Os filamentos de ParM mostran unha inestabilidade dinámica e poden particionar os plásmidos de ADN durante a división celular nun mecanismo análogo ao utilizado polos microtúbulos durante a mitose dos eucariotas.
Crescentina[editar | editar a fonte]
A bacteria Caulobacter crescentus contén unha terceira proteína, chamada crescentina, que está relacionada cos filamentos intermedios das células eucarióticas. A crescentina tamén participa no mantemento da forma celular, mais o mecanismo actualmente é pouco claro.[4]
Notas[editar | editar a fonte]
- ↑ Gitai, Z. (2005). "The New Bacterial Cell Biology: Moving Parts and Subcellular Architecture". Cell 120 (5): 577–586. doi:10.1016/j.cell.2005.02.026.
- ↑ Shih YL, Rothfield L (2006). "The bacterial cytoskeleton". Microbiol. Mol. Biol. Rev. 70 (3): 729–54. PMID 16959967. doi:10.1128/MMBR.00017-06.
- ↑ Michie KA, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton" (PDF). Annu. Rev. Biochem. 75: 467–92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452. Arquivado dende o orixinal (PDF) o 17 de novembro de 2006. Consultado o 06 de xuño de 2011.
- ↑ Charbon, G., Cabeen, M.T. y Jacobs-Wagner, C. (2009). "Bacterial intermediate filaments: in vivo assembly, organization, and dynamics of crescentin". Genes & development (Cold Spring Harbor Lab) 23 (9).
Véxase tamén[editar | editar a fonte]
| Wikimedia Commons ten máis contidos multimedia na categoría: Citoesqueleto |
