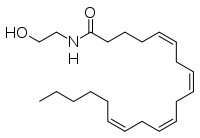
Anandamida
| Anandamida | |
|---|---|
 | |
Outros nomes N-araquidonoiletanolamina | |
| Identificadores | |
| Número CAS | 94421-68-8 |
| PubChem | 5281969 |
| ChemSpider | 4445241 |
| UNII | UR5G69TJKH |
| MeSH | Anandamide |
| ChEBI | CHEBI:2700 |
| ChEMBL | CHEMBL15848 |
| Ligando IUPHAR | 2364 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | C22H37NO2 |
| Masa molecular | 347,53 g/mol |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
A anandamida (ANA), tamén chamada N-araquidonoiletanolamina (AEA), unha N-aciletanolamina (NAE), é un ácido graxo neurotransmisor. A anandamida foi o primeiro endocannabinoide que se descubriu. Paricipa no sistema endocannabinoide do corpo uníndose a receptores de cannabinoides, os mesmos receptores sobre os que actúa o composto psicoactivo THC do cánnabis. A anandamida encóntrase en case todos os tecidos nun ampla variedade de animais.[1][2] A anandamida tamén se atopou en plantas, e hai pequenas cantidades no chocolate.[3] O nome 'anandamida' tomouse da palabra do sánscrito ananda, que significa "alegría, felicidade, pracer", e a terminación amida.[1][4]
A anandamida deriva do metaboismo non oxidativo do ácido araquidónico, un ácido graxo omega-6 esencial. Sintetízase a partir da N-araquidonoil fosfatidiletanolamina por múltiples vías.[5] É degradada principalmente polo encima amida de ácido graxo hidrolase (FAAH), que converte a anandamida en etanolamina e ácido araquidónico. En consecuencia, os inhibidores da FAAH causan unha elevación dos niveis de anandamida e búscase utilizalos terapeuticamente.[6][7]
A anandamida está sendo investigada polo seu papel na neuroptía diabética/neuropatía, xa que os cannabinoides e as anandamidas exóxenas e endóxenas demostran propiedades antinociceptivas de amplo espectro nun modelo de neuropatía diabética dolorosa, orixinadas pola activación periférica dos dous receptores cannabinoides, é dicir, o CB1 e o CB2,[8][9] ademais da implicación de canles de receptor transitorio vainilloide tipo-1 (TRPV1) na modulación da dor, xa que a sinalización dos endovainilloides modula a dor local,[10] así como na redución da inflamación asociada coa insuficiencia renal.[11]
Funcións fisiolóxicas[editar | editar a fonte]
Os efectos da anandamida poden ocorer tanto no sistema nervioso central coma no periférico. Estes distintos efectos prodúcense pola mediación principalmente do receptor cannabinoide CB1 no sistema nervioso central, e do CB2 no periférico.[12] Estes últimos están principalmente implicados nas funcións do sistema inmunitario. Os receptores cannabinoides foron descubertos orixinalmente como sensibles ao Δ9-tetrahidrocannabinol (Δ9-THC, xeralmente chamado THC), que é o principal cannabinoide psicoactivo do cánnabis. O descubrimento da anandamida debeuse á investigación dos receptores CB1 e CB2, xa que era inevitable que houbese algún composto natural endóxeno que afectase a eses receptores.
A anandamida é tamén importante para a implantación nos primeiros estadios do embrión cando está en forma de blastocisto no útero. Por tanto, os cannabinoides exóxenos como o Δ9-THC poderían influír en procesos durante os primeiros estadios do embarazo humano.[13] Hai un pico de anandamida no plasma durante a ovulación e relaciónase positivamente co pico de estradiol e os niveis de gonadotrofina, o que suxire que estes poden estar implicados na regulación dos niveis de anandamida.[14] En consecuencia, a anandamida foi proposta como un biomarcador de infertilidade, pero ata agora carece de valores preditivos para poder usala clinicamente.[15]
Os efectos beneficiosos agudos do exercicio físico (un estado eufórico e de benestar que se denomina subidón do corredor) parecen estar causados pola anandamida en ratos.[16] A anandamida é o precursor dunha clase de substancias activas fisioloxicamente chamadas prostamidas.[17] En 2007 descubriuse que a anandamida inhibe a proliferación de certas liñas celulares de cancro de mama humano in vitro.[18]
A anandamida atópase no chocolate xunto con dúas substancias que poderían imitar os efectos da anandamida, a N-oleoiletanolamina e a N-linoleoiletanolamina.[19]
Ademais, a anandamida e outros endocannabinoides atópanse no organismo modelo Drosophila melanogaster (mosca do vinagre), aínda que non se atopou ningún receptor CB neste nin en ningún insecto.[20][21]
Efectos no comportamento[editar | editar a fonte]
Tanto os receptores CB1 coma CB2 (aos cales se une a anandamida) parecen desempeñar un papel na identificación de interpretacións positivas e negativas do ambiente e escenario.[22] En modelos animais a anandamida é mediadora na interpretación de estímulos; concretamente, o optimismo e pesimismo en presenza de indicios ambiguos.[23] A anandamida altera a memoria de traballo en ratas,[24] mentres que o THC (o composto do cánnabis que tamén se une aos receptores CB1 e CB2) tamén crea un déficit na memoria de traballo.[25]
Esta relación da unión da anandamida aos CB1/CB2 pode afectar á neurotransmisión de dopamina, serotonina, GABA e glutamato.[26] Hai actualmente evidencias alentadoras, se ben embrionarias, para o uso do cánnabis medicinal no tratamento de varios trastornos psiquiátricos, pero os médicos deben ter presente consideracións de seguridade prescritiva e laboral á hora de iniciar a usar fórmulas con altas doses de THC.[27]
A anandamida inxectda directamente na estrutura cerebral prosencefálica relacionada coa recompensa, o nucleus accumbens, potencia as respostas pracenteiras de ratas a un sabor a sacarosa recompensante, e potencia a inxesta de comida tamén.[28] O aumento da anadamida parece incrementar o valor intrínseco da comida, non necesariamente por estimulación do apetito ou fame.[29]
A anandamida pode afectar á fame, sono, modulación da dor, memoria de traballo, identificación de novidades e interpretación do ambiente.[Cómpre referencia]
Síntese e degradación[editar | editar a fonte]
En humanos, a anandamida biosintetízase a partir da N-araquidonoil fosfatidiletanolamina (NAPE). Á súa vez a NAPE orixínase por transferencia de ácido araquidónico desde a lecitina á amina libre da cefalina catalizada por un encima N-aciltransferase.[30][31] A síntese da anandamida a partir de NAPE ocorre por múltiples vías e inclúe encimas como a fosfolipase A2, fosfolipase C e fosfolipase D hidrolizante da N-acetilfosfatidiletanolamina (NAPE-PLD).[5]
A estrutura cristalina da NAPE-PLD en complexo coa fosfatidiletanolamina e o desoxicolato mostra como se xera o cannabinoide anandamida a patir das N-acilfosfatidiletanolaminas (NAPEs) da membrana, e revela que os ácidos biliares, que están implicados principalmente na absorción de lípidos no intestino delgado, modulan a súa bioxénese.[32]
A anandamida endóxena está presente a niveis moi baixos e ten unha vida media moi curta debido á acción do encima amida de ácido graxo hidrolase (FAAH), que o degrada a ácido araquidónico e etanolamina libres. Os estudos en bácoros mostran os niveis dietarios de ácido araquidónico e outros ácidos graxos esenciais afectan aos niveis de anandamida e outros endocannabinoides no cerebro.[33] Nos ratos unha dieta alta en graxa incrementa os niveis de anandamida no fígado e incrementa a lipoxénese.[34] A anandamida pode ser relevante para o desenvolvemento da obesidade, polo menos en roedores.
O paracetamol (chamado acetaminophen en EUA e Canadá) é combinado metabolicamente co ácido araquidónico pola FAAH para formar AM404.[35] Este metabolito do paracetamol é un potente agonista no receptor TRPV1 vainilloide, un débil agonista nos receptores CB1 e CB2, e un inhibidor da recaptación da anandamida. Como resultado, os niveis de anandamida no cerebro e resto do corpo son elevados. Deste xeito, o paracetamol actúa como un profármaco para un metabolito cannabimimético. Esta acción pode ser parcial ou completamente reponsable dos efectos analxésicos do paracetamol.[36][37]
Entre os transportadores de endocannabinoides para a anandamida e 2-araquidonoilglicerol están as proteínas de choque térmico (Hsp70s) e as proteínas que se unen a ácidos graxos (FABPs).[38][39]
A anandamida prefire o colesterol e a ceramida máis que outros lípidos de membrana, e o colesterol pode comportarse como unha molécula que se une a ela, e despois dunha interacción inicial mediada polo establecemento dun enlace de hidróxeno, o endocannabinoide é atraído cara ao interior da membrana plasmática, onde forma un complexo molecular co colesterol despois dunha adaptación da conformación funcional ao medio apolar da membrana, e desde alí, o complexo é dirixido ao receptor cannabinoide (CB1) e ao exterior.[40]
Investigación e produción[editar | editar a fonte]
A pementa negra contén o alcaloide guineesina, que é un inhibidor da recaptación da anandamida. Pode, por tanto, incrementar os efectos fisiolóxicos da anandamida.[41]
A anandamida a baixa dose ten un efecto ansiolítico, mentres que nun estudo altas doses inxectadas directamente no fluído cerebral de ratos mostrou unha evidente apoptose celular (morte celular programada) in vitro en vez de necrose.[42] Pero, ao contrario, outro estudo realizado en condicioós similares demostrou que se producía crecemento neuronal tanto in vitro coma in vivo.[43]
Os endocannabinoides poden alterar a homeostase de vaias maneiras: aumentando a sensación de fame, favorecendo o incremento da inxestión de alimentos e cambiando o balance enerxético cara ao almacenamento de enerxía. Obsévase unha diminución resultante do gasto de enerxía.[44]
Outro estudo en ratas atopou que a redución na sinalización de anandamida por sobreexpresión da FAAH no complexo basoolateral da amígdala parecía reducir fiablemente as medidas da ansiedade e niveis globais de corticosterona, un glicocorticoide primario en animais como aves, roedores, réptiles e anfibios, responsable da regulación da enerxía, respostas inmune e ao estrés. Isto é similar ao principal glicocorticoide humano, o cortisol. A redución da anandamida na amígdala basolateral suprime o comportamento do medo e promove a extinción do medo. Isto suxire un posible uso da anandamida nun futuro tratamento de trastornos psicolóxicos. Porén, é necesario facer mais estudos neste campo, xa que se cre neste momento que a redución na sinalización de anandamida implica os receptores CB1 así como interaccións GABAérxicas e glutamatérxicas.[45]
A transmisión glutamatérxica cortical pode ser modulada por endocannabinoides durante a habituación ao medo e ao estrés.[46] A interacción glutamatérxica na amígdala basolateral crese que é responsable de cambios na ansiedade, e parece normalizar o comportamento similar á ansiedade inducido polo estrés. Un estudo indicou que a infusión do agonista do receptor de GluK1 ATPA na amígdala basolateral aumentaba a neurotransmisión GABAérxica, que actualmente se pensa que ten un importante papel na redución dos síntomas da ansiedade.[47]
Adicionalmente, os endocannabinoides, xunto coa anandamida, foron sinalados pola súa posible implicación no desenvolvemento da obesidade e os efectos daniños no metabolismo dos lípidos e a glicosa, que poden contribuír á deficiencia e resistencia á insulina, que son ambos factores de risco importantes para o desenvolvemento de diabetes mellitus tipo 2. O bloqueo de receptores CB1 mellora significativamente a resistencia a lípidos e o perfil lipídico en suxeitos obesos, pero tamén tiña o potencial de incrementar a acumulación de graxas polo incremento de consumo de alimentos, e favorecía a lipoxénese e a redución do gasto de enerxía. Isto pode afectar a sistemas augas abaixo como o páncreas, fígado, tecido adiposo e músculo esquelético, con inflamación e apoptose no caso do páncreas. A inhibición de CB1R con antagonistas restrinxidos perifericamente e agonistas inversos pode axudar no tratamento da neuropatía diabética e neuropatía. Os agonistas de CB2R poden ser prometedores para o tratamento da inflamación, a cal contribúe aos danos renais.[48]
A anandamida está asociada coa enfermidade do fígado graxo non alcohólico, esteatohepatite non alcohólica (NASH), e fibrose hepática. Os datos suxiren que a anandamida é un marcador para a enfermidade cardiometabólica e a gravidade da enfermidade do fígado graxo non alcohólico, a cal pode progresar a doenzas máis graves, como a esteatohepatite non alcohólica e o carcinoma hepatocelular.[49]
Un caso curioso é o dunha muller escocesa cunha rara mutación no seu xene da FAAH que tiña como resultado niveis elevados de ananadamida era inmune á ansiedade, incapaz de experimentar medo e era insensible á dor. As queimaduras e cortes frecuentes que ela sufría debido á súa hipoalxesia curaban máis rapidamente do que se esperaba.[50][51][52]
A anandamida tópica reduce a dor neuropática periférica por interacción cos receptores cannabinoides periféricos.[53]
A Academia Americana de Dermatoloxía considerou a anandamida unha terapia prometedora para o lupus eritematoso cutáneo.[54][55]
Notas[editar | editar a fonte]
- ↑ 1,0 1,1 Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. (decembro de 1992). "Isolation and structure of a brain constituent that binds to the cannabinoid receptor". Science 258 (5090): 1946–1949. Bibcode:1992Sci...258.1946D. PMID 1470919. doi:10.1126/science.1470919.
- ↑ Martin BR, Mechoulam R, Razdan RK (1999). "Discovery and characterization of endogenous cannabinoids". Life Sciences 65 (6–7): 573–595. PMID 10462059. doi:10.1016/S0024-3205(99)00281-7.
- ↑ di Tomaso E, Beltramo M, Piomelli D (agosto de 1996). "Brain cannabinoids in chocolate". Nature (Submitted manuscript) 382 (6593): 677–678. Bibcode:1996Natur.382..677D. PMID 8751435. doi:10.1038/382677a0.
- ↑ Mechoulam R, Fride E (1995). "The unpaved road to the endogenous brain cannabinoid ligands, the anandamides". En Pertwee RG. Cannabinoid receptors. Boston: Academic Press. pp. 233–258. ISBN 978-0-12-551460-6.
- ↑ 5,0 5,1 Wang J, Ueda N (setembro de 2009). "Biology of endocannabinoid synthesis system". Prostaglandins & Other Lipid Mediators 89 (3–4): 112–119. PMID 19126434. doi:10.1016/j.prostaglandins.2008.12.002.
- ↑ Gaetani S, Dipasquale P, Romano A, Righetti L, Cassano T, Piomelli D, Cuomo V (2009). "The endocannabinoid system as a target for novel anxiolytic and antidepressant drugs". International Review of Neurobiology 85: 57–72. ISBN 9780123748935. PMID 19607961. doi:10.1016/S0074-7742(09)85005-8.
- ↑ Hwang J, Adamson C, Butler D, Janero DR, Makriyannis A, Bahr BA (abril de 2010). "Enhancement of endocannabinoid signaling by fatty acid amide hydrolase inhibition: a neuroprotective therapeutic modality". Life Sciences 86 (15–16): 615–623. PMC 2848893. PMID 19527737. doi:10.1016/j.lfs.2009.06.003.
- ↑ Schreiber, Anne K.; Neufeld, Manuele; Jesus, Carlos H. A.; Cunha, Joice M. (2012-12-01). "Peripheral antinociceptive effect of anandamide and drugs that affect the endocannabinoid system on the formalin test in normal and streptozotocin-diabetic rats". Neuropharmacology (en inglés) 63 (8): 1286–1297. ISSN 0028-3908. PMID 22959964. doi:10.1016/j.neuropharm.2012.08.009.
- ↑ Ellington, Heather C; Cotter, Mary A; Cameron, Norman E; Ross, Ruth A (2002-06-01). "The effect of cannabinoids on capsaicin-evoked calcitonin gene-related peptide (CGRP) release from the isolated paw skin of diabetic and non-diabetic rats". Neuropharmacology (en inglés) 42 (7): 966–975. ISSN 0028-3908. PMID 12069907. doi:10.1016/S0028-3908(02)00040-0.
- ↑ Silva, M.; Martins, D.; Charrua, A.; Piscitelli, F.; Tavares, I.; Morgado, C.; Di Marzo, V. (2016-08-01). "Endovanilloid control of pain modulation by the rostroventromedial medulla in an animal model of diabetic neuropathy". Neuropharmacology (en inglés) 107: 49–57. ISSN 0028-3908. PMID 26965218. doi:10.1016/j.neuropharm.2016.03.007.
- ↑ Schreiber, Anne K.; Neufeld, Manuele; Jesus, Carlos H. A.; Cunha, Joice M. (2012-12-01). "Peripheral antinociceptive effect of anandamide and drugs that affect the endocannabinoid system on the formalin test in normal and streptozotocin-diabetic rats". Neuropharmacology (en inglés) 63 (8): 1286–1297. ISSN 0028-3908. PMID 22959964. doi:10.1016/j.neuropharm.2012.08.009.
- ↑ Pacher P, Bátkai S, Kunos G (setembro de 2006). "The endocannabinoid system as an emerging target of pharmacotherapy". Pharmacological Reviews 58 (3): 389–462. PMC 2241751. PMID 16968947. doi:10.1124/pr.58.3.2.
- ↑ Piomelli D (xaneiro de 2004). "THC: moderation during implantation". Nature Medicine 10 (1): 19–20. PMID 14702623. doi:10.1038/nm0104-19.
- ↑ El-Talatini MR, Taylor AH, Konje JC (abril de 2010). "The relationship between plasma levels of the endocannabinoid, anandamide, sex steroids, and gonadotrophins during the menstrual cycle". Fertility and Sterility 93 (6): 1989–1996. PMID 19200965. doi:10.1016/j.fertnstert.2008.12.033.
- ↑ Rapino C, Battista N, Bari M, Maccarrone M (2014). "Endocannabinoids as biomarkers of human reproduction". Human Reproduction Update 20 (4): 501–516. PMID 24516083. doi:10.1093/humupd/dmu004.
- ↑ Fuss J, Steinle J, Bindila L, Auer MK, Kirchherr H, Lutz B, Gass P (outubro de 2015). "A runner's high depends on cannabinoid receptors in mice". Proceedings of the National Academy of Sciences of the United States of America 112 (42): 13105–13108. Bibcode:2015PNAS..11213105F. PMC 4620874. PMID 26438875. doi:10.1073/pnas.1514996112.
- ↑ Woodward DF, Liang Y, Krauss AH (febreiro de 2008). "Prostamides (prostaglandin-ethanolamides) and their pharmacology". British Journal of Pharmacology 153 (3): 410–419. PMC 2241799. PMID 17721551. doi:10.1038/sj.bjp.0707434.
- ↑ De Petrocellis L, Melck D, Palmisano A, Bisogno T, Laezza C, Bifulco M, Di Marzo V (xullo de 1998). "The endogenous cannabinoid anandamide inhibits human breast cancer cell proliferation". Proceedings of the National Academy of Sciences of the United States of America 95 (14): 8375–8380. Bibcode:1998PNAS...95.8375D. PMC 20983. PMID 9653194. doi:10.1073/pnas.95.14.8375.
- ↑ di Tomaso E, Beltramo M, Piomelli D (agosto de 1996). "Brain cannabinoids in chocolate". Nature 382 (6593): 677–678. Bibcode:1996Natur.382..677D. PMID 8751435. doi:10.1038/382677a0.
- ↑ Jeffries KA, Dempsey DR, Behari AL, Anderson RL, Merkler DJ (maio de 2014). "Drosophila melanogaster as a model system to study long-chain fatty acid amide metabolism". FEBS Letters 588 (9): 1596–1602. PMC 4023565. PMID 24650760. doi:10.1016/j.febslet.2014.02.051.
- ↑ McPartland J, Di Marzo V, De Petrocellis L, Mercer A, Glass M (agosto de 2001). "Cannabinoid receptors are absent in insects". The Journal of Comparative Neurology 436 (4): 423–429. PMID 11447587. doi:10.1002/cne.1078.
- ↑ Crane NA, Schuster RM, Fusar-Poli P, Gonzalez R (xuño de 2013). "Effects of cannabis on neurocognitive functioning: recent advances, neurodevelopmental influences, and sex differences". Neuropsychology Review 23 (2): 117–137. PMC 3593817. PMID 23129391. doi:10.1007/s11065-012-9222-1.
- ↑ Kregiel J, Malek N, Popik P, Starowicz K, Rygula R (febreiro de 2016). "Anandamide mediates cognitive judgement bias in rats". Neuropharmacology 101: 146–153. PMID 26363193. doi:10.1016/j.neuropharm.2015.09.009.
- ↑ Mallet P, Beninger R (maio de 1996). "The endogenous cannabinoid receptor agonist anandamide impairs memory in rats". Behavioural Pharmacology (en inglés) 7 (3): 276–284. ISSN 0955-8810. doi:10.1097/00008877-199605000-00008.
- ↑ Calabrese EJ, Rubio-Casillas A (maio de 2018). "Biphasic effects of THC in memory and cognition". European Journal of Clinical Investigation 48 (5): e12920. PMID 29574698. doi:10.1111/eci.12920.
- ↑ Fantegrossi WE, Wilson CD, Berquist MD (febreiro de 2018). "Pro-psychotic effects of synthetic cannabinoids: interactions with central dopamine, serotonin, and glutamate systems". Drug Metabolism Reviews 50 (1): 65–73. PMC 6419500. PMID 29385930. doi:10.1080/03602532.2018.1428343.
- ↑ Sarris J, Sinclair J, Karamacoska D, Davidson M, Firth J (xaneiro de 2020). "Medicinal cannabis for psychiatric disorders: a clinically-focused systematic review". BMC Psychiatry 20 (1): 24. PMC 6966847. PMID 31948424. doi:10.1186/s12888-019-2409-8.
- ↑ Mahler SV, Smith KS, Berridge KC (novembro de 2007). "Endocannabinoid hedonic hotspot for sensory pleasure: anandamide in nucleus accumbens shell enhances 'liking' of a sweet reward". Neuropsychopharmacology 32 (11): 2267–2278. PMID 17406653. doi:10.1038/sj.npp.1301376.
- ↑ Williams CM, Kirkham TC (xuño de 2002). "Observational analysis of feeding induced by Δ9-THC and anandamide". Physiology & Behavior 76 (2): 241–250. PMID 12044596. doi:10.1016/S0031-9384(02)00725-4.
- ↑ Natarajan V, Reddy PV, Schmid PC, Schmid HH (agosto de 1982). "N-Acylation of ethanolamine phospholipids in canine myocardium". Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism 712 (2): 342–355. PMID 7126608. doi:10.1016/0005-2760(82)90352-6.
- ↑ Cadas H, di Tomaso E, Piomelli D (febreiro de 1997). "Occurrence and biosynthesis of endogenous cannabinoid precursor, N-arachidonoyl phosphatidylethanolamine, in rat brain". The Journal of Neuroscience 17 (4): 1226–1242. PMC 6793739. PMID 9006968. doi:10.1523/JNEUROSCI.17-04-01226.1997.
- ↑ Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (marzo de 2015). "Structure of human N-acylphosphatidylethanolamine-hydrolyzing phospholipase D: regulation of fatty acid ethanolamide biosynthesis by bile acids". Structure 23 (3): 598–604. PMC 4351732. PMID 25684574. doi:10.1016/j.str.2014.12.018.
- ↑ Berger A, Crozier G, Bisogno T, Cavaliere P, Innis S, Di Marzo V (maio de 2001). "Anandamide and diet: inclusion of dietary arachidonate and docosahexaenoate leads to increased brain levels of the corresponding N-acylethanolamines in piglets". Proceedings of the National Academy of Sciences of the United States of America 98 (11): 6402–6406. Bibcode:2001PNAS...98.6402B. PMC 33480. PMID 11353819. doi:10.1073/pnas.101119098.
- ↑ Osei-Hyiaman D, DePetrillo M, Pacher P, Liu J, Radaeva S, Bátkai S, et al. (maio de 2005). "Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity". The Journal of Clinical Investigation 115 (5): 1298–1305. PMC 1087161. PMID 15864349. doi:10.1172/JCI23057.
- ↑ Högestätt ED, Jönsson BA, Ermund A, Andersson DA, Björk H, Alexander JP, et al. (setembro de 2005). "Conversion of acetaminophen to the bioactive N-acylphenolamine AM404 via fatty acid amide hydrolase-dependent arachidonic acid conjugation in the nervous system". The Journal of Biological Chemistry 280 (36): 31405–31412. PMID 15987694. doi:10.1074/jbc.M501489200.
- ↑ Bertolini A, Ferrari A, Ottani A, Guerzoni S, Tacchi R, Leone S (setembro de 2006). "Paracetamol: new vistas of an old drug". CNS Drug Reviews 12 (3–4): 250–275. PMC 6506194. PMID 17227290. doi:10.1111/j.1527-3458.2006.00250.x.
- ↑ Sinning C, Watzer B, Coste O, Nüsing RM, Ott I, Ligresti A, et al. (decembro de 2008). "New analgesics synthetically derived from the paracetamol metabolite N-(4-hydroxyphenyl)-(5Z,8Z,11Z,14Z)-icosatetra-5,8,11,14-enamide". Journal of Medicinal Chemistry 51 (24): 7800–7805. PMID 19053765. doi:10.1021/jm800807k.
- ↑ Kaczocha M, Glaser ST, Deutsch DG (abril de 2009). "Identification of intracellular carriers for the endocannabinoid anandamide". Proceedings of the National Academy of Sciences of the United States of America 106 (15): 6375–6380. Bibcode:2009PNAS..106.6375K. PMC 2669397. PMID 19307565. doi:10.1073/pnas.0901515106.
- ↑ Oddi S, Fezza F, Pasquariello N, D'Agostino A, Catanzaro G, De Simone C, et al. (xuño de 2009). "Molecular identification of albumin and Hsp70 as cytosolic anandamide-binding proteins". Chemistry & Biology 16 (6): 624–632. PMID 19481477. doi:10.1016/j.chembiol.2009.05.004.
- ↑ Di Scala C, Fantini J, Yahi N, Barrantes FJ, Chahinian H (maio de 2018). "Anandamide Revisited: How Cholesterol and Ceramides Control Receptor-Dependent and Receptor-Independent Signal Transmission Pathways of a Lipid Neurotransmitter". Biomolecules 8 (2): 31. PMC 6022874. PMID 29789479. doi:10.3390/biom8020031.
- ↑ Nicolussi S, Viveros-Paredes JM, Gachet MS, Rau M, Flores-Soto ME, Blunder M, Gertsch J (febreiro de 2014). "Guineensine is a novel inhibitor of endocannabinoid uptake showing cannabimimetic behavioral effects in BALB/c mice". Pharmacological Research 80: 52–65. PMID 24412246. doi:10.1016/j.phrs.2013.12.010.
- ↑ Cernak I, Vink R, Natale J, Stoica B, Lea PM, Movsesyan V, et al. (May 2004). "The "dark side" of endocannabinoids: a neurotoxic role for anandamide". Journal of Cerebral Blood Flow and Metabolism 24 (5): 564–578. PMID 15129189. doi:10.1097/00004647-200405000-00011.
- ↑ Veldhuis WB, van der Stelt M, Wadman MW, van Zadelhoff G, Maccarrone M, Fezza F, et al. (maio de 2003). "Neuroprotection by the endogenous cannabinoid anandamide and arvanil against in vivo excitotoxicity in the rat: role of vanilloid receptors and lipoxygenases". The Journal of Neuroscience 23 (10): 4127–4133. PMC 6741091. PMID 12764100. doi:10.1523/JNEUROSCI.23-10-04127.2003.
- ↑ Schulz, Piotr; Hryhorowicz, Szymon; Rychter, Anna Maria; Zawada, Agnieszka; Słomski, Ryszard; Dobrowolska, Agnieszka; Krela-Kaźmierczak, Iwona (2021-01-26). "What Role Does the Endocannabinoid System Play in the Pathogenesis of Obesity?". Nutrients (en inglés) 13 (2): 373. ISSN 2072-6643. PMC 7911032. PMID 33530406. doi:10.3390/nu13020373.
- ↑ Morena, Maria; Aukema, Robert J.; Leitl, Kira D.; Rashid, Asim J.; Vecchiarelli, Haley A.; Josselyn, Sheena A.; Hill, Matthew N. (2019-02-13). "Upregulation of Anandamide Hydrolysis in the Basolateral Complex of Amygdala Reduces Fear Memory Expression and Indices of Stress and Anxiety". The Journal of Neuroscience (en inglés) 39 (7): 1275–1292. ISSN 0270-6474. PMC 6381235. PMID 30573646. doi:10.1523/JNEUROSCI.2251-18.2018.
- ↑ Kamprath, K.; Plendl, W.; Marsicano, G.; Deussing, J. M.; Wurst, W.; Lutz, B.; Wotjak, C. T. (marzo de 2009). "Endocannabinoids mediate acute fear adaptation via glutamatergic neurons independently of corticotropin-releasing hormone signaling". Genes, Brain and Behavior (en inglés) 8 (2): 203–211. PMID 19077175. doi:10.1111/j.1601-183X.2008.00463.x.
- ↑ Masneuf, Sophie; Lowery-Gionta, Emily; Colacicco, Giovanni; Pleil, Kristen E.; Li, Chia; Crowley, Nicole; Flynn, Shaun; Holmes, Andrew; Kash, Thomas (outubro de 2014). "Glutamatergic mechanisms associated with stress-induced amygdala excitability and anxiety-related behavior". Neuropharmacology (en inglés) 85: 190–197. PMC 4170856. PMID 24796255. doi:10.1016/j.neuropharm.2014.04.015.
- ↑ Gruden, G; Barutta, F; Kunos, G; Pacher, P (abril de 2016). "Role of the endocannabinoid system in diabetes and diabetic complications: Role of endocannabinoid system in diabetes". British Journal of Pharmacology (en inglés) 173 (7): 1116–1127. PMC 4941127. PMID 26076890. doi:10.1111/bph.13226.
- ↑ Kimberly, W. Taylor; O'Sullivan, John F.; Nath, Anjali K.; Keyes, Michelle; Shi, Xu; Larson, Martin G.; Yang, Qiong; Long, Michelle T.; Vasan, Ramachandran; Peterson, Randall T.; Wang, Thomas J.; Corey, Kathleen E.; Gerszten, Robert E. (2017-05-04). "Metabolite profiling identifies anandamide as a biomarker of nonalcoholic steatohepatitis". JCI Insight (en inglés) 2 (9): e92989. ISSN 2379-3708. PMC 5414569. PMID 28469090. doi:10.1172/jci.insight.92989.
- ↑ Habib AM, Okorokov AL, Hill MN, Bras JT, Lee MC, Li S, et al. (agosto de 2019). "Microdeletion in a FAAH pseudogene identified in a patient with high anandamide concentrations and pain insensitivity". British Journal of Anaesthesia 123 (2): e249–e253. PMC 6676009. PMID 30929760. doi:10.1016/j.bja.2019.02.019.
- ↑ Murphy H (28 de maro de 2019). "At 71, She's Never Felt Pain or Anxiety. Now Scientists Know Why.". The New York Times. Consultado o 29 de marzo de 2019.
- ↑ Sample I (28 de marzo de 2019). "Scientists find genetic mutation that makes woman feel no pain". The Guardian. Consultado o 29 de marzo de 2019.
- ↑ Police, Anitha; Shankar, Vijay Kumar; Pandey, Pankaj; Rangappa, Srinath; Doerksen, Robert J.; Narasimha Murthy, S. (2023). "Novel topical anandamide formulation for alleviating peripheral neuropathic pain". International Journal of Pharmaceutics 641: 123085. PMID 37245739. doi:10.1016/j.ijpharm.2023.123085.
- ↑ "AAD ePosters".
- ↑ "A New Treatment in a New Package for Cutaneous Lupus Erythematosus". 19 de marzo de 2023.
Véxase tamén[editar | editar a fonte]
Outros artigos[editar | editar a fonte]
Ligazóns externas[editar | editar a fonte]
- Could anandamide be the missing link to "runner's high"? Consultado o 31-10-2015
- Sparling PB, Giuffrida A, Piomelli D, Rosskopf L, Dietrich A (decembro de 2003). "Exercise activates the endocannabinoid system". NeuroReport 14 (17): 2209–2211. PMID 14625449. doi:10.1097/00001756-200312020-00015.
