Histidina
| L-Histidina | |
|---|---|

|

|
Histidina | |
Outros nomes Ácido 2-amino-3-(1H-imidazol-4-il)propanoico | |
| Identificadores | |
| Número CAS | 71-00-1 |
| PubChem | 773 |
| ChemSpider | 6038 |
| UNII | 4QD397987E |
| DrugBank | DB00117 |
| KEGG | D00032 |
| ChEBI | CHEBI:57595 |
| ChEMBL | CHEMBL17962 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H9N3O2 |
| Masa molar | 155,15 g mol−1 |
| Solubilidade en auga | 4,19g/100g a 25 °C [1] |
| Perigosidade | |
| NFPA 704 | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
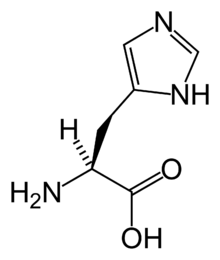

A histidina (abreviadamente His ou H)[2] é un α-aminoácido que forma parte das proteínas, polo que é un aminoácido proteinoxénico. Na súa cadea lateral ten un grupo funcional cíclico imidazol, que se carga positivamente facilmente (pKa = 6,5), polo que é un aminoácido básico.
É un aminoácido esencial que non pode ser sintetizado polo organismo e debe tomarse na dieta [3] Os seus codóns no código xenético son: CAU e CAC. Foi purificado por primeira vez en Alemaña por Albrecht Kossel en 1896.
Os produtos lácteos, a carne, o polo e o peixe son ricos en histidina. A histidina é un precursor da histamina, a cal intervén nas reaccións alérxicas. Participa tamén no desenvolvemento e mantemento dos tecidos, e particularmente no da mielina que cobre os axóns das neuronas.
Propiedades químicas
[editar | editar a fonte]O aminoácido ten un pKa de 6,5. Isto significa que, pequenas variacións do pH fisiolóxico cambiarán a súa carga total. Por debaixo de pH 6, o anel de imidazol está predominantemente protonado, con carga positiva. O seu punto isoelectrico é 7,59. O anel imidazol é aromático.
A súa cadea lateral está cargada positivamente (aminoácido básico) a valores de pH fisiolóxico. Dos vinte α-aminoácidos, unicamente a histidina ioniza dentro da escala de pH fisiolóxicos. A un pH por debaixo de 6, o seu grupo lateral imidazol está predominantemente cargado, e a carga distribúese por igual nos dous nitróxenos do anel de forma resoante. Este feito ten como consecuencia que as cadeas laterais da histidina participen nas reaccións catalíticas dos encimas. Durante a catálise, o nitróxeno básico da histidina pode captar un protón da serina, tirosina e cisteína, o que explica que forme parte do centro catalítico de determinados encimas. Nas anhidrases carbónicas utilízase unha histidina para extraer rapidamente protóns de moléculas de auga unidas ao grupo prostético de cinc para rexenerar rapidamente a forma activa do encima.
En canto ao seu papel na molécula de hemoglobina, o quinto ligando do hemo Fe(II) é HisF8, a histidina proximal. Na oxihemoglobina o Fe(II) está posicionado 0,22 Å fóra do plano do hemo do lado da histidina proximal e, ademais, está coordinado por osíxeno. A histidina distal únese por unha ponte de hidróxeno ao osíxeno. Na hemoglobina a sexta posición do ligando Fe (II) moveuse 0,55 Å fóra do plano do hemo.
Degradación
[editar | editar a fonte]Degrádase primeiro a glutamato e finalmente a alfa-cetoglutarato, polo que é un aminoácido glicoxénico. A súa degradación a glutamato é complicada. Sofre unha desaminación non oxidativa, logo hidrátase e o seu anel imidazol escíndese para formar N-formiminoglutamato. Despois o grupo formimino transfírese ao tetrahidrofolato para formar ácido glutámico e N5-formimino-tetrahidrofolato.
Biosíntese
[editar | editar a fonte]Cinco dos seis átomos da histidina derivan do 5-fosforribosil-α-pirofosfato (PRPP), un intermediario tamén implicado na biosíntese do triptófano, os nucleótidos de purina e os de pirimidina. O sexto carbono da histidina orixínase a partir do ATP. Os átomos de ATP que non se incorporan á histidina elimínanse como 5-aminoimidazol-4-carboxamida ribonucleótido que tamén é un intermediario na síntese de purinas. A biosíntese infrecuente da histidina a partir dunha purina foi utilizada para apoiar a idea de que a vida se orixinou inicialmente baseándose na química do ARN (hipótese do mundo de ARN). Os residuos de histidina son con frecuencia compoñentes dos centros activos dos encimas, onde actúan como nucleófilos ou catalizadores xerais ácido-base, ou ambos os dous. Por conseguinte, o descubrimento de que o ARN ten propiedades catalíticas suxire que a metade imidazol das purinas cumpre un papel similar nestes encimas de ARN (ribozimas). Isto suxire que a vía da síntesis da histidina é un fósil da transición cara a unha química da vida máis eficiente baseada nas proteínas.
A partrir da histidina pode sintetizarse histamina. A eliminación por acción do encima histidina descarboxilase do grupo -COOH da histidina (descarboxilación), converte a esta en histamina, unha substancia con importantes efectos fisiolóxicos, que se encontra libremente presente no intestino e nos gránulos basófilos das células do sistema reticuloendotelial. A histamina é un poderoso vasodilatador, intervén nas reaccións alérxicas, e estimula a secreción de pepsina e ácido clorhídrico polo estómago.

Usos terapéuticos
[editar | editar a fonte]Este aminoácido é vital por ser precursor da histamina, polo que se utiliza no tratamento da artrite reumatoide (inflamación e falta de mobilidade nas articulacións), enfermidades alérxicas, úlceras e anemia. En combinación coa hormona do crecemento e outros aminoácidos, contribúe á reparación dos tecidos, especialmente no sistema cardiovascular. No sistema nervioso central é sintetizada e liberada polas neuronas e utilizada como neuromodulador.
Fóra do sistema nervioso é un mediador fisiolóxico. A deficiencia de histidina pode causar problemas na audición. Tamén se sabe que a histidina axuda na desintoxicación de metais pesados, axuda no tratamento da impotencia e a frixidez, mellora a resposta inmunitaria, axuda a evitar os vómitos no embarazo. É importante tamén no mantemento das vaíñas de mielina que rodean os axóns neuronais. É necesaria tanto para a produción de glóbulos vermellos coma de brancos no sangue, protexe o organismo dos danos por radiación e reduce a presión arterial.
Notas
[editar | editar a fonte]- ↑ http://prowl.rockefeller.edu/aainfo/solub.htmModelo:Full
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. "Nomenclature and Symbolism for Amino Acids and Peptides". Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado o 2007-05-17.
- ↑ J D Kopple and M E Swendseid (1975). "Evidence that histidine is an essential amino acid in normal and chronically uremic man.". J Clin Invest. 55 (5): 881–891. PMC 301830. PMID 1123426. doi:10.1172/JCI108016. Arquivado dende o orixinal o 13 de novembro de 2013. Consultado o 22 de xullo de 2011.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- BIOQUÍMICA: Fundamentos para medicina y ciencias de la vida / Müller-Sterl, Werner; [Versión española por Josep Joan Centelles Serra].- Barcelona: Reverté, 2008
- BIOQUÍMICA / Donald Voet y Judith G. Voet - 3ª edición - Buenos Aires: Médica Panamericana, 2006. Traducido por: Silvia Rondinone, Diana Klajn y M.V. Preciado
- LEHNINGER: PRINCIPIOS DE BIOQUÍMICA / David L. Nelson y Michael M. Cox - 5ª edición - Barcelona: Ediciones Omega 2009. Traducido por: Claudi M. Cuchillo

